2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系毒理学研究所;
3. 750004 银川,宁夏医科大学公共卫生与管理学院劳动卫生与环境卫生学教研室
2. Institute of Toxicology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Occupational Health and Environmental Hygiene, College of Public Health and Management, Ningxia Medical University, Yinchuan, Ningxia Hui Autonomous Region, 750004, China
邻苯二甲酸二丁酯(dibutyl phthalate,DBP)是最具代表性的邻苯二甲酸酯类(phthalate esters,PAEs)化合物之一,作为增塑剂广泛应用于塑料工业中。由于DBP能够在体内大量蓄积,干扰人体内分泌,导致生殖系统的损害效应,因此受到国内外研究者的广泛关注[1]。机制研究表明,DBP可以影响睾丸支持细胞和间质细胞,导致生精细胞发生凋亡,干扰激素合成与分泌致精子生成紊乱[2]。然而,DBP导致生殖系统损伤作用的具体机制,以及损伤过程中的分子事件及相关分子信号通路仍然不十分清楚。
近年来,大麻素受体1(cannabinoid receptor 1, CBR1)因其在生殖系统中的重要作用而备受关注[3]。CBR1是内源和外源性大麻素的特异受体,属于7次跨膜的G蛋白偶联受体[4]。CBR1在下丘脑-垂体-卵巢轴、下丘脑-垂体-肾上腺轴以及相应效应器官均有表达,参与调控了人体的整个内分泌状态[5]。在雄性生殖系统中,CBR1可表达于睾丸支持细胞、间质细胞以及精子[6],在精子发生以及精子运动方面起到重要的调控作用[7]。最新研究表明,大麻素受体除了在生殖过程中发挥直接作用以外,还会受到某些环境化学物的影响。研究人员把内分泌干扰物4-壬基酚对金鱼染毒后发现,4-壬基酚可以干扰金鱼的内分泌状态,上调CBR1和CBR2受体的表达[8]。在一项研究PAEs与CBR1的结合实验中发现,PAEs类化合物nBBP、DnHP、DnBP、DEHP、DiOP以及DnOP等都能够不同程度地与CBR1结合[9]。然而,目前少见文献报道CBR1是否也在PAEs类化合物暴露导致的机体损伤过程中发挥作用。
因此,本研究拟以DBP为研究对象,观察DBP染毒对成年雄性大鼠生殖系统的损伤效应;在分子水平检测CBR1基因以及跨膜信号转导通路PI3K/Akt、ERK/p38MAPK的关键分子表达和磷酸化水平,初步探讨CBR1介导的PI3K、MAPK信号转导通路在DBP致大鼠生殖系统损伤中的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物6周龄健康雄性SD大鼠60只,体质量(200±20)g,购于陆军军医大学(第三军医大学)第三附属医院实验动物中心。动物合格证号:SCXK(军)2007-016。动物饲养于陆军军医大学(第三军医大学)实验动物中心,实验前动物适应性喂养1周,自由进食与饮水。60只大鼠按随机数字表法分为4组,对照组和高、中、低剂量染毒组,每组各15只。低剂量组给予100 mg/kg DBP、中剂量组给予250 mg/kg DBP、高剂量组给予500 mg/kg DBP,用玉米油配制成相应浓度,对照组给予相应体积的玉米油,1次/d。染毒期间每周称质量1次并记录,根据体质量变化调整灌胃剂量,连续灌胃28 d处死取材。
1.1.2 主要仪器计算机辅助精子分析系统(CASA, Spain),正置显微镜(日本OLYMPUS),CFX荧光定量PCR仪(美国Bio-Rad),蛋白电泳仪(美国Bio-Rad),Fusion FX凝胶成像系统(美国Viberlourmat)。
1.1.3 主要试剂DBP、玉米油、HTF(美国Sigma- Aldrich),苏木精-伊红(HE)染色试剂盒(上海碧云天公司),大鼠睾酮(T)、性激素结合蛋白(SHBG)、黄体生成素(LH)和促卵泡激素(FSH)ELISA试剂盒(江苏酶免实业有限公司),雌二醇(E2)ELISA试剂盒(美国,Cloud-clone corp公司),CBR1抗体(武汉博士德生物工程有限公司),AKT抗体、p38抗体(美国Santa Cruz Biotechnology),TaqDNA聚合酶、GoTaq PCR转录系统(美国Promega公司)。
1.2 方法 1.2.1 精子检测取一侧附睾,放入有1 mL HTF培养液的平皿中,纵向剪1~2刀并轻压组织块待精子释出,制备精子悬液。吸取适量精子悬液加至一次性精液分析玻璃载片中,用CASA精液分析软件分析精子密度及精子活力指标。
1.2.2 睾丸组织病理学及超微结构观察每只大鼠取一侧睾丸,切取一半用4%的多聚甲醛溶液固定,常规脱水,石蜡包埋,采用HE染色制作睾丸组织切片。光学显微镜下观察比较睾丸的组织病理学变化,生精上皮细胞层次、形态结构、脱落细胞及管腔受损程度等。另一半切取3块大小为1 mm×1 mm×1 mm的组织后用电镜专用戊二醛固定,包埋制备睾丸组织电镜包埋块制作半薄切片(0.5~1.5 μm),在透射电镜下进行睾丸组织超微结构的观察。
1.2.3 血清激素水平检测取大鼠股动脉血,2 000 r/min离心吸取上层血清,于-80 ℃保存备用。采用ELISA试剂盒检测大鼠血清T、E2、LH、FSH和SHBG水平,操作步骤分别参照ELISA试剂盒说明书进行。
1.2.4 蛋白表达检测采用Western blot法检测睾丸组织p38、ERK、AKT和CBR1的蛋白表达,实验方法参考文献[10]报道的方法。
1.2.5 睾丸组织中p38、ERK、AKT和CBR1 mRNA检测采用RT-PCR法检测睾丸组织中p38、ERK、AKT和CBR1的mRNA含量。按试剂盒说明书要求提取睾丸组织总RNA。提取的总RNA反转录获得cDNA,根据说明书的要求,设定PCR反应条件如下: 95 ℃ 10 min;95 ℃ 10 s, 60 ℃ 1 min,40循环。以GAPDH mRNA为内参,在CFX96 TM Real-time System上检测p38、ERK、AKT和CB1基因在睾丸组织中mRNA的表达水平。采用2-ΔΔCt的计算方法,比较各组cDNA的相对表达量。
p38上游引物为:5′-CGGTGTGTGCTGCTTTTGAT-3′,下游引物为:5′-CTGTAGGTCCTTTTGGCGTG-3′;ERK上游引物为:5′-GCAAGAGGGAAATCTATGTGGC-3′,下游引物为:5′-GCCGGAGGAAAGAGTCTAAAGC-3′;AKT上游引物为:5′-TGAGACCGACACCAGGTAT-TTTG-3′,下游引物为:5′-GCTGAGTAGGAGAACTGGGGAAA-3′;CBR1上游引物为:5′-CCACTGTGCAGTTGCTGTTTCCTT-3′,下游引物为:5′-TTGGCCATCGAGGCCTGAAATCTA-3′;GAPDH上游引物为:5′-TCAACAGCAACTCCCACTCTTCCA-3′,下游引物为:5′-AACCTGTTGCTGTAGCCGTATTCA-3′。
1.3 统计学分析采用SPSS 18.0统计软件对数据进行分析,计量资料以x±s表示,各组间均数比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 各组大鼠一般情况观察以及脏器系数变化暴露期间,对照组和各染毒组大鼠的饮食、活动均正常,无明显毒性作用表现。由表 1可见,与对照组比较,高剂量组(500 mg/kg)暴露大鼠体质量降低,睾丸脏体比升高,差异有统计学意义(P < 0.05);对照组和各染毒组的大鼠附睾脏体比差异均无统计学意义(P>0.05)。
| 组别 | 体质量/g | 睾丸/g | 附睾/g | 睾丸脏体比(g/100 g) | 附睾脏体比(g/100 g) |
| 对照组 | 355.00±27.16 | 1.75±0.21 | 0.25±0.04 | 4.80±0.23 | 0.70±0.09 |
| 低剂量组 | 342.00±34.43 | 1.81±0.16 | 0.26±0.04 | 5.30±0.70 | 0.80±0.14 |
| 中剂量组 | 338.00±30.64 | 1.73±0.17 | 0.27±0.04 | 5.30±0.53 | 0.80±0.14 |
| 高剂量组 | 321.00±23.23a | 1.78±0.17 | 0.26±0.04 | 5.60±0.46a | 0.80±0.11 |
| a:P < 0.05,与对照组比较 | |||||
2.2 各组大鼠附睾精子指标变化
与对照组相比,各暴露组大鼠前向运动精子和精子总活力显著降低,不动精子比例显著升高,差异有统计学意义(P < 0.01);与对照组相比,高剂量组(500 mg/kg)精子密度显著降低,差异有统计学意义(P < 0.05);对照组和各染毒组的大鼠精子畸形率差异无统计学意义(P>0.05,表 2)。
| 组别 | 前向运动精子(%) | 不动精子(%) | 精子总活力(%) | 精子密度(105) | 精子畸形率(%) |
| 对照组 | 39.5±9.9 | 26.4±3.2 | 73.6±3.2 | 196.0±29.7 | 2.5±0.1 |
| 低剂量组 | 20.1±9.2b | 59.3±24.4b | 40.7±24.4b | 170.0±11.5 | 2.4±0.1 |
| 中剂量组 | 22.3±6.2b | 58.8±4.6b | 41.2±4.6b | 174.0±69.5 | 2.8±0.2 |
| 高剂量组 | 21.0±14.2b | 70.5±21.2b | 29.5±21.2b | 152.0±67.0a | 2.8±0.2 |
| a:P < 0.05,b:P < 0.01, 与对照组比较 | |||||
2.3 各组大鼠激素水平变化
由表 3可知,与对照组相比,中、高剂量组染毒大鼠血清中T水平显著降低,高剂量组SHBG水平显著上升,差异具有统计学意义(P < 0.05);与对照组相比,各染毒剂量组E2和LH显著降低,差异具有统计学意义(P < 0.05);与对照组相比,各暴露组FSH水平显著上升,差异具有统计学意义(P < 0.05)。
| 组别 | T/nmol·L-1 | E2/pg·mL-1 | SHBG/nmol·L-1 | LH/ng·L-1 | FSH/IU·L-1 |
| 对照组 | 25.12±5.89 | 2.47±0.04 | 30.41±3.38 | 10.01±1.94 | 2.52±0.17 |
| 低剂量组 | 19.35±7.55 | 2.09±0.08a | 30.55±1.24 | 7.80±1.42a | 2.88±0.37a |
| 中剂量组 | 19.65±2.65a | 2.11±0.77a | 30.34±1.72 | 7.68±2.28a | 2.89±0.29a |
| 高剂量组 | 17.40±3.50a | 2.05±0.02a | 34.64±3.69a | 6.43±0.90a | 3.37±0.30a |
| a:P < 0.05,与对照组比较 | |||||
2.4 各组大鼠睾丸组织病理学变化
大鼠睾丸组织HE染色结果显示,对照组和低剂量组睾丸组织结构正常,生精小管管腔分布规则,曲细精管中的生精细胞排列整齐,结构紧密,未发现异常空泡,附睾管腔中布满成熟的精子。中剂量(250 mg/kg)和高剂量组(500 mg/kg)出现睾丸组织损伤,生精小管变性萎缩,生精细胞排列紊乱,间质细胞减少,管腔内出现明显的精子减少或缺乏。见图 1。
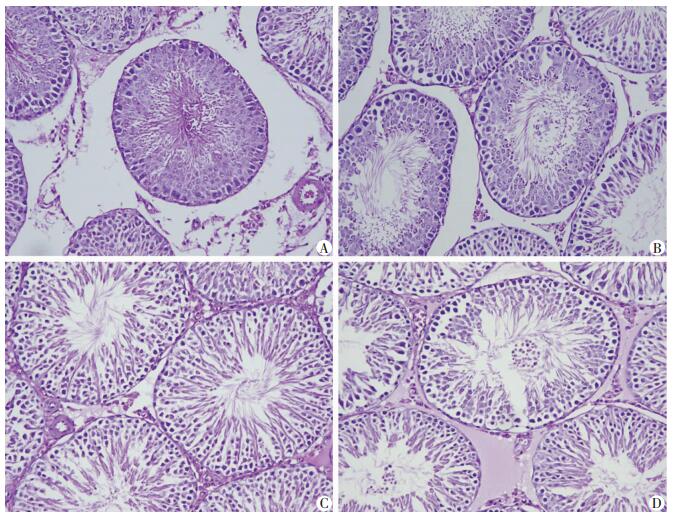
|
| A:对照组;B:低剂量组(100 mg/kg DBP);C:中剂量组(250 mg/kg DBP);D:高剂量组(500 mg/kg DBP) 图 1 各组大鼠睾丸组织病理学变化 (HE×400) |
在透射电镜下,对照组曲细精管基底膜致密,均匀平滑,各级生精细胞排列紧密,细胞结构完整清晰,胞质内线粒体、滑面内质网和高尔基体等细胞器数量丰富,结构完整;低剂量组和中剂量组细胞间出现间隙,支持细胞形态发生变化,为不规则形;高剂量组细胞内线粒体畸形、肿胀,内脊不明显,出现空泡, 精子异常,部分精子出现在精母细胞处。见图 2。
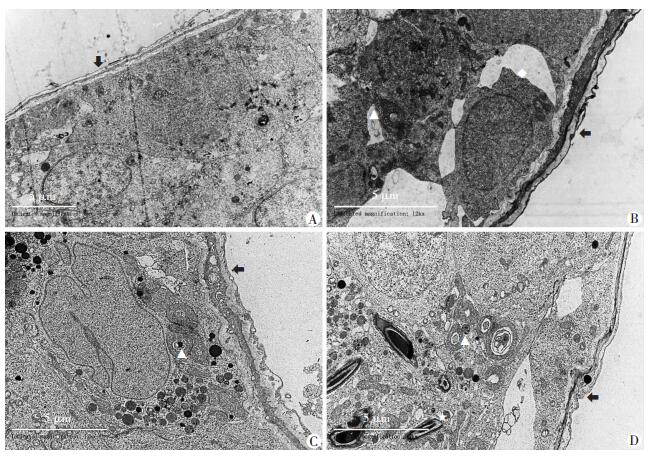
|
| A:对照组;B:低剂量组;C:中剂量组;D:高剂量组 ↑:示曲细精管膜;△:示线粒体;◇:示支持细胞;☆:示精子 图 2 DBP对各组大鼠睾丸组织超微结构的影响 |
2.5 DBP对各组大鼠睾丸p38、ERK、AKT和CBR1蛋白表达的影响
用Western blot检测p38、p-p38、ERK、p-ERK、AKT、p-AKT和CBR1蛋白表达的情况。结果显示,与对照组比较,随着染毒剂量的增加,大鼠睾丸组织中CBR1和ERK蛋白质表达显著增加,p38蛋白质水平显著降低;各染毒剂量组DBP大鼠睾丸组织中p-p38、p-ERK水平明显降低,差异有统计学意义(P < 0.05);高剂量组大鼠睾丸组织中AKT的表达水平和p-AKT的水平降低,差异有统计学意义(P < 0.05,图 3)。

|
| 1:对照组;2:低剂量组(100 mg/kg DBP);3:中剂量组(250 mg/kg DBP);4:高剂量组(500 mg/kg DBP) 图 3 DBP对各组大鼠睾丸组织中p38、ERK、AKT和CBR1蛋白表达的影响 |
2.6 DBP对各组大鼠睾丸p38、ERK、AKT和CBR1 mRNA表达的影响
RT-PCR检测结果显示,低、中、高剂量DBP组大鼠睾丸组织CBR1 mRNA水平分别为(1.20±0.12)、(1.40±0.15)、(1.49±0.16),与对照组相比,中、高剂量组CBR1 mRNA表达显著升高,差异有统计学意义(P < 0.05);与对照组比较,各染毒组大鼠ERK mRNA表达水平升高,低、中、高剂量DBP组分别为(1.19±0.12)、(1.22±0.10)、(1.44±0.10),与对照组相比,中、高剂量组ERK mRNA表达显著升高,差异有统计学意义(P < 0.05);与对照组比较,中、高剂量DBP组大鼠睾丸组织中p38 mRNA表达明显下调,差异有统计学意义(P < 0.05);AKT mRNA在对照组及染毒组之间表达差异无统计学意义(P>0.05,图 4)。
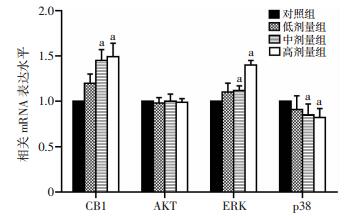
|
| a:P < 0.05, 与对照组比较 图 4 各组大鼠睾丸p38、ERK、AKT和CBR1 mRNA的表达 |
3 讨论
DBP是重要的环境内分泌干扰物之一,其中主要表现为对生殖系统的内分泌干扰作用。动物实验表明,DBP暴露会导致雄性大鼠睾丸组织超微结构改变,生殖器官发育异常,精子活力、密度下降,性激素水平改变等[11]。孕鼠暴露于DBP中,可造成第1代出生的幼鼠出生数量减少,体质量下降,显著降低其雄性子代的肛殖距,甚至引起生殖道畸形[12]。流行病学研究证据也显示,男性体内邻苯二甲酸酯类的暴露水平与降低的精液质量密切相关[13]。本课题组前期的研究表明,即使环境暴露的浓度低于美国EPA推荐的暴露限值(RfDs),尿液中DBP代谢产物MBP的浓度仍与男性精子活力呈显著负相关[14]。目前有关DBP对雄性生殖系统影响的研究已有很多,在同类研究中,大多采用250 mg/kg DBP或500 mg/kg DBP作为观察DBP大鼠生殖毒性的有效染毒剂量[15]。普遍认为在250 mg/kg DBP的剂量水平下即可观察到如生精小管损伤,精子质量下降,生殖激素水平改变等雄性生殖毒性效应[16]。与本研究的结果基本一致。然而DBP是如何导致精子活力下降的?其具体机制迄今尚不清楚。
研究表明,CBR1在生殖系统中主要通过抑制腺苷酸环化酶(adenylatecyclase,AC)的活性,从而降低细胞质cAMP浓度;调控PKA,PI3K和MAPK信号通路以及增强K+电流等途径发挥作用[17]。p38丝裂原活化蛋白激酶(p38)和ERK细胞外调节蛋白激酶(ERK)都是MAPK家族的重要成员。MAPK信号通路已被证明参与雄性生殖过程的很多阶段[18]。研究表明,ERK和p38MAPK作为细胞内重要的信号转导分子,也分别在精子发生的不同环节中发挥作用[19]。通过对ERK和p38 MAPK在正常大鼠睾丸中的定位分析,发现ERK和P38 MAPK分别定位于正常大鼠睾丸内的不同部位。大鼠睾丸中的p-p38 MAPK在间质细胞胞质阳性信号最强,支持细胞胞质也有明显阳性信号,表明在精子释放、睾酮合成分泌方面起作用;正常大鼠睾丸中p-ERK主要分布于精原细胞、细线前期到粗线期的初级精母细胞以及长形精子细胞的细胞核,提示ERK可能参与生精细胞增殖、分化的信号转导。本研究中,ERK总蛋白质水平和mRNA表达显著增加,p38总蛋白质水平和mRNA表达均显著降低;然而低、中、高剂量ERK和p38的蛋白质磷酸化水平均较对照组显著降低,提示ERK和p38正常的磷酸化状态受到了抑制,导致精子生成过程中的分化增殖受到影响,睾酮分泌水平下降,精子密度和精子活力降低。
一般认为,MAPK信号通路的激活具有对细胞的增殖抑制和凋亡诱导作用[20]。在研究DBP对大鼠睾丸的损害作用及相关信号通路的研究中,有研究表明DBP可激活ERK或p38通路[21],诱导凋亡产生,从而引起大鼠睾丸组织结构和功能损伤[22]。本研究发现DBP可上调CB1R的表达,抑制正常的ERK或p38活化,使细胞正常的增殖分化受损,从而影响睾酮分泌、降低精子活力。机制研究表明CBR1能抑制钙离子通道、活化钾离子通道,MAPK通路及激活PI3K通路。无论是对神经胶质细胞还是卵母细胞的研究均发现CBR1的激活都使AKT磷酸化水平升高[23-25]。在本研究中染毒组大鼠CBR1表达明显上调,而AKT的磷酸化水平显著降低。与以上文献报道不一致,提示CBR1可能在不同系统中的作用不同。此外由于内源性大麻素系统作用机制复杂,MAPK信号通路并非CBR1发挥作用的唯一通路,CBR1可能通过多条通路途径发挥作用。
本研究在建立大鼠染毒致精子活力下降模型的基础上,初步阐明了DBP暴露致CB1R上调,并可能通过ERK/p38MAPK信号通路来调控精子发生过程中生精细胞的增殖分化以及睾酮的合成分泌。大麻素系统在生殖过程起着重要的作用,因此对内源性大麻素系统的作用途径,尤其是CBR1作用的深入探索不仅可以丰富对DBP作用机制的认识,而且也能为采取干预CBR1信号通路来改善DBP暴露后导致的生殖损伤提供明确靶点,为环境污染PAEs暴露对男性生殖健康影响提供新的理论依据和可行的干预途径。
| [1] |
李蕾, 宋乃宁, 李海山, 等. 邻苯二甲酸酯类毒理学效应及其机制研究进展[J].
中国药理学与毒理学杂志, 2014, 28(3): 468–474.
LI L, SONG N N, LI H S, et al. Advances of toxicology and toxicologic mechanism of phthalate esters[J]. Chin J Pharm Toxicol, 2014, 28(3): 468–474. DOI:10.3867/j.issn.1000-3002.2014.03.027 |
| [2] | DESDOITS-LETHIMONIER C, ALBERT O, LE BIZEC B, et al. Human testis steroidogenesis is inhibited by phthalates[J]. Human Reproduction, 2012, 27(5): 1451–1459. DOI:10.1093/humrep/des069 |
| [3] | RAPINO C, BATTISTA N, BARI M, et al. Endocannabinoids as biomarkers of human reproduction[J]. Hum Reprod Update, 2014, 20(4): 501–516. DOI:10.1093/humupd/dmu004 |
| [4] | HOWLETT A C, BARTH F, BONNER T I, et al. International union of pharmacology. XXVII. classification of cannabinoid receptors[J]. Pharmacol Rev, 2002, 54(2): 161–202. DOI:10.1124/pr.54.2.161 |
| [5] | MACCARRONE M. Endocannabinoids: Friends and foes of reproduction[J]. Prog Lipid Res, 2009, 48(6): 344–354. DOI:10.1016/j.plipres.2009.07.001 |
| [6] | FRANCAVILLA F, BATTISTA N, BARBONETTI A, et al. Characterization of the endocannabinoid system in human spermatozoa and involvement of transient receptor potential vanilloid 1 receptor in their fertilizing ability[J]. Endocrinology, 2009, 150(10): 4692–4700. DOI:10.1210/en.2009-0057 |
| [7] | BARBONETTI A, VASSALLO M R, FORTUNATO D, et al. Energetic metabolism and human sperm motility: impact of CB1 receptor activation[J]. Endocrinology, 2010, 151(12): 5882–5892. DOI:10.1210/en.2010-0484 |
| [8] | POMATTO V, PALERMO F, MOSCONI G, et al. Xenoestrogens elicit a modulation of endocannabinoid system and estrogen receptors in 4NP treated goldfish, carassiusauratus[J]. Gen Comp Endocrinol, 2011, 174(1): 30–35. DOI:10.1016/j.ygcen.2011.08.001 |
| [9] | BISSET K M, DHOPESHWARKAR A S, LIAO C Y, et al. The G protein-coupled cannabinoid-1 (CB1) receptor of mammalian brain: Inhibition by phthalate esters in vitro[J]. Neurochem Int, 2011, 59(5): 706–713. DOI:10.1016/j.neuint.2011.06.019 |
| [10] |
韩晓杰, 段婷婷, 庞雨, 等. Western blot免疫印迹法检测磷酸化蛋白表达条件优化研究[J].
现代生物医学进展, 2017, 17(21): 4047–4050, 4037.
HAN X J, DUAN T T, PANG Y, et al. Optimization research on the Westem blot experimental conditions for detecting phosphorylated protein[J]. Prog Mod Biomed, 2017, 17(21): 4047–4050, 4037. DOI:10.13241/j.cnki.pmb.2017.21.011 |
| [11] | KUMAR N, SRIVASTAVA S, ROY P. Impact of low molecular weight phthalates in inducing reproductive malfunctions in male mice: Special emphasis on Sertoli cell functions[J]. Gen Comp Endocrinol, 2015, 215: 36–50. DOI:10.1016/j.ygcen.2014.09.012 |
| [12] |
李玉秋, 马明月. 邻苯二甲酸酯对胚胎发育毒作用及其机制的研究进展[J].
环境与职业医学, 2016, 33(6): 606–609.
LI Y Q, MA M Y. Advances on effects of phthalate acid esters on development of embryos and related mechanism[J]. J Environ Occup Med, 2016, 33(6): 606–609. DOI:10.13213/j.cnki.jeom.2016.16111.jeom.2016.16111 |
| [13] | JUREWICZ J, RADWAN M, SOBALA W, et al. Human urinary phthalate metabolites level and main semen parameters, sperm chromatin structure, sperm aneuploidy and reproductive hormones[J]. Reprod Toxicol, 2013, 42: 232–241. DOI:10.1016/j.reprotox.2013.10.001 |
| [14] | CHEN Q, YANG H, ZHOU N Y, et al. Phthalate exposure, even below US EPA reference doses, was associated with semen quality and reproductive hormones: Prospective MARHCS study in general population[J]. Environ Int, 2017, 104: 58–68. DOI:10.1016/j.envint.2017.04.005 |
| [15] |
李俊涛, 曲晓伟, 张蜀武, 等. 益肾生精胶囊对邻苯二甲酸二丁酯致生殖功能损伤大鼠精子质量及生殖激素水平的影响[J].
中华男科学杂志, 2016, 22(12): 1110–1115.
LI J T, QU X W, ZHANG S W, et al. Effects of Yishen-shengjing capsules on semen quality and gonadal hormone levels in rats with dibutyl phthalate-induced reproductive function injury[J]. Nat J Androl, 2016, 22(12): 1110–1115. DOI:10.13263/j.cnki.nja.2016.12.010 |
| [16] | LI H G, DING X F, GUAN H T, et al. Inhibition of human sperm function and mouse fertilization in vitro by an antibody against cation channel of sperm 1: the contraceptive potential of its transmembrane domains and pore region[J]. FertilSteril, 2009, 92(3): 1141–1146. DOI:10.1016/j.fertnstert.2008.07.1751 |
| [17] | DI BLASIO A M, VIGNALI M, GENTILINI D. The endocannabinoid pathway and the female reproductive organs[J]. J Mol Endocrinol, 2013, 50(1): R1–R9. DOI:10.1530/jme-12-0182 |
| [18] | ALMOG T, NAOR Z. Mitogen activated protein kinases (MAPKs) as regulators of spermatogenesis and spermatozoa functions[J]. Mol Cell Endocrinol, 2008, 282(1/2): 39–44. DOI:10.1016/j.mce.2007.11.011 |
| [19] |
钱晓菁, 常青, 许增禄, 等. 磷酸化的丝裂原活化蛋白激酶在大鼠睾丸的表达[J].
解剖学报, 2008, 39(2): 214–218.
QIAN X J, CHANG Q, XU Z L, et al. The expression of phospho-MAPKs in the adult rat testis[J]. Acta Anat Sin, 2008, 39(2): 214–218. DOI:10.3321/j.issn:0529-1356.2008.02.015 |
| [20] | SUN Y H, ZHANG D J, MAO M, et al. Roles of p38 and JNK protein kinase pathways activated by compound cantharidin capsules containing serum on proliferation inhibition and apoptosis of human gastric cancer cell line[J]. Exp Ther Med, 2017, 14(2): 1809–1817. DOI:10.3892/etm.2017.4704 |
| [21] | LEE H L, LIN C S, KAO S H, et al. Gallic acid induces G1 phase arrest and apoptosis of triple-negative breast cancer cell MDA-MB-231 via p38 mitogen-activated protein kinase/ p21/p27 axis[J]. Anticancer Drugs, 2017, 28(10): 1150–1156. DOI:10.1097/CAD.0000000000000565 |
| [22] |
赵金昌, 靳曙光, 徐一波, 等. ERK-MAPK通路在DBP致大鼠睾丸缝隙连接损伤中作用[J].
中国公共卫生, 2017, 33(2): 206–210.
ZHAO J C, JIN S G, XU Y B, et al. Role of ERK-MAPK signaling pathway in dibutyl phthalate induced gap junction injury in testis of rat[J]. Chin J Public Health, 2017, 33(2): 206–210. DOI:10.11847/zgggws2017-33-02-09 |
| [23] | LÓPEZ-CARDONA A P, PÉREZ-CEREZALES S, FERNÁNDEZ-GONZÁLEZ R, et al. CB1 cannabinoid receptor drives oocyte maturation and embryo development via PI3K/Akt and MAPK pathways[J]. FASEB J, 2017, 31(8): 3372–3382. DOI:10.1096/fj.201601382RR |
| [24] | HOWLETT A C, BREIVOGEL C S, CHILDERS S R, et al. Cannabinoid physiology and pharmacology: 30 years of progress[J]. Neuropharmacology, 2004, 47(Suppl 1): 345–358. DOI:10.1016/j.neuropharm.2004.07.030 |
| [25] | MOLINA-HOLGADO E, VELA J M, ARÉVALO-MARTÍN A, et al. Cannabinoids promote oligodendrocyte progenitor survival: involvement of cannabinoid receptors and phosphatidylinositol-3 kinase/Aktsignaling[J]. J Neurosci, 2002, 22(22): 9742–9753. DOI:10.1523/JNEUROSCI.22-22-09742.2002 |


