骨肉瘤(osteosarcoma,OS)是一种多发于青少年的恶性骨肿瘤,因其恶性程度高,侵袭力强,且早期即容易发生肺转移的特点,导致5年生存率很低。随着近年放化疗技术的发展,OS的生存率有所提高,但总体生存率仍然无太大变化[1-2]。尤其是对于早期发生远端转移的患者,其生存率只有30%[3-4]。即使忍受了放疗带来的强烈副作用,其远期生存率也并无改善[5]。由于分子靶向治疗的副作用低以及治疗效果显著,因此其一直是近年研究的热点。
细胞核与细胞质之间物质转运的失平衡在多种肿瘤中被认为是重要的发生机制[6]。小于40×103的小分子主要依赖于渗透作用进入细胞核,而大于40×103的大分子主要由核转运蛋白介导通过核孔复合物(nuclear pore complex,NPC)进入细胞核。核转运蛋白(karyopherina,KPNA)和输入蛋白β(importin β)是核转运蛋白中的两大输入蛋白家族。其中KPNA2在脊椎动物中高度保守,是KPNA家族中重要的成员之一[7]。KPNA2在肝癌中可以通过抑制多形性腺瘤基因1(rattus norvegicus pleiomorphic adenoma gene 1,PLAG1)转运入核从而干扰肝癌细胞的增殖[8],在卵巢癌中可以通过干扰卵巢癌细胞的上皮间充质转化过程从而抑制卵巢癌的转移[9],在肺癌中通过阻断八聚体结合转录因子-4(octamer-binding transcription factor-4,OCT4)入核来抑制肺癌的转移[10]。众所周知,肿瘤血管的形成可以为肿瘤的生长提供必要的氧气和营养,同时为肿瘤的转移提供重要的途径,其中血小板内皮细胞黏附因子1(platelet endothelial cell adhesion molecule-1, Pecam-1)在血管生成中扮演着重要的作用,其常用于检测肿瘤的血管生成。而肿瘤干细胞的干性也为肿瘤的增殖、转移和复发提供了基本的必备条件,其中睾丸决定因子Y染色体性别决定区基因(SRY related HMG box-2,Sox2)正是维持干细胞干性的关键转录因子。
本研究通过对骨肉瘤异体移植物模型进行小动物活体荧光分子断层成像系统(fluorescence molecular tomography,FMT)扫描和免疫组化检测,观察敲低KPNA2对骨肉瘤血管生成的影响,通过RT-qPCR和Western blot检测KPNA2的敲低后Sox2的表达变化。结果显示KPNA2通过影响OS细胞的增殖、OS肿瘤血管的生成及其干细胞干性来影响OS的发生、发展和转移,为KPNA2作为临床OS靶向治疗的分子靶点提供实验依据。
1 材料与方法 1.1 材料人OS细胞Saos-2来自美国模式培养物集存库(American Type Culture Collection, ATCC);GV115-ShRNA慢病毒包装购自上海吉凯基因化学技术有限公司;裸鼠购自北京斯贝福实验动物科技有限公司;RPMI1640购自美国Gibico公司,胎牛血清购自北京Cellmax公司;Matrigel购自美国Corning公司;兔抗人GAPDH、KPNA2、SOX2、Pecam-1一抗购自英国Abcam公司,羊抗兔二抗购自武汉Abclonal公司;TRIzol、逆转录试剂盒、扩增试剂盒购自日本TaKaRa公司;AngioSense 750 EX购自美国PerkinElmer公司。
1.2 细胞培养与慢病毒转染人骨肉瘤Saos-2细胞培养于10%胎牛血清、1%青链霉素配制的RPMI1640培养基中,放置在5% CO2的37 ℃恒温培养箱中。将培养的Saos-2细胞分为两组:转染敲低KPNA2后Sh-KPNA2慢病毒载体的Sh-KPNA2组和转染空载体Sh-Control的Sh-Control组。待其浓度达30%左右,每孔加入MOI=10的病毒感染液1 mL,并于12 h后换成2 mL的RPMI1640培养基。72 h后在荧光显微镜下观察Saos-2内的绿色荧光蛋白,其转染效率达到90%。此时将细胞用胰蛋白酶消化,以2 000/孔的细胞种植在6孔板上,每组3复孔,使用全视野细胞分析仪计数细胞,共记录5 d。
1.3 裸鼠成瘤和生物成像分析成瘤前使Saos-2细胞在培养瓶中约占80%以保证其活力。将其用胰岛素酶消化后,加入1%胎牛血清、无青链霉素的RPMI1640培养基中以保证其侵袭性,细胞数为1×107/mL。将细胞与Matrigel胶1 :1混合后,得到细胞混悬液。10只4~6周的BALB/c nude雌性裸鼠被随机分成Sh-KPNA2和Sh-Control两组,每只背部皮下分别注射400 μL细胞混悬液。培养2周后10只裸鼠全部成瘤,每周用游标卡尺记录2次瘤体大小。5周时,腹腔注射氯胺酮(75 mg/kg)和右美托咪定(0.5 mg/kg)麻醉后,尾静脉注射1 μmol/L的AngioSense 750 EX,48 h后用PerkinElmer的荧光成像仪进行成像。成像完成后于麻醉状态下取出瘤体,将瘤体剪成2 mm3小块若干,分别放置于RNAlater和蛋白裂解液中,置于-80 ℃冰箱以留作后续实验。取出瘤体后颈椎脱臼法处死裸鼠。
1.4 HE染色及免疫组化检测瘤体血管生成指标Pecam-1瘤体组织用于福尔马林固定48 h后用石蜡进行包埋,组织切片置于载玻片上,取瘤体进行脱蜡至脱水后进行HE染色。按照免疫组化试剂盒说明书步骤进行操作。用Image-Pro Plus 6.0分析Pecam-1蛋白表达情况。
1.5 RT-qPCR检测KPNA2和Sox2的表达取出冻存的瘤体将其放入含有3粒钢制研磨珠的研磨管内,并将其投入盛有液氮的保温杯。1 min后取出EP管放入多样品组织匀浆机,75 Hz,1 min后取出研磨管。将研磨管再次放入盛有液氮的保温杯1 min以将组织粉末化。TRIzol法提取总RNA,保证D(260)/D(280)在1.8~2.0。进行逆转录得到cDNA。以cDNA为模板,用TaKaRa扩增试剂盒进行PCR扩增。GAPDH为内参基因,引物序列如下:KPNA2正义链5′- TGTGGTAGATGGAGGTGC-3′,反义链5′-GAGCCAACAGTGGGTCA-3′;Sox2正义链5′-AGCTACAGCATGATGCAGGA-3′,反义链5′-GGTCATGGAGTTGTACTGCA-3′。
1.6 Western blot检测KPNA2和Sox2的表达将瘤体用组织匀浆机研磨后,加入蛋白裂解液进行裂解,14 000 r/min离心15 min后取上清,用BCA法测蛋白浓度。使用10孔梳,每孔蛋白量为15 μg,进行电泳,PVDF膜转膜,孵育一、二抗后曝光。转膜条件为90 V恒压90 min。以GAPDH为内参蛋白,使用其灰度值的差值来表示KPNA2和Sox2的相对表达量。
1.7 统计学分析采用SPSS 22.0统计软件,计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,检验水准:α=0.05。
2 结果 2.1 Sh-KPNA2抑制OS细胞增殖通过两组转染后的荧光显微镜观察(图 1)及细胞生长曲线(图 2)可见,相较于Sh-Control组,Sh-KPNA2组细胞生长趋势受到抑制(P<0.05)。
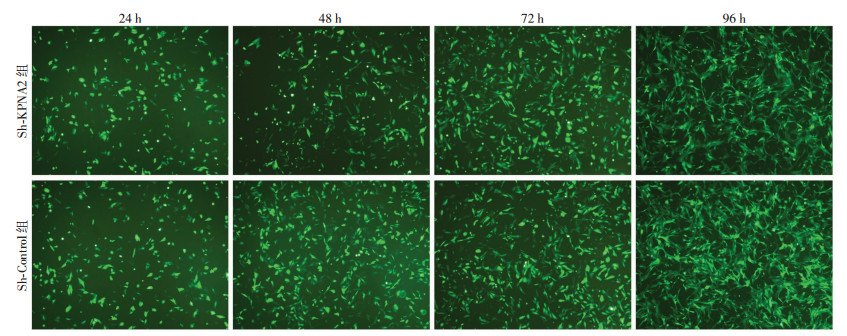
|
| 图 1 荧光显微镜下观察Saos-2细胞转染不同病毒后不同时间的变化 (×200) |
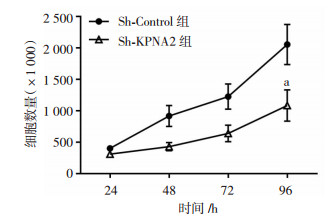
|
| a:P<0.05,与Sh-Control组比较 图 2 Sh-KPNA2组与Sh-Control组细胞生长曲线 |
2.2 Sh-KPNA2体内抑制OS生长
两组裸鼠大体观以及肿瘤的生长曲线(图 3)可见,收获时,Sh-KPNA2组小鼠瘤体体积为(1 289.00± 481.57) mm3,明显小于Sh-Control组的(2 913.33± 1 158.46)mm3,且Sh-KPNA2组小鼠瘤体质量为(1.20± 0.15)g,明显小于Sh-Control组的(2.21±0.37)g,差异均有统计学意义(P<0.05)。
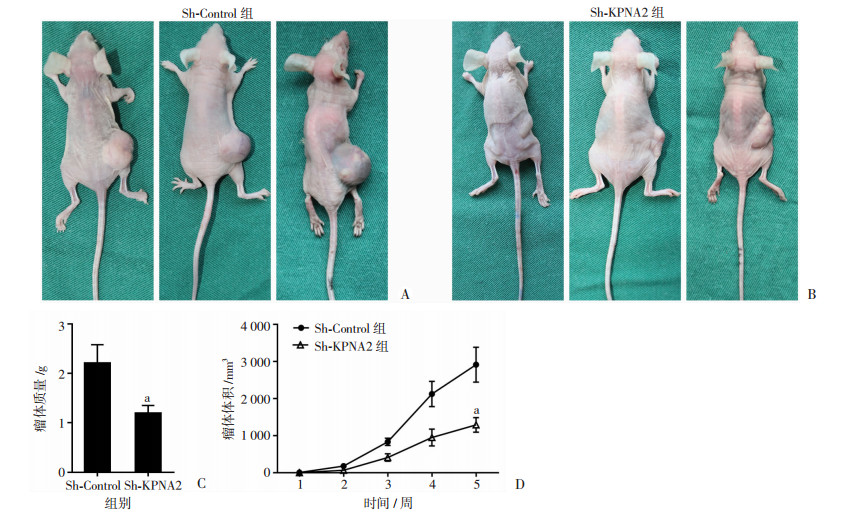
|
| A、B:分别为Sh-Control组和Sh-KPN A2组裸鼠大体观;C:两组肿瘤质量对比;D:两组肿瘤生长曲线分析 a:P < 0.05与Sh-Control组比较 图 3 两组裸鼠成瘤后大体观与瘤体大小对比分析 |
2.3 Sh-KPNA2体内抑制OS血管生成
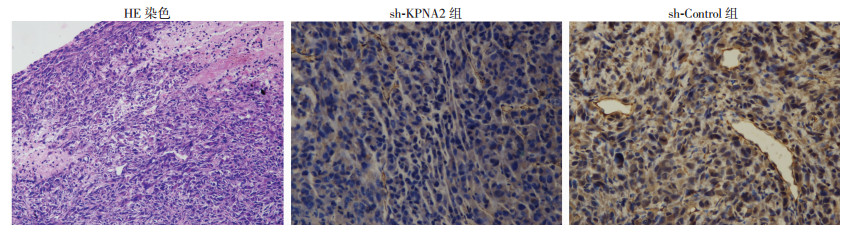
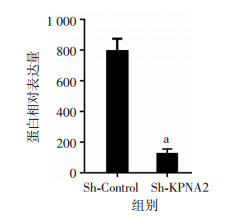
对AngioSense 750 EX扫描发现,Sh-Control组体内的OS血管生成明显多于Sh-KPNA2组(图 4, P<0.05)。显示敲低KPNA2对肿瘤血管生成产生了强烈的抑制作用。对瘤体用Pecam-1免疫组化染色(图 5)发现,Sh-Control组的血管明显比Sh-KPNA2组更为粗大,Pecam-1的表达更多(P<0.05, 图 6),血管生成更加强烈。
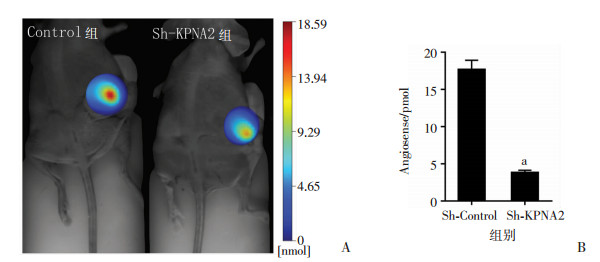
|
| a:P<0.05,与Sh-Control组比较 图 4 Sh-KPNA2组与Sh-Control组裸鼠活体生物荧光成像观(A)与Angiosense相对表达(B) |
|
| 图 5 移植瘤组织HE染色(×100)与两组裸鼠瘤体Pecam-1免疫组化染色结果 (二步法×200) |
|
| a:P<0.05,与Sh-Control组比较 图 6 Sh-KPNA2组与Sh-Control组裸鼠瘤体Pecam-1相对表达量分析 |
2.4 Sh-KPNA2抑制Sox2的表达
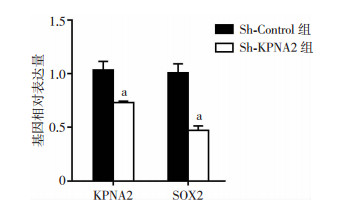
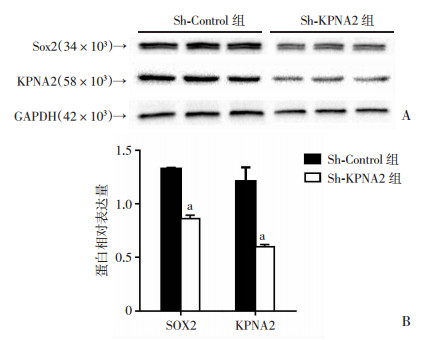
收集裸鼠瘤体后进行qRT-PCR(图 7)和Western blot(图 8)检测,结果显示,与Sh-Control组比较,Sh-KPNA2组不仅KPNA2的表达受到了抑制,Sox2的表达也受到了抑制(P<0.05)。表明敲低KPNA2基因对OS的干细胞干性也产生了严重的影响。
|
| a:P<0.05,与Sh-Control组比较 图 7 RT-qPCR检测Sh-KPNA2组与Sh-Control组裸鼠瘤体Sox2的表达 |
|
| a:P<0.05,与Sh-Control组比较 图 8 Western blot检测Sh-KPNA2组与Sh-Control组裸鼠瘤体Sox2的表达 |
3 讨论
KPNA2作为核转运蛋白,其通过胞质运输过程参与了多种生命活动。其在前列腺癌、乳腺癌、卵巢癌、子宫内膜癌等多种恶性肿瘤中已被证实高表达[9, 11],但其对OS的在体影响还不清楚。本实验旨在研究敲低KPNA2后,对OS的在体影响。本研究发现,使用慢病毒载体敲低OS细胞Saos-2内的KPNA2后,细胞增殖受到了明显的抑制。将转染了慢病毒的Saos-2转入裸鼠体内进行成瘤之后发现裸鼠在体的肿瘤生长也因为KPNA2的敲低受到了明显的抑制。
由于肿瘤的生长需要肿瘤血管带来远端的营养,所以肿瘤血管的形成是OS发生、发展的关键。WANG等[12]发现在多种恶性肿瘤中KPNA2的表达与雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)密切正相关。而mTOR可通过PI3K/Akt/mTOR信号通路影响恶性肿瘤的血管生成[13]。本研究通过FMT扫描发现,敲低KPNA2后,AngioSense的荧光强度明显减低,说明肿瘤新生血管生成受到了明显抑制。这可能是导致OS生长受限的原因之一。
肿瘤干细胞学说表明肿瘤的干细胞干性影响着肿瘤的发生,发展,复发与转移[14]。Sox2是转录因子家族Sox中的一员,其内的高迁移基因域(high mobility group,HMG)负责与DNA序列特异性结合,从而调控基因的修复与复制。Sox2在维持人类干细胞的多功能性方面发挥着重要的作用,但是同时其也对维持肿瘤细胞的低分化性起着重要的作用。相关研究表明,Sox2对OS的干细胞干性有着至关重要的影响[15]。本研究发现在裸鼠的瘤体内,KPNA2的敲除会导致Sox2表达量的减少。其可能的机制是由于作为核转运蛋白的KPNA2可以影响转录因子向核内的转运,而敲低KPNA2影响Sox2蛋白向核内的转运,进而通过Wnt/β-catenin通路影响OS细胞的增殖和肿瘤生成[16]。
本研究通过体内外实验观察敲低KPNA2后OS细胞增殖和荷瘤小鼠体内血管生成的情况,证实敲低KPNA2可抑制OS细胞的增殖和血管生成。但本研究尚未得到临床大样本研究的验证,而且KPNA2与Sox2的具体相互作用机制还未探明。综上所述,KPNA2在OS发展进程中扮演重要角色,其机制可能是通过影响肿瘤血管形成和肿瘤干细胞干性进而影响OS的增殖。KPNA2有望成为OS治疗的重要靶向基因。
| [1] | LUETKE A, MEYERS P A, LEWIS I, et al. Osteosarcoma treatment——where do we stand? A state of the art review[J]. Cancer Treat Rev, 2014, 40(4): 523–532. DOI:10.1016/j.ctrv.2013.11.006 |
| [2] | FERRARI S, MEAZZA C, PALMERINI E, et al. Nonmetastatic osteosarcoma of the extremity. Neoadjuvant chemotherapy with methotrexate, cisplatin, doxorubicin and ifosfamide. An Italian Sarcoma Group study (ISG/OS-Oss)[J]. Tumori, 2014, 100(6): 612–619. DOI:10.1700/1778.19262 |
| [3] | BULUT G, HONG S H, CHEN K, et al. Small molecule inhibitors of ezrin inhibit the invasive phenotype of osteosarcoma cells[J]. Oncogene, 2012, 31(3): 269–281. DOI:10.1038/onc.2011.245 |
| [4] | DURFEE R A, MOHAMMED M, LUU H H. Review of osteosarcoma and current management[J]. Rheumatol Ther, 2016, 3(2): 221–243. DOI:10.1007/s40744-016-0046-y |
| [5] | SCHWARTZ B, BENADJAOUD M A, CLÉRO E, et al. Risk of second bone sarcoma following childhood cancer: role of radiation therapy treatment[J]. Radiat Environ Biophys, 2014, 53(2): 381–390. DOI:10.1007/s00411-013-0510-9 |
| [6] | VERHAAK R G, GOUDSWAARD C S, VAN PUTTEN W, et al. Mutations in nucleophosmin (NPM1) in acute myeloid leukemia (AML): association with other gene abnormalities and previously established gene expression signatures and their favorable prognostic significance[J]. Blood, 2005, 106(12): 3747–3754. DOI:10.1182/blood-2005-05-2168 |
| [7] | HUANG L, WANG H Y, LI J D, et al. KPNA2 promotes cell proliferation and tumorigenicity in epithelial ovarian carcinoma through upregulation of c-Myc and downregulation of FOXO3a[J]. Cell Death Dis, 2013, 4(8): e745. DOI:10.1038/cddis.2013.256 |
| [8] | HU Z Y, YUAN S X, YANG Y, et al. Pleomorphic adenoma gene 1 mediates the role of karyopherin alpha 2 and has prognostic significance in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2014, 33: 61. DOI:10.1186/s13046-014-0061-1 |
| [9] | LIN J X, ZHANG L, HUANG H, et al. MiR-26b/KPNA2 axis inhibits epithelial ovarian carcinoma proliferation and metastasis throughdownregulating OCT4[J]. Oncotarget, 2015, 6(27): 23793–23806. DOI:10.18632/oncotarget.4363 |
| [10] | LI X L, JIA L L, SHI M M, et al. Downregulation of KPNA2 in non-small-cell lung cancer is associated with Oct4 expression[J]. J Transl Med, 2013, 11(1): 232. DOI:10.1186/1479-5876-11-232 |
| [11] | BLATTNER M, LEE D J, O'REILLY C, et al. SPOP mutations in prostate cancer across demographically diverse patient cohorts[J]. Neoplasia, 2014, 16(1): 14. DOI:10.1593/neo.131704 |
| [12] | WANG C I, CHEN YY, WANG C L, et al. mTOR regulates proteasomal degradation and Dp1/E2F1-mediated transcription of KPNA2 in lung cancer cells[J]. Oncotarget, 2016, 7(18): 25432–25442. DOI:10.18632/oncotarget.8170 |
| [13] | FAES S, SANTORO T, DEMARTINES N, et al. Evolving significance and future relevance of anti-angiogenic activity of mTOR inhibitors in cancer therapy[J]. Cancers (Basel), 2017, 9(11): E152. DOI:10.3390/cancers9110152 |
| [14] | AUFFINGER B, TOBIAS A L, HAN Y, et al. Conversion of differentiated cancer cells into cancer stem-like cells in aglioblastoma model after primary chemotherapy[J]. Cell Death Differ, 2014, 21(7): 1119–1131. DOI:10.1038/cdd.2014.31 |
| [15] | MARTINS-NEVES S R, CORVER W E, PAIVA-OLIVEIRA D I, et al. Osteosarcoma stem cells have active wnt/β-catenin and overexpress SOX2 and KLF4[J]. J Cell Physiol, 2016, 231(4): 876–886. DOI:10.1002/jcp.25179 |
| [16] | MAURIZI G, VERMA N, GADI A, et al. Sox2 is required for tumor development and cancer cell proliferation in osteosarcoma[J]. Oncogene, 2018, 37(33): 4626–4632. DOI:10.1038/s41388-018-0292-2 |



