冠脉介入是目前常用的急性心肌梗死(acute myocardial infarction,AMI)治疗手段,可在一定程度上再通血管、挽救濒临死亡的心肌。然而,由此带来的缺氧再灌注损伤可使心肌细胞产生大量的氧自由基,线粒体功能障碍,钙稳态失调,从而导致冠脉再通后心肌细胞发生凋亡坏死,最终引起的心室重构进而发展为心力衰竭甚至心源性猝死[1-2]。
miRNAs通过与靶基因mRNA 3′/5′UTR中6~8个碱基互补结合,从而影响蛋白质翻译过程,进而达到沉默基因表达的效应[3-4]。有研究表明,在心肌梗死边缘区miR-214明显上调,miR-214可通过多条信号通路提高心脏谱系细胞抗氧化应激能力[5],并能通过抑制钠/钙交换通道1(NCX1),进而降低氧化应激状态下细胞内钙负荷[6]。我们通过(www.targetscan.org/)及GCBI在线平台(www.gcbi.com.cn)发现miR-214可通过3′UTR靶向调节CaMKⅡ mRNA翻译过程。CaMKⅡ为Ca2+/CaM信号通路中关键酶,活化的CaMK2可多途径调节细胞氧化应激水平[7]。目前,关于miR-214/ CaMKⅡ对缺氧复氧条件下心肌细胞氧化应激水平的调节作用尚不清楚。本研究观察miR-214/CaMKⅡ对缺氧复氧心肌细胞的调节作用,探讨其潜在的作用机制,为临床心肌缺血再灌注损伤治疗提供新的实验依据。
1 材料与方法 1.1 主要材料ROS检测试剂盒购自上海索来宝公司,miR-214、CaMKⅡ引物由广州锐博生物公司设计,SOD、MAD检测试剂盒购自南京建成生物公司,TUNEL检测试剂盒购自Sigma公司,miR-214茎环法逆转录试剂盒购自广州锐博生物公司,qPCR试剂盒购自上海生工生物公司,双荧光素酶报告基因试剂盒购自广州锐博生物公司,Anti-CaMKⅡ、Anti-β-actin兔抗大鼠一抗购自博士德生物公司。
1.2 H9c2心肌细胞传代培养及缺氧复氧模型建立H9c2大鼠心肌细胞株(上海中国科学院细胞库)经消化后传代培养,待细胞密度达到80%左右时重复传代操作,取P5~P8代细胞进行后续实验。采用37 ℃ 5%CO2、94%N2、1%O2不含FBS的低糖DMEM完全培养液作为该细胞的缺氧培养条件。采用37 ℃ 5% CO2、95%O2培养箱,含10%FBS高糖DMEM培养液作为H9c2心肌细胞培养的复氧条件。设计不同的缺氧及复氧时间,采用CCK-8法检测细胞活性,探索诱导H9c2心肌细胞氧化损伤的最佳缺氧复氧时间。通过预实验,将缺氧24 h复氧6 h作为诱导H9c2心肌细胞氧化损伤条件。
1.3 以脂质体2000为载体转染miR-214至H9c2心肌细胞中并建立缺氧复氧模型取生长良好的P5~P8代H9c2心肌细胞,消化、收集细胞并进行细胞计数,细胞按每孔5×105接种于6孔板中,37 ℃孵箱继续培养过夜,观察细胞生长状态、弃去培养基,采用脂质体2000并按说明书进行转染miR-214模拟物及其阴性对照至细胞内。实验分4组,①正常组:正常培养的心肌细胞;②缺氧复氧组:心肌细胞经缺氧24 h复氧6 h处理;③miR-214模拟物组:心肌细胞转染miR-214模拟物后予缺氧复氧处理;④miR-214模拟物阴性对照组:心肌细胞转染miR-214模拟物阴性对照后予以缺氧复氧处理。
1.4 荧光定量PCR检测细胞中miR-214及CaMKⅡ mRNA水平按RNA抽提试剂盒说明书进行,提取总RNA,miR-214通过茎环法逆转录试剂盒说明书进行逆转录,按miRNA荧光定量PCR试剂盒进行cDNA扩增。以U6为内参,CaMKⅡ按普通mRNA逆转录试剂盒进行操作,随后按荧光定量PCR试剂盒进行cDNA扩增,引物序列见表 1。实验重复3次,数据通过2-△△Ct法进行分析。
| 引物 | 序列 |
| miR-214逆转录引物 | 5′-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAACCGAT-3′ |
| 上游引物 | 5′-TTGGGCATATGTGACCATCA-3′ |
| 下游引物 | 5′-GGAGCTCAACCATACCAGGA-3′ |
| U6逆转录引物 | 5′-AACGCTTCACGAATTTGCGT-3′ |
| 上游引物 | 5′-CTCGCTTCGGCAGCACA-3′ |
| 下游引物 | 5′-AACGCTTCACGAATTTGCGT-3′ |
| CaMKⅡ上游引物 | 5′-TTGGGCATATGTGACCATCA-3′ |
| 下游引物 | 5′-GGAGCTCAACCATACCAGGA-3′ |
| kβ-actin上游引物 | 5′-CTCGCTTCGGCAGCACA-3′ |
| 下游引物 | 5′-AACGCTTCACGAATTTGCGT-3′ |
1.5 流式细胞术检测ROS荧光探针DCFH-DA变化
运用原位荧光探针装载法装载DCFH-DA荧光探针,使用流式细胞术(FCM)检测FITC通道DCF的荧光信号值变化。选取生长状态良好的H9c2心肌细胞,按条件处理细胞后,按ROS试剂盒说明书进行操作,并采用流式细胞仪上机检测,每组重复3次。
1.6 检测超氧化物歧化酶及丙二醛的表达按不同条件处理细胞后,收集细胞培养液于-20 ℃冻存,随后按试剂盒说明书检测细胞内超氧化物歧化酶(superoxide dismutase,SOD)与丙二醛(malondialdehyde,MDA)的表达变化。
1.7 TUNEL法检测细胞凋亡水平接种细胞至petra皿中后,根据分组对应实验条件处理细胞,PBS液润洗1~2遍后加入4%多聚甲醛1 mL室温固定1 h,洗涤后以0.1 mol/L pH 6.0柠檬酸钠缓冲液配制的0.1%Triton X-100 500 μL破膜2 min,再以PBS液摇床洗涤细胞2次,5 min/次,弃掉洗涤液后,避光加入100 μL预先配制好的TUNEL反应混合液。将皿置入37 ℃ 5%CO2培养箱中避光孵育1 h后洗涤3次,5 min/次,DAPI避光孵育5~10 min,PBS液摇床洗涤3次后荧光显微镜拍照, Image J软件计算TUNEL阳性细胞数及接种细胞数后统计分析。
1.8 CCK-8法检测细胞活力情况选取生长良好的P5代H9c2心肌细胞,经计数后接种于96孔板中,待贴壁满意后,按不同条件处理细胞后,每孔中加入20 μL CCK-8溶液,于细胞培养箱内继续孵育1 h;随后用酶标仪测定波长450 nm处每孔的光密度值[D(450)],将实验组每孔的光密度值减去对应空白组的光密度值即为不同处理条件对细胞活性的影响,分析比较不同组之间细胞活力情况。
1.9 双荧光素酶报告基因将含有miR-214靶位点的CaMKⅡ 3′-UTR插入荧光素酶基因编码区下游的报告基因载体psi-CHECK2, 构建psi-CHECK2-CaMKⅡ野生型重组报告基因载体(psi-CHECK2-CaMKⅡ-WT),以及构建突变型报告基因载体(psi-CHECK2-CaMKⅡ-Mut),将野生型和突变型报告基因载体与miR-214模拟物和阴性对照分别共转染入H9c2心肌细胞培养48 h后,收集细胞。采用双荧光素酶活性报告系统检测细胞的荧光素酶活性。
1.10 采用腺病毒转染过表达细胞中CaMKⅡ取P5~P8代生长状况良好的H9c2心肌细胞,待细胞融合约80%时,转染携带CaMKⅡ基因并表达GFP绿色荧光蛋白的重组腺病毒(Ad-Caspase-1-GFP)或表达GFP的空病毒(Ad-GFP),以感染复数(multiplicity of infection,MOI)为100进行腺病毒转染。预实验中发现,48 h时转染效率>80%,48 h与72 hGFP阳性表达的细胞数量无明显差别,但感染72 h时细胞脱落现象更广泛,故后续实验将采用腺病毒转染48 h作为转染时间。实验分4组,①缺氧复氧组:心肌细胞经缺氧24 h复氧6 h处理;②miR-214模拟物组:心肌细胞转染miR-214模拟物后予缺氧复氧处理;③miR-214模拟物+CaMKⅡ组:采用腺病毒转染CaMKⅡ至心肌细胞48 h,随后转染miR-214模拟物24 h后予缺氧复氧处理;④miR-214模拟物+空病毒组:采用空载腺病毒转染心肌细胞48 h,随后转染miR-214模拟物24 h后予缺氧复氧处理。
1.11 Western blot检测CaMKⅡ蛋白表达变化按实验分组对各组细胞进行干预,干预之后提取各组细胞蛋白并测定浓度(按BCA蛋白定量试剂盒说明书操作)。将提取的总蛋白与5×蛋白上样缓冲液按4 :1比例充分混匀后,蛋白变性(99 ℃,10 min)。等量上样至SDS-PAGE凝胶,55 V跑积层胶55 min,100 V跑至胶底部,然后转膜至PVDF膜,5% BSA封闭1 h,一抗孵育4 ℃过夜,加入辣根过氧化物酶标记二抗室温孵育1 h,用免疫印迹曝光仪检测灰度值,实验重复3次。
1.12 统计学分析采用SPSS 13.0统计软件,正态分布资料以x ± s表示,组间比较采用单因素方差分析,方差齐采用LSD法,方差不齐采用Tambane’s T2法,偏态分布资料采用多个独立样本非参数检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 心肌细胞传代培养及缺氧复氧模型的确立H9c2心肌细胞消化后传代培养第2天,可见大量扩增的长梭形细胞呈岛状环形分布,细胞融合至80%左右(图 1A),可进行后续功能实验或继续消化、传代培养。根据预实验结果,选取缺氧24 h复氧6 h为诱导H9c2心肌细胞氧化应激处理时间,可见经缺氧复氧处理的心肌细胞,细胞皱缩明显,形态不规则,细胞密度明显下降,并可见大量已经皱缩呈团的坏死细胞(图 1B)。
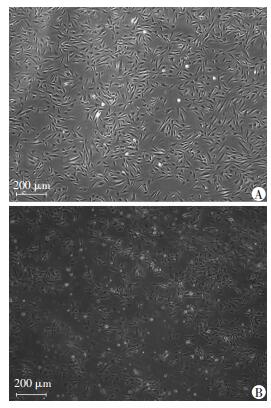
|
| A:常氧条件下培养;B:缺氧24 h复氧6 h 图 1 电镜观察H9c2心肌细胞形态 |
2.2 不同条件处理H9c2心肌细胞活力及miR-214相对表达量变化
为验证miR-214调控缺氧复氧诱导心肌细胞氧化应激损伤的作用,采用CCK-8法检测各组细胞活力情况(图 2)。与正常组比较,缺氧复氧组及miR-214模拟物阴性对照组细胞活力显著下降(P < 0.05);而与缺氧复氧组比较,miR-214模拟物组中细胞活力显著上调(P < 0.05)。qPCR结果显示(图 3),与正常组比较,缺氧复氧组及miR-214模拟物阴性对照组中miR-214表达显著下降(P < 0.05),而miR-214模拟物组中miR-214明显上调(P < 0.05)。推测miR-214与缺氧复氧诱导细胞损伤存在负相关。

|
| 1:正常组;2:缺氧复氧组;3:miR-214模拟物组;4:miR-214模拟物阴性对照组;a:P < 0.05,与正常组比较;b:P < 0.05,与缺氧复氧组比较 图 2 CCK-8法检测各组细胞活力(n=9,x ± s) |

|
| 1:正常组;2:缺氧复氧组;3:miR-214模拟物组;4:miR-214模拟物阴性对照组;a:P < 0.05,与正常组比较;b:P < 0.05,与缺氧复氧组比较 图 3 qPCR检测各组细胞中miR-214的表达(n=9,x ± s) |
2.3 miR-214对HR诱导H9c2心肌细胞ROS释放的影响
运用DCFH-DA试剂盒检测miR-214对缺氧复氧诱导H9c2心肌细胞ROS释放的影响。采用FCM检测FITC通道荧光变化来反映ROS的DCF荧光信号值。结果显示,与正常组比较,缺氧复氧组ROS释放比例显著增高(P < 0.05,图 4);与缺氧复氧组比较,miR-214模拟物组ROS释放比例显著降低(P < 0.05,图 4)。推测miR-214可改善缺氧复氧诱导的细胞氧化应激状态。
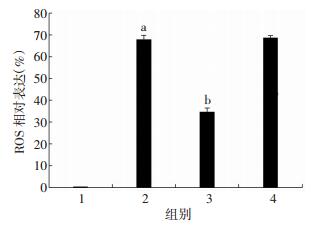
|
| 1:正常组;2:缺氧复氧组;3:miR-214模拟物组;4:miR-214模拟物阴性对照组;a:P < 0.05,与正常组比较;b:P < 0.05,与缺氧复氧组比较 图 4 不同处理条件下H9c2心肌细胞中ROS释放百分比 |
2.4 miR-214对HR诱导H9c2心肌细胞凋亡的影响
TUNEL免疫荧光检测H9c2心肌细胞凋亡晚期DNA片段化情况(图 5),正常组TUNEL阳性细胞比例数较少,缺氧复氧及miR-214模拟物阴性对照组TUNEL阳性细胞数比例显著增加,而miR-214模拟物组TUNEL阳性细胞比例较缺氧复氧组明显下降。说明miR-214模拟物可显著抑制缺氧复氧诱导的H9c2心肌细胞晚期凋亡过程中DNA的片段化效应,从而抑制凋亡的发生。
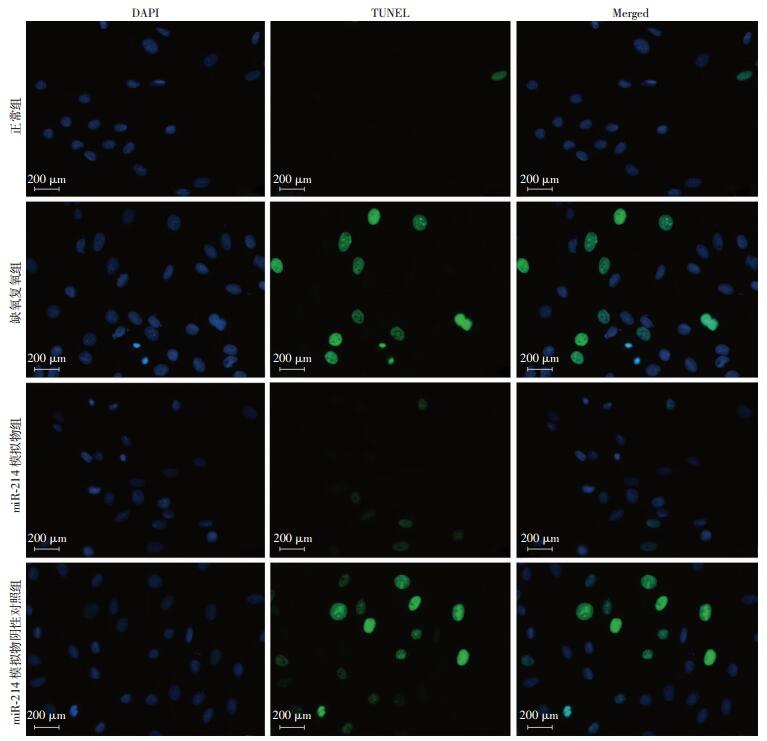
|
| 图 5 免疫荧光观察不同处理条件下H9c2心肌细胞中TUNEL阳性表达 |
2.5 miR-214对HR诱导H9c2心肌细胞中SOD与MDA表达的影响
结果显示,与正常组比较,缺氧复氧组及miR-214模拟物阴性对照组细胞中SOD表达下降,而MDA表达升高,差异均具有统计学意义(P < 0.05,图 6)。与缺氧复氧组比较,miR-214模拟物组中抗氧化应激作用的SOD显著增高,而促进氧化损伤的MDA明显下降(P < 0.05,图 6)。进一步验证了miR-214可调控缺氧复氧诱导的氧化应激效应。

|
| 1:正常组;2:缺氧复氧组;3:miR-214模拟物组;4:miR-214模拟物阴性对照组;a:P < 0.05, 与正常组比较;b:P < 0.05,与缺氧复氧组比较 图 6 miR-214对HR诱导H9c2心肌细胞中SOD(A)与MDA(B)表达的影响(n=3,x ± s) |
2.6 miR-214靶向抑制CaMKⅡ
经TargetScan生物信息学网站检测miR-214与CaMKⅡ在小鼠细胞中存在结合位点,进一步采用双荧光素酶报告基因结果显示在H9c2心肌细胞中miR-214可与CaMKⅡ相结合(图 7)。为进一步检测miR-214对靶基因CaMKⅡ的抑制效应,从mRNA及蛋白水平分别检测CaMKⅡ表达量,结果显示(图 8、9),与正常组比较,缺氧复氧可诱导CaMKⅡ的mRNA及蛋白水平显著增高(P < 0.05),与缺氧复氧组比较,miR-214模拟物组CaMKⅡ在mRNA及蛋白水平均明显下降(P < 0.05),提示miR-214可与CaMKⅡ相结合,从而抑制CaMKⅡ表达。

|
| MNC:miR-214模拟物阴性对照;Mimics:miR-214模拟物;WT:野生型;MT:突变型;a:P < 0.05,与MT比较 图 7 miR-214与CaMKⅡ在小鼠细胞中TargetScan预测结合位点(A)以及双荧光素酶活性分析(B) (n=3,x ± s) |
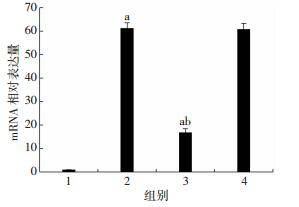
|
| 1:正常组;2:缺氧复氧组;3:miR-214模拟物组;4:miR-214模拟物阴性对照组;a:P < 0.05,与正常组比较;b:P < 0.05,与缺氧复氧组比较 图 8 各组CaMKⅡ mRNA相对表达量(n=3,x ± s) |
|
|
1:正常组;2:缺氧复氧组;3:miR-214模拟物组;4:miR-214模拟物阴性对照组;a:P < 0.05,与正常组比较;b:P < 0.05,与缺氧复氧组比较 A:Western blot检测结果;B:半定量分析结果 图 9 Western blot检测不同处理条件下CaMKⅡ蛋白的表达(n=3,x ± s) |
2.7 腺病毒转染过表达细胞中CaMKⅡ基因后,miR-214对细胞氧化应激及凋亡的影响
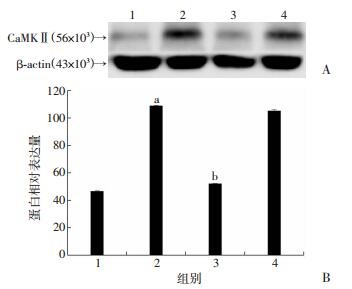
为进一步验证miR-214通过靶向抑制CaMKⅡ发挥抗缺氧复氧诱导的细胞氧化应激及凋亡作用,采用过表达细胞中CaMKⅡ作为回复实验。Western blot检测显示,与缺氧复氧组比较,miR-214模拟物组中CaMKⅡ表达显著下降(P < 0.05,图 10);而与miR-214模拟物组比较,miR-214模拟物+CaMKⅡ组细胞中CaMKⅡ表达显著增加(P < 0.05,图 10),miR-214模拟物+空病毒组中CaMKⅡ表达无显著变化,可见采用腺病毒转染可明显增加CaMKⅡ蛋白表达量,抵抗miR-214对CaMKⅡ的靶向抑制作用。

|
|
1:缺氧复氧组;2:miR-214模拟物组;3:miR-214模拟物+ CaMKⅡ组;4:miR-214模拟物+空载病毒组;a:P < 0.05,与缺氧复氧组比较;b:P < 0.05,与miR-214模拟物组比较 A:Western blot检测结果;B:半定量分析结果 图 10 过表达CaMKⅡ后Western blot检测各组CaMKⅡ蛋白的表达(n=3,x ± s) |
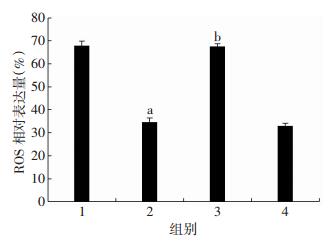
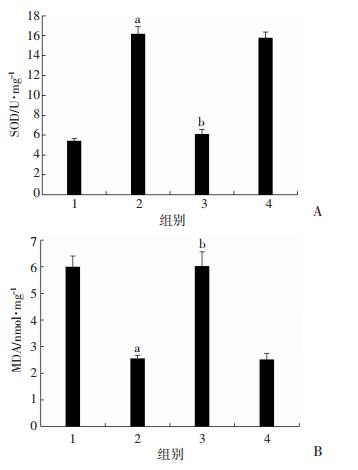
采用流式细胞术检测细胞中ROS变化(图 11),与缺氧复氧组比较,miR-214模拟物组ROS释放比例显著降低,差异具有统计学意义(P < 0.05)。与miR-214模拟物组比较,miR-214模拟物+CaMKⅡ组ROS释放比例显著增加(P < 0.05)。细胞内SOD及MDA水平反映细胞氧化应激损伤程度,检测结果见图 12,与缺氧复氧组比较,miR-214模拟物组SOD显著增高,MDA明显下降(P < 0.05),与miR-214模拟物组比较,miR-214模拟物+CaMKⅡ组中SOD表达下降,而MDA表达增高,差异具有统计学意义(P < 0.05),提示过表达细胞中CaMKⅡ可抵消miR-214抗缺氧复氧诱导的细胞氧化应激损伤效应。
|
| 1:缺氧复氧组;2:miR-214模拟物组;3:miR-214模拟物+ CaMKⅡ组;4:miR-214模拟物+空载病毒组;a:P < 0.05,与缺氧复氧组比较;b:P < 0.05,与miR-214模拟物组比较 图 11 流式细胞术检测各组H9c2心肌细胞中ROS释放百分比(n=3,x ± s) |
|
| 1:缺氧复氧组;2:miR-214模拟物组;3:miR-214模拟物+ CaMKⅡ组;4:miR-214模拟物+空载病毒组a:P < 0.05, 与缺氧复氧组比较;b:P < 0.05, 与miR-214模拟物组比较 图 12 过表达CaMKⅡ后miR-214对HR诱导H9c2心肌细胞中SOD(A)及MDA(B)表达的影响(n=3,x ± s) |
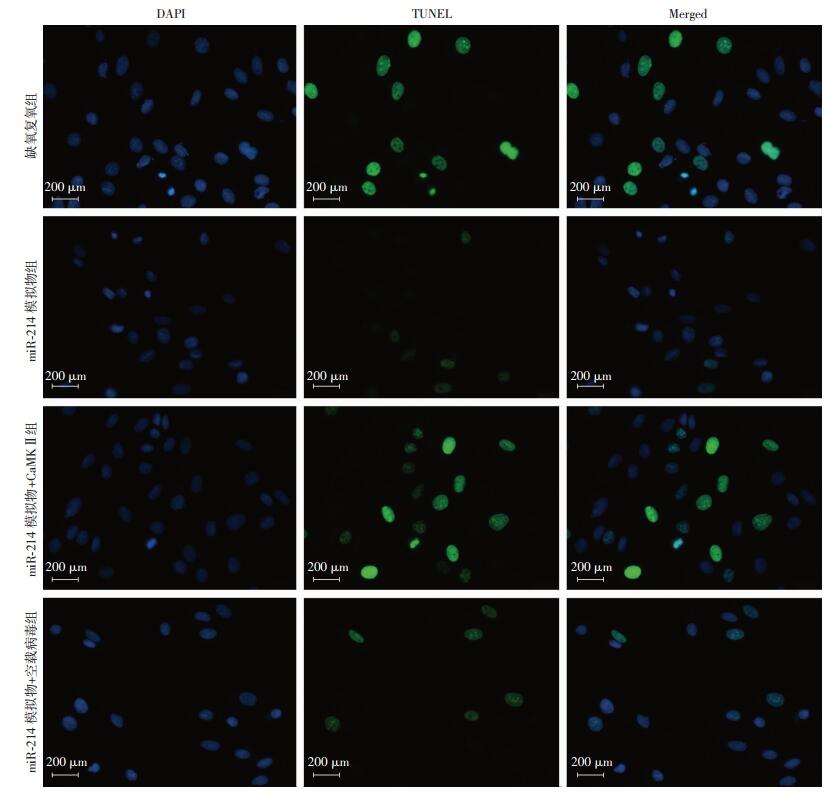
进一步采用TUNEL免疫荧光检查H9c2凋亡晚期DNA片段化,结果见图 13,与缺氧复氧组比较,miR-214组TUNEL染色阳性细胞数比例显著下降,而与miR-214组比较,miR-214+CaMKⅡ组TUNEL阳性细胞比例显著增加。说明过表达CaMKⅡ可部分抵消miR-214抗细胞凋亡效应。
|
| 图 13 免疫荧光观察过表达CaMKⅡ后不同处理条件下H9c2心肌细胞中TUNEL阳性表达 |
3 讨论
研究表明,在缺血再灌注(ischemia reperfusion, I/R)损伤过程中往往伴随着心肌细胞活性氧(ROS)的过度累积、线粒体功能障碍、离子功能紊乱,从而引发心肌细胞凋亡、坏死等变化[8-9],在心肌梗死(myocardial infarction, MI)后心肌细胞经历的缺氧复氧过程同样会造成不可逆性的心肌细胞氧化应激损伤,导致细胞凋亡或坏死,从而引起心功能不全的发生[10]。如何减少缺氧复氧引起的心肌细胞氧化损伤从而改善心室重构,恢复梗死后心脏功能是防治心血管疾病的重要举措[11]。
miRNAs是微小非编码RNAs,长约有20个核苷酸,通过与靶基因mRNAs的3′-UTRs或5′-UTRs特异性结合,或促进mRNA降解,进而调节转录后靶基因翻译过程[12-13]。在过去的几年里,多项研究表明miRNAs可能是细胞分化、增殖以及凋亡的重要调控因子[14-16]。miR-214为心脏特异性miRNA,而且还是缺氧诱导型miRNA[17-19]。LU等[20]研究发现,在缺血性疾病患者血液中miR-214明显升高。此外,在心肌梗死大鼠模型的心梗区域及心梗边缘区亦发现miR-214升高趋势。在小鼠缺血再灌注损伤模型中,miR-214敲除个体中心肌细胞凋亡明显增加,并且伴随着细胞内钙离子紊乱[21]。由此可见miR-214对缺血再灌注损伤心脏中的心肌细胞具有保护作用。故本研究设想,是否能通过提高心肌细胞中miR-214的表达进而改善缺氧复氧诱导的心肌细胞氧化应激及细胞凋亡。
本实验采用CCK-8检测发现,缺氧24 h复氧6 h,可导致心肌细胞活力下降约50%,后续均采用该缺氧复氧时间建立心肌细胞氧化损伤模型。采用qPCR检测结果发现,缺氧复氧后心肌细胞中miR-214表达下降。既往研究显示,在不同的组织细胞,或同一细胞类型在不同病理生理状态下,miRNA的表达存在差异性。这些差异表达的miRNA参与调节细胞分化、增殖、凋亡等过程。那为什么miRNA在细胞不同病理生理条件下会产生差异表达呢?这其中涉及的调控机制异常复杂,主要包括DNA甲基化、组蛋白乙酰化以及细胞内转录因子的表达变化等。此外,miRNA从前体加工为成熟的miRNA过程中,也会因为抑制性因子的表达变化而发生上调或下调。在本实验中,心肌细胞经缺氧复氧损伤后,miR-214表达下降也可能涉及上述机制,并推测miR-214表达下降可能参与缺氧复氧诱导的细胞氧化损伤过程[22]。本研究采用脂质体2000可有效将miR-214模拟物转染至心肌细胞中,促进其在缺氧复氧的心肌细胞中高表达。目前,氧自由基损伤被认为是组织损伤的重要分子机制之一,为观察miR-214是否与心肌细胞氧化应激损伤存在关联性,采用流式细胞术检测细胞内ROS发现,缺氧复氧可导致细胞内ROS表达明显增高,而过表达细胞中miR-214可显著降低缺氧复氧诱导的ROS表达增加。此外,当ROS过度生成并积累时,组织细胞脂膜发生过氧化损伤,生成大量丙二醛(MDA),促进细胞进一步损害,MDA为不饱和脂肪酸代谢产物,是体内重要的脂质自由基,可通过不同途径造成细胞损伤,并能够反映机体受活性氧氧化损伤的程度[23]。考虑到细胞防御功能,本研究同时检测了心肌细胞分泌的超氧化物歧化酶(SOD)的表达变化,SOD是催化超氧阴离子歧化反应的一类抗氧化金属酶,在一定刺激下可反应性增高,保护细胞免受氧化应激损伤,然而,当ROS过度积累时,会导致SOD消耗性降低[24]。本实验发现,在缺氧复氧造成心肌细胞ROS增多的同时,心肌细胞分泌SOD下降,MDA表达升高。而过表达miR-214可明显上调SOD表达量,降低MDA表达。在细胞氧化损伤过程中,往往伴随着细胞凋亡增加,故本实验进一步采用TUNEL法检测细胞晚期凋亡状态,结果显示,缺氧复氧可诱导细胞凋亡,表现为TUNEL阳性细胞数增加,而过表达miR-214可使凋亡细胞数显著减少。
然而,miR-214发挥作用需通过调控相应基因表达。有研究报道,miR-214可能通过作用于CaMKⅡ mRNA 3′UTR,进而调节CaMKⅡ表达[12]。我们通过TargetScan数据库及GCBI在线平台检索发现miR-214通过3p′-GACGAC-5p′与CaMKⅡ mRNA 5p′-CUGCUGA-3p′相互配对。并采用双荧光素酶报告基因验证miR-214可与CaMKⅡ靶向结合,同时从mRNA及蛋白水平检测结果发现,缺氧复氧可至CaMKⅡ在mRNA及蛋白水平均明显上调,而过表达miR-214后,在缺氧复氧损伤的心肌细胞模型中CaMKⅡ无论在mRNA还是蛋白水平均显著下调。此外,为进一步验证miR-214通过靶向抑制CaMKⅡ发挥抗氧化应激及凋亡的作用,予以过表达CaMKⅡ做回复实验,结果显示:过表达细胞中CaMKⅡ后,miR-214的抗氧化应激及凋亡效应被显著阻断。该效应可能是因为CaMKⅡ为Ca2+/CaMKⅡ信号通路中关键酶,活化的CaMKⅡ可诱导钙离子泄漏,通过多途径促进ROS表达增加,进一步加重氧化损伤,同时耗竭细胞内抗氧化应激作用的SOD,而促进MDA高表达[7, 25]。
综上所述,过表达miR-214可改善缺氧复氧诱导的心肌细胞氧化应激水平,并推测miR-214可能通过抑制CaMKⅡ mRNA表达,阻止其转录后翻译过程,发挥改善心肌细胞内氧化应激作用。这为缺氧再灌注损伤心肌细胞的保护效应提供实验依据。
| [1] | LENG Y, WU Y, LEI S Q, et al. Inhibition of HDAC6 activity alleviates myocardial ischemia/reperfusion injury in diabetic rats: potential role of peroxiredoxin 1 acetylation and redox regulation[J]. Oxid Med Cell Longev, 2018, 2018: 9494052. DOI:10.1155/2018/9494052 |
| [2] | CHOUCHANI E T, PELL V R, GAUDE E, et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS[J]. Nature, 2014, 515(7527): 431–435. DOI:10.1038/nature13909 |
| [3] | DONG S, CHENG Y, YANG J, et al. MicroRNA expression signature and the role of microRNA-21 in the early phase of acute myocardial infarction[J]. J Biol Chem, 2009, 284(43): 29514–29525. DOI:10.1074/jbc.M109.027896 |
| [4] | AURORA A B, MAHMOUD A I, LUO X, et al. MiRNA-214 protects the mouse heart from ischemic injury by controlling Ca2+ overload and cell death[J]. J Clin Invest, 2012, 122(4): 1222–1232. DOI:10.1172/JCI59327 |
| [5] | LV G, SHAO S, DONG H, et al. MicroRNA-214 protects cardiac myocytes against H2O2-induced injury[J]. J Cell Biochem, 2014, 115(1): 93–101. DOI:10.1002/jcb.24636 |
| [6] | LIU P Y, TIAN Y, XU S Y. Mediated protective effect of electroacupuncture pretreatment by miR-214 on myocardial ischemia/reperfusion injury[J]. J Geriatr Cardiol, 2014, 11(4): 303–310. DOI:10.11909/j.issn.1671-5411.2014.04.005 |
| [7] | FEDERICO M, PORTIANSKY E L, SOMMESE L, et al. Calcium-calmodulin-dependent protein kinase mediates the intracellular signalling pathways of cardiac apoptosis in mice with impaired glucose tolerance[J]. J Physiol, 2017, 595(12): 4089–4108. DOI:10.1113/jp273714 |
| [8] | CHEN C, HU L X, DONG T, et al. Apoptosis and autophagy contribute to gender difference in cardiac ischemia-reperfusion induced injury in rats[J]. Life Sci, 2013, 93(7): 265–270. DOI:10.1016/j.lfs.2013.06.019 |
| [9] | FLISS H, GATTINGER D. Apoptosis in ischemic and reperfused rat myocardium[J]. Circ Res, 1996, 79(5): 949–956. DOI:10.1161/01.RES.79.5.949 |
| [10] | QIU H, LIU J Y, WEI D G, et al. Cardiac-generated prostanoids mediate cardiac myocyte apoptosis after myocardial ischaemia[J]. Cardiovasc Res, 2012, 95(3): 336–345. DOI:10.1093/cvr/cvs191 |
| [11] | ABBATE A, NARULA J. Role of apoptosis in adverse ventricular remodeling[J]. Heart Fail Clin, 2012, 8(1): 79–86. DOI:10.1016/j.hfc.2011.08.010 |
| [12] | AMBROS V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350–355. DOI:10.1038/nature02871 |
| [13] | ZHANG C. MicroRNAs: role in cardiovascular biology and disease[J]. Clin Sci, 2008, 114(12): 699–706. DOI:10.1042/CS20070211 |
| [14] | CHENG R, DANG R, ZHOU Y, et al. MicroRNA-98 inhibits TGF-β1-induced differentiation and collagen production of cardiac fibroblasts by targeting TGFBR1[J]. Hum Cell, 2017, 30(3): 192–200. DOI:10.1007/s13577-017-0163-0 |
| [15] | ZHANG J S, ZHAO Y, LV Y, et al. miR-873 suppresses H9C2 cardiomyocyte proliferation by targeting GLI1[J]. Gene, 2017, 626: 426–432. DOI:10.1016/j.gene.2017.05.062 |
| [16] | ZHU J, YAO K, GUO J, et al. miR-181a and miR-150 regulate dendritic cell immune inflammatory responses and cardiomyocyte apoptosis via targeting JAK1-STAT1/c-Fos pathway[J]. J Cell Mol Med, 2017, 21(11): 2884–2895. DOI:10.1111/jcmm.13201 |
| [17] | KUKREJA R C, YIN C, SALLOUM F N. MicroRNAs: new players in cardiac injury and protection[J]. Mol Pharmacol, 2011, 80(4): 558–564. DOI:10.1124/mol.111.073528 |
| [18] | EL AZZOUZI H, LEPTIDIS S, DIRKX E, et al. The hypoxia-inducible microRNA cluster miR-199a~214 targets myocardial PPARδ and impairs mitochondrial fatty acid oxidation[J]. Cell Metab, 2013, 18(3): 341–354. DOI:10.1016/j.cmet.2013.08.009 |
| [19] | LV G, SHAO S, DONG H, et al. MicroRNA-214 protects cardiac myocytes against H2O2-induced injury[J]. J Cell Biochem, 2014, 115(1): 93–101. DOI:10.1002/jcb.24636 |
| [20] | LU H Q, LIANG C, HE Z Q, et al. Circulating miR-214 is associated with the severity of coronary artery disease[J]. J Geriatr Cardiol, 2013, 10(1): 34–38. DOI:10.3969/j.issn.1671-5411.2013.01.007 |
| [21] | CHENG Y, LIU X, ZHANG S, et al. MicroRNA-21 protects against the H2O2-induced injury on cardiac myocytes via its target gene PDCD4[J]. J Mol Cell Cardiol, 2009, 47(1): 5–14. DOI:10.1016/j.yjmcc.2009.01.008 |
| [22] | BERINDAN-NEAGOE I, MONROIG PDEL C, PASCULLI B, et al. MicroRNAome genome: a treasure for cancer diagnosis and therapy[J]. CA Cancer J Clin, 2014, 64(5): 311–336. DOI:10.3322/caac.21244 |
| [23] | MAO H, TAO T, WANG X, et al. Zedoarondiol attenuates endothelial cells injury induced by oxidized low-density lipoprotein via nrf2 activation[J]. Cell Physiol Biochem, 2018, 48(4): 1468–1479. DOI:10.1159/000492257 |
| [24] | BAI J, YANG F, DONG L, et al. Ghrelin protects human lens epithelial cells against oxidative stress-induced damage[J]. Oxid Med Cell Longev, 2017, 2017: 1910450. DOI:10.1155/2017/1910450 |
| [25] | MUSTROPH J, LEBEK S, MAIER L S, et al. Mechanisms of cardiac ethanol toxicity and novel treatment options[J]. Pharmacol Ther, 2018: S0163-S7258(18)30228-6. DOI: 10.1016/j.pharmthera.2018.12.006. |



