2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系:环境卫生学教研室
2. Department of Environmental Hygiene, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类分布广泛的环境污染物,主要来源于有机物的不完全燃烧,可通过吸入、饮食、皮肤沾染等途径在人体组织中富集。PAHs中的许多种类被证实具有致突变性和致癌性。此外,PAHs对雄性生殖系统也具有危害作用。流行病学研究表明PAHs的暴露与男性精液质量降低有密切联系,而精液质量的降低则增加了不育的风险[1-3]。苯并芘(benzo [a] pyrene, B[a]P)是PAHs的代表性化学物,系列研究表明B[a]P能直接损伤睾丸间质细胞并影响睾酮合成过程。ARCHIBONG等[4]发现急性吸入B[a]P可以造成大鼠睾酮水平、黄体生成素(luteinizing hormone, LH)水平以及附睾中精子数量的降低[5]。CHUNG等[6]发现B[a]P的暴露会导致睾酮水平的变化进而影响生精细胞凋亡和附睾中精子质量。但是B[a]P影响睾丸间质细胞睾酮合成所涉及的靶细胞器以及分子机制尚不明确。
线粒体作为存在于真核生物细胞中的特殊结构,也是参与睾酮生物合成的主要细胞器之一。在睾丸间质细胞中,线粒体氧化磷酸化产生的三磷酸腺苷(ATP)提供合成睾酮所需要的能量。此外,转位因子蛋白(translocator protein, TSPO)、固醇类荷尔蒙生成急性调节蛋白(steroidogenic acute regulatory, StAR)以及胆固醇侧链裂解酶细胞色素P450(CYP11A1)是调节睾酮前体物质胆固醇在线粒体内转运和代谢的重要蛋白,均定位于线粒体。研究表明,线粒体是环境化学物质毒作用的重要靶细胞器,提示在睾丸间质细胞中,线粒体的损伤可能影响睾酮的生成。为进一步明确B[a]P是否通过损伤线粒体而抑制间质细胞的睾酮生物合成,本研究采用B[a]P的活性代谢产物苯并[a]芘-7, 8-二醇-9, 10-环氧化物(benzo[a]pyrene-r-7, t-8-dihydrodiol-t-9, 10-epoxide(±), (anti), BPDE)处理睾丸间质细胞株TM3,观察BPDE对细胞线粒体的损伤效应,检测细胞睾酮合成相关酶和睾酮水平的改变,为深入研究B[a]P雄性生殖损伤的分子机制提供参考依据。
1 材料与方法 1.1 材料与试剂小鼠睾丸间质细胞株TM3购于ATCC细胞库。BPDE购买于美国Midwest研究所;二甲基亚砜(dimethyl sulfoxide, DMSO)和LH购于Sigma公司;ZLN005购自Med Chem Express公司;DMEM/F-12,马血清和胎牛血清培养基购自Gibco公司;睾酮检测ELISA试剂盒购自江苏酶免公司;E.Z.N.A.TMDNA分离试剂盒购于Omega公司;PGC-1α抗体购于Abcam公司;TSPO抗体购自Bioworld公司;StAR抗体购于CST公司;β-actin抗体、辣根过氧化物酶标记的山羊抗兔和山羊抗鼠二抗,台盼蓝染色试剂盒,线粒体膜电位检测试剂盒和ATP检测试剂盒购于碧云天公司;PVDF膜及ECL发光液购自Millipore公司。
1.2 方法 1.2.1 细胞培养和处理TM3细胞培养于DMEM/F12培养基(含5%马血清和2.5%胎牛血清),培养基中添加1U LH。培养条件为37 ℃,5% CO2。BPDE溶解于DMSO,使BPDE终浓度为25、50、100、200、400、800 nmol/L,染毒时间48 h。对照组使用DMSO处理,终浓度为0.05%。线粒体保护组(ZLN005预处理)的细胞采用5 μmol/L的ZLN005预处理24 h后,再进行100 nmol/L BPDE的染毒处理。
1.2.2 细胞活率检测采用台盼蓝染色试剂盒进行细胞活率检测。不同浓度BPDE处理细胞后,收获细胞并用0.4%的台盼蓝染色3 min。光镜下观察并分别计数存活细胞和死细胞。细胞活率采用活细胞数/总细胞数的百分比表示。
1.2.3 透射电镜BPDE处理48 h后,弃去培养基,加入电镜固定液并用细胞刮轻轻刮下细胞,收集细胞至离心管内,弃固定液后加入新的电镜固定液室温固定2 h,再转移至4 ℃保存。电镜样品的制备和拍照在陆军军医大学中心实验室完成,线粒体相关指标(线粒体嵴长度、线粒体长度和线粒体面积)通过Image J软件(美国国立卫生研究院)进行分析。
1.2.4 线粒体膜电位检测采用线粒体膜电位检测试剂盒进行检测。染毒结束后,收获细胞,加入JC-1荧光染液在37 ℃孵育细胞20 min。细胞在C6流式细胞仪(美国BD公司)上检测,采用FlowJo软件(美国Treestar公司)进行数据分析。
1.2.5 线粒体DNA拷贝数检测按照E.Z.N.A.TM DNA分离试剂盒说明书提供的方法提取细胞DNA。线粒体DNA拷贝数通过荧光定量PCR检测线粒体基因COXⅠ与核基因GAPDH的比值来反映。基因引物分别如下所示:COXⅠ上游引物: 5′-TCGCCATCATATTCGTAGGAG-3′,下游引物: 5′-GTAGCGTCGTGGTATTCCTGA-3′;GAPDH上游引物:5′-GAGGGGCCATCCACAGTCTTC-3′,下游引物:5′-CATCACCATCTTCCAGGAGCG-3′。提取的DNA用无RNA酶的双蒸水稀释至20 ng/μL。反应体系为25 μL,含有DNA模板40 ng。扩增条件为95 ℃ 15 s和60 ℃ 15 s,循环50次。每一个样品均做3个平行样,取均值作为该样本的Ct值。采用2-ΔΔCt对PCR结果进行相对定量分析,计算出每个待测样本COXⅠ/GAPDH比值,即为线粒体DNA拷贝数。结果表示为相对于对照组细胞的百分数。
1.2.6 ATP含量检测采用ATP检测试剂盒检测细胞ATP含量。BPDE处理48 h后,收集细胞。加入200 μL的ATP检测试剂盒中的裂解缓冲液,涡旋1 min后12 000×g,4 ℃离心5 min。将上清转移至新管中进行ATP检测。每个样本中取100 μL,加入100 μL的ATP检测溶液,充分混匀后,通过荧光酶标仪(Varioskan® LUX)进行检测。最后根据标准曲线计算出每个样本中ATP的浓度。
1.2.7 Western blot检测收集细胞,用含有10%苯甲基磺酰氟的RIPA裂解液提取蛋白。冰上充分裂解后,将混合液移至1.5 mL离心管中,4 ℃ 12 000×g离心30 min,小心吸取上清,即为细胞总蛋白。取少量蛋白进行定量,其余100 ℃变性后分装,-80 ℃保存。各样品分别取80 μg总蛋白进行SDS-PAGE电泳,电转至PVDF膜,10%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜,辣根过氧化物酶标记的二抗于37 ℃孵育1 h,ECL化学发光试剂显色曝光。
1.2.8 ELISA检测培养基睾酮水平BPDE处理48 h后,收集细胞培养液,200×g离心10 min,取上清液,按照小鼠睾酮ELISA试剂盒说明书的方法,采用酶标仪在波长450 nm处检测光密度值D(450),最终根据标准曲线计算得到培养基睾酮含量,采用培养基睾酮含量/活细胞数表示相对细胞睾酮水平。
1.3 统计学分析采用SPSS 16.0统计软件,数据以x±s表示,各组间差异比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 BPDE处理对TM3细胞活率影响台盼蓝染色实验结果显示:随着BPDE处理浓度升高,细胞存活率呈逐渐降低的趋势(图 1)。与对照组比较,25、50、100 nmol/L浓度BPDE处理组的细胞活率无明显改变,而200、400、800 nmol/L BPDE处理后,细胞活率明显下降,差异有统计学意义(P < 0.01)。后续采用对细胞活率无明显影响的染毒剂量进行实验。
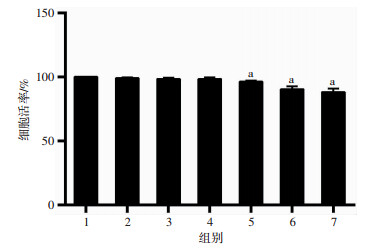
|
| 1:对照组;2: BPDE 25 nmol/L组;3: BPDE 50 nmol/L组;4: BPDE 100 nmol/L组;5: BPDE 200 nmol/L组;6: BPDE 400 nmol/L组;7: BPDE 800 nmol/L组;a:P < 0.01,与对照组比较 图 1 不同浓度BPDE对TM3细胞活率的影响 |
2.2 BPDE对TM3细胞睾酮水平的影响
低剂量BPDE(0、25、50、100 nmol/L)处理TM3细胞48 h后,细胞培养基中睾酮浓度的检测结果显示:睾酮水平随BPDE染毒剂量升高呈降低趋势,其中50 nmol/L和100 nmol/L BPDE处理可分别导致细胞睾酮水平降低21.15%和34.96%(P < 0.01,图 2)。提示BPDE可抑制睾丸间质细胞株TM3的睾酮生成。
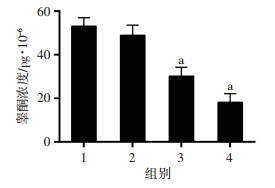
|
| 1:对照组;2: BPDE 25 nmol/L组;3: BPDE 50 nmol/L组;4: BPDE 100 nmol/L组;a:P < 0.01,与对照组比较 图 2 BPDE对TM3细胞睾酮水平的影响 |
2.3 BPDE对TM3细胞线粒体超微结构的影响
采用透射电镜观察TM3细胞线粒体超微结构的变化,结果显示(图 3):对照组TM3细胞中,线粒体嵴数量多,排列紧密整齐,线粒体内膜完整。25 nmol/L BPDE处理组的细胞线粒体结构改变不明显,线粒体嵴有少量断裂,但排列整齐,线粒体内膜基本完整。50 nmol/L BPDE处理后细胞线粒体改变较明显,部分线粒体嵴断裂,线粒体嵴的空泡化增加并伴随内膜损伤。100 nmol/L BPDE处理组的细胞线粒体损伤严重,其中大量的线粒体嵴断裂和消失,线粒体内膜损伤严重。进一步电镜结果分析显示:50和100 nmol/L BPDE处理可导致细胞线粒体嵴长度显著降低(P < 0.05,图 4A),线粒体长度和线粒体面积明显减少(P < 0.01,图 4B、C)。

|
| A:对照组;B: BPDE 25 nmol/L组;C: BPDE 50 nmol/L组;D: BPDE 100 nmol/L组 图 3 透射电镜检测各组TM3细胞线粒体结构变化 |
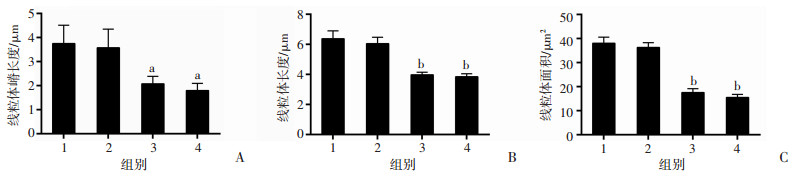
|
| A:细胞线粒体嵴长度分析;B:细胞线粒体长度分析;C:细胞线粒体面积分析;1:对照组;2: BPDE 25 nmol/L组;3: BPDE 50 nmol/L组;4: BPDE 100 nmol/L组;a:P < 0.05,b:P < 0.01,与对照组比较 图 4 BPDE对各组TM3细胞线粒体超微结构的影响 |
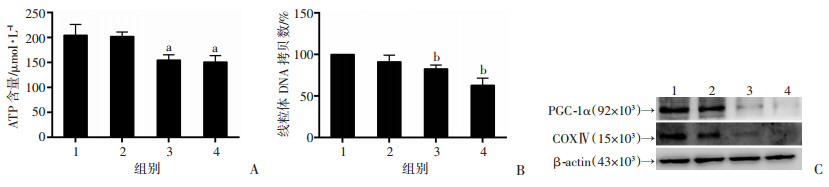
2.4 BPDE处理后TM3细胞线粒体功能和生物生成的改变
50、100 nmol/L BPDE处理可引起细胞线粒体膜电位水平显著降低(P < 0.05,图 5)。同时ATP检测结果显示:上述剂量可导致细胞内ATP含量的显著降低(P < 0.05,图 6A)。荧光定量PCR检测结果显示:BPDE处理也可导致细胞线粒体DNA拷贝数的下降(图 6B),其中50、100 nmol/L剂量组细胞与对照组细胞比较差异有统计学意义(P < 0.05)。进一步的蛋白表达分析结果显示:调控线粒体生物合成的关键蛋白PGC-1α的表达随着BPDE剂量的增加逐渐降低,线粒体氧化磷酸化重要酶基因COX Ⅳ的蛋白表达同样呈剂量依赖性降低(图 6C)。上述结果提示BPDE可诱导TM3细胞线粒体功能障碍、线粒体生物合成降低、能量供应下降。
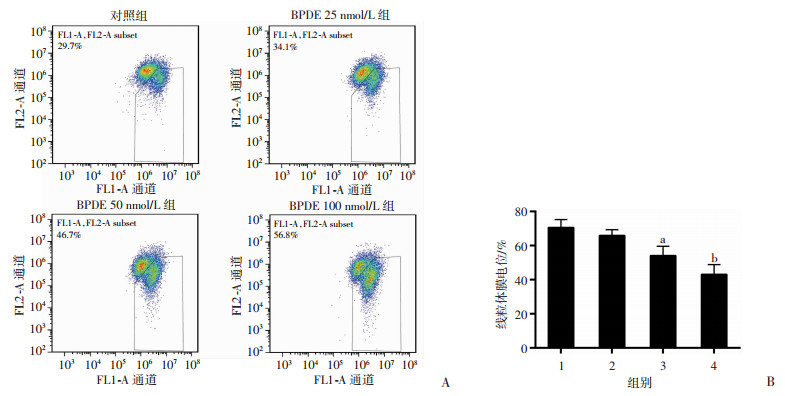
|
| A: JC-1染色及流式细胞仪检测细胞线粒体膜电位; B:细胞线粒体膜电位分析;1:对照组;2: BPDE 25 nmol/L组;3: BPDE 50 nmol/L组;4: BPDE 100 nmol/L组;a:P < 0.05,b:P < 0.01,与对照组比较 图 5 BPDE对各组TM3细胞线粒体膜电位的影响 |
|
| A:ATP检测试剂盒检测细胞内的ATP含量;B:荧光定量PCR检测细胞线粒体DNA拷贝数;C:Western blot检测蛋白表达变化;1:对照组;2: BPDE 25 nmol/L组;3: BPDE 50 nmol/L组;4: BPDE 100 nmol/L组;a:P < 0.05,b:P < 0.01,与对照组比较 图 6 BPDE对TM3细胞线粒体功能和生物生成的影响 |
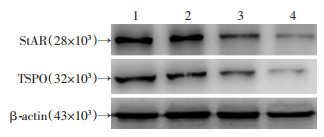
2.5 BPDE对TM3细胞睾酮合成相关蛋白的影响
TSPO和StAR是定位于细胞线粒体的睾酮合成关键蛋白。Western blot检测结果显示:随着BPDE处理浓度的增加,TSPO和StAR的表达逐渐降低,存在一定的剂量依赖关系(图 7)。
|
| 1:对照组;2: BPDE 25 nmol/L组;3: BPDE 50 nmol/L组;4: BPDE 100 nmol/L组 图 7 Western blot检测BPDE对各组TM3细胞睾酮合成相关蛋白的影响 |
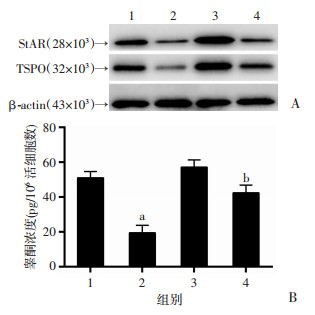
2.6 线粒体保护剂预处理对BPDE所致的线粒体损伤和睾酮水平降低的影响
小分子激活剂ZLN005可激活PGC-1α的转录,从而促进线粒体的生物合成并保护线粒体功能。采用ZLN005对细胞预处理24 h后,再进行BPDE(100 nmol/L)染毒,结果显示:与BPDE单独处理组比较,ZLN005+BPDE处理组细胞的线粒体膜电位水平、ATP含量、线粒体DNA拷贝数均显著升高(P < 0.05,图 8A~C)。同时线粒体相关蛋白,包括PGC-1α、COX Ⅳ均明显上调(图 8D)。此外,与BPDE单独处理组比较,ZLN005预处理也提高了TSPO和StAR的表达(图 9A),并增加细胞的睾酮生成水平(P < 0.05,图 9B)。上述结果提示促进线粒体生物合成和保护线粒体功能可明显减轻BPDE诱导的TM3细胞睾酮水平降低。

|
| A:JC-1探针检测细胞线粒体膜电位改变;B:ATP检测试剂盒检测细胞内的ATP含量;C:荧光定量PCR检测细胞线粒体DNA拷贝数;D:Western blot检测蛋白表达变化; 1:对照组;2: BPDE 100 nmol/L组;3: ZLN005组;4: BPDE 100 nmol/L+ ZLN005组;a: P < 0.05,b: P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与BPDE 100 nmol/L组比较 图 8 线粒体保护剂ZLN005预处理对BPDE所致的线粒体损伤的影响 |
|
| A:Western blot检测蛋白表达变化;B:ELISA检测细胞睾酮水平变化; 1:对照组;2: BPDE 100 nmol/L组;3: ZLN005组;4: BPDE 100 nmol/L + ZLN005组;a:P < 0.01,与对照组比较;b:P < 0.01,与BPDE 100 nmol/L组比较 图 9 线粒体保护剂ZLN005预处理对BPDE所致的各组细胞睾酮水平降低的影响 |
3 讨论
B[a]P属于典型的内分泌干扰物[7]。人类在日常生活工作中接触的B[a]P的浓度都较低,例如一支香烟中的B[a]P含量是20~40 ng[8]。CHUNG等[6]在经过等剂量换算后,用等同于人类每日暴露的B[a]P浓度对大鼠进行染毒,结果显示低浓度B[a]P暴露引起大鼠睾酮水平降低,但不伴随LH及其受体表达的降低。该研究表明睾酮合成相关蛋白表达降低,提示低浓度B[a]P暴露可能直接影响睾丸间质细胞的睾酮生成机制。但是目前有关B[a]P直接影响间质细胞及其睾酮生成的具体机制和亚细胞水平改变并不清楚[5-6]。
本研究发现:在不引起明显的细胞死亡的条件下,低浓度BPDE可导致TM3细胞显著的线粒体损伤,包括线粒体超微结构破坏和功能障碍,如线粒体膜电位、细胞内ATP水平和线粒体DNA拷贝数的显著降低。线粒体膜电位在线粒体代谢中有着重要的作用,线粒体膜电位为氧化磷酸化提供动力,并参与蛋白质的运输以及代谢[9]。在睾丸间质细胞中,对线粒体膜电位产生影响的化学物会改变类固醇合成水平[10]。线粒体膜电位的降低伴随着细胞内ATP持续的下降,而睾丸间质细胞内ATP的减少会直接导致对睾酮合成过程提供的能量减少。同时ATP的减少会降低cAMP的水平,而cAMP通过动员和运输胆固醇直接参与了睾酮的生物合成[11]。本研究结果进一步显示:BPDE引起TM3细胞线粒体生物合成减少以及线粒体DNA拷贝数的降低。线粒体的生物合成取决于细胞核DNA和线粒体DNA的协同表达,而PGC-1α是线粒体生物合成及线粒体功能的重要调节因子,对线粒体生物合成、氧化磷酸化、糖异生等过程都有重要的调控作用[12]。线粒体的生物合成同样与细胞ATP产生有着密切的联系,线粒体生物合成降低会减少细胞内ATP水平[13]。除此以外,睾酮合成的重要相关蛋白StAR和TSPO参与了胆固醇的转运过程,StAR和TSPO均定位于线粒体。线粒体的损伤可降低睾酮合成重要相关蛋白含量,最终导致睾酮合成的减少。
线粒体作为细胞中特殊的结构,是多种环境毒物作用的敏感靶点[14-15]。WONG等[16]发现室内空气B[a]P浓度的增加与白细胞中线粒体DNA拷贝数的降低密切相关。本课题组前期的横断面研究发现,PAHs的暴露与男性精子线粒体DNA拷贝数呈负相关[17]。这些研究结果均提示PAHs化学物可导致细胞线粒体损伤。我们采用PGC-1α激活剂ZLN005保护线粒体功能和增加线粒体生物合成之后,观察到线粒体的状态和功能都有明显的恢复,睾酮合成相关蛋白和细胞睾酮的水平也有明显的上调。进一步证实了BPDE介导的TM3细胞线粒体损伤是导致细胞睾酮合成水平降低的重要因素,为今后PAHs生殖损伤的防治提供了参考依据。
综上所述,本研究发现BPDE可能通过引起睾丸间质细胞线粒体功能障碍,减少线粒体生物合成和ATP产生,减少定位于线粒体内睾酮合成通路上重要酶的含量,最终导致睾丸间质细胞睾酮合成水平的下降。而改善线粒体功能和促进线粒体生物合成后,睾酮水平明显增加。本研究为探索多环芳烃类有机污染物的雄性生殖损害作用机制提供了新的线索。但本研究观察到的BPDE诱导TM3细胞线粒体超微结构损伤和线粒体功能障碍之间是否存在一定的关联,还需要后续的实验进一步验证。此外,本研究仅为细胞水平的实验研究,由于机体复杂的调节机制,关于B[a]P通过损伤间质细胞线粒体而导致的雄性生殖毒性,还需要进一步的动物实验以及人群研究资料加以验证。
| [1] | HAN X, ZHOU N Y, CUI Z H, et al. Association between urinary polycyclic aromatic hydrocarbon metabolites and sperm DNA damage:A population study in Chongqing, China[J]. Environ Health Perspect, 2011, 119(5): 652–657. DOI:10.1289/ehp.1002340 |
| [2] | HSU P C, CHEN I Y, PAN C H, et al. Sperm DNA damage correlates with polycyclic aromatic hydrocarbons biomarker in coke-oven workers[J]. Int Arch Occup Environ Health, 2006, 79(5): 349–356. DOI:10.1007/s00420-005-0066-3 |
| [3] | XIA Y K, HAN Y, ZHU P F, et al. Relation between urinary metabolites of polycyclic aromatic hydrocarbons and human semen quality[J]. Environ Sci Technol, 2009, 43(12): 4567–4573. DOI:10.1021/es9000642 |
| [4] | ARCHIBONG A E, RAMESH A, NIAZ M S, et al. Effects of benzo(a)pyrene on intra-testicular function in F-344 rats[J]. Int J Environ Res Public Health, 2008, 5(1): 32–40. DOI:10.3390/ijerph5010032 |
| [5] | INYANG F, RAMESH A, KOPSOMBUT P, et al. Disruption of testicular steroidogenesis and epididymal function by inhaled benzo(a)pyrene[J]. Reprod Toxicol, 2003, 17(5): 527–537. DOI:10.1016/S0890-6238(03)00071-6 |
| [6] | CHUNG J Y, KIM Y J, KIM J Y, et al. Benzo[a]pyrene reduces testosterone production in rat Leydig cells via a direct disturbance of testicular steroidogenic machinery[J]. Environ Health Perspect, 2011, 119(11): 1569–1574. DOI:10.1289/ehp.1003391 |
| [7] | ANNAMALAI J, NAMASIVAYAM V. Endocrine disrupting chemicals in the atmosphere:Their effects on humans and wildlife[J]. Environ Int, 2015, 76: 78–97. DOI:10.1016/j.envint.2014.12.006 |
| [8] | KULLER L H, GARFINKEL L, CORREA P, et al. Contribution of passive smoking to respiratory cancer[J]. Environ Health Perspect, 1986, 70: 57–69. DOI:10.1289/ehp.867057 |
| [9] | GLANCY B, HARTNELL L M, MALIDE D, et al. Mitochondrial reticulum for cellular energy distribution in muscle[J]. Nature, 2015, 523(7562): 617–620. DOI:10.1038/nature14614 |
| [10] | FA S, POGRMIC-MAJKIC K, SAMARDZIJA D, et al. HBCDD-induced sustained reduction in mitochondrial membrane potential, ATP and steroidogenesis in peripubertal rat Leydig cells[J]. Toxicol Appl Pharmacol, 2015, 282(1): 20–29. DOI:10.1016/j.taap.2014.11.001 |
| [11] | HALES D B. Testicular macrophage modulation of Leydig cell steroidogenesis[J]. J Reprod Immunol, 2002, 57(1/2): 3–18. |
| [12] | WARREN J S, TRACY C M, MILLER M R, et al. Histone methyltransferase Smyd1 regulates mitochondrial energetics in the heart[J]. Proc Natl Acad Sci USA, 2018, 115(33): E7871–E7880. DOI:10.1073/pnas.1800680115 |
| [13] | ITAMI N, SHIRATSUKI S, SHIRASUNA K, et al. Mitochondrial biogenesis and degradation are induced by CCCP treatment of porcine oocytes[J]. Reproduction, 2015, 150(2): 97–104. DOI:10.1530/REP-15-0037 |
| [14] | BANSAL S, LEU A N, GONZALEZ F J, et al. Mitochondrial targeting of cytochrome P450 (CYP) 1B1 and its role in polycyclic aromatic hydrocarbon-induced mitochondrial dysfunction[J]. J Biol Chem, 2014, 289(14): 9936–9951. DOI:10.1074/jbc.M113.525659 |
| [15] | MARQUES V B, FARIA R A, DOS SANTOS L. Overview of the pathophysiological implications of organotins on the endocrine system[J]. Front Endocrinol (Lausanne), 2018, 9: 101. DOI:10.3389/fendo.2018.00101 |
| [16] | WONG J Y Y, HU W, DOWNWARD G S, et al. Personal exposure to fine particulate matter and benzo[a]pyrene from indoor air pollution and leukocyte mitochondrial DNA copy number in rural China[J]. Carcinogenesis, 2017, 38(9): 893–899. DOI:10.1093/carcin/bgx068 |
| [17] | LING X, ZHANG G W, SUN L, et al. Polycyclic aromatic hydrocarbons exposure decreased sperm mitochondrial DNA copy number:A cross-sectional study (MARHCS) in Chongqing, China[J]. Environ Pollut, 2017, 220(Pt A): 680–687. DOI:10.1016/j.envpol.2016.10.026 |



