半月板是位于膝关节内衬于股骨和胫骨关节面的一种纤维软骨组织,形似半月,是膝关节的重要组成部分,在膝关节的稳态维持与功能发挥中起重要作用[1-3]。半月板损伤是临床上常见的运动损伤,然而由于半月板独特的细胞及组织结构与血供分布[4],其自我修复能力较差,临床上目前尚无有效的治疗方法,最普遍的治疗方式就是手术摘除破损的半月板,但该手术有导致患者发生骨性关节炎的潜在风险,长期预后不良[5-7]。因此,探索半月板损伤的治疗新方法,特别是促进愈合的生物治疗措施是临床上亟待解决的问题。组织器官的再生修复与其发育过程在一定程度上是相似的,揭示半月板发育机制有助于明确其损伤后的修复机制,为研发相关生物治疗措施提供线索。然而,目前对于半月板发育过程认识还比较粗浅[8],深入研究其发育过程,发掘该过程中关键基因,可望为研发相关生物治疗措施提供靶分子。
成纤维细胞生长因子受体(fibroblast growth factor receptors, FGFRs)属于酪氨酸蛋白激酶家族,与其配体成纤维细胞生长因子(fibroblast growth factors, FGFs)结合后发挥多种生物学功能,在骨、软骨发育和疾病过程中起重要作用[9-10]。半月板作为一种纤维软骨组织,并有局部骨化,提示FGF信号可能参与其发育与稳态维持,但目前缺乏系统研究,明确FGFRs在半月板发育过程中的表达模式是深入研究其功能的基础。
本研究利用骨和软骨研究领域应用最多的模式动物小鼠,观察小鼠出生后的半月板发育过程及3种不同FGFRs在其中的表达模式,为今后深入研究FGF信号在半月板发育及损伤修复中作用与机制,寻求改善半月板损伤的治疗措施提供基础实验数据。
1 材料与方法 1.1 实验动物及分组实验小鼠均为SPF级野生型C57BL/6J小鼠,购自北京华阜康生物技术有限公司并饲养于陆军军医大学大坪医院野战外科研究所实验动物中心。根据不同年龄分组,选取发育良好的雄性小鼠,每组4只(共24只)。分组为:1日龄和1、2、4、6、12周龄。本实验已通过陆军军医大学实验动物管理委员会批准。
1.2 主要仪器和试剂仪器:石蜡切片机(Leica BM2135,德国),普通荧光显微镜(Olympus BX51,日本)。试剂:免疫组化系列检测试剂盒(中杉金桥,中国),藏红、固绿染料(Sigma-Aldrich,美国),anti-type Ⅰ collagen多克隆抗体(Abcam,美国),anti-type Ⅱ collagen多克隆抗体(Chondrex, 美国),anti-FGFR1、anti-FGFR2、anti-FGFR3、anti-Runx2、anti-Osteocalcin多克隆抗体(Santa Cruz,美国)。
1.3 方法 1.3.1 取材和标本处理处死小鼠,迅速取其双下肢,置于4%的多聚甲醛中固定过夜,14.5%乙二胺四乙酸(EDTA)脱钙(2周),梯度酒精脱水,二甲苯透明后石蜡包埋。常规膝关节矢状位切片,切片厚度为5 μm。将切片置于37 ℃烤箱中烘烤1 h,装盒备用。
1.3.2 藏红-固绿染色不同组间每个标本各选取4张相近位置的切片进行藏红-固绿染色,中性树胶封片,普通光学显微镜下观察、拍照。
1.3.3 免疫组织化学检测目的蛋白的表达各组选取位置相近的切片,经熔蜡、二甲苯脱蜡、梯度酒精复水后,依次用H2O2封闭内源性过氧化物酶,0.1%胰蛋白酶修复抗原,山羊血清封闭非特异性抗原,而后滴加适当比例稀释的一抗工作液(anti-typeⅠ collagen、anti-typeⅡ collagen、anti-Runx2和anti-Osteocalcin多克隆抗体为1 :200稀释,anti-FGFR1、anti-FGFR2、anti-FGFR3多克隆抗体为1 :100稀释),4 ℃孵育过夜。根据一抗的种属来源滴加对应的二抗工作液孵育,辣根过氧化物酶标记链霉卵白素工作液结合二抗,DAB显色剂显色,0.05%的甲基绿染液复染,室温自然晾干,中性树胶封片,普通光学显微镜下观察,拍照。
1.3.4 阳性细胞数计数及统计分析用Image Pro Plus软件进行总细胞和阳性细胞计数,并计算阳性细胞占总细胞的百分比。结果用GraphPad Prism v.6.02软件进行统计分析,两组均数比较用独立样本t检验,多组均数比较用完全随机设计资料方差分析,组间两两比较采用LSD法,结果以x±s表示,检验标准:α=0.05。
2 结果 2.1 小鼠出生后半月板基质染色变化通过藏红固绿染色(图 1A)观察,新生小鼠半月板有明显的内-外侧分区(图 1B)。1周时,半月板分区更加明显,内侧区半月板富含蛋白聚糖,藏红着色较深,细胞呈卵圆形,类似于软骨细胞,而外侧区半月板基本上不被藏红着色,细胞呈扁平状,类似于成纤维细胞。2周时,半月板前角内侧区部分细胞发生肥大,4周时细胞进一步肥大,肥大细胞数量增加且体积增大(图 1C),直到6周,在半月板前角出现小面积的矿化区域,且矿化区域细胞Runx2和Osteocalcin免疫组织化学染色阳性(图 2)。12周时,小鼠半月板的发育过程基本完成,在前角可观察到明显的骨化组织,出现类骨髓腔的结构,且后角也出现了小区域的矿化。
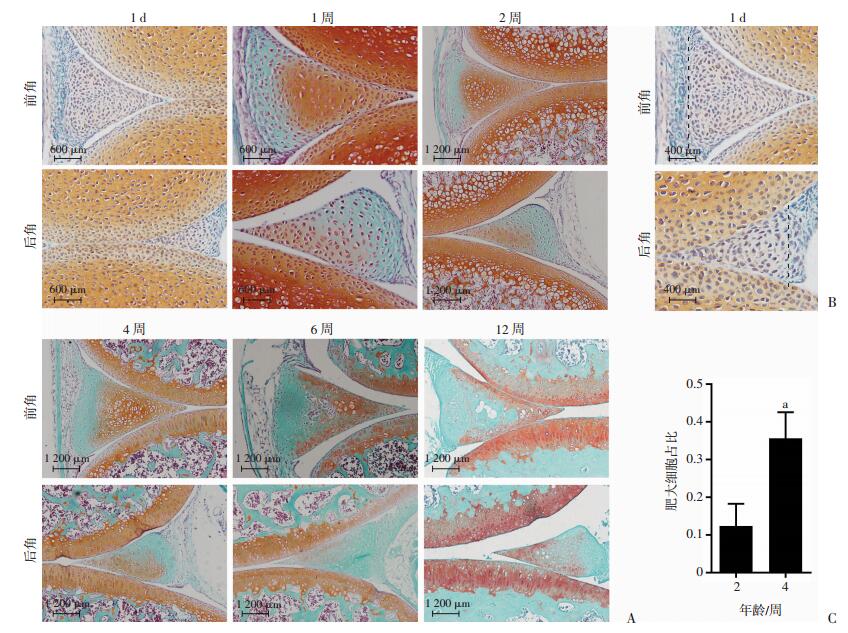
|
| A:不同年龄小鼠半月板矢状位石蜡切片前角和后角; B:1日龄小鼠半月板,虚线分别为半月板内、外侧分区; C:2周龄和4周龄半月板肥大细胞数占总细胞数的比值a:P < 0.01, 与第2周比较 图 1 不同年龄小鼠半月板石蜡切片藏红-固绿染色观察 |

|
| 方框示矿化区域 图 2 6周龄小鼠半月板石蜡切片Runx2(A)和Osteocalcin(B)免疫组化染色观察(S-P) |
2.2 小鼠出生后半月板胶原分布变化
新生小鼠的半月板前角和后角均匀分布Ⅰ型胶原,但仅在前角内侧区部分表达Ⅱ型胶原。1周时,半月板前角Ⅰ型胶原分布主要集中在半月板外侧区,而后角中Ⅰ型胶原均匀分布。此时前角Ⅱ型胶原的表达增加,集中均匀分布在半月板内侧区,后角内侧区也开始表达Ⅱ型胶原。此后直到12周,两种胶原的分布基本维持不变,Ⅰ型胶原均匀分布于后角及前角的外侧区,Ⅱ型胶原主要分布于前、后角的内侧区。在半月板的矿化区域,Ⅰ型胶原的表达明显增加(图 3、4)。

|
| 图 3 不同年龄小鼠半月板Ⅰ型胶原免疫组化染色观察(S-P |
|
| 图 4 不同年龄小鼠半月板Ⅱ型胶原免疫组化染色观察(S-P) |
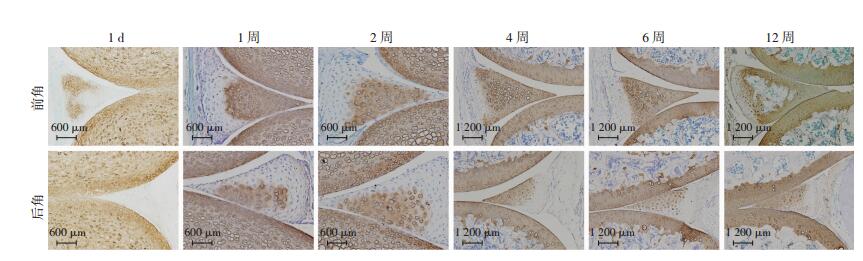
2.3 小鼠出生后半月板FGFRs表达模式
3种FGFRs在小鼠半月板的发育过程中有着相似的表达模式(图 5、6)。新生小鼠的半月板前、后角均未检测到FGFRs的明显表达。1~2周时,3种FGFRs均匀分布于半月板前角和后角内侧区,且在前角的表达量明显增加并达到峰值。4周时,3种FGFRs在前角的表达均明显减少,分布位置也出现边缘化的趋势。随着发育,FGFRs在半月板前角的表达逐渐减少,到12周时,FGFRs仅表达在半月板前角表层的3~4层细胞中。半月板后角3种FGFRs主要表达在内侧区,且不同年龄组间表达差异无统计学意义。

|
| 细胞核内棕色颗粒为阳性信号 图 5 不同年龄小鼠半月板FGFR1、FGFR2、FGFR3免疫组化染色观察(S-P) |

|
| A~C:前角; D~F:后角a:P < 0.05, b:P < 0.01, 与1周比较 图 6 不同年龄小鼠半月板FGFR1、FGFR2、FGFR3免疫组化染色统计分析 |
3 讨论
半月板的生理结构较为复杂,目前人类及其他大型哺乳动物成年期半月板组织结构与功能已较为清楚[11-14]。然而大动物繁殖周期较长,难以进行遗传修饰,不利于深入研究半月板发育、退变及损伤修复等机制。小鼠繁殖周期短,成本低,更重要的是遗传修饰技术成熟、稳定,在研究运动系统疾病发生机制与治疗方面应用广泛,是深入研究半月板的发育、稳态维持机制和防治措施的重要模型。然而目前对于小鼠半月板了解甚少,研究小鼠半月板的发育过程可为利用小鼠作为模式动物开展半月板发育及损伤修复研究奠定基础。本研究发现成熟小鼠的半月板在组织学上与人的半月板的细胞类型和胶原成分相似。小鼠半月板可分为内侧区和外侧区,内侧区基质丰富,藏红着色深,外侧区基本不被藏红着色。有趣的是,部分小鼠半月板在自然发育过程(6周)中可出现矿化,而大型哺乳动物的半月板大多只在发生损伤或退变后才发生矿化[15]。小鼠半月板的胶原分布与人相似且有时空特异性。出生时小鼠的半月板前角和后角均匀分布Ⅰ型胶原,但仅在前角内侧区有少量的Ⅱ型胶原表达。出生1周后,胶原的表达模式基本固定,半月板的前、后角内侧区大量表达Ⅱ型胶原,而Ⅰ型胶原主要分布前角外侧区和整个后角。胶原的表达和分布模式,反映了半月板不同区域细胞类型的差异,同时复杂的胶原分布和结构也与半月板不同区域的力学状态相适应,有利于半月板的正常生理功能的发挥。
成纤维细胞生长因子受体及其配体在骨骼发育和相关遗传性骨病的发生中起重要作用,尤其是FGFR1~3是参与骨和软骨发育过程的重要调节分子[16-17]。HYDE等[18]用谱系示踪的方法发现半月板部分起源于胚胎发育时期的interzone,提示其与关节软骨具有相似的细胞来源。鉴于FGFRs在关节发育和稳态维持中的重要作用,我们推测其可能也是半月板发育和功能维持的重要调控因子,检测各FGFRs在小鼠半月板中的时空表达可为探讨FGF信号在半月板发育及疾病发生中的作用与机制奠定基础。FGFR1、2、3在长骨、颅骨等骨组织发育中具有各自特异的表达模式,但它们在小鼠半月板发育过程中的表达模式却是相似的。新生小鼠的半月板未检测到FGFRs的表达,1~2周小鼠半月板前角FGFRs表达增加,并达到峰值,且均匀分布在半月板内侧区。随着发育进程,其表达逐渐减少,到12周时,FGFRs的表达量较顶峰时期有明显的减少,且在前角主要分布在表层的3~4层细胞中。而后角FGFRs的表达未见明显变化,可能是因为半月板后角的细胞类型及生物力学状态不同于前角。总之,FGFRs在小鼠半月板时空表达模式提示它们可能是参与调节半月板发育的关键基因,其具体的调控和作用机制有待进一步研究。
本研究观察了小鼠从出生到12周半月板发育过程的组织形态学变化及FGFR1、2、3在其中的时空表达规律,为研究小鼠出生后半月板的发育过程与机制,特别是FGFs/FGFRs在半月板的损伤和退变发生中的作用与机制提供了重要数据。但本研究仅开展小鼠出生后半月板的发育过程的研究,对半月板胚胎早期发育过程有待于进一步观察。
| [1] | MAKRIS E A, HADIDI P, ATHANASIOU K A. The knee meniscus: structure-function, pathophysiology, current repair techniques, and prospects for regeneration[J]. Biomaterials, 2011, 32(30): 7411–7431. DOI:10.1016/j.biomaterials.2011.06.037 |
| [2] | MCDEVITT C A, WEBBER R J. The ultrastructure and biochemistry of meniscal cartilage[J]. Clin Orthop Relat Res, 1990(252): 8–18. DOI:10.1097/00003086-199003000-00003 |
| [3] | MCNULTY A L, GUILAK F. Mechanobiology of the meniscus[J]. J Biomech, 2015, 48(8): 1469–1478. DOI:10.1016/j.jbiomech.2015.02.008 |
| [4] | ARNOCZKY S P, WARREN R F. Microvasculature of the human meniscus[J]. Am J Sports Med, 1982, 10(2): 90–95. DOI:10.1177/036354658201000205 |
| [5] | ANDERSSON-MOLINA H, KARLSSON H, ROCKBORN P. Arthroscopic partial and total meniscectomy[J]. Arthroscopy, 2002, 18(2): 183–189. DOI:10.1053/jars.2002.30435 |
| [6] | ROOS E M, OSTENBERG A, ROOS H, et al. Long-term outcome of meniscectomy: symptoms, function, and performance tests in patients with or without radiographic osteoarthritis compared to matched controls[J]. Osteoarthr Cartil, 2001, 9(4): 316–324. DOI:10.1053/joca.2000.0391 |
| [7] | SIHVONEN R, PAAVOLA M, MALMIVAARA A, et al. Arthroscopic partial meniscectomy versus sham surgery for a degenerative meniscal tear[J]. N Engl J Med, 2013, 369(26): 2515–2524. DOI:10.1056/NEJMoa1305189 |
| [8] | SANCHEZ-ADAMS J, ATHANASIOU K A. The knee meniscus: a complex tissue of diverse cells[J]. Cel Mol Bioeng, 2009, 2(3): 332–340. DOI:10.1007/s12195-009-0066-6 |
| [9] | SU N, JIN M, CHEN L. Role of FGF/FGFR signaling in skeletal development and homeostasis: learning from mouse models[J]. Bone Res, 2014, 2: 14003. DOI:10.1038/boneres.2014.3 |
| [10] | ORNITZ D M, MARIE P J. Fibroblast growth factor signaling in skeletal development and disease[J]. Genes Dev, 2015, 29(14): 1463–1486. DOI:10.1101/gad.266551.115 |
| [11] | VERDONK P C M, FORSYTH R G, WANG J, et al. Characterisation of human knee meniscus cell phenotype[J]. Osteoarthr Cartil, 2005, 13(7): 548–560. DOI:10.1016/j.joca.2005.01.010 |
| [12] | MELROSE J, SMITH S, CAKE M, et al. Comparative spatial and temporal localisation of perlecan, aggrecan and type Ⅰ, Ⅱ and Ⅳ collagen in the ovine meniscus: an ageing study[J]. Histochem Cell Biol, 2005, 124(3/4): 225–235. DOI:10.1007/s00418-005-0005-0 |
| [13] | FOX A J, BEDI A, RODEO S A. The basic science of human knee menisci: structure, composition, and function[J]. Sports Health, 2012, 4(4): 340–351. DOI:10.1177/1941738111429419 |
| [14] | KREINEST M, REISIG G, STRÖBEL P, et al. Analysis of gene expression and ultrastructure of stifle menisci from juvenile and adult pigs[J]. Comp Med, 2016, 66(1): 30–40. |
| [15] | GLASS R S, BARNES W M, KELLS D U, et al. Ossicles of knee menisci[J]. Clin Orthop Relat Res, 1975, 111: 163–171. DOI:10.1097/00003086-197509000-00023 |
| [16] | ISEKI S, WILKIE A O, MORRISS-KAY G M. Fgfr1 and Fgfr2 have distinct differentiation- and proliferation-related roles in the developing mouse skull vault[J]. Development, 1999, 126(24): 5611–5620. |
| [17] |
苏楠, 陈林. FGFG3在骨骼发育和疾病中作用的研究进展[J].
国际遗传学杂志, 2006, 29(3): 222–225.
SU N, CHEN L. The effect of FGFR3 on skeleton development and disease[J]. Int J Genet, 2006, 29(3): 222–225. DOI:10.3760/cma.j.issn.1673-4386.2006.03.0157 |
| [18] | HYDE G, BOOT-HANDFORD R P, WALLIS G A. Col2a1 lineage tracing reveals that the meniscus of the knee joint has a complex cellular origin[J]. J Anat, 2008, 213(5): 531–538. DOI:10.1111/j.1469-7580.2008.00966.x |



