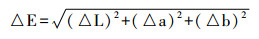2. 401147 重庆,重庆医科大学:口腔疾病与生物医学重庆市重点实验室;
3. 401147 重庆,重庆医科大学:重庆市高校市级口腔生物医学工程重点实验室
2. Chongqing Key Laboratory of Oral Disease and Biomedical Sciences, Chongqing Medical University, Chongqing, 401147, China;
3. Chongqing Key Laboratory of Oral Biomedical Engineering of Higher Education, Chongqing Medical University, Chongqing, 401147, China
牙齿的颜色和光泽对人的容貌影响很大。对人们牙色不满意度的调查表明,28%的英国人不满意自己的牙色,34%的美国人对自己的牙色不满意,而在我国城市人群中,牙色不满意度高达52.6%[1]。目前牙齿漂白因其微创性及高效性成为轻度及中度牙齿着色的主要治疗手段。从1864年开始,过氧化氢就已成为主要的牙齿漂白试剂,它可以产生氧活性物质从而与色素物质发生反应[2]。目前诊室漂白技术由高浓度过氧化氢凝胶(或过氧化脲)和催化系统如光源或热源组成,但是光源或热源是否具有催化作用至今仍有争议[3-4],而且高浓度的过氧化氢也带来了一些副作用,如牙髓损伤、釉质表面形态及粗糙度改变、牙本质渗透性改变、牙颈部吸收、牙龈损伤等[5-6]。因此,理想的牙齿着色治疗方案应该是在有效改善牙齿颜色的同时拥有良好的生物安全性。从2009年以来,大气压低温等离子体因其安全、高效、便利等特点在牙齿漂白领域引起了人们极大的兴趣。研究证实通过产生活性氧(ROS),如羟自由基和超氧阴离子,大气压低温等离子体联合过氧化氢凝胶(或生理盐水)能高效地漂白牙齿[7-9]。但是这种新的漂白技术与主流漂白技术如Beyond冷光漂白技术的疗效对比少见报道,同时也需进一步研究大气压低温等离子体是否同过氧化氢凝胶一样会刺激牙髓组织。因此,本研究以氩气流联合生理盐水组为对照,比较分析大气压低温等离子体与过氧化氢凝胶(伴或不伴冷光)的漂白效率和安全性。
1 材料与方法 1.1 材料 1.1.1 牙齿选择与预备40颗无龋坏、缺损及结构异常的人类离体牙通过超声刮治器去除牙洁石及牙周软组织,使用橡胶抛光杯抛光后存在0.1%的麝香草酚溶液备用。在实验前,为了确保牙齿保持稳定,舌面用高速水冷牙科车针磨成一个平面。
1.1.2 实验设备本实验使用大气压低温等离子体进行牙齿漂白的示意图见图 1。此设备主体为一个内径3 mm的聚四氟乙烯管,在其末端固定着内径2 mm的不锈钢铁环,正中心则固定着一根钨针,钨针的尖端与铁环的距离为1 mm,钨针通过稳流电阻器(0.4~2.0 MΩ)连接高压直流电源,同时为了监测电流和安全,不锈钢铁环通过100 Ω的无感电阻接地。本实验工作气体为氩气,电压6 kV,气流流速8 slm。设备在此条件下可产生长约10 mm、可安全接触的低温等离子体射流。

|
| 图 1 大气压低温等离子体应用于牙齿漂白的示意图(A)及工况图(B) |
1.1.3 实验动物
40只SPF级SD大鼠由重庆医科大学实验动物中心提供,雄性,体质量180~250 g,无牙体牙周等疾病。实验动物均用普通饲料喂养,自由进食饮水。
1.2 方法 1.2.1 牙齿漂白程序40颗离体牙完全随机化分为4组,每组10颗。A组:低温等离子体联合生理盐水漂白组;B组:35%过氧化氢凝胶联合冷光源漂白组;C组:35%过氧化氢凝胶漂白组;D组:氩气流联合生理盐水组。各组在相应条件下均处理标本颊面20 min。A组中等离子体设备喷头末端距标本颊面为10 mm,每分钟涂抹生理盐水于牙面以保持湿润。B组中冷光源(Beyond Technology公司, 美国)也固定在距标本颊面10 mm处,涂抹过氧化氢凝胶于标本颊面并光照10 min后彻底清洁与干燥标本,随后再次涂抹过氧化氢凝胶并光照10 min。C组中仅用过氧化氢凝胶处理标本颊面共20 min,无冷光源照射,其余操作同B组。D组中氩气的流速与生理盐水涂抹频率与A组保持一致。
1.2.2 漂白效果评价使用Canon EOS Rebel T3i数码相机搭配EF-S18-55 mm f/3.5-5.6 ISI镜头(Canon公司,日本)来记录离体牙颜色[7-8],将数码相机安装在带有光源的暗箱开口处,将标本固定于暗箱底部黑色背景纸中心,在所有记录过程中用黑布将整个暗箱及相机覆盖以避免外界光线干扰,设置曝光时间1/60 s,光圈值f/5.6,感光度400,焦距55 mm(图 2)。每个标本在术前术后均重复记录颜色5次并求均值。通过计算离体牙术前术后的颜色改变来评估漂白疗效,使用国际照明委员会(Commission Internationale de L’Eclairage, CIE)颜色系统进行牙齿颜色改变分析。该系统通过3个维度(L、a、b)对颜色进行评估:L代表黑(-)/白(+)程度(明亮程度),a代表绿(-)/红(+)程度,b代表蓝(-)/黄(+)程度。通过Adobe Photoshop CS6 (Adobe Systems公司, 美国)来获取L、a、b值,从而得到术前术后牙色各维度的变化量(ΔL、Δa、Δb),并按公式计算样本处理前后的总体颜色变化(ΔE)。

|
| 图 2 牙齿漂白前后颜色记录装置示意图 |
1.2.3 釉质表面超微形态检测
经干燥、24 K金镀膜、抽真空后,利用扫描电镜(SEM, S3000N, Hitachi公司, 日本)在放大2 000倍和5 000倍下,对比观察各组样本在处理后的釉质表面超微形态。
1.2.4 病理学分析40只SD大鼠完全随机化分为4组(A~D),处理方法同1.2.1。戊巴比妥钠按剂量35 mg/kg腹腔注射行全身麻醉后,实验大鼠的右上颌第一磨牙按实验分组依次接受相应处理20 min。术后2 d,所有大鼠通过过量剂量麻药处死,即刻解剖右上颌骨连同三颗磨牙,修整后立即在4 ℃下固定于10%中性福尔马林中24 h,在15% EDTA(pH 7.4)溶液中脱钙40 d,梯度酒精脱水,二甲苯透明,石蜡包埋,制备5 μm厚的连续切片;HE常规染色,中性树脂封固。将冠髓和根髓各分为上1/3、中1/3、下1/3共6部位,并在各部位分别计数炎症细胞。牙髓组织反应的组织病理学评级标准主要依据在光镜(×400倍, BX41, Olympus公司, 日本)下牙髓组织中炎症细胞的密度:1级为无或少量散在炎症细胞,2级为轻度炎症细胞浸润(≤25个/视野)或血管扩张充血,3级为中度炎症细胞浸润(>25~125个/视野),4级为重度炎症细胞浸润(>125个/视野)或牙髓坏死。
1.3 统计学分析采用SPSS 22.0统计软件。各组样本处理前后的牙齿颜色参数(x±s)采用单因素方差分析和Turkey’s检验,各组样本牙髓反应评级(中位数)采用Kruskal- Wallis检验和Mann-whitney检验。检验水准:α=0.05。
2 结果 2.1 牙齿漂白效果通过20 min的不同处理过程,4组实验离体牙的颜色改变(△L、△a、△b、△E)情况见表 1,A组牙齿△E值显著高于C组和D组(P < 0.05),与B组比较差异无统计学意义(P>0.05)。可以看出牙齿颜色的改变主要是由于明亮程度(L)上升及黄色程度(b)下降造成。
| 组别 | △L | △a | △b | △E |
| A组 | 3.18±2.29a | -0.82±0.64 | -5.40±2.30b | 6.68±2.40bc |
| B组 | 2.82±3.16a | -0.90±0.69 | -5.12±2.05b | 6.64±2.14b |
| C组 | 2.06±1.61 | -0.74±0.42 | -3.32±1.61b | 4.35±1.36b |
| D组 | 0.18±1.59 | -0.32±0.71 | -0.68±1.04 | 1.94±1.03 |
| a:P < 0.05,b:P < 0.01,与D组比较;c:P < 0.05,与C组比较 | ||||
2.2 釉质表面形态检测
4组离体牙实验术后的牙齿釉质表面扫描电镜结果见图 3。B组和C组在35%过氧化氢处理后釉质表面明显变得粗糙,似酸蚀后轻度脱矿改变,表现为蜂窝样凹陷;A组较D组略显粗糙,表现为釉质表面总体光滑,局部区域有少量散在的弹坑状凹陷。与B组和C组比较,A组20 min的低温等离子体联合生理盐水对釉质表面形态的改变被认为是可接受的。

|
| 图 3 各组样本处理后釉质表面扫描电镜观察 |
2.3 牙髓组织病理分析
动物实验术后2 d,D组样本的牙髓组织中成牙本质细胞层排列有序,牙髓组织中血管和细胞分布均匀。A组样本中,牙髓组织各部位均出现了轻度炎症细胞浸润及不同程度的血管扩张,其中3例出现了中度炎症细胞浸润。B组中所有样本的冠髓和根髓均出现了大范围的坏死。C组中大部分样本的牙髓坏死从冠髓累及至根髓中1/3,根尖1/3则有7例出现了轻度炎症细胞浸润(图 4)。各组样本牙髓组织各部位病理反应评级见表 2。

|
| A:低温等离子体联合生理盐水漂白组;B:35%过氧化氢凝胶联合冷光源漂白组;C:35%过氧化氢凝胶漂白组;D:氩气流联合生理盐水组;A~D:×100;E~H:分别为A~D中黑框部位放大(×400);红色箭头示炎症细胞/坏死区域 图 4 HE染色观察各实验组牙髓组织病理学改变 |
| 组别 | 冠髓牙合1/3 | 冠髓中1/3 | 冠髓颈1/3 | 根髓颈1/3 | 根髓中1/3 | 根髓根尖1/3 |
| A组 | 2a | 2a | 2 | 1 | 1.5 | 1 |
| B组 | 4b | 4b | 4b | 4b | 4b | 4b |
| C组 | 4b | 4b | 4b | 4b | 4b | 2a |
| D组 | 1 | 1 | 1 | 1 | 1 | 1 |
| a:P < 0.05,b:P < 0.01,与D组比较 | ||||||
3 讨论
本研究对比大气压低温等离子体联合生理盐水漂白术和冷光美白术的效果及安全性。通过离体实验及动物实验证实了大气压低温等离子体联合生理盐水可以有效漂白牙齿,同时拥有更佳的生物兼容性。
临床上主流的牙齿漂白系统仍然依赖于高浓度的过氧化氢。它在提供有效的漂白效果的同时仅对牙齿硬组织造成较小的损伤,但是过氧化氢(尤其是高浓度)也有诸多缺点,如牙髓损伤、牙颈部吸收、牙龈损伤、釉质表面形态及牙本质渗透性改变等。实验表明等离子体联合过氧化氢凝胶在漂白牙齿过程中等离子体可以通过去除牙齿表面蛋白、增加活性氧(ROS)生成来提高漂白效果[7]。一些研究则报道了等离子体联合生理盐水的漂白效果优于单纯使用过氧化氢凝胶[8-9],本研究结果也证实了这一点,而且结果显示等离子体联合生理盐水的漂白效果可以与过氧化氢凝胶协同冷光源相媲美。研究报道当等离子体中的自由基接触液体转为液相时会产生ROS如超氧阴离子(·O2-)、羟自由基(·OH)[8]。因此,在等离子体与生理盐水接触界面产生的ROS可以同传统牙齿漂白过程一样与色原物质相作用,从而达到漂白效果。另外,通过不断涂抹生理盐水于牙齿表面,等离子体可以持续产生足量的ROS,同时生理盐水的高流动性液态表面也可以增强ROS与牙齿的接触。
当牙齿接触10%或更高浓度的过氧化脲时,其釉质表面会发生超微结构及形态改变如出现凹坑、粗糙。过氧化物引起的氧化反应可以导致有机物及矿物成分丢失。35%过氧化氢与催化剂二氧化硅接触后呈酸性(pH=5.0~5.2),以往的研究显示当pH值低于5.2时釉质开始脱矿[10-11],而釉质脱矿会导致其表面粗糙从而增加患龋概率。但是生理盐水经等离子体处理后其pH仍保持在7.42[8]。本实验中,扫描电镜结果显示经过氧化氢凝胶(伴或不伴冷光源)处理的牙齿釉质表面出现了如蜂窝状凹坑的轻度脱矿表现,同时与氩气流联合生理盐水组相比等离子体处理后的牙齿表面粗糙度虽有略微差异,但比过氧化氢凝胶处理的牙齿表面光滑很多。证明大气压低温等离子体较35%过氧化氢凝胶对釉质表面的损伤更小,粗糙度的略微增加则可能是等离子体所产生的少量过氧化氢所引起的。
牙齿敏感是利用过氧化氢漂白牙齿后常见的术后不良反应,但是漂白术后牙齿敏感的具体机制目前仍未证实。一般认为高浓度的过氧化氢可以穿透釉质和牙本质进入牙髓组织,进入髓腔的过氧化氢可以减少细胞活性,影响细胞代谢、增殖,其分解产生的ROS则可以引起细胞膜不可逆损伤。一系列研究表明过氧化氢可以造成细胞损伤,如炎症反应[12]、细胞毒性[13]。研究证明合适剂量的大气压低温等离子体不会对口腔软组织及人体正常组织造成损害[14],但是牙髓组织对等离子体的反应仍然有待研究,而动物实验可以很好地反映牙髓组织对漂白物质的生理反应。尽管人类与大鼠的牙釉质与牙本质厚度明显不同,但是大鼠的磨牙与人类磨牙有类似的解剖和生理特性,比如它们的牙髓组织与髓腔形态在生理结构与组成上是相同的。另外,大鼠磨牙牙髓在创伤愈合进程中各阶段的重要生理反应与其他哺乳动物也是相似的[15]。研究报道,利用高浓度过氧化氢凝胶漂白大鼠磨牙与人类下切牙45 min,2 d后拔除处理牙进行牙髓组织病理分析发现:无论是大鼠磨牙还是人类下切牙均有部分标本出现牙髓液化坏死[16-17]。CINTRA等[17-18]认为大鼠磨牙可以作为在相同处理条件下预测人类下颌切牙牙髓对不同漂白产品反应的动物模型。因此,本实验设计了大鼠动物实验来比较上述不同处理方法的牙髓组织反应,研究发现高浓度过氧化氢凝胶在大鼠磨牙表面涂抹20 min后出现了严重的炎症浸润和牙髓坏死,而等离子体处理后的牙髓组织则多表现为正常状态或轻度炎症细胞浸润,表明比起高浓度过氧化氢凝胶,等离子体对大鼠牙髓组织更为安全。
等离子体中包含了多种活性成分,如紫外线、带电粒子、化学活性粒子等,等离子体通过它们对生物体产生不同的作用,如灭活病菌、处理癌细胞、促进凝血等。其中大气压低温等离子体产生的紫外线对人体正常组织及牙髓组织并无明显损伤作用。DOBRYNIN等[19]研究了大气压低温等离子体各成分的作用,结果表明其产生的紫外线并不包含可以失活生物体的紫外波段(200~290 nm),对生物体无损伤作用。当带电粒子接触液体转化为液相时会产生化学活性粒子,其中ROS在与生物体作用过程中一般认为是最重要的成分。ROS包括过氧化氢(H2O2)、超氧阴离子(·O2-)、羟自由基(·OH)等,过量的ROS会导致细胞的氧化应激反应。其中超氧阴离子(·O2-)、羟自由基(·OH)等由于含有不成对电子表现得十分活跃,如羟自由基(·OH)在溶液中存在时间为0.25 ms[20],因此并不会进入髓腔产生细胞氧化应激反应。等离子体通过与生理盐水接触可以直接产生足量的ROS,其中过氧化氢的含量是羟自由基(·OH)的十分之一[8]。而高浓度过氧化氢凝胶通过分解产生ROS从而达到漂白效果的同时,大量的过氧化氢分子通过釉质和牙本质进入髓腔引起术后牙齿敏感。因此相较过氧化氢凝胶,等离子体处理过程中进入髓腔的过氧化氢是有限的,对牙髓组织的损伤也会更小。
需要指出的是,对于大气压低温等离子体在医学方面的应用,虽然在诱导癌细胞凋亡、灭活病菌、促进凝血及口腔医学相关应用等诸多领域取得了瞩目的成就,但仍处于起步阶段,等离子体中的各种活性成分对生物体的作用机制并没有完全研究清楚,仍待从分子生物学角度进一步研究。对于等离子体在牙齿漂白方面的临床应用,一个重要的问题是活髓在体牙对等离子体的牙髓反应。因此,本研究利用大鼠活髓磨牙观察经等离子体处理后的牙髓组织变化情况,以此来评价等离子体应用于牙齿漂白的安全性,为其临床应用提供数据支撑。另外,等离子体装置需要针对临床应用环境进一步研发改进,如增大等离子体射流的处理面积及效率,增强等离子装置的可操作性及便携性。
总之,本实验表明大气压低温等离子体可以有效漂白牙齿并且对牙齿软硬组织造成的损伤更小。运用等离子体漂白牙齿的效果可以媲美传统的冷光美白。而且,经等离子体处理后牙齿釉质表面并无明显改变,表明其并不会对牙齿硬组织显微结构造成太大影响。另外,动物实验的牙髓组织病理分析表明等离子体会对大鼠牙髓产生损伤,但相较过氧化氢其刺激性是可以接受的。考虑到动物模型的限制,运用等离子体漂白牙齿仍须临床研究来验证其效果和生物安全性。
| [1] | XIAO J, ZHOU X D, ZHU W C, et al. The prevalence of tooth discolouration and the self-satisfaction with tooth colour in a Chinese urban population[J]. J Oral Rehabil, 2007, 34(5): 351–360. DOI:10.1111/j.1365-2842.2007.01729.x |
| [2] | DAHL J E, PALLESEN U. Tooth bleaching—a critical review of the biological aspects[J]. Crit Rev Oral Biol Med, 2003, 14(4): 292–304. DOI:10.1177/154411130301400406 |
| [3] | LUK K, TAM L, HUBERT M. Effect of light energy on peroxide tooth bleaching[J]. J Am Dent Assoc, 2004, 135(2): 194–201. DOI:10.14219/jada.archive.2004.0151 |
| [4] | MARSON F C, SENSI L G, VIEIRA L C, et al. Clinical evaluation of in-office dental bleaching treatments with and without the use of light-activation sources[J]. Oper Dent, 2008, 33(1): 15–22. DOI:10.2341/07-57 |
| [5] | GOLDBERG M, GROOTVELD M, LYNCH E. Undesirable and adverse effects of tooth-whitening products: A review[J]. Clin Oral Investig, 2010, 14(1): 1–10. DOI:10.1007/s00784-009-0302-4 |
| [6] | WANG W, ZHU Y H, LI J J, et al. Efficacy of cold light bleaching using different bleaching times and their effects on human enamel[J]. Dent Mater J, 2013, 32(5): 761–766. DOI:10.4012/dmj.2013-109 |
| [7] | LEE H W, KIM G J, KIM J M, et al. Tooth bleaching with nonthermal atmospheric pressure plasma[J]. J Endod, 2009, 35(4): 587–591. DOI:10.1016/j.joen.2009.01.008 |
| [8] | CHENG Y C, WU C H, LIU C T, et al. Tooth bleaching by using a helium-based low-temperature atmospheric pressure plasma jet with saline solution[J]. Plasma Process Polym, 2017, 14(11): 1600235. DOI:10.1002/ppap.201600235 |
| [9] | PAN J, SUN P, TIAN Y, et al. A novel method of tooth whitening using cold plasma microjet driven by direct current in atmospheric-pressure air[J]. IEEE Trans Plasma Sci, 2010, 38(11): 3143–3151. DOI:10.1109/tps.2010.2066291 |
| [10] | CAVALLI V, ARRAIS C A, GIANNINI M, et al. High-concentrated carbamide peroxide bleaching agents effects on enamel surface[J]. J Oral Rehabil, 2004, 31(2): 155–159. DOI:10.1111/j.1365-2842.2004.01138.x |
| [11] | SHI X C, MA H, ZHOU J L, et al. The effect of cold-light-activated bleaching treatment on enamel surfaces in vitro[J]. Int J Oral Sci, 2012, 4(4): 208–213. DOI:10.1038/ijos.2012.70 |
| [12] | HAHN H J, KIM K B, AN I S, et al. Protective effects of rosmarinic acid against hydrogen peroxide induced cellular senescence and the inflammatory response in normal human dermal fibroblasts[J]. Mol Med Rep, 2017, 16(6): 9763–9769. DOI:10.3892/mmr.2017.7804 |
| [13] | TRINDADE F Z, RIBEIRO A P, SACONO N T, et al. Trans-enamel and trans-dentinal cytotoxic effects of a 35% H2O2 bleaching gel on cultured odontoblast cell lines after consecutive applications[J]. Int Endod J, 2009, 42(6): 516–524. DOI:10.1111/j.1365-2591.2009.01544.x |
| [14] |
熊紫兰, 卢新培, 曹颖光. 等离子体医学[J].
中国科学:技术科学, 2011, 41(10): 1279–1298.
XIONG Z L, LU X P, CAO Y G. Plasma medicine[J]. Scientia Sinica(Technologica), 2011, 41(10): 1279–1298. DOI:10.1360/ze2011-41-10-1279 |
| [15] | DAMMASCHKE T. Rat molar teeth as a study model for direct pulp capping research in dentistry[J]. Lab Anim, 2010, 44(1): 1–6. DOI:10.1258/la.2009.008120 |
| [16] | COSTA C A, RIEHL H, KINA J F, et al. Human pulp responses to in-office tooth bleaching[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2010, 109(4): e59–e64. DOI:10.1016/j.tripleo.2009.12.002 |
| [17] | CINTRA L T, BENETTI F, DA SILVA FACUNDO A C, et al. The number of bleaching sessions influences pulp tissue damage in rat teeth[J]. J Endod, 2013, 39(12): 1576–1580. DOI:10.1016/j.joen.2013.08.007 |
| [18] | CINTRA L T, BENETTI F, FERREIRA L L, et al. Evaluation of an experimental rat model for comparative studies of bleaching agents[J]. J Appl Oral Sci, 2016, 24(2): 171–180. DOI:10.1590/1678-775720150393 |
| [19] | DOBRYNIN D, FRIDMAN G, FRIEDMAN G, et al. Physical and biological mechanisms of direct plasma interaction with living tissue[J]. New J Phys, 2009, 11(11): 115020. DOI:10.1088/1367-2630/11/11/115020 |
| [20] | NORBERG S A, TIAN W, JOHNSEN E, et al. Atmospheric pressure plasma jets interacting with liquid covered tissue: touching and not-touching the liquid[J]. J Phys D Appl Phys, 2014, 47(47): 475203. DOI:10.1088/0022-3727/47/47/475203 |