心肌肥厚是心脏对各种刺激产生的适应性增生,是一种产生缓慢而有效的代偿性重构,但这种代偿功能可增加心肌的需氧量,使心血管意外事件增加,最终导致心力衰竭,探索预防及减轻甚至逆转心肌肥厚的方法意义重大。内皮素(Endothelin,ET)是1988年日本学者YANAGISAWA等[1]从猪的主动脉内皮细胞分离纯化而来,是目前已知的最强的收缩血管物质之一,据ET氨基酸序列不同,分为ET-1、ET-2、ET-3三个同源异构体[2]。内皮素-1(Endothelin-1,ET-1)是ET家族中表达最多的成员,其表达受到缺血、缺氧[3]、机械应力[4]等多种刺激因素的调控。ET-1可在心肌细胞中被合成及分泌,并诱导心肌细胞的肥大[5-7],加重心肌损伤,升高脑钠肽,增加心肌纤维化,提示ET-1是与心功能密切相关[8],且内皮素A(Endothelin-A,ETA)受体是ET-1诱导心肌肥大的必要通路[9],然而,临床试验中特异性ETA受体拮抗剂治疗心衰的结果令人失望[10],近期发现原因可能在于ET-1浓度一旦升高,其诱导心肌细胞肥大的效应持续存在[9]。那么直接抑制其作用的信号通路来改善心肌细胞肥大是否可行呢?已知通过抑制钙调神经磷酸酶/活化T细胞核因子3(Calcineurin/Activated T cell nuclear factor 3,CaN/NAFT3)可改善ET-1诱导心肌细胞肥大[9]。G蛋白偶联胆汁酸受体1(G protein-coupled bile acid receptor 1,TGR5)是一种由胆汁酸调控的细胞表面G蛋白偶联受体,又称为GPBAR1、M-Bar、CPR131或BG37[11]。研究表明,TGR5参与体内胆汁酸代谢、糖代谢、脂代谢及能量代谢[12-14]。TGR5在心血管系统的作用研究有限,冯健等[15]观察到TGR5激活后可通过抑制CaN/NAFT3信号通路减轻高糖诱导的心肌细胞肥大。基于上述证据,推测TGR5可减轻ET-1诱导的心肌细胞肥大,部分机制可能与CaN/NAFT3信号通路相关。为验证假设,本实验以乳鼠心肌细胞为研究对象,给予ET-1诱导建立心肌肥厚模型,分别用特异性TGR5受体激动剂及siTGR5转染心肌细胞,检测心肌细胞表面积、细胞总蛋白、ANF及β-MHC表达,进而探讨TGR5对ET-1诱导心肌细胞肥大的作用及机制。
1 材料和方法 1.1 实验动物出生0-2 d昆明乳小鼠(湖北省疾控中心提供孕鼠生的乳鼠)生产许可证:SCXK(鄂)2015-0018。
1.2 主要试剂ET-1、INT-777(Med Chem Express),胰酶-EDTA和DMEM低糖(HyClone),结晶紫(武汉阿斯本生物技术有限公司),D-Hanks、PBS(吉诺生物医药技术有限公司),胶原酶Ⅱ、5-溴脱氧氟尿嘧啶核苷(Sigma),BCA蛋白质浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒、RIPA总蛋白裂解液、磷酸化蛋白酶抑制剂、ECL化学发光检测试剂盒、100*PMSF(ASPEN),Protease Inhibitor Cocktail(ROCHE),胎牛血清(杭州天杭生物科技有限公司),培养基(Hyclone),NFAT3抗体(Cell Signaling Technology),CaN抗体、ANF抗体、b-MHC抗体、TGR5抗体(abcam),PrimeScriptTM RT reagent Kit with gDNA Eraser和SYBR®Premix Ex TaqTM(TaKaRa),Trizol Reagent(Invitrogen),TGR5-siRNA三保一套装(南京建成)。
1.3 方法 1.3.1 新生乳鼠心肌细胞分离与原代培养参照冯健等[16]的描述的方法分离及培养心肌细胞。
1.3.2 实验分组 1.3.2.1 观察ET-1诱导心肌细胞肥厚的浓度及时间实验分为空白对照组,ET-1 10-8、ET-1 10-7 、ET-1 10-6 mmol/L组,各组分别干预12、24、36、48 h;
1.3.2.2 观察TGR5激活对心肌细胞肥厚的影响实验分为:空白对照组:给予DMEM/F-12完全培养液培养48 h;ET-1组:给予ET-1 10-6 mmol/L培养48 h;ET-1+INT-777组:给予ET-1 10-6 mmol/L和TGR5特异性激动剂INT-777 30 μmol/L(根据实验组得出的数据,论文暂未公布)共同培养48 h;ET-1+ INT-777+TGR5 siRNA组:先予以TGR5 siRNA转染心肌细胞6 h后,给予ET-1 10-6 mmol/L和TGR5特异性激动剂INT-777 30 umol/L共同培养48 h,ET-1+ INT-777+TGR5 siRNA-NC组:先予以TGR5 siRNA空病毒转染心肌细胞6 h后,给予ET-1 10-6 mmol/L和TGR5特异性激动剂INT-777 30 μmol/L共同培养48 h。
1.3.3 心肌细胞表面积和总蛋白的测定将各组分别干预特定时间后于超净工作台内,打开六孔板,放置灭菌盖玻片。将细胞悬液滴加至盖玻片上,置于CO2浓度为5%的培养箱中于37 ℃培养至细胞固着(约2 h)。加入2 mL细胞培养液继续培养约6 h。倒去培养基,用PBS洗3次,每次5 min。用甲醇固定10 min,PBS洗3次。用新鲜的生理盐水与结晶紫母液按2 :9的比例稀释成结晶紫工作液。将结晶紫染液加入孔内染色30 min。PBS洗两次。随机选择3-4个视野进行拍照,采用IPP6.0软件进行描记和测量单个细胞的表面积。
干预各组六孔板中的特定时间后,收集各组细胞,每孔加入100 μL细胞裂解液,提取总蛋白。采BC法检测每组总蛋白量。
1.3.4 siTGR5转染心肌细胞方法先将对数生长期原代小鼠心肌细胞,调整细胞浓度为5×104个/mL,接种于六孔板,24 h细胞贴壁,转染时要求细胞汇合度为30%~50%。验证实验分为对照组、siRNA-NC组、siRNA1-TGR5组、siRNA2-TGR5组和siRNA3-TGR5组,根据Lipofectamine 2000 Transfection Reagent说明书,在每孔细胞中加入500 μL转染液,轻轻摇匀,37 ℃培养CO2培养箱中培养,转染6 h,再进行采用WB和PCR实验检测TGR5的蛋白和mRNA表达水平。选择siRNA1,分别进行药物和转染处理,进行后续实验。
1.3.5 RT-PCR检测细胞基因表达各组细胞经干预后,用预冷PBS洗涤,Trizol溶液提取总RNA。采用PrimeScriptTMRT reagent Kit with gDNA Eraser进行合成第一链cDNA,以cDNA为模板,加入特异性引物和SYBR®Premix Ex TaqTM在Life technologies公司的StepOneTM Real-Time PCR仪上对其mRNA进行扩增及检测。PCR反应条件:预变性,95 ℃,1 min;95 ℃,15 s→58 ℃,20 s→72 ℃,45 s,40次循环;熔解曲线60 ℃→95 ℃,每20 s升温1 ℃。使用引物序列如下:M-GAPDH上游5′-TGAAGGGTGGAGCCG-3′,下游5′- AGTCTTCTGGGTGGCAGTGAT-3′;M-TGR5上游5′-CTGTGTGAGATCCGCCGACT-3′,下游5′-CGC-TCATAGGCCAAGACTGAC-3′;M-CAN上游5′-CGGAA-GAAATCACGACTCTGG-3′,下游5′-CCTCTGTCTCTTCTTCTGCTCCA-3′。结果分析:以GAPDH为内参,计算各组细胞中相应基因的ΔΔCT值。ΔΔCT= CT(目的基因,实验样本)-CT(内标基因,实验样本)-CT(目的基因,对照样本)+CT(内标基因,对照样本),以目的基因的量(2-ΔΔCT)为定量结果进行统计学分析。
1.3.6 Western blot检测蛋白表达各组经干预特定时间后,提取细胞总蛋白及核蛋白,用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。根据测得浓度取相应体积样品至每孔40 μg蛋白,加入5×蛋白上样缓冲液,95~100 ℃沸水浴5 min。接着,制胶-上样-电泳-转膜-封闭1 h-一抗4 ℃过夜-二抗室温30 min- ECL反应-暗室曝光。最后,将胶片进行扫描存档,AlphaEaseFC软件处理系统分析目标带的光密度值。
1.4 统计学分析采用SSPS 17.0软件,计量数据均采用x±s表示,多组间比较采用单因素方差分析,组间两两比较采用独立样本t检验。
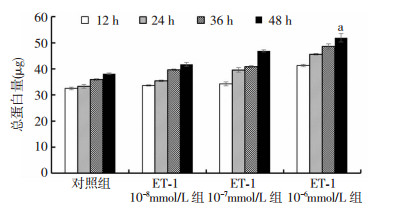
2 结果 2.1 ET-1诱导乳鼠心肌细胞表面积增大及总蛋白增加与对照组相比,ET-1在10-8 mmol/L~10-6 mmol/L浓度范围内随浓度增高,心肌细胞表面积增大,总蛋白量增多;且在48 h内培养的时间越长,心肌细胞表面积越大、总蛋白量越多(P < 0.05)。ET-1浓度为10-6 mmol/L培养48 h心肌细胞表面积为(3 624.7±71.60)um2,总蛋白量(51.810±1.47)μg,显著高于对照组培养48 h的心肌细胞表面积(1 560.8±3 188.94)um2,总蛋白量为(37.827±0.47)μg,两组比较差异显著(P < 0.05)。见图 1、2。

|
| A:48 h对照组;B:48 h ET-1 10-6 mmol/L组 图 1 ET-1诱导乳鼠心肌细胞表面积 |
|
| a: P < 0.05与对照组比较 图 2 ET-1诱导乳鼠心肌细胞总蛋白的表达 |
2.2 TGR5-siRNA转染验证实验结果
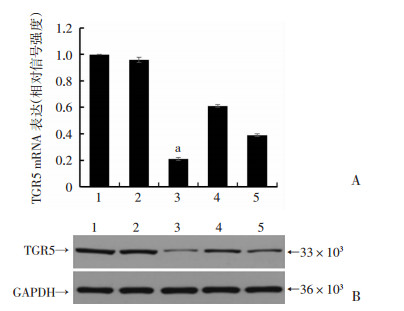
验证实验中,与对照组相比,siRNA1-TGR5组TGR5mRNA扩增倍数为0.21±0.01,蛋白表达是内参GAPDH的0.231±0.017,与对照组相比差异最为显著(P < 0.05)。见图 3。选择siRNA1-TGR5进行后续实验。
|
| 1:对照组; 2: siRNA-NC组; 3: siRNA1-TGR5组; 4: siRNA2-TGR5组; 5: siRNA3-TGR5组;A:mRNA表达; B:蛋白表达a: P < 0.05与对照组比较;B:蛋白表达 图 3 TGR5-siRNA转染乳鼠心肌心肌细胞TGR5mRNA及蛋白表达 |
2.3 激活TGR5抑制ET-1诱导心肌细胞表面积的增大和总蛋白量的增加
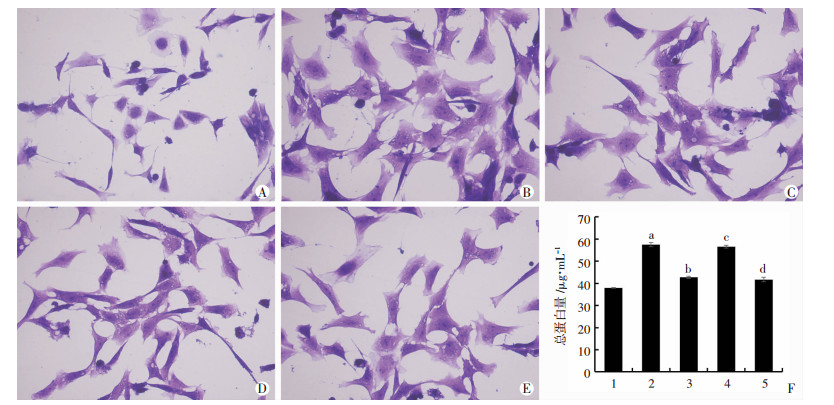
与对照组相比,ET-1组干预48 h后心肌细胞表面积增大,总蛋白量增加(P < 0.05)。ET-1+INT-777组较ET-1组心肌细胞表面积增大受限,总蛋白增加受到抑制(P < 0.05)。ET-1组与ET-1+INT-777+TGR5 siRNA组相比无统计学差异(P>0.05),ET-1+INT-777组与ET-1+ INT-777+TGR5 siRNA-NC组相比无统计学意义(P>0.05), 见图 4。
|
| A~E:心肌细胞表面积的结晶紫染色观察;A:对照组;B:ET-1组;C:ET-1+INT-777组;D:ET-1+ INT-777+TGR5 siRNA组, E:ET-1+ INT-777+TGR5 siRNA-NC组;F:总蛋白量定量分析,1:对照组,2:ET-1组,3:ET-1+INT-777组,4:ET-1+INT-777+TGRs siRNA组,5:ET-1+ INT-777+TGR5 siRNA-NC组;a: P < 0.05与对照组比较;b:P < 0.05与ET-1组比较;c: P < 0.05与ET-1+INT-777组比较;d:P < 0.05与ET-1+ INT-777+TGR5 siRNA组比较 图 4 激活TGR5受体后乳鼠心肌细胞表面积的大小及总蛋白表达量 |
2.4 TGR5激活后抑制ET-1诱导乳鼠心肌细胞ANF及β-MHC蛋白的表达
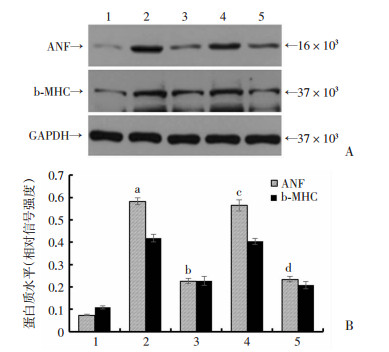
与对照组相比,ET-1组干预48 h后心肌细胞ANF及β-MHC蛋白表达明显增多(P < 0.05)。激活TGR5后,心肌细胞ANF及β-MHC表达增加受到抑制(P < 0.05)。ET-1组与TGR5 siRNA组干预组相比无统计学差异(P>0.05),ET-1+INT-777组与TGR5 siRNA空病毒组相比无统计学意义(P>0.05)。见图 5。
|
| 1:对照组; 2:ET-1组; 3:ET-1+INT-777组; 4:ET-1+ INT-777+TGR5 siRNA组; 5:ET-1+ INT-777+TGR5 siRNA-NC组; a: P < 0.05与对照组比较;b:P < 0.05与ET-1组比较;c: P < 0.05与ET-1+INT-777组比较;d:P < 0.05与ET-1+ INT-777+TGR5 siRNA组比较A:wester blot结果;B:半定量结果 图 5 激活TGR5受体后乳鼠心肌细胞ANF及β-MHC蛋白的表达 |
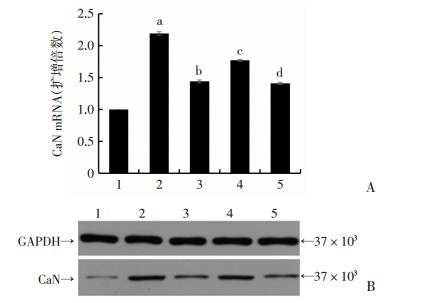
2.5 TGR5激活后抑制ET-1诱导心肌细胞CaN-mRNA及蛋白的表达
与对照组相比,ET-1组CaNmRNA及蛋白的表达明显增加(P < 0.05)。与ET-1组相比,激活TGR5及予以空病毒组,CaNmRNA及蛋白的表达增加量受抑制(P < 0.05);予以转染病毒后,CaNmRNA及蛋白的表达增加(P < 0.05)。见图 6。
|
| 1:对照组; 2:ET-1组; 3:ET-1+INT-777组; 4:ET-1+ INT-777+TGR5 siRNA组;5:ET-1+ INT-777+TGR5 siRNA-NC组; a: P < 0.05与对照组比较;b:P < 0.05与ET-1组比较;c: P < 0.05与ET-1+INT-777组比较;d:P < 0.05与ET-1+INT-777+TGR5 siRNA组比较A:mRNA表达结果;B:蛋白表达结果 图 6 TGR5激活后心肌细胞CaNmRNA及蛋白的表达 |
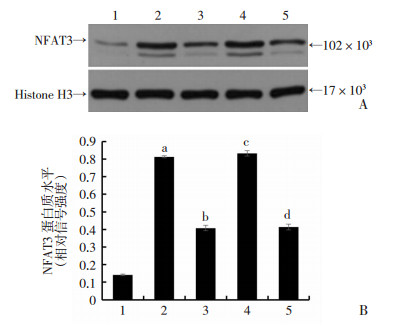
2.6 TGR5激活抑制ET-1诱导心肌细胞NFAT3核蛋白的表达
与对照组相比,ET-1组NFAT3的表达明显增加(P < 0.05)。与ET-1组相比,激活TGR5及予以空病毒组,NFAT3的表达增加量受抑制(P < 0.05);予以转染病毒后,NFAT3的表达增加(P < 0.05)。见图 7。
|
| 1:对照组; 2:ET-1组; 3:ET-1+INT-777组; 4:ET-1+ INT-777+TGR5 siRNA组;5:ET-1+ INT-777+TGR5 siRNA-NC组; a: P < 0.05与对照组比较;b:P < 0.05与ET-1组比较;c: P < 0.05与ET-1+INT-777组比较;d:P < 0.05与ET-1+ INT-777+TGR5 siRNA组比较。A:Wester blot结果;B:半定量结果 图 7 TGR5激活后NFAT3核蛋白的表达 |
3 讨论
心肌肥厚是心功能不全、心律失常猝死的独立危险因素,其主要表现为心肌细胞体积增大、蛋白增加和相关肥厚基因表达增加[17]。尽管致心肌肥厚的病因不同,但其发生机制均与相关细胞信号通路的激活有关。目前认为参与心肌肥厚的信号通路包括蛋白激酶C(Protein kinase C, PKC)信号通路、.丝裂原激活的蛋白激酶(Mitogen-activated protein kinase, MAPK)信号通路、Ca2+及其依赖的信号通路等等,各信号通路相互作用,共同导致心肌细胞总蛋白合成增加、细胞体积增大、心肌肥大因子(如ANF、β-MHC等)表达增加[18]。MOLKENTIN等[19]于1998年首次报道了CaN/NFAT3信号通路对心肌肥厚的作用,当外界刺激或体液因子导致细胞内Ca2+浓度升高时, 通过Ca2+与CaM激活Ca2+-CaN依赖的信号通路在不同肥大刺激介导的心肌肥大中起中心枢纽作用, 是它们的最后共同信号机制[20]。
ET-1在多种心血管疾病的发生发展中具有重要的病理生理学作用,包括动脉粥样硬化、缺血性心脏病、糖尿病血管病变、糖尿病肾病和胰岛素抵抗[21-23],且ET-1在心肌细胞中能诱导心肌细胞肥大[24]。ET-1诱导心肌细胞肥大主要有两条途径:一、通过与ETA受体结合,激活PKC,使细胞内Ca+浓度增加[25],通过CaN/NAFT3信号通路[17]及钙调蛋白依赖性蛋白激酶Ⅱ(calmodulin-dependent protein kinase Ⅱ, CaMKⅡ)信号通路[26]诱导心肌肥大;二、PKC激活细胞外信号调节激酶(extracellular signal-regulated kinase, ERKs)促进心肌肥大[27]。可知ETA是ET-1诱导心肌肥大的必要通路之一[9],然而,临床试验中特异性ETA受体拮抗剂波生坦治疗心衰的结果却并不理想[10],原因可能在于ET-1浓度一旦升高,其诱导心肌细胞肥大的效应持续存在[9]。所以我们探索抑制其他信号通路可否抑制其心肌细胞的肥大,实验表明,通过抑制CaN/NAFT3可改善ET-1诱导心肌细胞肥大[9],同时也证实了CaN/NAFT3是ET-1诱导心肌肥大的信号通路之一[28]。本实验结果显示:48 h内ET-1在10-8 mmol/L-10-6 mmol/L浓度范围内可诱导心肌细胞肥大,且具有浓度依赖性和时间依赖性。且ET-1 10-6 mmol/L培养48 h诱导心肌细胞面积明显增大及总蛋白显著增多,有效建立心肌细胞肥大模型。已知CaN/NAFT3信号通路是ET-1诱导心肌肥大通路之一[28],在实验2结果也显示ET-1组中CaN及NFAT3表达较对照组明显增加,与既往研究一致。
TGR5是一种由胆汁酸调控的细胞表面G蛋白偶联受体[11],人体组织中广泛表达,包括肝脏、小肠、心脏、骨骼肌和白细胞等组织器官中。但不同器官中表达程度不同[29],在各个器官的作用也有差异,如在肠内分泌细胞L细胞[30],其作用可降低血糖[31-32];在小鼠活体实验中,对淀粉样β蛋白1-42(Amyloid beta protein 1-42, Aβ 1-42)诱导的神经毒性有保护效应[33];在骨骼肌中,TGR5表达增加可通过增加非折叠蛋白反应(Unfolded Protein Response, UPR)的表达,改善肌肉功能[34]。心脏中的TGR5作用研究逐渐增多,激活心脏的TGR5可改善心脏细胞对生理、肌力和血流动力学应激反应,在心肌适应性中起着重要的作用[35]。已知通过抑制CaN/NAFT3可改善ET-1诱导心肌细胞肥大[9],而TGR5激活后可通过抑制CaN/NAFT3信号通路减轻高糖诱导的心肌细胞肥大[15],据此本实验假设:TGR5受体激活后可通过抑制CaN/NAFT3信号通路减轻ET-1诱导的心肌细胞肥大。结果显示:予以TGR5特异性激动剂INT-777后,能明显抑制ET-1诱导的心肌细胞表面积及蛋白含量的增加;予以siTGR5转染细胞后,部分消除了INT-777的上述改善作用,说明激活TGR5能改善ET-1诱导的心肌细胞肥大。予以INT-777后明显抑制了ET-1诱导的CaN的表达,予以siTGR5转染细胞后,部分消除了上述抑制作用,证实了TGR5与CaN的关系。CaN激活后,使细胞质中的NFAT3去磷酸化, 致使NF-AT3的构型改变, 暴露出核定位序列(NLS), 使NF-AT3得以转位到核, 在细胞核内与锌指转录因子GATA4相互作用, 激活下游传导系统,引起心脏肥大基因的转录:如ANF、B—MHC等表达[20]。实验中予以INT-777后NFAT3核蛋白表达增多,予以siTGR5转染细胞后,部分消除了上述的抑制作用,提示激活TGR5通过CaN/NAFT3信号通路抑制ET-1诱导的心肌细胞肥大。
综上所述,本研究表明激活TGR5能抑制ET-1诱导的心肌细胞肥大,其部分机制可能与CaN/NAFT3信号通路相关。为治疗ET-1导致心功能不全提供了一个新的思路,但关于TGR5在人体中对ET-1诱导的心肌重构是否有效,还需进一步探讨。
| [1] | YANAGISAWA M, KURIHARA H, KIMURA S, et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J]. Nature, 1988, 332(6163): 411–415. DOI:10.1038/332411a0 |
| [2] | FAGAN K A, MCMURTRY I F, RODMAN D M. Role of endothelin-1 in lung disease[J]. Respir Res, 2001, 2(2): 90. DOI:10.1186/rr44 |
| [3] | WU W, KUANG P, LI Z. Changes of endothelin-1 gene expression in rat brains during ischemia and ischemic reperfusion[J]. Chin Med Sci J, 1996, 11(4): 228–231. |
| [4] | KOHAN D E. The renal medullary endothelin system in control of sodium and water excretion and systemic blood pressure[J]. Curr Opin Nephrol Hypertens, 2006, 15(1): 34–40. DOI:10.1097/01.mnh.0000186852.15889.1a |
| [5] |
孔宏亮, 黄带发, 王聿杰, 等. 人参皂甙Rbl通过PKC途径抑制ET-1诱发的乳鼠心肌肥大[J].
心血管康复医学杂志, 2015, 24(1): 10–15.
KONG H L, HUANG D F, WANG Y J, et al. Ginsenosides-Rbl inhibits ET-1-induced cardiomyocyte hypertrophy via PKC pathway in neonatal rats[J]. Chin J Cardiovasc Rehabil Med, 2015, 24(1): 10–15. DOI:10.3969/j.issn.1008-0074.2015.01.03 |
| [6] | ICHIKAWA K I, HIDAI C, OKUDA C, et al. Endogenous endothelin-1 mediates cardiac hypertrophy and switching of myosin heavy chain gene expression in rat ventricular myocardium[J]. J Am Coll Cardiol, 1996, 27(5): 1286–1291. DOI:10.1016/0735-1097(95)00568-4 |
| [7] | LIOU S F, HSU J H, CHEN Y T, et al. KMUP-1 attenuates endothelin-1-induced cardiomyocyte hypertrophy through activation of heme oxygenase-1 and suppression of the Akt/GSK-3β, Calcineurin/NFATc4 and RhoA/ROCK pathways[J]. Molecules, 2015, 20(6): 10435–10449. DOI:10.3390/molecules200610435 |
| [8] | KALK P, WESTERMANN D, HERZFELD S, et al. Additional lack of iNOS attenuates diastolic dysfunction in aged ET-1 transgenic mice[J]. Can J Physiol Pharmacol, 2008, 86(6): 353–357. DOI:10.1139/Y08-032 |
| [9] | ARCHER C R, ROBINSON E L, DRAWNEL F M, et al. Endothelin-1 promotes hypertrophic remodelling of cardiac myocytes by activating sustained signalling and transcription downstream of endothelin type A receptors[J]. Cell Signal, 2017, 36: 240–254. DOI:10.1016/j.cellsig.2017.04.010 |
| [10] | KIRKBY S, HADOKE F, BAGNALL J, et al. The endothelin system as a therapeutic target in cardiovascular disease: great expectations or bleak house?[J]. Br J Pharmacol, 2009, 153(6): 1105–1119. DOI:10.1038/sj.bjp.0707516 |
| [11] | KAWAMATA Y, FUJII R, HOSOYA M, et al. A G protein-coupled receptor responsive to bile acids[J]. J Biol Chem, 2003, 278(11): 9435–9440. DOI:10.1074/jbc.m209706200 |
| [12] | POLS T W H, NORIEGA L G, NOMURA M, et al. The bile acid membrane receptor TGR5 as an emerging target in metabolism and inflammation[J]. J Hepatol, 2011, 54(6): 1263–1272. DOI:10.1016/j.jhep.2010.12.004 |
| [13] |
郝保兵, 饶建华, 吕凌, 等. 胆汁酸膜受体TGR5在肝脏代谢免疫中的研究进展[J].
中华肝胆外科杂志, 2014, 20(11): 834–837.
HAO B B, RAO J H, LYU L, et al. Progress of TGR5 receptors in liver metabolism and immune[J]. Chin J Hepatobil Surg, 2014, 20(11): 834–837. DOI:10.3760/cma.j.issn.1007-8118.2014.11.019 |
| [14] |
颜勇, 李旭忠, 王时光, 等. G蛋白偶联胆汁酸受体TGR5在炎症及炎性疾病中的作用[J].
医学研究杂志, 2016, 45(3): 185–188.
YAN Y, LI X Z, WANG S G, et al. The role of G-protein-conjugated bile acid receptor TGR5 in inflammation and inflammatory diseases[J]. J Med Res, 2016, 45(3): 185–188. |
| [15] |
冯健, 吴丹, 陈旭昕, 等. 激活TGR5通过CaN/NFAT3途径减轻高糖诱导的心肌细胞肥大[J].
中国病理生理杂志, 2017, 33(2): 239–243.
FENG J, WU D, CHEN X X, et al. Activation of TGR5 reduces high glucose-induced cardiomyocyte hyper-trophy by inhibiting CaN/NFAT3 signaling[J]. Chin J Pathophysiol, 2017, 33(2): 239–243. DOI:10.3969/j.issn.1000-4718.2017.02.008 |
| [16] |
吴丹, 冯健, 莫显刚, 等. 改良的乳小鼠心肌细胞原代培养方法[J].
中国比较医学杂志, 2016, 26(4): 62–67.
WU D, FENG J, MO X G, et al. An improved method for primary culture of neonatal mouse cardiomyocytes[J]. Chin J Comp med, 2016, 26(4): 62–67. DOI:10.3969/j.issn.1671-7856.2016.04.011 |
| [17] | THAM Y K, BERNARDO B C, OOI J Y, et al. Pathophysiology of cardiac hypertrophy and heart failure: signaling pathways and novel therapeutic targets[J]. Arch Toxicol, 2015, 89(9): 1401–1438. DOI:10.1007/s00204-015-1477-x |
| [18] |
刘丽娜, 李法琦. 心肌肥厚相关信号通路的研究进展[J].
重庆医学, 2010, 39(20): 2805–2808.
LIU L N, LI F Q. Advances in the study of signaling pathways related to cardiac hypertrophy[J]. Chongqing Med, 2010, 39(20): 2805–2808. DOI:10.3969/j.issn.1671-8348.2010.20.049 |
| [19] | HUNTER J J, CHIEN K R. Signaling pathways for cardiac hypertrophy and failure[J]. N Engl J Med, 1999, 341(17): 1276–1283. DOI:10.1056/nejm199910213411706 |
| [20] | HONGO K, WHITE E, ORCHARD C H. Effect of stretch on contraction and the Ca2+ transient in ferret ventricular muscles during hypoxia and acidosis[J]. Am J Physiol, 1995, 269(3 Pt 1): C690–C697. DOI:10.1152/ajpcell.1995.269.3.C690 |
| [21] |
董化江, 徐鹏霄. 血管内皮素的研究进展[J].
武警后勤学院学报(医学版), 2009, 18(6): 557–560.
DONG H J, XU P X. The research progress of endothelin axis[J]. J Armed Police Logist Coll (Med Sci), 2009, 18(6): 557–560. |
| [22] | PERNOW J, SHEMYAKIN A, BÖHM F. New perspectives on endothelin-1 in atherosclerosis and diabetes mellitus[J]. Life Sci, 2012, 1(13/14): 507–516. DOI:10.1016/j.lfs.2012.03.029 |
| [23] | SCHOOLING C M, KODALI H, LI S, et al. ET (endothelin)-1 and ischemic heart disease: A mendelian randomization study[J]. Circ Genom Precis Med, 2018, 11(3): e002026. DOI:10.1161/CIRCGENETICS.117.002026 |
| [24] | LI M, HE H P, GONG H Q, et al. NFATc4 and myocardin synergistically up-regulate the expression of LTCC α1C in ET-1-induced cardiomyocyte hypertrophy[J]. Life Sci, 2016, 155: 11–20. DOI:10.1016/j.lfs.2016.05.007 |
| [25] | SUZUKI T, HOSHI H, MITSUI Y. Endothelin stimulates hypertrophy and contractility of neonatal rat cardiac myocytes in a serum-free medium[J]. FEBS Lett, 1990, 268(1): 149–151. DOI:10.1016/0014-5793(90)80995-U |
| [26] | LU Y M, SHIODA N, HAN F, et al. DY-9760e inhibits endothelin-1-induced cardiomyocyte hypertrophy through inhibition of CaMKII and ERK activities[J]. Cardiovasc Ther, 2009, 27(1): 17–27. DOI:10.1111/j.1755-5922.2008.00068.x |
| [27] |
鲁伟, 刘培庆, 徐江, 等. ERKs及细胞内游离钙在内皮素-1诱导心肌细胞肥大反应中的作用[J].
中国病理生理杂志, 2001, 17(6): 496–500.
LU W, LIU P Q, XU J, et al. Roles of ERKs and intracellular free calcium in cardiomyocyte hypertrophic response induced by endothelin-1[J]. Chin J Pathophysiol, 2001, 17(6): 496–500. DOI:10.3321/j.issn:1000-4718.2001.06.005 |
| [28] | ZHU W D, ZOU Y Z, SHIOJIMA I, et al. Ca2+/calmodulin-dependent kinase Ⅱ and calcineurin play critical roles in endothelin-1-induced cardiomyocyte hypertrophy[J]. J Biol Chem, 2000, 275(20): 15239–15245. DOI:10.1074/jbc.275.20.15239 |
| [29] | MARUYAMA T, MIYAMOTO Y, NAKAMURA T, et al. Identification of membrane-type receptor for bile acids (M-BAR)[J]. Biochem Biophys Res Commun, 2002, 298(5): 714–719. DOI:10.1016/S0006-291X(02)02550-0 |
| [30] | REIMANN F, HABIB A M, TOLHURST G, et al. Glucose sensing in L cells: A primary cell study[J]. Cell Metab, 2008, 8(6): 532–539. DOI:10.1016/j.cmet.2008.11.002 |
| [31] | PARKER H E, WALLIS K, LE ROUX C W, et al. Molecular mechanisms underlying bile acid-stimulated glucagon-like peptide-1 secretion[J]. Br J Pharmacol, 2012, 165(2): 414–423. DOI:10.1111/j.1476-5381.2011.01561.x |
| [32] | THOMAS C, GIOIELLO A, NORIEGA L, et al. TGR5-mediated bile acid sensing controls glucose homeostasis[J]. Cell Metab, 2009, 10(3): 167–177. DOI:10.1016/j.cmet.2009.08.001 |
| [33] | WU X, LV Y G, DU Y F, et al. Neuroprotective effects of INT-777 against Aβ1-42-induced cognitive impairment, neuroinflammation, apoptosis, and synaptic dysfunction in mice[J]. Brain Behav Immun, 2018, 73: 533–545. DOI:10.1016/j.bbi.2018.06.018 |
| [34] | SASAKI T, KUBOYAMA A, MITA M, et al. The exercise-inducible bile acid receptor Tgr5 improves skeletal muscle function in mice[J]. J Biol Chem, 2018, 293(26): 10322–10332. DOI:10.1074/jbc.RA118.002733 |
| [35] | EBLIMIT Z, THEVANANTHER S, KARPEN S J, et al. TGR5 activation induces cytoprotective changes in the heart and improves myocardial adaptability to physiologic, inotropic, and pressure-induced stress in mice[J]. Cardiovasc Ther, 2018, 36(5): e12462. DOI:10.1111/1755-5922.12462 |



