2. 610041 成都,四川大学华西医院卫生部移植工程与移植免疫重点实验室
2. Key Laboratory of Transplantation Engineering and Transplantation Immunity of National Health Commission, West China Hospital of Sichuan University, Chengdu, Sichuan Province, 610041, China
染色体组蛋白修饰作为表观遗传修饰之一,通过调节染色体空间构象,招募转录因子,调控基因表达[1]。其中,组蛋白乙酰化中和染色质电荷,开放DNA序列,促进转录因子与DNA相应序列结合,促进基因表达[2]。组蛋白去乙酰化酶3(Hdac3)基因,可以编码一种组蛋白去乙酰化酶,抑制核小体组蛋白乙酰化,压缩基因组DNA构象,抑制基因表达[3]。在造血系统发育过程中,组蛋白乙酰化、去乙酰化动态改变,调控关键基因表达,维持造血干细胞的分化和自我更新过程[4-6]。组蛋白修饰酶如SIRT去乙酰化酶的缺失促进HSCs衰老[7],抑制组蛋白去乙酰化酶可促进造血干细胞的自我更新[8],表明组蛋白去乙酰化酶参与造血发育过程。
研究表明Hdac3与多种血液系统肿瘤相关,但其在造血发育中的作用尚不明确[9-12]。为探讨Hdac3在血液系统发育中的功能,本研究拟通过Floxp-Cre条件性基因敲除鼠系统,构建Mx1启动子介导造血干细胞特异性Hdac3基因敲除鼠,研究Hdac3对血液系统分化的影响。
1 材料与方法 1.1 材料携带Hdac3条件性等位基因(Hdac3flox/flox)的小鼠由四川大学华西医院石毓君教授课题组赠予[13],Mx1-Cre的小鼠购于上海南方模式生物科技股份有限公司,品系均为C57BL /6J,饲养于重庆医科大学附属儿童医院动物中心SPF动物房。动物实验获得重庆医科大学附属儿童医院实验动物伦理委员会的批准。
1.2 试剂及仪器组织裂解缓冲液A:100 μL 0.5 mol/L EDTA (pH 8.0),625 μL 10 mol/L NaOH,ddH2O定容至250 mL;组织裂解缓冲液B: 100 mL 40 mmol/L Tribase (pH 3.0)。polyinosinic-polycytidylic acid [poly (I:C)]购自Sigma公司; Lineage Cell Depletion Kit购自德国美天旎生物技术有限公司;MethylcelluLose Stock Solution购自R&D Systems; DNA提取试剂盒、红细胞裂解液购自天根生化科技有限公司;逆转录试剂盒、PCR Master Mix (2×)、TB Green Ⅱ均购自日本TaKaRa公司;细胞因子均购自美国PeproTech公司;流式荧光抗体均购自美国eBioscience公司;其他试剂均为国产分析纯。
Bio-Rad公司凝胶电泳仪、凝胶成像仪,美国BD公司FACSCanto流式细胞仪,美国Costar 6孔细胞培养板,倒置显微镜(Olympus),荧光显微镜(Leica)均由重庆医科大学附属儿童医院研究所和临床分子医学中心提供。
1.3 小鼠Hdac3条件性敲除Hdac3fl/fl小鼠与Mx1-Cre小鼠杂交得到Hdac3fl/fl Mx1-Cre小鼠;3~4周龄时通过腹腔注射250 μg poly(I:C)以诱导Mx1-Cre的表达。PCR检测鉴定小鼠基因型。TqPCR[14]检测小鼠造血干细胞Hdac3敲低效率。
1.4 小鼠基因型鉴定小鼠3~4周龄时剪取耳朵组织,加75 μL组织裂解缓冲液A,100 ℃金属浴40 min,每20 min混匀、瞬时离心1次。待组织完全溶解后,加225 μL组织裂解缓冲液B,混匀后13 000 r/min离心3 min,取上清鉴定小鼠基因型。基因型鉴定的PCR反应体系25 μL,体系(总量25 μL):Master Mix 12.5 μL,ddH2O 7.5 μL,Primer F(10 μmol/L) 1 μL,Primer R1(10 μmol/L) 1 μL,Primer R2(10 μmol/L) 1 μL,模板DNA 2 μL。扩增条件:94 ℃ 10 min;94 ℃ 30 s,68 ℃ 30 s(每个循环降1 ℃,降到59 ℃),72 ℃ 40 s (10个循环);94 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s(35个循环);72 ℃ 10 min,4 ℃保存。引物序列见表 1。
| 基因 | 引物(5′→3′) | 产物大小/bp |
| Hdac3(Genotype) | 正向GCTTGGTAGCCAGCCAGCTTAG 反向CATGTGACCCCAGACATGACGG |
330 |
| 反向CAGTCCATGCCTATAATCCCAGC | 280 | |
| Hdac3(TqPCR) | 正向GACATGTGCCGCTTCCATTC 反向CTGGCTGGAAAAGGTGCTTG |
174 |
| Mx1-Cre | 正向AGCGATGGATTTCCGTCTCTGG 反向AGCTTGCATGATCTCCGGTATTGAA |
272 |
| GAPDH | 正向CAGCGACACCCACTCCTCCACCTT 反向CATGAGGTCCACCACCCTGTTGCT |
210 |
1.5 造血干细胞提取及Hdac3敲低鉴定
摘取小鼠股骨,剪开两端髓腔3 000 r/min,2 min离心得到骨髓细胞悬液。裂解细胞悬液中的红细胞,磁珠分选法分出Lin-的骨髓细胞,流式细胞术分选Sca-1- APC+/anti-CD117-PE/Cy7+细胞,即LSK细胞(lin-Sca-1+c-kit+)。TRIzol法提取LSK细胞总RNA,逆转录为cDNA,TqPCR检测细胞mRNA表达。引物序列见表 1。
1.6 流式细胞术及抗体取小鼠胸腺,剪碎并研磨制成细胞悬液,裂解红细胞,2 000 r/min离心3 min。收集小鼠外周血裂解红细胞,取1×106个胸腺细胞及外周血细胞标记荧光抗体检测细胞表面特定标记(anti-CD3-FITC,anti-CD4-PE/Cy7,anti-CD8-eFluor450,anti-CD44-PE,anti-CD25-APC,anti-CD11b-PE和anti-B220-APC),4 ℃避光孵育30 min后流式细胞仪检测。
1.7 甲基纤维素克隆形成实验将2 500个LSK细胞加入含有甲基纤维素、FBS及细胞因子(SCF、EPO、IL-6、IL-3)的混合物中,混匀后37 ℃,5% CO2孵育10~12 d,显微镜下观察细胞克隆形态及数目。实验重复3次,计算均值及标准差。
1.8 苏木精-伊红制片取小鼠胸腺、脾脏组织于4%多聚甲醛固定48 h,进行脱水、透明、浸蜡、包埋,制作成4 μm石蜡切片并进行苏木精-伊红(HE)染色。中性树脂封片,显微镜观察组织形态学结构变化。
1.9 统计学分析采用SPSS 13.0统计软件,数据以x±s表示,两组间比较采用配对t检验,检验水准:α=0.05。
2 结果 2.1 建立造血干细胞Hdac3条件性敲除小鼠模型Hdac3fl/fl、Hdac3+/+小鼠与Mx1-Cre的小鼠杂交得到Hdac3fl/fl Mx1-Cre及Hdac3+/+ Mx1-Cre小鼠(图 1A,C)。在0、2、4、18 d分别腹腔注射250 μg poly(I:C),得到Hdac3+/+ Mx1-Cre+(WT)野生型对照组小鼠及Hdac3fl/fl Mx1-Cre+(CKO)小鼠(图 1B)。处死小鼠后,通过TqPCR分析WT对照组及CKO小鼠骨髓LSK细胞Hdac3表达。与对照组相比,CKO小鼠Hdac3的mRNA表达水平显著降低[(1.000±0.203) vs (0.048± 0.025),P < 0.01]。结果显示,成功建立了造血干细胞CKO小鼠模型。
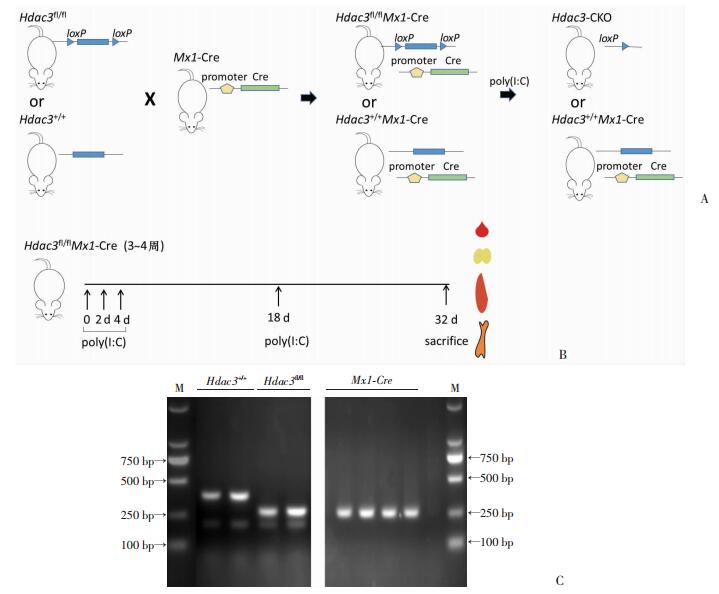
|
| A:Hdac3条件性敲除小鼠模型构建示意图;B:poly(I:C)诱导Cre表达示意图;C:小鼠基因型鉴定PCR结果左侧图示PCR扩增小鼠Hdac3基因,Hdac3fl/fl小鼠产物大小约330 bp、Hdac3+/+小鼠产物大小约280 bp,小于250 bp产物为内参;右侧图示PCR扩增小鼠Mx1-Cre基因,产物大小约272 bp;M:标准 图 1 成功建立造血干细胞Hdac3-CKO小鼠模型 |
2.2 Hdac3fl/fl Mx1-Cre+小鼠淋巴细胞数量及比例异常
取WT及CKO小鼠外周血进行血常规分析,结果显示,两组间血小板、红细胞、血红蛋白数量差异无统计学意义(P>0.05),但CKO小鼠外周血白细胞明显低于对照组(P < 0.01),其中以淋巴细胞数减少为主(P < 0.001),而中性粒细胞及嗜碱性粒细胞的绝对数差异无统计学意义(P>0.05,图 2A、B)。通过流式细胞术细胞分群显示,CKO小鼠外周血淋巴细胞群比例明显低于对照组[(14.764±3.612)% vs (28.800±2.884)%,P < 0.01,图 2C]。
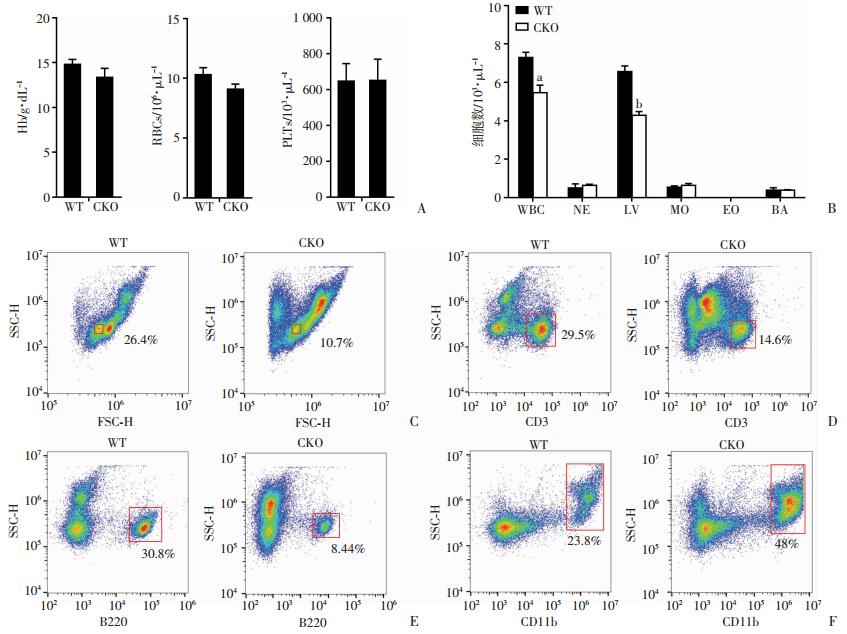
|
| A:CKO及WT小鼠外周血血红蛋白(Hb)、红细胞(RBC)、血小板(PLT)绝对计数;B:CKO及WT小鼠外周血白细胞(WBC)、中性粒细胞(NE)、淋巴细胞(LY)、单核细胞(MO)、嗜酸性粒细胞(EO)及嗜碱性粒细胞(BA)绝对计数 a:P < 0.01,b:P < 0.001,与WT比较;C~F:流式细胞术检测CKO及WT小鼠外周血淋巴细胞、CD3+细胞、B220+细胞及CD11b+细胞比例 图 2 CKO小鼠淋巴细胞数量及比例异常 |
为进一步明确Hdac3敲除对小鼠造血发育影响,利用流式细胞术和CD3、B220及CD11b标记,检测小鼠外周血中T细胞、B细胞及粒细胞各群比例,结果显示,与WT组比较,CKO小鼠中T/B淋巴细胞比例显著降低[(28.500±2.179)% vs (16.700±1.836)%,P < 0.01;(29.933±2.610)% vs (10.047±1.631)%,P < 0.001],粒细胞比例显著升高[(25.567±2.108)% vs (43.533±4.500)%,P < 0.01,图 2D~F]。结果显示,CKO小鼠中淋巴细胞发育受阻,但对粒/单核细胞群发育无影响。
2.3 Hdac3fl/fl Mx1-Cre+小鼠胸腺及脾淋巴细胞生成障碍为进一步检测Hdac3敲除对小鼠造血系统影响,取小鼠造血器官做组织学形态观察。大体形态学观察显示CKO小鼠胸腺和脾体积明显变小(图 3)。HE染色结果显示,CKO小鼠胸腺内淋巴细胞数目显著少于WT鼠(图 4A),CKO小鼠脾内淋巴细胞生发中心数显著少于WT鼠(图 4B)。为探究外周血淋巴细胞减少原因,检测了胸腺细胞发育至T细胞各期细胞比例,明确T细胞减少是否由T细胞胸腺内发育阻滞引起。根据胸腺细胞表面CD4、CD8表达,胸腺细胞分为DN(CD4-CD8-)、CD4单阳(SP: CD4+CD8-)、CD8单阳(SP: CD4-CD8+)及DP(CD4+CD8+)期,流式细胞分析结果显示两组间胸腺细胞DN、SP、DP期胸腺细胞比例差异无统计学意义(图 4C)。进一步根据CD4-CD8-胸腺细胞表面CD44、CD25的表达,将DN期分为DN1(CD44+CD25-)、DN2(CD44+CD25+)、DN3(CD44-CD25+)和DN4(CD44-CD25-)期,流式细胞分析显示两组间DN1~4期胸腺细胞比例差异无统计学意义(P>0.05,图 4D)。结果显示CKO鼠的胸腺及脾脏发生淋巴细胞生成障碍,其可能是由造血干细胞分化至淋巴祖细胞障碍引起。
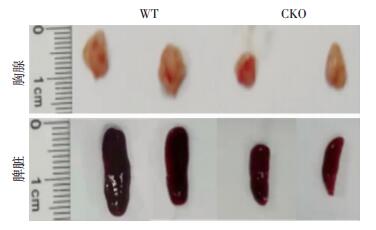
|
| 图 3 WT及CKO小鼠胸腺、脾脏大体形态 |
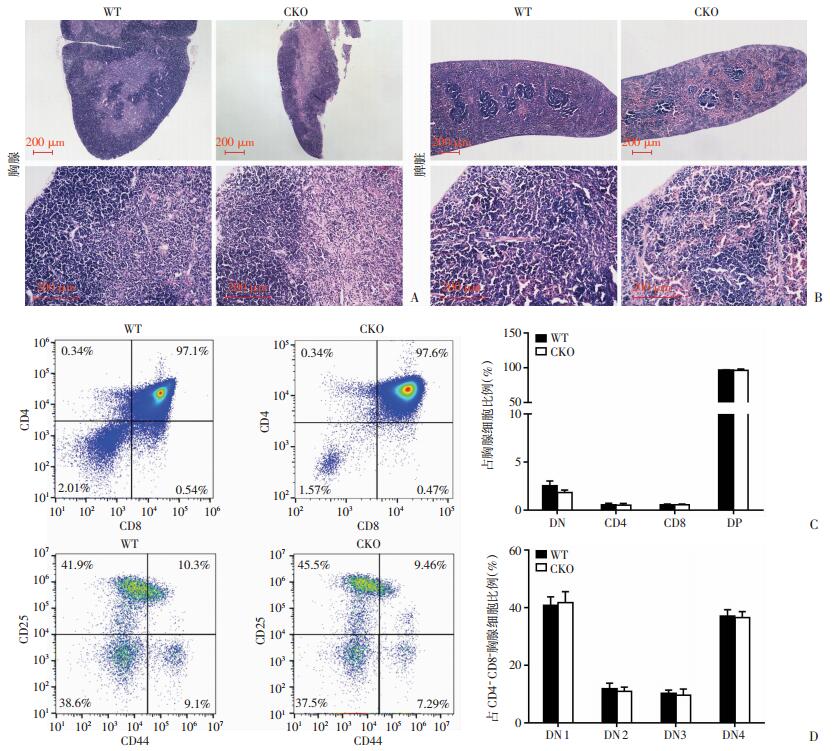
|
| A、B:HE染色后光镜下观察WT及CKO小鼠胸腺、脾脏组织形态学变化;C:流式细胞术检测WT及CKO小鼠胸腺细胞CD4及CD8表达情况;右侧柱状图表示DN、CD4单阳、CD8单阳及DP胸腺细胞比例;D:流式细胞术检测WT及CKO小鼠CD4-CD8-胸腺细胞CD44及CD25表达情况;右侧柱状图表示DN1、DN2、DN3及DN4各期胸腺细胞的比例 图 4 Hdac3fl/fl Mx1-Cre+小鼠胸腺及脾脏淋巴细胞生成障碍 |
2.4 Hdac3fl/fl Mx1-Cre+小鼠淋巴祖细胞诱导分化障碍
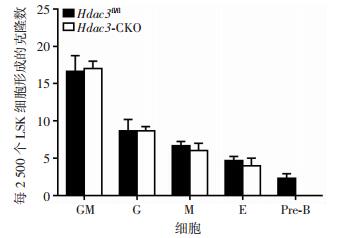
为明确Hdac3对小鼠造血干细胞向淋巴祖细胞分化影响,提取CKO及WT组小鼠LSK细胞,利用甲基纤维素克隆形成实验,观测两组LSK细胞在细胞因子(SCF、EPO、IL-6、IL-3)诱导下各系分化情况。结果显示,CKO和WT组LSK细胞可形成包括粒系、巨核系、红系在内的各系粒细胞,且各系克隆数差异无统计学意义,提示Hdac3敲除对小鼠HSC向粒系分化无明显影响。在WT组中,成功诱导LSK细胞向前B细胞分化,而CKO组中前B细胞样克隆缺失(图 5、6)。结果显示,小鼠造血干细胞中Hdac3在淋巴祖细胞分化中起重要作用。

|
| ↑:分别示粒细胞-巨噬细胞(GM)克隆、粒细胞(G)克隆、巨噬细胞(M)克隆、红细胞(E)克隆及前B细胞(Pre-B)克隆的形态 图 5 克隆形成实验观察两组LSK细胞体外培养10~12 d克隆形态 |
|
| 图 6 两组小鼠LSK细胞各系克隆数目分析 |
3 讨论
血液系统发育是连续阶段性的过程。根据各期细胞分化潜能,血液系统发育经历了造血干细胞期,多能祖细胞期两个具有干性,保持多向分化潜能时期。在这期间,细胞不表达各系特征性表面抗原,是造血系统发育幼稚期。之后,造血祖细胞在趋化因子介导下,迁移到相应组织,在细胞因子诱导下,分化为粒单核细胞祖细胞和淋巴细胞祖细胞,继而获得特定细胞分化潜力。粒单核祖细胞自骨髓不同结构部位,接受相应因子刺激,分别分化成熟为巨核细胞,红细胞,中性粒/单核细胞。而部分CCR7+淋巴细胞祖细胞在趋化因子作用下,迁移到胸腺组织,发育成熟为T细胞。另一部分则在骨髓中,发育成熟为B细胞。此过程连续,且不可逆转[15-16]。
组蛋白修饰作为表观遗传修饰的一种,通过有序变化调控基因转录,参与各组织系统发育。参与组蛋白修饰调控分子异常,可导致基因表达异常,在肿瘤分子机制中发挥重要作用。表观遗传学是造血系统疾病治疗的一个策略,组蛋白甲基转移酶和组蛋白乙酰转移酶直接参与造血系统疾病的发生。EZH2、EP300等组蛋白修饰相关基因的突变参与构成急性T淋巴细胞白血病的遗传学基础[17]。MLL重排参与调节H3K4、H3K79甲基化水平,促进造血祖细胞向白血病干细胞转化[18-19]。在血细胞发育过程,组蛋白去甲基化酶Lsd1是造血分化不可或缺的表观调控因子[20]。HDAC3属于I类组蛋白去乙酰化酶,在调控基因表达、染色质结构和基因组稳定性方面发挥重要作用。HDAC3的活性是急性早幼粒细胞白血病的发生所需[12],靶向HDAC3协助逆转急性髓细胞白血病化疗的耐药过程[11]。本研究发现,在小鼠造血干细胞中特异性敲除HDAC3,小鼠淋巴细胞绝对数及相对数显著减少,粒系细胞及红细胞绝对数无明显降低。流式细胞术检测及胸腺、脾脏切片HE染色结果均提示T细胞及B细胞发育缺失,考虑若为T细胞及B细胞发育后期出现阻滞,则胸腺及脾脏会累积大量幼稚期T/B细胞。而CKO小鼠表现为组织萎缩。结合细胞因子诱导HSCs克隆形成实验结果,我们判定外周血中淋巴细胞缺失非T/B细胞发育晚期阻滞引起,而是多能祖细胞分化为淋巴细胞祖细胞障碍引起。
染色质重塑能力是干细胞的重要特征,可以确保其多向分化及自我更新,进而生成成熟的造血系。HDAC3作为组蛋白去乙酰化酶,可通过促进染色体结构发生改变,抑制基因表达。多种调控淋巴细胞分化基因的表达受HDAC3调控[21-22]。本实验结果显示HDAC3表达促进淋巴细胞祖细胞分化,而相应机制仍不清楚。后期研究重点需聚焦HDAC3调控淋巴细胞发育机制,找到受HDAC3调控关键基因,为定向诱导HSCs向淋巴细胞分化探索方向。
| [1] | VENKATESH S, WORKMAN J L. Histone exchange, chromatin structure and the regulation of transcription[J]. Nat Rev Mol Cell Biol, 2015, 16(3): 178–189. DOI:10.1038/nrm3941 |
| [2] | SABARI B R, ZHANG D, ALLIS C D, et al. Metabolic regulation of gene expression through histone acylations[J]. Nat Rev Mol Cell Biol, 2017, 18(2): 90–101. DOI:10.1038/nrm.2016.140 |
| [3] | LAWRENCE M, DAUJAT S, SCHNEIDER R. Lateral thinking: how histone modifications regulate gene expression[J]. Trends Genet, 2016, 32(1): 42–56. DOI:10.1016/j.tig.2015.10.007 |
| [4] | BHASKARA S, KNUTSON S K, JIANG G C, et al. Hdac3 is essential for the maintenance of chromatin structure and genome stability[J]. Cancer Cell, 2010, 18(5): 436–447. DOI:10.1016/j.ccr.2010.10.022 |
| [5] | DHOKE N R, KALABATHULA E, KAUSHIK K, et al. Histone deacetylases differentially regulate the proliferative phenotype of mouse bone marrow stromal and hematopoietic stem/progenitor cells[J]. Stem Cell Res, 2016, 17(1): 170–180. DOI:10.1016/j.scr.2016.07.001 |
| [6] | BARTELS M, GEEST C R, BIERINGS M, et al. Histone deacetylase inhibition modulates cell fate decisions during myeloid differentiation[J]. Haematologica, 2010, 95(7): 1052–1060. DOI:10.3324/haematol.2009.008870 |
| [7] | SHARMA S, GURUDUTTA G. Epigenetic regulation of hematopoietic stem cells[J]. Int J Stem Cells, 2016, 9(1): 36–43. DOI:10.15283/ijsc.2016.9.1.36 |
| [8] | GEIGER H, DE HAAN G, FLORIAN M C. The ageing haematopoietic stem cell compartment[J]. Nat Rev Immunol, 2013, 13(5): 376–389. DOI:10.1038/nri3433 |
| [9] | HARADA T, OHGUCHI H, GRONDIN Y, et al. HDAC3 regulates DNMT1 expression in multiple myeloma: therapeutic implications[J]. Leukemia, 2017, 31(12): 2670–2677. DOI:10.1038/leu.2017.144 |
| [10] | SU R, GONG J N, CHEN M T, et al. C-Myc suppresses miR-451-1YWTAZ/AKT axis via recruiting HDAC3 in acute myeloid leukemia[J]. Oncotarget, 2016, 7(47): 77430–77443. DOI:10.18632/oncotarget.12679 |
| [11] | LONG J, FANG W Y, CHANG L, et al. Targeting HDAC3, a new partner protein of AKT in the reversal of chemoresistance in acute myeloid leukemia via DNA damage response[J]. Leukemia, 2017, 31(12): 2761–2770. DOI:10.1038/leu.2017.130 |
| [12] | MEHDIPOUR P, SANTORO F, BOTRUGNO O A, et al. HDAC3 activity is required for initiation of leukemogenesis in acute promyelocyticleukemia[J]. Leukemia, 2017, 31(4): 995–997. DOI:10.1038/leu.2017.3 |
| [13] |
张蕾, 卢徐锋, 纪洪杰, 等. HDAC3缺失抑制小鼠肝再生并引起肝细胞凋亡[J].
世界华人消化杂志, 2015(35): 5597–5605.
ZHANG L, LU X F, JI H J, et al. Ablation of histone deacetylase 3 in hepatocytes inhibits liver regeneration and induces apoptosis in mice[J]. World Chin J Digestol, 2015(35): 5597–5605. DOI:10.11569/wcjd.v23.i35.5597 |
| [14] | ZHANG Q, WANG J, DENG F, et al. TqPCR: A touchdown qPCR assay with significantly improved detection sensitivity and amplification efficiency of SYBR green qPCR[J]. PLoS ONE, 2015, 10(7): e0132666. DOI:10.1371/journal.pone.0132666 |
| [15] | ORKIN S H, ZON L I. Hematopoiesis: an evolving paradigm for stem cell biology[J]. Cell, 2008, 132(4): 631–644. DOI:10.1016/j.cell.2008.01.025 |
| [16] | EAVES C J. Hematopoietic stem cells: concepts, definitions, and the new reality[J]. Blood, 2015, 125(17): 2605–2613. DOI:10.1182/blood-2014-12-570200 |
| [17] | ZHANG J H, DING L, HOLMFELDT L, et al. The genetic basis of early T-cell precursor acute lymphoblastic leukaemia[J]. Nature, 2012, 481(7380): 157–163. DOI:10.1038/nature10725 |
| [18] | BERNT K M, ZHU N, SINHA A U, et al. MLL-rearranged leukemia is dependent on aberrant H3K79 methylation by DOT1L[J]. Cancer Cell, 2011, 20(1): 66–78. DOI:10.1016/j.ccr.2011.06.010 |
| [19] | KRIVTSOV A V, ARMSTRONG S A. MLL translocations, histone modifications and leukaemia stem-cell development[J]. Nat Rev Cancer, 2007, 7(11): 823–833. DOI:10.1038/nrc2253 |
| [20] | KERENYI M A, SHAO Z, HSU Y J, et al. Histone demethylase Lsd1 represses hematopoietic stem and progenitor cell signatures during blood cell maturation[J]. Elife, 2013, 2: e00633. DOI:10.7554/eLife.00633 |
| [21] | SWEET M J, SHAKESPEAR M R, KAMAL N A, et al. HDAC inhibitors: modulating leukocyte differentiation, survival, proliferation and inflammation[J]. Immunol Cell Biol, 2012, 90(1): 14–22. DOI:10.1038/icb.2011.88 |
| [22] | ZHANG F, SHI Y, WANG L, et al. Role of HDAC3 on p53 expression and apoptosis in T cells of patients with multiplesclerosis[J]. PLoS ONE, 2011, 6(2): e16795. DOI:10.1371/journal.pone.0016795 |



