2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系毒理学研究所
2. Institute of Toxicology, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
鱼藤酮为线粒体复合体Ⅰ的抑制剂,大量的流行病学和实验室研究证实,鱼藤酮暴露与帕金森病(Parkinson’s disease,PD)的发病相关[1]。我们前期研究显示鱼藤酮染毒PC12细胞线粒体复合体Ⅰ的活性下降,线粒体ATP合成减少,ROS的生成增加[2]。文献[3]报道ROS的产生可通过氧化修饰和核酸酶酶切介导的DNA片段化引起DNA损伤,与细胞核DNA相比,线粒体DNA(mitochondrial DNA, mtDNA)编码参与氧化磷酸化和产生ATP的多肽,其结构位置特殊,且mtDNA相对核DNA更容易受到损伤且缺乏有效的修复系统,因此任何损伤突变都可能对线粒体功能产生影响[4]。有研究表明,在PD患者大脑中发现了较高水平的线粒体DNA缺失[5],提示mtDNA损伤在PD中发挥了作用。PARP-1是聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)家族中主要发挥功能的基因[6],主要参与核DNA的损伤修复并保持DNA完整性。近年来有学者发现PARP-1可能部分存在于线粒体上,并能够调节线粒体功能[7]。此外,MARTIRE等[8]报道PARP-1可参与到神经退行性疾病中,发挥重要作用。提示PARP-1很可能在鱼藤酮诱导的PC12细胞损伤中发挥作用,而这种作用除了以往认为与细胞核DNA的损伤修复相关之外,是否与细胞线粒体DNA的损伤相关则并不清楚。本研究通过建立鱼藤酮多巴胺神经元PC12体外染毒模型,探讨鱼藤酮对多巴胺神经元PC12细胞线粒体DNA的影响以及PARP-1在鱼藤酮诱导PC12细胞线粒体损伤中的作用。
1 材料与方法 1.1 细胞与主要试剂大鼠肾上腺髓质嗜铬细胞瘤来源的PC12细胞株(高分化)购自中国科学院生物化学与细胞生物学研究所上海细胞库。鱼藤酮(rotenone)、四甲基罗丹明乙酯(TMRM)购自Sigma公司,PJ34购自Selleck公司。1640培养基、胰蛋白酶、双抗购自美国HyClone公司,胎牛血清购自以色列BI公司。CCK-8试剂盒购自日本Dojindo公司,活性氧检测试剂盒购自碧云天生物科技有限公司,ATP含量检测试剂盒购自南京建成生物技术有限公司,SYBR Premix Ex TaqTM试剂盒购自美国Promega公司,PARP-1、Tomm20购自英国Abcam公司,β-actin购自北京博奥森公司,HRP标记的羊抗兔IgG、HRP标记的羊抗小鼠IgG购自碧云天生物科技有限公司,所有引物、探针由上海生物工程有限公司合成。
1.2 细胞培养与分组PC12细胞用含10%胎牛血清和1%双抗的1640培养基,在CO2浓度为5%,温度为37 ℃,100%饱和温度的培养箱中培养。2 d换液1次,至70%~80%融合度时进行传代消化。细胞于生长对数期时消化和接种,24 h后,更换含有鱼藤酮的培养基处理24 h,鱼藤酮终浓度分别为0、0.1、0.5、1.0、1.5 μmol/L。先用10、20 μmol/L PJ34处理细胞选择抑制效果明显的剂量对细胞进行预处理24 h,再用1.0 μmol/L鱼藤酮处理24 h以观察PJ34的作用。
1.3 方法 1.3.1 线粒体分离纯化鱼藤酮处理细胞后,取约5×106个细胞,清洗后于预冷的裂解液中裂解,裂解结束后收集并置于分离液中用钝头针进行反复吹打,在1 000×g,4 ℃下离心收集上清,进一步于6 000×g, 4 ℃下离心,取沉淀于线粒体纯化试剂中进行纯化,纯化3遍可见管底有明显沉淀,该沉淀即为线粒体,可用于线粒体蛋白提取。
1.3.2 Western blot检测蛋白的表达提取细胞总蛋白,每孔30 μg蛋白上样,经10% SDS-PAGE,90 V电泳。安装砖模装置,湿转(220 mA,2 h)转移蛋白至PVDF膜上,5%脱脂奶粉摇床封闭2 h后,加入一抗PARP-1(稀释比1 :1 000),Tomm20(稀释比1 :2 000),β-actin(稀释比1 :3 000), 4 ℃孵育过夜,结束后TBST洗膜3次,室温下加入相应的辣根过氧化酶标记的山羊抗兔二抗,辣根过氧化酶标记的山羊抗小鼠二抗,孵育2 h。用增强型ECL显色液避光进行显色,凝胶成像系统进行显影拍照,ImageJ 2×进行灰度分析。
1.3.3 细胞增殖活力检测取生长对数期细胞,以1×104个/孔接种在96孔板中,在37 ℃,5% CO2的培养箱中培养24 h。分别加入不同浓度(0、0.1、0.5、1.0、1.5 μmol/L)的鱼藤酮处理24 h,处理结束后,各孔细胞分别加入CCK-8(每孔100 μL加入10 μL CCK-8)。37 ℃孵育2 h后,采用酶联免疫检测仪测定每孔波长450 nm处的光密度值[D(450)],计算实验组的存活率,实验重复3次。
存活率=[实验组D(450)-空白对照组D(450)]/ [正常对照组D(450)-空白对照组D(450)]×100%
1.3.4 线粒体常见片段缺失检测为了更灵敏检测线粒体DNA片段,针对mtDNA最常见缺失片段(mtDNA 4 834 bp)设计引物,采用TaqMan探针法PCR检测mtDNA 4 834 bp缺失突变占总mtDNA的比率。mtDNA D-loop上游引物:5′-GGTTCTTACTTCAGGGCCATCA-3′, 下游引物:5′-GATTAGACCCGTTACCATCG-AGAT-3′,探针:FAM-TTGGTTCATCGTCCATACGTTCCCCTTATAMRA;mtDNA deletion上游引物:5′-AAGGACGAACCTGAGCCCTAATA-3′,下游引物为:5′-CGAA- GTAGATGATCCGTATGCTGTA-3′,探针:FAM-TCACT-TTAATCGCCACATCCATAACTGCTGTTAMRA。反应体系:2×mix 10 μL, 引物各1 μL,探针0.5 μL,DNA(80 ng),ddH2O补足20 μL。反应条件:94 ℃预变性20 s,95 ℃变性50 s,60 ℃退火延伸30 s, 共40个循环。采用2-△Ct法计算mtDNA 4 834 bp大片段缺失占总mtDNA的比率,△Ct=Ctdeletion-CtD-loop。
1.3.5 Real-time PCR检测线粒体DNA拷贝数处理结束后,胰酶消化,收集细胞,提取基因组DNA。测定DNA浓度并检测质量,A260/A280在1.8~2.0之间,可用于后续实验。线粒体编码基因mtco1的正向引物序列为:5′-ACCCCCGCTATAACCCAATATCAG AC-3′,反向引物序列为5′-TGGGT-GTCCGAAGAATCAAAATAG-3′,核编码基因Ndufv1的正向引物序列为5′-CGCCATGACTGGAGGTGAGGXAG-3′,反向引物序列为5′-GGCCCCGTAAACCCGATGTCTTC-3′。反应体系:2×qPCR mix 10 μL,引物各0. 5 μL,gDNA 2 μL(10 ng),ddH2O 7 μL,共20 μL。扩增程序:94 ℃预变性20 s; 95 ℃变性10 s,55 ℃退火20 s,72 ℃延伸80 s, 共40个循环。采用2-△△Ct法进行结果计算。
1.3.6 线粒体膜电位检测将细胞接种于6孔板内,不同浓度鱼藤酮处理结束后,去除培养基,加入终浓度为20 nmol/L的TMRM工作液(储存液用DMSO配制),于37 ℃孵育30 min,去除TMRM工作液后,用PBS清洗3遍,加入新鲜培养基。随后用荧光显微镜观察并拍照,ImageJ 2×进行分析。
1.3.7 细胞内ROS含量检测PC12细胞处理结束后,去除培养基,用新鲜无血清培养基配制DCFH-DA探针工作液(1 :2 000),37 ℃避光孵育30 min后,PBS清洗3遍,最后胰酶消化收集细胞,用多功能酶标仪在488 nm激发波长,525发射波长下检测荧光强度。
1.4 统计学分析以上每个实验至少重复3次,取平均值。采用Graphpad Prism 6.0制图,数据以x±s表示,采用SPSS 16.0统计软件进行单因素方差分析。检验水准:α=0.05。
2 结果 2.1 鱼藤酮对PC12细胞线粒体DNA损伤的影响TaqMan探针法PCR和qPCR法检测结果显示,与对照组比较,不同剂量鱼藤酮处理后,PC12细胞线粒体DNA可出现具有统计学意义的DNA常见缺失(mtDNA 4 834 bp),随着鱼藤酮浓度的增加,mtDNA缺失突变率也增加(P < 0.05, 图 1A)。与此同时,鱼藤酮染毒PC12细胞,线粒体DNA拷贝数也出现明显下降,与对照组比较,差异具有统计学意义(P < 0.05,图 1B)。因此,鱼藤酮可以诱导线粒体DNA损伤,表现在常见缺失片段的缺失增加和线粒体DNA拷贝数的下降。
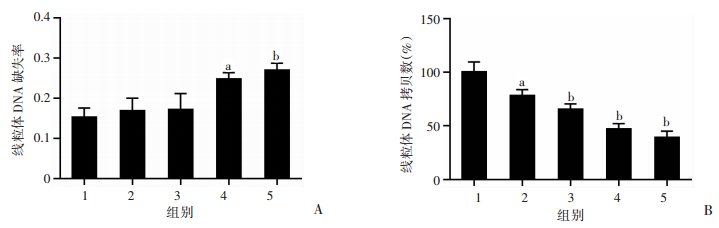
|
| 1:对照组;2:鱼藤酮0.1 μmol/L组;3:鱼藤酮0.5 μmol/L组;4:鱼藤酮1.0 μmol/L组;5:鱼藤酮1.5 μmol/L组A:鱼藤酮处理后线粒体DNA缺失率变化;B:鱼藤酮处理后线粒体DNA拷贝数变化a:P < 0.05,b:P < 0.01,与对照组比较 图 1 鱼藤酮对PC12细胞线粒体DNA的损伤影响 |
2.2 鱼藤酮对PC12细胞及线粒体PARP-1蛋白表达的影响
Western blot检测结果显示,鱼藤酮处理PC12细胞后,细胞内PARP-1蛋白的表达随着鱼藤酮染毒剂量的增加而升高,差异具有统计学意义(P < 0.05,图 2A、C)。进一步分离细胞线粒体,检测发现随着鱼藤酮浓度的增加,线粒体内PARP-1表达逐渐增高,当染毒剂量达到1.5 μmol/L时,PARP-1蛋白的表达较对照组显著升高(P < 0.05,图 2B、D)。
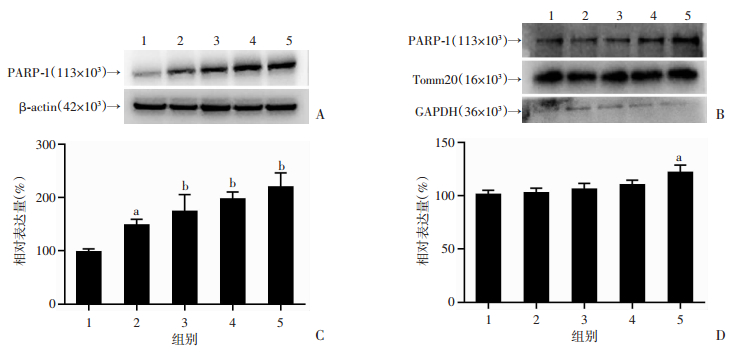
|
|
1:对照组;2:鱼藤酮0.1 μmol/L组;3:鱼藤酮0.5 μmol/L组;4:鱼藤酮1.0 μmol/L组;5:鱼藤酮1.5 μmol/L组 A、C:Western blot检测全细胞中PARP-1蛋白表达及半定量分析;B、D:Western blot检测线粒体内PARP-1蛋白表达及半定量分析a:P < 0.05, b:P < 0.01,与对照组比较 图 2 鱼藤酮对多巴胺神经元PC12细胞及线粒体PARP-1蛋白表达的影响 |
2.3 PAPR蛋白选择性抑制剂PJ34对鱼藤酮诱导的PC12细胞形态学和增殖活力的影响
Western blot检测结果显示,当PJ34剂量为20 μmol/L时可以明显抑制PARP-1蛋白的表达水平(图 3)。CCK-8实验结果显示(图 4A),鱼藤酮单独染毒PC12细胞后,细胞活力较对照组明显下降,而PJ34预处理组细胞活力较鱼藤酮染毒组显著增加(P < 0.05, 图 4B)。细胞形态学观察显示, 正常对照组PC12呈长梭形,且两边有触角,轮廓清晰, 而鱼藤酮染毒组PC12细胞皱缩,触角消失,轮廓不清,相比之下,PJ34预处理组PC12细胞皱缩情况和触角形态能得到很好的改善。提示PARP抑制剂PJ34可显著改善鱼藤酮对PC12细胞形态学和细胞活力的影响。

|
| 1:对照组;2:PJ34 10 μmol/L组;3:PJ34 20 μmol/L组 图 3 Western blot检测PJ34处理后PARP-1蛋白的表达 |
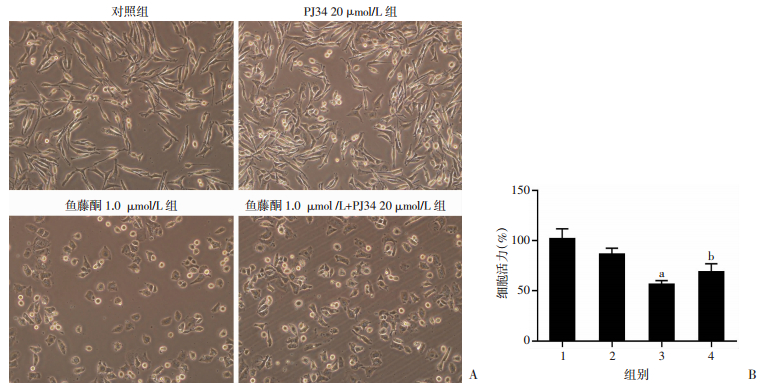
|
| A:光镜下各组细胞形态学的变化(×200);B:CCK-8法检测PJ34对细胞活力的影响1:对照组;2: PJ34 20 μmol/L组;3:鱼藤酮1.0 μmol/L组;4:鱼藤酮1.0 μmol/L+PJ34 20 μmol/L组;a:P < 0.01, 与对照组比较;b:P < 0.05,与鱼藤酮1.0 μmol/L组比较 图 4 PARP抑制剂PJ34预处理对鱼藤酮染毒PC12细胞活性和形态的影响 |
2.4 PARP蛋白抑制剂PJ34对鱼藤酮诱导的线粒体DNA损伤的影响
鱼藤酮处理后线粒体缺失增加,使线粒体DNA完整性下降,同时线粒体DNA拷贝数也下降。而PJ34预处理后可显著改善PC12细胞线粒体DNA缺失(图 5A),增加线粒体DNA拷贝数(图 5B),与鱼藤酮单独处理组比较差异具有统计学意义(P < 0.05)。提示PJ34可以有效减轻鱼藤酮引起的线粒体DNA损伤,对线粒体DNA损伤具有保护作用。
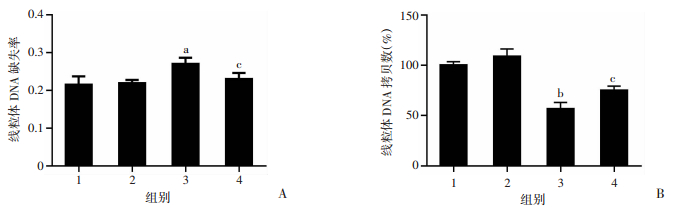
|
|
1:对照组;2: PJ34 20 μmol/L处理组;3:鱼藤酮1.0 μmol/L处理组;4:鱼藤酮1.0 μmol/L+PJ34 20 μmol/L组 A: TaqMan探针法PCR检测mtDNA常见片段缺失;B:qPCR检测线粒体DNA拷贝数改变a:P < 0.05,b: P < 0.01,与对照组比较;c:P < 0.05,与鱼藤酮1.0 μmol/L组比较 图 5 PARP抑制剂PJ34对鱼藤酮染毒PC12细胞线粒体DNA损伤的影响 |
2.5 PARP蛋白抑制剂PJ34对鱼藤酮诱导的PC12细胞线粒体功能的影响
TMRM染色结果显示,鱼藤酮处理后PC12细胞线粒体膜电位明显下降,与对照组比较差异有统计学意义(P < 0.05,图 6),PJ34预处理可显著改善鱼藤酮导致的PC12细胞线粒体膜电位的下降。DCFH-DA探针结合多功能酶标仪分析发现,鱼藤酮处理后PC12细胞内活性氧的形成增加,而PJ34预处理可显著降低PC12细胞内的活性氧水平(图 7)。提示PJ34预处理能有效改善鱼藤酮诱导的PC12细胞线粒体功能损伤。

|
|
1:对照组;2:PJ34 20 μmol/L组;3:鱼藤酮1.0 μmol/L组;4:鱼藤酮1.0 μmol/L+PJ34 20 μmol/L组 A:TMRM染色检测PC12细胞线粒体膜电位的改变(×200);B:PJ34预处理对细胞线粒体膜电位的影响a:P < 0.01, 与对照组比较;b:P < 0.05,与鱼藤酮1.0 μmol/L组比较 图 6 PARP蛋白抑制剂PJ34预处理对PC12细胞线粒体膜电位的改变 |

|
| 1:对照组;2:PJ34 20 μmol/L组;3:鱼藤酮1.0 μmol/L组;4:鱼藤酮1.0 μmol/L+PJ34 20 μmol/L组; a:P < 0.05, 与对照组比较;b:P < 0.05,与鱼藤酮1.0 μmol/L组比较 图 7 PARP蛋白抑制剂PJ34预处理对鱼藤酮染毒PC12细胞活性氧的影响 |
3 讨论
流行病学调查显示,我国帕金森病患者数量逐年增长,对社会和医疗机构将带来一定的挑战[9]。因此,研究帕金森病的发病机制及其防治具有重要的意义[10]。
鱼藤酮是一种天然的杀虫剂,能够抑制线粒体呼吸链复合物Ⅰ的活性,实验证明鱼藤酮处理大鼠后会出现帕金森样临床症状。有学者指出[11],环境毒素鱼藤酮能产生与PD流行病学和病理学特征更相似的表现,因此机制上会更接近于人类的PD病程。PARP是一类广泛存在于原核与真核生物中,在维持基因组完整性、细胞衰老、细胞凋亡、炎性反应等生理、病理过程中起着重要作用,PARP-1是PARP家族中主要发挥功能的基因[12]。已有研究表明,PARP-1蛋白主要作用于细胞核内,由活性氧簇、紫外照射和烷化剂等诸多因素引起的DNA断裂,是PARP激活的主要直接因素[13]。当细胞DNA受损伤时,PARP-1可立即对其做出反应,快速地与DNA单双链断裂、交叉、螺旋等多种构象相结合,催化分解成尼克酰胺和ADP,进一步形成多聚ADP核糖复合体(Poly ADP-ribose, PAR)而发挥修复作用[14]。但是PARP-1的过度活化会消耗内源性NAD和ATP,进而导致细胞能量枯竭诱导细胞死亡,由此提示可以通过阻滞PAPR的过度激活调节DNA的修复。然而,近年来有学者提出[14],PARP-1除了在细胞核内表达,可能同时存在于线粒体,但其线粒体定位是否与线粒体DNA修复相关及其对线粒体功能的调控机制并不清楚。本研究发现,鱼藤酮可以导致线粒体DNA缺失增加和线粒体DNA拷贝数下降,进一步的分离PC12细胞总蛋白和线粒体蛋白,检测结果显示PARP-1在细胞和线粒体中的表达均显著增加。由此提示鱼藤酮可通过诱导PC12细胞线粒体DNA损伤,进而激活线粒体内的PARP-1蛋白,PARP-1过度激活又加重线粒体DNA损害,最终导致细胞死亡。以往的研究认为,PARP-1主要是在细胞核DNA中发挥作用,但本研究发现当线粒体DNA损伤时,可激活PARP蛋白,PARP-1可部分转移至线粒体内进一步发挥调控作用,影响线粒体DNA结构和功能,在线粒体DNA损伤中发挥作用。但在目前的研究中,关于PARP-1在线粒体DNA损伤中的作用的报道比较少见。
PJ34是一种新型PARP抑制剂,能明显抑制PARP的活性。通过PJ34预处理鱼藤酮染毒PC12细胞,发现预处理组细胞活力明显提高,且细胞形态得到改善,同时,PJ34预处理可以改善由鱼藤酮处理引起的线粒体DNA常见片段缺失增加和线粒体DNA拷贝数下降。线粒体DNA大片段缺失(mtDNA 4 834 bp)的出现将引起呼吸链完整性破坏[15],此时减少的线粒体DNA拷贝数将不能弥补个别线粒体DNA损伤造成的损害,从而导致线粒体功能失衡。BENDER等[5]研究发现,在帕金森病患者的多巴胺神经元细胞中发现mtDNA缺失的累积,且另有研究表明,与健康人群相反,患有帕金森病的个体中线粒体DNA拷贝数并不会随着年龄的增加而增加[16]。因此,由线粒体DNA的完整性和拷贝数下降引起的线粒体功能缺失在帕金森病的发病机制中可能有重要的意义[17]。基于PARP-1过度激活参与了鱼藤酮引起线粒体DNA的损伤,因此调节PARP-1活性可能对于线粒体DNA损伤修复有重要意义。实验结果显示PJ34预处理鱼藤酮染毒PC12细胞后,线粒体膜电位明显提高且细胞内活性氧水平下降。提示,PJ34通过抑制PARP的活性,缓解线粒体DNA损伤,增强线粒体功能。另有研究证实,在阿尔兹海默症模型中,PARP抑制剂可调节SIRT1的转录而发挥对神经元保护作用[18]。此外,在A549细胞中[19],内源性线粒体PARP-1可影响线粒体DNA完整性及其修复,进而影响线粒体功能。结合本研究结果,提示可通过调控PARP-1的过度激活,缓解线粒体DNA敏感损伤因素,增强线粒体功能,最终提高细胞活力,对鱼藤酮诱导的线粒体DNA损伤修复有重要作用,同时为帕金森病的临床防治提供了新的理论依据。
PJ34相比传统的PARP抑制剂,其抑酶活性和生物利用度都比较高[20],相比之下更具应用前景。尽管目前国内外有PARP抑制剂单药、联合应用于肿瘤[21]以及缺血再灌注,脑外伤[22]等的临床治疗,但在线粒体损伤疾病和神经退行性疾病中的应用少见。线粒体DNA修复机制复杂,但可以明确的是线粒体DNA的修复与核DNA修复之间存在密切联系。结合以往研究,提示PARP-1很可能是核DNA修复与线粒体DNA修复的联系之一,调节PARP-1很可能实现对线粒体功能的调控,而PARP抑制剂PJ34在线粒体DNA的损伤修复以及帕金森病的防治上有一定的应用潜力。但本研究仅为细胞水平研究,由于体内调节机制复杂,关于PARP-1的作用及PJ34的应用还需要进行动物实验验证。
| [1] | XIONG N, HUANG J S, ZHANG Z T, et al. Stereotaxical infusion of rotenone: A reliable rodent model for Parkinson's disease[J]. PLoS ONE, 2009, 4(11): e7878. DOI:10.1371/journal.pone.0007878 |
| [2] | PENG K G, TAO Y, ZHANG J, et al. Resveratrol regulates mitochondrial biogenesis and Fission/Fusion to attenuate rotenone-induced neurotoxicity[J]. Oxid Med Cell Longev, 2016, 2016: 6705621. DOI:10.1155/2016/6705621 |
| [3] | SILVA R, AGUIAR T Q, OLIVEIRA R, et al. Light exposure during growth increases riboflavin production, reactive oxygen species accumulation and DNA damage in Ashbya gossypii riboflavin-overproducing strains[J]. FEMS Yeast Res, 2019, 19(1). DOI:10.1093/femsyr/foy114 |
| [4] | ZAPICO S C, UBELAKER D H. MtDNA mutations and their role in aging, diseases and forensic sciences[J]. Aging Dis, 2013, 4(6): 364–380. DOI:10.14336/AD.2013.0400364 |
| [5] | BENDER A, KRISHNAN K J, MORRIS C M, et al. High levels of mitochondrial DNA deletions in substantia nigra neurons in aging and Parkinson disease[J]. Nat Genet, 2006, 38(5): 515–517. DOI:10.1038/ng1769 |
| [6] | LANGELIER M F, SERVENT K M, ROGERS E E, et al. A third zinc-binding domain of human poly(ADP-ribose) polymerase-1 coordinates DNA-dependent enzyme activation[J]. J Biol Chem, 2008, 283(7): 4105–4114. DOI:10.1074/jbc.m708558200 |
| [7] | ROSSI M N, CARBONE M, MOSTOCOTTO C, et al. Mitochondrial localization of PARP-1 requires interaction with mitofilin and is involved in the maintenance of mitochondrial DNA integrity[J]. J Biol Chem, 2009, 284(46): 31616–31624. DOI:10.1074/jbc.M109.025882 |
| [8] | MARTIRE S, MOSCA L, D'ERME M. PARP-1 involvement in neurodegeneration: A focus on Alzheimer's and Parkinson's diseases[J]. Mech Ageing Dev, 2015, 146-148: 53–64. DOI:10.1016/j.mad.2015.04.001 |
| [9] |
刘疏影, 陈彪. 帕金森病流行现状[J].
中国现代神经疾病杂志, 2016, 16(2): 98–101.
LIU S Y, CHEN B. Epidemiology of Parkinson's disease[J]. Chin J Contemp Neurol Neurosurg, 2016, 16(2): 98–101. DOI:10.3969/j.issn.1672-6731.2016.02.007 |
| [10] | WINKLHOFER K F, HAASS C. Mitochondrial dysfunction in Parkinson's disease[J]. Biochim Biophys Acta, 2010, 1802(1): 29–44. DOI:10.1016/j.bbadis.2009.08.013 |
| [11] | GREENAMYRE J T, BETARBET R, SHERER T B. The rotenone model of Parkinson's disease: genes, environment and mitochondria[J]. Parkinsonism Relat Disord, 2003, 9(Suppl 2): S59–S64. |
| [12] | GAGNE J P, ROULEAU M, POIRIER G G. PARP-1 activation: bringing the pieces together[J]. Science, 2012, 336(6082): 678–679. DOI:10.1126/science.1221870 |
| [13] | ZHEN Y L, YU Y H. Proteomic analysis of the downstream signaling network of PARP1[J]. Biochemistry, 2018, 57(4): 429–440. DOI:10.1021/acs.biochem.7b01022 |
| [14] | HEGEDVS C, VIRÁG L. Inputs and outputs of poly(ADP-ribosyl)ation: Relevance to oxidative stress[J]. Redox Biol, 2014, 2: 978–982. DOI:10.1016/j.redox.2014.08.003 |
| [15] |
赵伟, 王永伟, 韦冠山, 等. PARP-1介导的自噬流受阻在大鼠心肌细胞缺血再灌注损伤中的作用[J].
南方医科大学学报, 2018, 38(8): 975–979.
ZHAO W, WANG Y W, WEI G S, et al. Role of poly(ADP-ribose) polymerases-1-mediated blockade of autophagy in ischemia/reperfusion injury of rat cardiomyocytes[J]. J South Med Univ, 2018, 38(8): 975–979. DOI:10.3969/j.issn.1673-4254.2018.08.12 |
| [16] | DÖLLE C, FLØNES I, NIDO G S, et al. Defective mitochondrial DNA homeostasis in the substantia nigra in parkinson disease[J]. Nat Commun, 2016, 7: 13548. DOI:10.1038/ncomms13548 |
| [17] | BRISTON T, HICKS A R. Mitochondrial dysfunction and neurodegenerative proteinopathies: mechanisms and prospects for therapeutic intervention[J]. Biochem Soc Trans, 2018, 46(4): 829–842. DOI:10.1042/BST20180025 |
| [18] | CZAPSKI G A, CIESŚLIK M, WENCEL P L, et al. Inhibition of poly(ADP-ribose) polymerase-1 alters expression of mitochondria-related genes in PC12 cells: relevance to mitochondrial homeostasis in neurodegenerative disorders[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(2): 281–288. DOI:10.1016/j.bbamcr.2017.11.003 |
| [19] | SZCZESNY B, BRUNYANSZKI A, OLAH G, et al. Opposing roles of mitochondrial and nuclear PARP1 in the regulation of mitochondrial and nuclear DNA integrity: implications for the regulation of mitochondrial function[J]. Nucleic Acids Res, 2014, 42(21): 13161–13173. DOI:10.1093/nar/gku1089 |
| [20] |
王莹颖, 刘文景, 宁瑶, 等. PARP抑制剂的作用机制和研究进展[J].
中国新药杂志, 2018, 27(3): 306–313.
WANG Y Y, LIU W J, NING Y, et al. Progress in the research of PARP inhibitors and their mechanisms of action[J]. Chin J New Drug, 2018, 27(3): 306–313. |
| [21] | SONI A, LI F H, WANG Y, et al. Inhibition of PARP1 by BMN673 effectively sensitizes cells to radiotherapy by upsetting the balance of repair pathways processing DNA double-strand breaks[J]. Mol Cancer Ther, 2018, 17(10): 2206–2216. DOI:10.1158/1535-7163.MCT-17-0836 |
| [22] | EL AMKI M, LEROUET D, GARRAUD M, et al. Improved reperfusion andvasculoprotection by the poly(ADP-Ribose)Polymerase inhibitor PJ34 after stroke and thrombolysis in mice[J]. Mol Neurobiol, 2018, 55(12): 9156–9168. DOI:10.1007/s12035-018-1063-3 |



