支气管哮喘(哮喘)是呼吸系统常见疾病,具有易反复和病程长的特点,严重影响患者身心健康。维生素D在钙、磷及骨骼代谢中的作用是众所周知的,其中1,25-二羟维生素D3[1,25-(OH)2-D3]是维生素D的主要生物活性形式。近年来,维生素D的免疫调节作用在多领域受到广泛关注。现有研究结果表明:低维生素D水平与气道高反应性、肺功能下降、哮喘控制不良及激素抵抗型哮喘相关[1-4]。临床试验发现:在儿童及成人中补充维生素D能够降低哮喘的严重程度,延缓哮喘复发,更好地控制哮喘[5-6]。但维生素D对于哮喘的防治仍缺乏可靠的生物学证据。Ⅱ型固有淋巴细胞(typeⅡinnate lymphoid cells,ILC2s)是新近发现的固有免疫相关细胞,因其能够分泌Th2型细胞因子IL-13、IL-5、IL-4,促进哮喘的发生、发展而备受重视。而维生素D能否调节哮喘相关ILC2s的作用尚不清楚。本课题通过研究1,25-(OH)2-D3对哮喘小鼠ILC2细胞及相关细胞因子影响,以期为探寻哮喘全身免疫治疗的新途径提供参考。
1 材料与方法 1.1 实验动物和主要试剂4~6周龄SPF级BALB/c雌性小鼠24只,体质量(20±1.8)g,购自上海动物资源中心,饲养于徐州医科大学实验动物中心,适应性饲养1周。主要试剂:卵清蛋白(OVA)、氢氧化铝、1,25-(OH)2-D3(美国Sigma公司);TRIzol、逆转录试剂盒(江苏溥博生物科技有限公司);引物合成(上海生物工程有限公司);IL-5、IL-13及IL-33 ELISA试剂盒(上海江莱生物科技有限公司);抗Lineage-FITC抗体、抗CD278-PerCP(ICOS)/Cy5.5抗体(美国Biolegend公司),抗ST-2-PE抗体(美国eBioscience公司),Ⅰ型胶原酶(美国Gibco公司)。
1.2 方法 1.2.1 动物分组和哮喘小鼠模型的制备将24只BALB/c雌性小鼠按随机数字法分为对照组、哮喘组和干预组,每组8只。动物模型的建立参照文献[7]方法,稍作调整。哮喘组和干预组在第1、8、15天腹腔注射OVA混合液0.2 mL(含OVA 50 μg、10%氢氧化铝0.15 mL和生理盐水0.05 mL)致敏,对照组用PBS替代。第22天开始,哮喘组和干预组雾化吸入2%OVA激发,每日1次,每次60 min,雾化激发1周,共计7次。对照组雾化吸入PBS。干预组每次激发前30 min腹腔注射1,25-(OH)2-D3混合液0.08 mL[含1,25-(OH)2-D3 0.08 μg、生理盐水0.08 mL和无水乙醇2.0 μL]。
1.2.2 支气管肺泡灌洗液(BALF)中炎性细胞总数及嗜酸性粒细胞(EOS)计数末次雾化激发24 h后,颈椎脱臼处死小鼠,开胸暴露气管及肺脏,迅速结扎左主支气管,行右肺灌洗,回收BALF,于4 ℃低温离心机离心,取上清液保存于-80 ℃冰箱,行ELISA检测;细胞沉淀经PBS重悬后行炎症细胞总数及EOS分类计数。
1.2.3 HE染色观察小鼠肺部病理变化取部分左肺于甲醛固定48 h后,石蜡包埋切片, 每张玻片贴2张切片,行HE染色,光镜下观察肺组织的病理改变,每张切片随机选取5个以上高倍镜视野进行观察。
1.2.4 qRT-PCR检测肺组织抑瘤因子2(suppressor of tumorigenicity 2,ST-2)、可诱导共刺激分子(inducible costimulator,ICOS)、IL-33、IL-5、IL-13 mRNA的表达用左肺下叶制作组织匀浆,提取总RNA,紫外分光光度计检测RNA浓度及D(260)/D(280)比值,按逆转录试剂盒说明逆转录合成cDNA。内参及引物序列:β-actin,上游引物5′-TGCTGTCCCTGTATGCCTCTG-3′,下游引物5′-CTCTTTGATGTCACGCACGATT-3′,片段长度227 bp;IL-5,上游引物5′-AAGTGCTGGAGATGGAACCC-3′,下游引物5′-TCAGCCTGGAATACTTGAG-ACC-3′,片段长度106 bp;IL-13,上游引物5′-GCTCTTGCTTGCCTTGGTG-3′,下游引物5′-ACAGGGGAGTCT-GGTCTTGTG-3′,片段长度124 bp;IL-33,上游引物5′-CGCTACTATGAGTCTCCCTGTCC-3′,下游引物5′-CGGAGTAGTCCTTGTCGTTGG-3′,片段长度133 bp;ST-2,上游引物5′-TTGCCTACGAGCAGGAGATTG-3′,下游引物5′-GTCGGCTTGCCTCACCCA-3′,片段长度99 bp;ICOS,上游引物5′-CCGTGTCTTTGTCTTCTGCTTC-3′,下游引物5′-TTCCCTTGGTCTTGGTGAGTT-3′,片段长度194 bp。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃30 s,共40个循环。每样品3复孔。
1.2.5 ELISA检测BALF中IL-33、IL-5及IL-13表达按ELISA试剂盒说明书进行检测,采用酶标仪在450 nm处测光密度值[D(450)],根据拟合曲线,将D(450)值转换为浓度。
1.2.6 流式细胞仪检测肺来源ILC2s比例取新鲜肺组织剪碎,加入5 mL 0.5%Ⅰ型胶原酶、1 mL CaCl2研磨消化,37 ℃恒温水浴箱消化2 h,过200目筛网,加入红细胞裂解液(ACK),PBS洗涤2次;滴加台盼蓝行细胞计数;加入抗Hematopoietic Lineage-FITC抗体、抗CD278(ICOS-PerCP/Cy5.5)抗体、抗ST2-PE抗体,混匀后4 ℃避光染色50 min;离心弃去上清;PBS洗涤2次;加入200 μL PBS重悬,上机检测。
1.3 统计学分析采用SPSS 16.0统计软件。计量数据采用x ±s表示,多组间均数比较采用单因素方差分析,方差齐时,组间比较采用LSD法,方差不齐时,组间比较采用Dunnett’s T3法。P < 0.05为差异有统计学意义。Pearson相关分析BALF中EOS计数、IL-33表达与ILC2s百分比的相关性,BALF中IL-33与IL-13的相关性。采用GraphPad Prism 6软件绘制统计图。
2 结果 2.1 肺组织形态学观察各组小鼠肺组织HE染色观察结果显示:对照组小鼠支气管壁结构完整,管壁无皱褶,上皮细胞形态正常,无明显炎症细胞浸润;哮喘组病理改变明显,可见支气管管腔狭窄,管壁皱褶,大量炎性细胞浸润,上皮细胞肿胀,黏液分泌明显增多,黏液栓形成;干预组病理改变较哮喘组减轻(图 1)。

|
| A:对照组,B:哮喘组,C:干预组 图 1 HE染色观察各组小鼠肺组织形态(×400) |
2.2 BALF中炎性细胞总数及EOS计数
与对照组比较,哮喘组、干预组炎性细胞总数和EOS计数均升高(P < 0.01),干预组较哮喘组降低(P < 0.01,表 1)。
| 组别 | 炎性细胞总数 | EOS计数 |
| 对照组 | 5.91±1.08 | 0.11±0.06 |
| 哮喘组 | 20.01±2.55a | 3.55±0.64a |
| 干预组 | 13.75±1.64ab | 1.45±0.36ab |
| F值 | 115.624 | 134.405 |
| P值 | < 0.001 | < 0.001 |
| a: P < 0.01, 与对照组比较;b: P < 0.01, 与哮喘组比较 | ||
2.3 BALF中IL-13、IL-5及IL-33表达的变化
ELISA检测结果显示:哮喘组、干预组BALF中IL-33、IL-13、IL-5表达较对照组升高(P < 0.01);干预组IL-33、IL-13表达较哮喘组降低(P < 0.01),但IL-5表达与哮喘组比较差异无统计学意义(表 2)。
| 组别 | IL-13 | IL-5 | IL-33 |
| 对照组 | 14.29±2.93 | 55.25±10.97 | 54.52±15.21 |
| 哮喘组 | 48.48±6.96a | 102.00±16.02a | 156.90±23.59a |
| 干预组 | 31.64±3.22ab | 96.57±10.83a | 119.62±17.86ab |
| F值 | 104.122 | 31.743 | 58.243 |
| P值 | < 0.001 | < 0.001 | < 0.001 |
| a: P < 0.01, 与对照组比较;b: P < 0.01, 与哮喘组比较 | |||
2.4 肺组织ST-2、ICOS、IL-33、IL-5及IL-13 mRNA表达的变化
qRT-PCR检测结果显示:哮喘组肺组织ST-2、ICOS、IL-33、IL-5、IL-13 mRNA表达高于对照组(P < 0.01);干预组小鼠肺组织ST-2、ICOS、IL-33、IL-13 mRNA表达较哮喘组下降(P < 0.05),IL-5 mRNA表达较哮喘组升高(P < 0.05,表 3)。
| 组别 | ICOS | ST-2 | IL-13 | IL-5 | IL-33 |
| 对照组 | 1.04±0.32 | 1.05±0.35 | 1.15±0.67 | 1.15±0.71 | 1.03±0.26 |
| 哮喘组 | 4.70±1.92a | 8.51±2.70a | 16.87±9.25a | 10.89±5.54a | 4.67±1.60a |
| 干预组 | 2.08±0.65ab | 4.90±1.79ab | 5.73±2.56ab | 23.39±9.92ab | 2.15±0.98ac |
| F值 | 20.229 | 31.525 | 16.446 | 23.025 | 23.392 |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 |
| a: P < 0.01, 与对照组比较;b: P < 0.05, c: P < 0.01, 与哮喘组比较 | |||||
2.5 肺来源ILC2s比例的变化
流式细胞仪检测结果显示:哮喘组、干预组肺来源ILC2s(lineage- ICOS+ST-2+)百分比较对照组升高(P < 0.01),干预组较哮喘组降低(P < 0.01,图 2)。
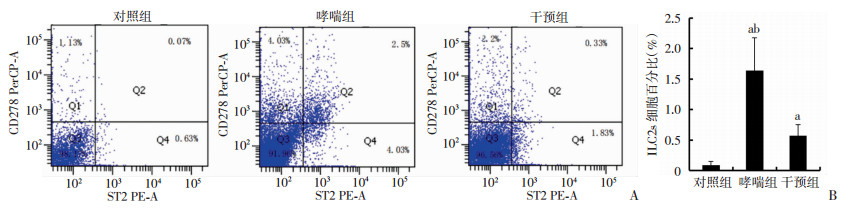
|
| A:流式细胞仪检测右上象限(Q2)群为ILC2s(lineage-ICOS+ST2+);B:ILC2s比例分析a:P < 0.01, 与对照组比较;b: P < 0.01,与干预组比较 图 2 流式细胞仪检测各组肺来源ILC2s比例 |
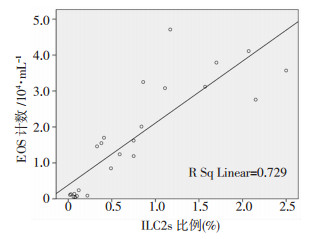
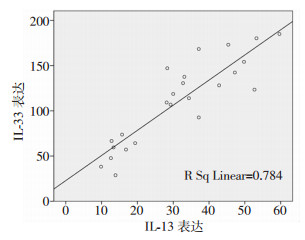
2.6 EOS计数、IL-33与ILC2s及IL-33与IL-13间相关性分析
EOS计数与ILC2s比例、IL-33表达与ILC2s比例、IL-33与IL-13表达均呈正相关关系(r=0.854、0.757、0.886,P < 0.05,图 3~5)。
|
| 图 3 BALF中EOS计数与肺来源ILC2s比例相关性分析 |

|
| 图 4 BALF中IL-33表达与肺来源ILC2s比例相关性分析 |
|
| 图 5 BALF中IL-33与IL-13表达相关性分析 |
3 讨论
哮喘的发病机制尚不完全清楚。Th1/Th2比值失衡是哮喘发生发展的基础,但该理论并不能解释所有类型哮喘的病理机制。ILC2s是新近发现的来源于骨髓淋巴祖细胞的固有免疫细胞,其活化依赖转录因子GATA结合蛋白3(GATA binding protein 3, GATA3)、B细胞淋巴瘤/白血病11B(B-cell lymphoma/leukaemia 11B, Bcl11b)、维甲酸相关孤核受体α(retinoid acid receptor related orphan receptor α, RORα)、转录因子1(transcription factor 1, TCF-1)、独立生长因子1(growth factor independence 1, Gfi1)以及上皮细胞来源的IL-33、胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)和IL-25等[8-9]。激活的ILC2s表面表达CD90、CD25、CD278、ST-2等,同时能够产生多种细胞因子、趋化因子和肽物质,包括IL-5、IL-6、IL-9、IL-13、嗜酸性粒细胞趋化因子和甲硫氨酸脑啡肽等。其中Th2型细胞因子在防治寄生虫感染中起关键作用,同时还参与了哮喘、过敏性皮炎、嗜酸性食管炎、过敏性鼻炎、慢性鼻窦炎及鼻息肉等疾病的病理过程[10-11]。研究显示:在哮喘动物模型气道炎症反应中,ILC2s能迅速活化释放大量致炎因子IL-5和IL-13[12]。ILC2s在不依赖T辅助细胞的作用下即可早期分泌Th2型细胞因子促进哮喘的发生、发展, 而与野生型小鼠相较,ILC2s缺陷小鼠致敏后Th2细胞活化显著减少,炎症反应减弱,提示ILC2s能驱动Th2细胞的分化[13-14]。研究发现肺内ILC2s在过敏原暴露早期即能产生大量IL-5和IL-13,诱导气道嗜酸性粒细胞浸润、黏液分泌,引起气道高反应性,并有助于启动和维持适应性2型免疫应答[15]。这些结果显示ILC2s参与哮喘发展的病理生理过程并起到关键作用。IL-33是IL-1相关的核细胞因子。ST-2是IL-1受体家族的新成员,存在4种亚型,可与IL-33特异性结合,参与炎症及变态反应性疾病的病理生理过程。IL-33与ST-2结合,可以活化Th2细胞,促进释放多种促炎因子,在炎症的发生、发展过程中起重要作用[16]。IL-33已被证明可以通过ST-2受体信号通路促进ILC2s在体外和体内的扩张[17-19]。KEARLEY等[20]发现持续气道高反应与IL-33/ST-2通路有关,用抗体阻断IL-33的ST-2受体可减少Th2型细胞因子IL-13、IL-4的分泌,减轻气道高反应和过敏性炎症。孙亚林[21]研究发现:补充维生素D能抑制哮喘小鼠IL-33表达,从而减轻炎症反应,因此,我们猜测维生素D有可能通过抑制IL-33/ST-2通路调节ILC2s的活化。
维生素D的作用通常是免疫抑制,它的缺乏与自身免疫和过敏性疾病的高易感性有关[22-23]。维生素D可调节多种免疫细胞,参与固有免疫及适应性免疫应答。本研究建立了雌性小鼠哮喘模型,发现哮喘组小鼠肺部出现典型哮喘的病理改变,BALF炎性细胞总数、EOS计数及炎性因子的表达均较对照组明显增强, 而维生素D干预组上述表现较哮喘组明显减轻,可见维生素D干预治疗能有效减轻哮喘炎症反应,上述结果与既往研究[7, 24]一致。同时,本研究发现在哮喘组及干预组中,肺部ILC2s表面标记物ST-2和ICOS(CD278)mRNA表达及ILC2s活化较对照组显著增强,且ILC2s的活化与EOS呈正相关,提示ILC2s参与了哮喘的病理生理过程,与上述结论一致[12]。经维生素D干预后,小鼠肺部ILC2s比例较哮喘组显著下降。有研究表明维生素D能减少呼吸道上皮细胞TSLP和IL-33的表达[25],抑制人外周血单核细胞(PBMC)中的ILC2s细胞活化[26]。因此,我们认为维生素D可能通过抑制哮喘小鼠ILC2s的活化减缓哮喘炎症反应。本研究观察到:给予1,25-(OH)2-D3后,IL-33/ST-2信号通路及ILC2s活化均被抑制,IL-33的下降与ILC2s及其细胞因子IL-13的抑制均呈正相关关系。因此,我们认为在模型鼠体内维生素D可能通过抑制IL-33/ST-2信号通路调节ILC2s的活化及功能,减缓哮喘炎症反应。但在研究中同时发现:维生素D对炎症因子IL-5无明显抑制作用,考虑Th2细胞可能是IL-5的主要来源,而维生素D对过敏性反应炎症中Th2的影响尚不完全明确。吸入糖皮质激素仍是控制哮喘的经典手段,但仅通过气道局部用药并不能完全抑制全身哮喘变态炎性反应。有实验数据表明:维生素D能增加对糖皮质激素的治疗反应,并可能作为激素耐药性哮喘患者的附加治疗药物[27],但其机制尚不完全清楚。KABATA等[28]研究发现:在激素抵抗型哮喘中,糖皮质激素不能有效抑制由IL-33介导的ILC2s的作用。根据本研究结果,可推测维生素D能够通过负向调控ILC2s协同激素治疗哮喘。
综上所述,适量维生素D3能够减轻哮喘的炎症反应,通过抑制ILC2s的生物学效应发挥免疫调控作用。本研究为临床补充维生素D提供了部分理论依据,但仍需进一步研究维生素以及协同激素治疗哮喘的机制。维生素D的补充有望成为哮喘治疗的新途径。
| [1] | MÄÄTTÄ A M, KOTANIEMI-SYRJÄNEN A, MALMSTRÖM K, et al. Vitamin D, high-sensitivity C-reactive protein, and airwayhyperresponsiveness in infants with recurrent respiratory symptoms[J]. Ann Allergy Asthma Immunol, 2017, 119(3): 227–231. DOI:10.1016/j.anai.2017.06.014 |
| [2] | HAUGEN J, BASNET S, HARDANG I M, et al. Vitamin D status is associated with treatment failure and duration of illness in Nepalese children with severe pneumonia[J]. Pediatr Res, 2017, 82(6): 986–993. DOI:10.1038/pr.2017.71 |
| [3] | HAN Y Y, FORNO E, ALVAREZ M, et al. Diet, lung function, and asthma exacerbations inpuerto rican children[J]. Pediatr Allergy Immunol Pulmonol, 2017, 30(4): 202–209. DOI:10.1089/ped.2017.0803 |
| [4] |
杨海华, 龙丰, 李圣青, 等. 1,25-(OH)2 D3对激素抵抗型哮喘患者T淋巴细胞JNK/AP-1和糖皮质激素受体的影响[J].
中国呼吸与危重监护杂志, 2017, 16(2): 155–159.
YANG H H, LONG F, LI S Q, et al. Effect of 1,25-(OH)2 D3 on JNK/AP-1 and glucocorticoid receptor of T lymphocytes in steroid-resistant asthmatics[J]. Chin J Respirat Crit Care Med, 2017, 16(2): 155–159. DOI:10.7507/1671-6205.201610033 |
| [5] | KANG Q H, ZHANG X Y, LIU S J, et al. Correlation between the vitamin D levels and asthma attacks in children: Evaluation of the effects of combination therapy of atomization inhalation of budesonide, albuterol and vitamin D supplementation on asthmatic patients[J]. Exp Ther Med, 2018, 15(1): 727–732. DOI:10.3892/etm.2017.5436 |
| [6] |
刘文君, 王亚亭, 毕良学, 等. 维生素D3辅助治疗儿童重症哮喘可降低血清TLR4、S100β蛋白水平以及延缓哮喘复发[J].
中国免疫学杂志, , 34(9): 1382–1386.
LIU W J, WANG Y T, BI L X, et al. Adjuvant therapy of vitamin D3 was associated with decreased serum TLR4 and S100 beta proteins and delayed recurrence of severe asthma among children[J]. Chin J Immunol, , 34(9): 1382–1386. DOI:10.3969/j.issn.1000-484X.2018.09.020 |
| [7] |
乔俊英, 宋丽, 张艳丽, 等. 哮喘小鼠HMGB1/TLR4/NF-κB信号通路及维生素D的作用[J].
中国当代儿科杂志, 2017, 19(1): 95–103.
QIAO J Y, SONG L, ZHANG Y L, et al. HMGB1/TLR4/NF-κB signaling pathway and role of vitamin D in asthmatic mice[J]. Chin J Contemp Pediatr, 2017, 19(1): 95–103. DOI:10.7499/j.issn.1008-8830.2017.01.016 |
| [8] | SERAFINI N, VOSSHENRICH C A, DI SANTO J P. Trans-criptional regulation of innate lymphoid cell fate[J]. Nat Rev Immunol, 2015, 15(7): 415–428. DOI:10.1038/nri3855 |
| [9] | WALKER J A, OLIPHANT C J, ENGLEZAKIS A, et al. Bcl11b is essential for group 2 innate lymphoid cell development[J]. J Exp Med, 2015, 212(6): 875–882. DOI:10.1084/jem.20142224 |
| [10] | HALIM T Y. Group 2 innate lymphoid cells in disease[J]. Int Immunol, 2016, 28(1): 13–22. DOI:10.1093/intimm/dxv050 |
| [11] | KABATA H, MORO K, KOYASU S, et al. Group 2 innate lymphoid cells and asthma[J]. Allergol Int, 2015, 64(3): 227–234. DOI:10.1016/j.alit.2015.03.004 |
| [12] | WANG X H, ZHAO H Q, MA C H, et al. Gallic acid attenuates allergic airway inflammation via suppressed interleukin-33 and group 2 innate lymphoid cells in ovalbumin-induced asthma in mice[J]. Int Forum Allergy Rhinol, 2018, 8(11): 1284–1290. DOI:10.1002/alr.22207 |
| [13] | HALIM T Y, KRAUSS R H, SUN A C, et al. Lung natural helper cells are a critical source of Th2 cell-type cytokines in protease allergen-induced airway inflammation[J]. Immunity, 2012, 36(3): 451–463. DOI:10.1016/j.immuni.2011.12.020 |
| [14] | HALIM T Y, STEER C A, MATHÄ L, et al. Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation[J]. Immunity, 2014, 40(3): 425–435. DOI:10.1016/j.immuni.2014.01.011 |
| [15] | VAN RIJT L, VON RICHTHOFEN H, VAN REE R. Type 2 innate lymphoid cells: at the cross-roads in allergic asthma[J]. Semin Immunopathol, 2016, 38(4): 483–496. DOI:10.1007/s00281-016-0556-2 |
| [16] | MORIMOTO Y, HIRAHARA K, KIUCHI M, et al. Amphiregulin-producing pathogenic memory T helper 2 cells instruct eosinophils to secrete osteopontin and facilitate airway fibrosis[J]. Immunity, 2018, 49(1): 134–150. DOI:10.1016/j.immuni.2018.04.023 |
| [17] | SALMOND R J, MIRCHANDANI A S, BESNARD A G, et al. IL-33 induces innate lymphoid cell-mediated airway inflammation by activating mammalian target ofrapamycin[J]. J Allergy Clin Immunol, 2012, 130(5): 1159–1166. DOI:10.1016/j.jaci.2012.05.018 |
| [18] | YASUDA K, MUTO T, KAWAGOE T, et al. Contribution of IL-33-activated type Ⅱ innate lymphoid cells to pulmonary eosinophilia in intestinal nematode-infected mice[J]. Proc Natl Acad Sci U S A, 2012, 109(9): 3451–3456. DOI:10.1073/pnas.1201042109 |
| [19] | MOLOFSKY A B, NUSSBAUM J C, LIANG H E, et al. Innate lymphoid type 2 cells sustain visceral adipose tissueeosinophils and alternatively activated macrophages[J]. J Exp Med, 2013, 210(3): 535–549. DOI:10.1084/jem.20121964 |
| [20] | KEARLEY J, BUCKLAND K F, MATHIE S A, et al. Reso-lution of allergic inflammation and airwayhyperreactivity is dependent upon disruption of the T1/ST2-IL-33 pathway[J]. Am J Respir Crit Care Med, 2009, 179(9): 772–781. DOI:10.1164/rccm.200805-666OC |
| [21] |
孙亚林.研究维生素D和维生素AD对哮喘小鼠气道炎症IL-33、IgE的影响[D].苏州: 苏州大学, 2016.
SUN Y L. Effects of the vitamin D and vitamin AD on the airway inflammation IL-33 and IgE in a murine model of asthma[D]. Suzhou: Soochow University, 2016. |
| [22] | YANG C Y, LEUNG P S, ADAMOPOULOS I E, et al. The implication of vitamin D and autoimmunity: a comprehensive review[J]. Clin Rev Allergy Immunol, 2013, 45(2): 217–226. DOI:10.1007/s12016-013-8361-3 |
| [23] | MUEHLEISEN B, GALLO R L. Vitamin D in allergic disease: shedding light on a complex problem[J]. J Allergy Clin Immunol, 2013, 131(2): 324–329. DOI:10.1016/j.jaci.2012.12.1562 |
| [24] |
郭欣, 洪建国, 周小建, 等. 细菌溶解产物和1,25-二羟维生素D3对支气管哮喘小鼠呼吸道炎症的影响[J].
中华实用儿科临床杂志, 2016, 31(12): 936–939.
GUO X, HONG J G, ZHOU X J, et al. Effect of bacteria lysates and 1,25-dihydroxy vitamin D3 on airway inflammation in asthmatic mice models[J]. Chin J Appl Clin Pediatr, 2016, 31(12): 936–939. DOI:10.3760/cma.j.issn.2095-428X.2016.12.016 |
| [25] | PAPLIŃSKA-GORYCA M, NEJMAN-GRYZ P, PROBOSZCZ M, et al. The effect of 1,25-dihydroxy vitamin D3 on TSLP, IL-33 and IL-25 expression in respiratory epithelium[J]. Eur Cytokine Netw, 2016, 27(2): 54–62. DOI:10.1684/ecn.2016.0377 |
| [26] | RUITER B, PATIL S U, SHREFFLER W G. Vitamins A and D have antagonistic effects on expression of effector cytokines and gut-homing integrin in human innate lymphoid cells[J]. Clin Exp Allergy, 2015, 45(7): 1214–1225. DOI:10.1111/cea.12568 |
| [27] | MIRAGLIA DEL GIUDICE M, ALLEGORICO A. The role of vitamin D in allergic diseases in children[J]. J Clin Gastroenterol, 2016, 50: S133–S135. DOI:10.1097/mcg.0000000000000679 |
| [28] | KABATA H, MORO K, FUKUNAGA K, et al. Thymic stromal lymphopoietin induces corticosteroid resistance in natural helper cells during airway inflammation[J]. Nat Commun, 2013, 4: 2675. DOI:10.1038/ncomms3675 |



