随着脓毒症病情严重程度的增加,神经肌肉功能障碍的发生率也不断增加,在急性呼吸窘迫综合征的患者中其发病率可达60%[1-2]。烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor, nAChR)是维持神经肌肉接头(neuromuscular junction, NMJ)正常功能的重要组成单位。正常生理状态下,骨骼肌突触后膜仅表达成熟型nAChR(ε-nAChR),而在脓毒症等病理情况下,神经肌肉功能异常,胚胎时期占主要作用的幼稚型nAChR(γ-nAChR)和神经α7型nAChR(α7-nAChR)再度出现且分布于整个细胞膜之上,产生异质化受体广泛高表达且呈异常分布的现象[3-5]。聚集蛋白(agrin)是一种蛋白聚糖,可由运动神经元分泌,作用于骨骼肌突触后膜,不仅在NMJ结构的形成及稳定性的维持中有重要作用,还可以调节烟碱型乙酰胆碱受体相关亚基的表达[6-8]。然而,agrin能否改善脓毒症导致的神经肌肉功能障碍和nAChR异质化表达,目前少见报道。因此,本研究拟通过盲肠结扎穿孔(cecal ligation and puncture, CLP)建立脓毒症大鼠模型,观察外源神经性agrin对神经肌肉功能和异质化nAChR的影响,为临床治疗脓毒症导致的神经肌肉功能障碍提供实验依据。
1 材料与方法 1.1 材料大鼠IL-6 ELISA试剂盒购自深圳欣博盛生物科技有限公司;BL420F生物机能实验系统购自成都泰盟软件;兔抗大鼠γ-nAChR购自美国Santa Cruz公司;兔抗大鼠α7-nAChR抗体购自美国Abcam公司;Alexa Fluor 488标记山羊抗兔抗体、Cy3标记的山羊抗兔抗体、多聚甲醛和TritonX-100等购自碧云天生物技术有限公司。
1.2 实验动物与分组实验动物采用2月龄成年雄性SD大鼠,体质量250~280 g,属于无特定病原体级动物。实验动物购自重庆医科大学实验动物中心,使用许可证编号为SCXK(渝)2007-0001。48只动物采用随机数字表法分为4组(n=12):假手术组(Sham组)、Sham+Agrin组(ShamA组)、CLP组、CLP+Agrin组(CLPA组)。CLPA组和ShamA组在建模后,双侧胫前肌内注射0.1 mL agrin(100 μg/mL,R&D公司,美国)。
1.3 实验动物模型的建立大鼠术前可自由饮水和进食,腹腔注射45 mg/kg戊巴比妥钠,待夹尾反射消失后仰卧位固定。脓毒症组大鼠备皮消毒后,于腹中线左侧行2 cm切口并逐层分离组织,找到盲肠后轻柔牵拉至体外,使用3号丝线在回盲瓣与盲肠末端中点处结扎,再使用18G针头分别于盲肠结扎远端行纵向和横向穿刺各一,挤压盲肠使内容物流出,小心将盲肠还纳至腹腔,逐层缝合腹腔后消毒切口。假手术组打开腹腔后,不行盲肠结扎穿孔术,探查腹腔后逐层关腹。术毕于大鼠四肢皮下注射0.9%生理盐水(40 mL/kg)进行补液治疗。在建模后第48小时,单侧行相应功能学检测后,处死大鼠取材。
1.4 ELISA检测血浆中炎症因子IL-6水平大鼠左心室穿刺取血后,血液经3 000 r/min离心20 min后取上清液,保存于-80 ℃冰箱中备用。检测时取出血清于4 ℃环境中复温,根据ELISA试剂盒(欣博盛生物科技有限公司,上海)说明书进行操作。设立空白孔、标准孔以及样品孔,样品孔每孔加入血清样品100 μL,37 ℃孵育90 min,洗板后依次按照操作步骤加入抗体稀释液及酶结合物稀释液,加入终止液终止反应之后,使用酶标仪于450 nm波长处测定各孔光密度值D(450),并以标准孔每组浓度为横坐标、光密度值为纵坐标绘制标准曲线,将实验组光密度值带入标准曲线计算血浆中炎症因子IL-6水平。
1.5 神经肌肉功能检测所有大鼠于CLP建模后第48小时行功能学检测。麻醉大鼠后放置成俯卧位,逐层钝性分离暴露坐骨神经,将正、负刺激电极置于坐骨神经上,记录电极放置于胫前肌处,参考电极接入尾部,设定参数为单脉冲方波,强度为3 V,波宽为0.2 ms,频率为1 Hz。使用BL420F生物机能实验系统采集右侧坐骨神经复合肌动作电位(compound muscle action potential, CMAP),测定和计算CMAP振幅、时程、潜伏期和神经传导速度,用以评价各组功能学情况。
1.6 免疫荧光检测胫前肌γ-nAChR和α7-nAChR蛋白表达取大鼠胫前肌组织以4%多聚甲醛固定48 h后,石蜡包埋组织并切片。切片脱蜡后进行抗原修复,温度自然降至室温后,PBS漂洗5 min 3次,0.25%TritonX-100破膜15 min,然后10%山羊血清封闭30 min,滴加γ-nAChR一抗(1 :100)或α7-nAChR一抗(1 :300),4 ℃孵育过夜。取出切片用PBS漂洗10 min 3次,滴加Cy3标记的山羊抗兔和Alexa Fluor 488标记的山羊抗兔荧光二抗(1 :500),37 ℃避光孵育1 h后,PBS漂洗10 min 3次,滴加DAPI室温孵育10 min后,PBS漂洗10 min 3次,抗荧光淬灭剂封片,激光共聚焦显微镜采集图片。
1.7 Western blot检测胫前肌γ-nAChR和α7-nAChR蛋白表达取大鼠胫前肌组织和裂解液放入匀浆器内,冰上研磨至组织碎裂溶解,静置30 min后,12 000 r/min离心15 min(4 ℃),取上清液分装保存,按照BCA试剂盒说明书测定蛋白样品浓度。制备5%浓缩胶-10%分离胶,每孔加入煮沸5 min后的蛋白样品30 μg,电泳后恒流250 mA转于聚偏二氟乙烯膜上。TBST洗膜3次后将膜放置于5%脱脂奶粉中封闭2 h,并在下列一抗抗体中孵育过夜(4 ℃):抗γ-nAChR(1 :500)、抗α7-nAChR(1 :1 000)和抗GAPDH(1 :1 000,碧云天)。TBST清洗3次,每次10 min后,根据一抗来源选择相应的二抗抗体(1 :1 000)室温孵育1 h。使用ECL反应液后,将膜放于Bio-Rad化学发光成像系统显影、曝光。通过Image J软件进行灰度值分析,采用各组目的蛋白与各组内参蛋白的比值表示各组蛋白的相对表达量。
1.8 统计学分析采用SPSS 22.0统计软件。正态分布的计量资料以x ±s表示。大鼠IL-6炎症因子表达、CMAP各项检测指标、γ-nAChR和α7-nAChR蛋白表达采用单因素方差分析进行组间比较,两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果建模后观察各组大鼠,Sham组和ShamA组大鼠活动、饮食正常,脓毒症组大鼠活动、进食减少,蜷缩于鼠笼角落,对外界刺激反应减弱,毛发竖起、无光泽,在眼周出现血性分泌物,大鼠死亡后剖开腹腔可见坏死盲肠及脓血性腹水。建模至取材,Sham组及ShamA组无大鼠死亡,存活率为100%;CLP组死亡5只,存活率为58.33%;CLPA组死亡4只,存活率为66.67%。
2.1 大鼠血浆中IL-6水平与Sham组和ShamA组比较,CLP组和CLPA组血浆炎症因子IL-6水平明显增加(P < 0.05);Sham组和ShamA组比较、CLP组和CLPA组比较,IL-6水平差异均无统计学意义(图 1)。

|
| 1:Sham组;2:ShamA组;3:CLP组;4:CLPA组;a:P < 0.05,与Sham组比较;b:P < 0.05,与ShamA组比较 图 1 各组大鼠血浆中IL-6水平的比较 |
2.2 Agrin对大鼠CMAP的影响
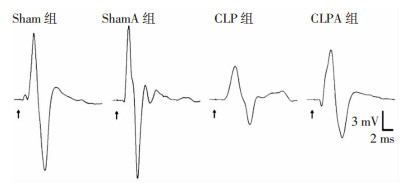
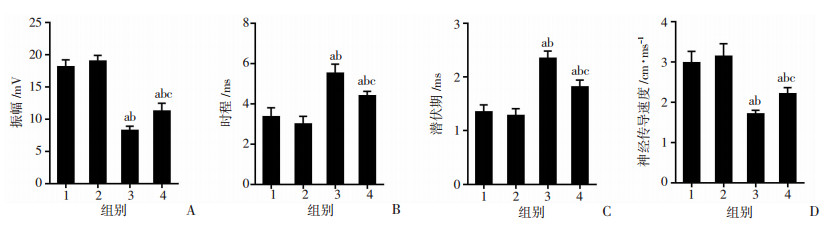
各组大鼠CMAP如图 2所示。CLP组、CLPA组较Sham组、ShamA组CMAP时程和潜伏期延长(P < 0.05),而振幅和神经传导速度缩短(P < 0.05),均表现出神经肌肉功能障碍;Sham组和ShamA组各测量指标差异无统计学意义,但振幅和神经传导速度有所提升,而时程和潜伏期缩短;与CLP组比较,CLPA组CMAP振幅增高,时程缩短,潜伏期缩短,神经传导速度增快(P < 0.05,图 3),神经肌肉功能有所恢复。
|
| 箭头标记处为刺激起始点 图 2 各组大鼠胫前肌CMAP原始电位图 |
|
| A:CMAP振幅;B:CMAP时程;C:CMAP潜伏期;D:神经传导速度1:Sham组;2:ShamA组;3:CLP组;4:CLPA组;a:P < 0.05,与Sham组比较;b:P < 0.05,与ShamA组比较;c:P < 0.05,与CLP组比较 图 3 各组大鼠胫前肌CMAP各测量值的比较 |
2.3 Agrin对大鼠胫前肌异质化nAChR表达的影响
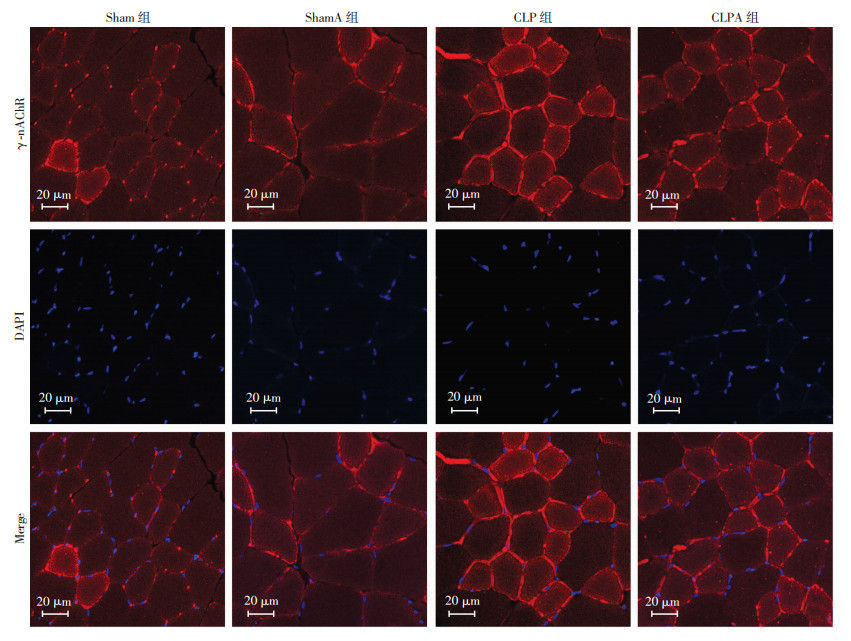
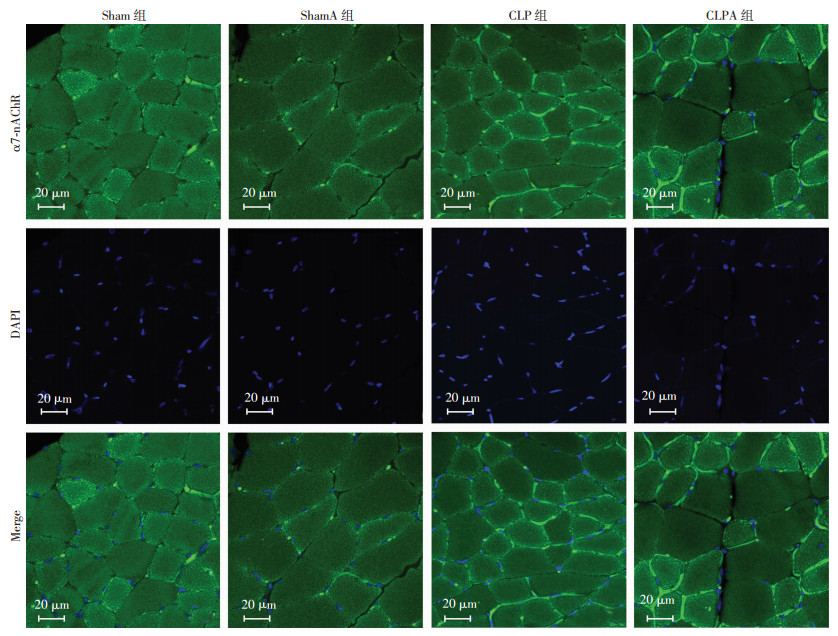
免疫荧光观察结果显示:Sham组和ShamA组大鼠胫前肌组织有少量的γ-nAChR和α7-nAChR表达,而在CLP组,γ-nAChR和α7-nAChR荧光强度增加且分布增多;经过外源性注射agrin后,γ-nAChR和α7-nAChR表达量减少(图 4、5)。
|
| 图 4 免疫荧光观察各组大鼠胫前肌γ-nAChR的表达 |
|
| 图 5 免疫荧光观察各组大鼠胫前肌α7-nAChR的表达 |
Western blot检测结果显示:Sham组和ShamA组γ-nAChR和α7-nAChR表达明显低于CLP组和CLPA组(P < 0.05),脓毒症处理组表现出nAChR的异质化表达;与Sham组比较,ShamA组γ-nAChR和α7-nAChR蛋白表达降低(P < 0.05);与CLP组比较,CLPA组γ-nAChR和α7-nAChR表达下降(P < 0.05,图 6)。
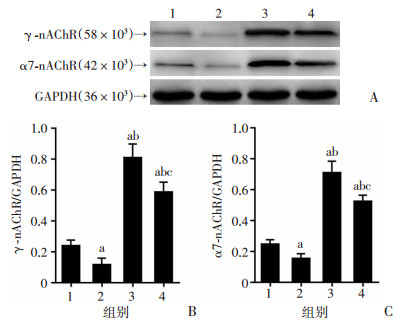
|
| A: Western blot检测; B:γ-nAChR蛋白表达;C:α7-nAChR蛋白表达1:Sham组;2:ShamA组;3:CLP组;4:CLPA组;a:P < 0.05,与Sham组比较;b:P < 0.05,与ShamA组比较;c:P < 0.05,与CLP组比较 图 6 Western blot检测各组大鼠胫前肌γ-nAChR和α7-nAChR蛋白表达 |
3 讨论
脓毒症是促炎与抗炎因素失衡导致的危及生命的免疫反应,可引起肺、心、脑和骨骼肌等功能障碍[9]。本研究采用CLP建立脓毒症模型[10]。模型处理组大鼠表现出少食、少动和对外界刺激反应差等症状,与假手术组相比,脓毒症组大鼠血浆中IL-6炎症因子水平升高,提示脓毒症模型成功建立,而外源性肌肉注射agrin对于全身炎症水平没有影响。
脓毒症导致的骨骼肌神经肌肉功能障碍在临床中多表现为全身性肌无力和感觉功能障碍。在临床及动物实验中多采用CMAP评估脓毒症导致的神经肌肉功能障碍,并以CMAP振幅下降超过正常值20%和潜伏期延长作为诊断标准[11]。研究表明在脓毒症早期24 h内即会出现CMAP潜伏期的延长和振幅的降低[12]。本课题组前期研究发现在脓毒症建模后至48 h,骨骼肌神经肌肉功能出现障碍,呈时间相关性。在本研究中,建模后注射agrin可以提高脓毒症下CMAP振幅和神经传导速度,并缩短潜伏期及动作电位时程,提示脓毒症下神经肌肉功能障碍的发生可能与神经调节因子的作用相关。
nAChR分为神经型和肌肉型两种类型,根据亚基的不同,肌肉型nAChR又可以分为成熟型和幼稚型。当运动神经元与NMJ突触后膜建立联系之后,骨骼肌突触后膜nAChR亚基在正常生理条件下只表达ε亚基。在脊髓损伤、烧伤、制动和老龄等情况下,突触后膜再度表达幼稚型和神经型nAChR[13]。异常nAChR引起神经肌肉功能改变的原因,可能是由于与成熟型nAChR相比,γ-nAChR和α7-nAChR更容易与乙酰胆碱相结合,并表现出更小的通道导电性,内向电流幅值减低,持续时间延长,从而影响骨骼肌细胞的兴奋性,造成功能学的改变[14]。本研究发现:脓毒症引起的骨骼肌nAChR的异常表达,可被外源性agrin干预后降低,提示agrin减轻脓毒症导致的神经肌肉功能障碍的机制,可能与调节nAChR相关亚基的表达有关。
神经和骨骼肌都可以分泌agrin蛋白,然而肌源性agrin因为缺少C端结合位点,不能引起突触后膜nAChR的集聚[15]。近期研究表明agrin可以修复受损的心肌细胞[16]。在部分重症肌无力的患者中发现了抗agrin抗体,表明agrin在重症肌无力的诊断与治疗中发挥着重要作用[17-18]。研究表明脓毒症情况下导致的神经肌肉功能障碍的机制复杂,可能与炎症及泛素-蛋白酶系统蛋白质降解有关。Agrin可以与肌肉特异性激酶(muscle-specific kinase,MuSK)和低密度脂蛋白受体相关蛋白4(low-density lipoprotein receptor-related protein 4, LRP4)形成的复合体结合,从而引起MuSK的磷酸化,引起下游信号通路变化,调节NMJ的稳定性并调节nAChR相关亚基的表达[19-20]。本课题组前期研究表明:脓毒症情况下产生拟去神经化现象,导致突触后膜肌细胞部分丧失来自周围神经系统的调控,突触前膜分泌的神经作用因子neurogulin-1等减少,而agrin作为突触前膜释放的重要信号分子,在拟去神经化的现象下其表达量可能受到影响,从而影响突触后膜nAChR相关亚基的表达[5, 21]。而在本研究中,外源性给予agrin后没有改变机体炎症因子水平,但可以逆转脓毒症所导致的nAChR异质化表达,而这可能与agrin通过其信号通路调控突触后膜相关蛋白表达有关。
综上所述,agrin可能通过下调γ-nAChR和α7-nAChR蛋白的表达,从而改善脓毒症情况下受损的骨骼肌神经肌肉功能。外源性使用agrin可能成为治疗脓毒症所导致的骨骼肌神经肌肉功能障碍的手段,然而仍需进一步研究其内在信号通路机制。
| [1] | HERMANS G, VAN DEN BERGHE G. Clinical review: intensive care unit acquired weakness[J]. Crit Care, 2015, 19: 274. DOI:10.1186/s13054-015-0993-7 |
| [2] | HUND E. Neurological complications of sepsis: critical illness polyneuropathy and myopathy[J]. J Neurol, 2001, 248(11): 929–934. DOI:10.1007/s004150170043 |
| [3] | MARTYN J A, FAGERLUND M J, ERIKSSON L I. Basic principles of neuromuscular transmission[J]. Anaesthesia, 2009, 64(Suppl 1): 1–9. DOI:10.1111/j.1365-2044.2008.05865.x |
| [4] | XIE F, MIN S, CHEN J Y, et al. Ulinastatin inhibited sepsis-induced spinal inflammation to alleviate peripheral neuromuscular dysfunction in an experimental rat model of neuromyopathy[J]. J Neurochem, 2017, 143(2): 225–235. DOI:10.1111/jnc.14145 |
| [5] | LIU L, XIE F, WEI K, et al. Sepsis induced denervation-like changes at the neuromuscular junction[J]. J Surg Res, 2016, 200(2): 523–532. DOI:10.1016/j.jss.2015.09.012 |
| [6] | BEZAKOVA G, RUEGG M A. New insights into the roles of agrin[J]. Nat Rev Mol Cell Biol, 2003, 4(4): 295–308. DOI:10.1038/nrm1074 |
| [7] | RIMER M, MATHIESEN I, LØMO T, et al. Gamma-AChR/epsilon-AChR switch at agrin-induced postsynaptic-like apparatus in skeletal muscle[J]. Mol Cell Neurosci, 1997, 9(4): 254–263. DOI:10.1006/mcne.1997.0622 |
| [8] | EBRAHIMI M, OSTROVIDOV S, SALEHI S, et al. Enhanced skeletal muscle formation on microfluidic spun gelatin methacryloyl (GelMA) fibres using surface patterning and agrin treatment[J]. J Tissue Eng Regen Med, 2018, 12(11): 2151–2163. DOI:10.1002/term.2738 |
| [9] | SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801–810. DOI:10.1001/jama.2016.0287 |
| [10] | RITTIRSCH D, HUBER-LANG M S, FLIERL M A, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1): 31–36. DOI:10.1038/nprot.2008.214 |
| [11] | XIE F, ZHANG F, MIN S, et al. Glial cell line-derived neurotrophic factor (GDNF) attenuates the peripheral neuromuscular dysfunction without inhibiting the activation of spinal microglia/monocyte[J]. BMC Geriatr, 2018, 18(1): 110. DOI:10.1186/s12877-018-0796-1 |
| [12] | CANKAYALI I, DOGAN Y H, SOLAK I, et al. Neuromuscular deterioration in the early stage of sepsis in rats[J]. Crit Care, 2007, 11(1): R1. DOI:10.1186/cc5139 |
| [13] | RUDOLF R, KHAN M M, LABEIT S, et al. Degeneration of neuromuscular junction in age and dystrophy[J]. Front Aging Neurosci, 2014, 6: 99. DOI:10.3389/fnagi.2014.00099 |
| [14] | JONSSON FAGERLUND M, DABROWSKI M, ERIKSSON L I. Pharmacological characteristics of the inhibition of nondepolarizing neuromuscular blocking agents at human adult muscle nicotinic acetylcholine receptor[J]. Anesthesiology, 2009, 110(6): 1244–1252. DOI:10.1097/ALN.0b013e31819fade3 |
| [15] | BEZAKOVA G, HELM J P, FRANCOLINI M, et al. Effects of purified recombinant neural and muscle agrin on skeletal muscle fibers in vivo[J]. J Cell Biol, 2001, 153(7): 1441–1452. DOI:10.1083/jcb.153.7.1441 |
| [16] | BASSAT E, MUTLAK Y E, GENZELINAKH A, et al. The extracellular matrix protein agrin promotes heart regeneration in mice[J]. Nature, 2017, 547(7662): 179–184. DOI:10.1038/nature22978 |
| [17] | GASPERI C, MELMS A, SCHOSER B, et al. Anti-agrin autoantibodies in myasthenia gravis[J]. Neurology, 2014, 82(22): 1976–1983. DOI:10.1212/WNL.0000000000000478 |
| [18] | OHNO K, OHKAWARA B, ITO M. Agrin-LRP4-MuSK signaling as a therapeutic target for myasthenia gravis and other neuromuscular disorders[J]. Expert Opin Ther Tar, 2017, 21(10): 949–958. DOI:10.1080/14728222.2017.1369960 |
| [19] | BARIK A, ZHANG B, SOHAL G S, et al. Crosstalk between agrin and wnt signaling pathways in development of vertebrate neuromuscular junction[J]. Dev Neurobiol, 2014, 74(8): 828–838. DOI:10.1002/dneu.22190 |
| [20] | YANG X, ARBER S, WILLIAM C, et al. Patterning of muscle acetylcholine receptor gene expression in the absence of motor innervation[J]. Neuron, 2001, 30(2): 399–410. DOI:10.1016/S0896-6273(01)00287-2 |
| [21] | WANG X, MIN S, XIE F, et al. Glial cell-derived neurotrophic factor alleviates sepsis-induced neuromuscular dysfunction by decreasing the expression of γ- and α7-nicotinic acetylcholine receptors in an experimental rat model of neuromyopathy[J]. Biochem Biophys Res Commun, 2018, 496(2): 260–266. DOI:10.1016/j.bbrc.2018.01.020 |



