MYH9综合征(MYH9 disorder)是指由编码非肌性肌球蛋白重链ⅡA(nonmuscle myosin heavy chain ⅡA,NMMHC-ⅡA)的MYH9基因突变引起的一种以巨大血小板、血小板减少和中性粒细胞内包涵体(MYH9三联征)为临床特征的常染色体显性遗传病[1-2]。MYH9综合征在我国的发病率小于1/100万,属于罕见病[3]。大多数MYH9综合征患者在幼年时期或成人时期,会出现其他非先天性临床表现,即感音神经性耳聋(sensorineural hearing loss,SNHL)、肾炎、白内障和/或肝酶改变[4-5]。根据临床表型的不同,MYH9综合征分为6种类型:①常染色体显性17型耳聋(MIM#603622):表现为MYH9三联征和耳聋;②巨大血小板伴随进行性感音神经性耳聋(MIM#600208):以MYH9三联征和进行性感音神经性耳聋为主要特征;③May-Hegglin异常(MHA; MIM#155100):主要特征为MYH9三联征;④Sebastian综合征(MIM#605249):则是MHA类型的一种变形,其中性粒细胞内核蛋白体随机弥散排列,而MHA为平行排列;⑤Fechtner综合征(MIM#153640):除表现为MYH9三联征外,常伴有耳聋、肾炎及白内障;⑥Epstein综合征(MIM#153650):主要特征为巨大血小板减少症、无中性粒细胞内包涵体,常伴有耳聋及肾炎。这6种类型的临床表型都可伴有或不伴有肝酶改变。目前关于MYH9综合征耳聋方面的报道较少,且其确切作用相关机制尚不清楚。耳聋是临床上常见的感觉缺陷性疾病,引起耳聋的常见病因包括环境因素和遗传因素。高通量测序技术的应用推动了耳聋致病基因的鉴定与研究,截至2018年10月,遗传性耳聋主页数据库(https://hereditaryhearingloss.org)已收录100多个遗传性耳聋基因。本研究对一个MYH9综合征家系中的2例耳聋患者进行临床检查及耳聋相关基因突变检测的研究,旨在分析该家系耳聋患者临床特征及寻找患者耳聋症状的分子遗传学基础。
1 资料与方法 1.1 家系资料的采集1个来自海南海口的MYH9综合征家系,家系中先证者(Ⅲ-1),女,44岁,自3岁起反复皮肤出血点、碰撞后易出现淤青,未予检查及治疗。2006年患者因体检发现血小板数目为60×109/L,此后多次查血小板值偏低,期间使用激素治疗无效。于2008年开始到我院门诊就诊,多次检测血小板数目波动在(45~98)×109/L,白细胞、红细胞及血红蛋白数值结果均正常,每次对其外周血涂片进行瑞-吉染色后在光镜下观察均可见巨大血小板、中性粒细胞内包涵体,该患者还伴有高脂血症、转氨酶中度升高,肝胆脾胰B超未见异常,遂考虑诊断为MYH9综合征。并于2013年由本研究团队通过Sanger测序确认该家系综合征由MYH9基因第32外显子c.G4546C:p.V1516L突变引起[6]。对家系进行详细的病史问诊和体格检查、血常规和尿常规检查、生化检查、听力学检查、瑞-吉染色和免疫荧光染色观察外周血细胞形态学。为了排除耳部器质性疾病,对2例耳聋患者进行颞骨CT扫描检查。分别抽取2例耳聋患者的外周EDTA抗凝静脉血6 mL,用于DNA的提取。本研究2017年获得中南大学湘雅医学院附属海口医院伦理审查委员会审批[2017-(伦审)-103],所有研究对象签署知情同意书。
先证者母亲(Ⅱ-1):女,67岁,自8岁起皮肤黏膜常有出血点,血小板为(24~49)×109/L,该患者具有白内障、高脂血症和转氨酶中度升高的临床表型。52岁时才出现轻度听力下降,而后随着年龄增长逐渐加重。
先证者妹妹(Ⅲ-4):女,34岁,自6岁起皮肤黏膜常有出血点、淤青,血小板为(14~38)×109/L。该患者因月经量多,引起轻-中度贫血(Hb 80~99 g/L)。23岁开始出现轻度听力下降,并随着年龄增长逐渐加重。
1.2 方法 1.2.1 听力检测方法应用丹麦Madsen MM622临床诊断型听力计完成纯音测听检查及Madsen ZO901声道阻抗测量仪完成声导抗测试,以初步了解耳聋患者的听力损失程度、中耳传导情况及病变性质。
1.2.2 耳聋表型分析按照听力损失性质的差别,分为感音神经性聋、传导性聋和混合性聋;根据发病年龄的差别,分为语前聋和语后聋;采用1980年WHO的听力分级标准,分为轻度、中度、中重度、重度、极重度和全聋;按照听力频率特征,分为以低频、中频和高频听力下降为主及全频听力下降4种类型。
1.2.3 外周血涂片瑞-吉染色和NMMHC-ⅡA免疫荧光染色① 外周血涂片瑞-吉染色:分别取家系中先证者母亲(Ⅱ-1)和健康对照个体(Ⅳ-2)EDTA外周抗凝血进行涂片,待其干燥后进行瑞-吉染色,风干,光学显微镜下观察。②外周血涂片NMMHC-ⅡA免疫荧光染色:分别取Ⅱ-1和Ⅳ-2外周血涂片晾干后,冷丙酮固定并风干;将涂片与封闭血清常温孵育30 min;滴加1 :5 000 MYH9抗体4 ℃湿盒孵育20 h;0.1 mol/L PBS冲洗数次;滴加1 :5 000 Dylight TM 488标记的山羊抗兔IgG二抗(北京中杉金桥公司)常温湿盒避光孵育20 min;0.1 mol/L PBS冲洗数次;滴加1 :500 7-AAD核染料(美国BD公司)常温避光孵育10 min;甘油封片;IX71倒置相差荧光显微镜(日本OLYMPUS公司)镜检照相分析,观察中性粒细胞胞浆NMMHC-ⅡA分布和中性粒细胞包涵体。
1.2.4 全外显子组测序应用上海生工磁珠法血液基因组DNA抽提试剂盒提取外周血DNA,将提取好的DNA部分送至广州锐博生物科技有限公司,采用Illumina测序平台PE150模式进行人类全外显子组高通量测序。在对测序获得的原始数据进行质控后获得有效数据,采用BWA软件进行序列基因比对,应用GATK软件检测变异位点,并对检测到的SNV、InDel等变异位点进行统计注释与分析。使用Annovar软件从外部数据库获取相关信息以综合分析给定序列突变的影响;根据数据分析结果,结合耳聋相关基因突变并参考Gwas Catalog、dbSNP和HGMD数据库找出致病突变,列出突变表。
1.2.5 Sanger测序验证针对高通量测序发现的可疑突变位点,通过常规PCR扩增及Sanger测序法对先证者母亲(Ⅱ-1)及妹妹(Ⅲ-4)进行突变检测和验证。采用Prime 5.0软件进行引物设计,上游引物序列为5′-TCCTTCCCCAGGGAGCTTAG-3′,下游引物序列为5′-TCTGTGATGACCCCACTCGG-3′,扩增长度356 bp;反应体系25 μL:ddH2O 10 μL,2×pfu Mix 12.5 μL,10 pmol/μL上、下游引物各1 μL,50 ng/μL模板DNA 0.5 μL;PCR反应条件:95 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,循环35次,最后72 ℃延伸10 min。使用2%琼脂糖凝胶电泳鉴定PCR扩增产物,将切胶纯化后的PCR产物进行Sanger测序。通过使用BLAST及DNAstar软件将测序所得结果与GenBank的标准序列进行比对以确定突变位点。
2 结果 2.1 家系临床资料及遗传学特征该MYH9综合征家系共4代、17人患病,系谱分析符合常染色体显性遗传特征(图 1)。该家系所有患者有MYH9三联征,临床表型复杂多样(表 1)。其中确定患有耳聋者2人(Ⅱ-1、Ⅲ-4),且2例耳聋患者还伴有贫血、高脂血症和转氨酶升高,均无明显噪声接触史、无耳鸣和眩晕、无耳毒性药物使用史和无耳部外伤史。
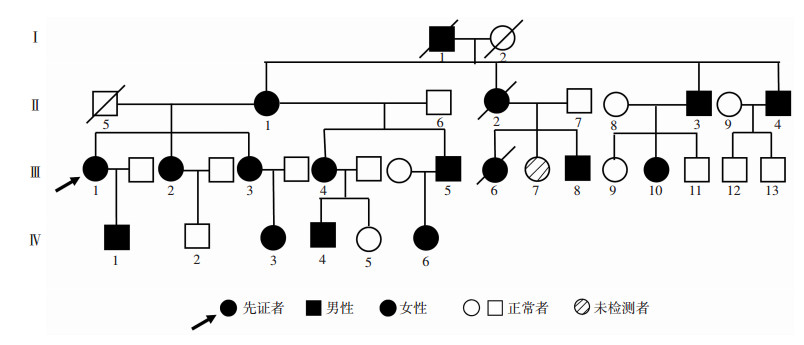
|
| (其中Ⅱ-1、Ⅲ-4为耳聋患者) 图 1 海南省MYH9综合征的家系图谱 |
| 编号 | 性别 | 年龄/岁 | 血小板计数(×10 9/L) | 肾功能损害、眼部疾病、听力损失 | 其他临床表现 |
| Ⅰ-1 | 男 | 已亡 | 41 | 鼻出血 | |
| Ⅱ-1 | 女 | 67 | 24~49 | 白内障、听力损失 | 转氨酶升高、高脂血症 |
| Ⅱ-2 | 女 | 已亡 | 34~49 | 蛋白尿1+ | |
| Ⅱ-3 | 男 | 61 | 53~79 | 心律不齐、心房早搏 | |
| Ⅱ-4 | 男 | 49 | 41~60 | ||
| Ⅲ-1 | 女 | 44 | 45~98 | 转氨酶升高、高脂血症 | |
| Ⅲ-2 | 女 | 38 | 50~75 | 双侧青少年型青光眼 | 转氨酶升高 |
| Ⅲ-3 | 女 | 36 | 73~98 | 蛋白尿1+ | 鼻出血、转氨酶升高 |
| Ⅲ-4 | 女 | 34 | 14~38 | 听力损失 | 月经量多、轻-中度贫血 |
| Ⅲ-5 | 男 | 31 | 20~64 | 蛋白尿2+ | 转氨酶升高、高脂血症 |
| Ⅲ-6 | 女 | 已亡 | 62~183 | 蛋白尿2+ | 月经量多,急性白血病(M3a) |
| Ⅲ-8 | 男 | 20 | 31~45 | ||
| Ⅱ-10 | 女 | 23 | 43~62 | 月经量多 | |
| Ⅳ-1 | 男 | 19 | 37~160 | ||
| Ⅳ-3 | 女 | 11 | 91~140 | 轻度贫血 | |
| Ⅳ-4 | 男 | 5 | 36 | ||
| Ⅳ-6 | 女 | 7 | 64 | 进行性肌营养不良 |
2.2 听力学特征
2例耳聋患者颞骨CT扫描检查均未发现中耳、内耳结构异常和内听道的占位性病变,双耳声导抗测试未见异常。该家系先证者母亲(Ⅱ-1)和妹妹(Ⅲ-4)发病年龄分别为52岁和23岁;耳聋特征为语后性、迟发型和渐进性听力下降,以中高频听力损失为主的感音神经性耳聋。Ⅱ-1纯音测听示:双耳中高频听力重度感音神经性聋,低频听力中度下降,表现为全频听力损失。左、右耳的听力曲线均呈下降型,平均听阈值分别是69、64 dB(图 2A)。Ⅲ-4纯音测听示:双耳中高频听力中度感音神经性聋,低频听力正常。左、右耳的听力曲线均呈下降型,平均听阈值分别是34、31 dB(图 2B)。
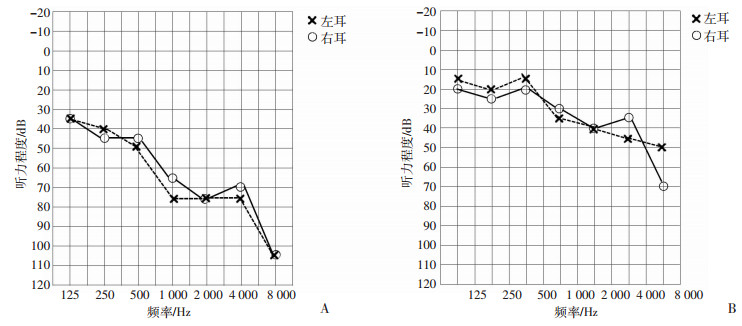
|
| A:先证者母亲(Ⅱ-1)67岁时听力图示中高频听力重度感音神经性聋,听力图特点为下降型;B:先证者妹妹(Ⅲ-4)34岁时听力图示中高频听力中度感音神经性聋,听力图特点为下降型 图 2 家系耳聋患者纯音听阈检测结果 |
2.3 实验室检测及形态学结果
光镜观察可见家系中先证者母亲(Ⅱ-1)外周血涂片中性粒细胞内包涵体和巨大血小板(图 3A);健康对照个体(Ⅳ-2)中性粒细胞和血小板正常(图 3B)。荧光显微镜观察发现Ⅱ-1中性粒细胞NMMHC-ⅡA的异常分布(图 3C);Ⅳ-2中性粒细胞NMMHC-ⅡA的分布正常(图 3D)。
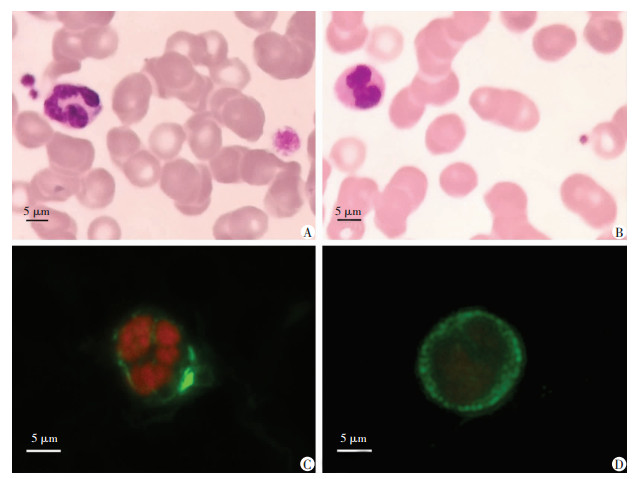
|
| A:Ⅱ-1外周血涂片瑞-吉染色示淡蓝色的中性粒细胞包涵体和巨大血小板;B:Ⅳ-2外周血涂片瑞-吉染色示正常中性粒细胞和血小板;C:Ⅱ-1免疫荧光染色示中性粒细胞胞浆中荧光呈环状分布,在细胞周边间断斑点聚集,可见中性粒细胞包涵体;D:Ⅳ-2免疫荧光染色示中性粒细胞胞浆中散点状的荧光无丛集现象 图 3 MYH9综合征患者(Ⅱ-1)和健康对照(Ⅳ-2)外周血涂片的瑞-吉染色和中性粒细胞包涵体、NMMHC-ⅡA的免疫荧光分析 |
2.4 全外显子组测序结果
采用全外显子组测序技术分别获得先证者母亲(Ⅱ-1)及妹妹(Ⅲ-4)目标区域平均测序深度为75.94X、116.68X,目标区域覆盖度为99.23%、99.42%;先证者母亲测序深度达到10X和20X以上的区域分别占芯片目标捕获区域的96.67%、92.73%,先证者妹妹分别为98.48%、97.16%,芯片对目标区域覆盖良好。通过过滤测序数据,筛选出了MYH9基因第32外显子c.G4546C:p.V1516L突变,未发现其他已知遗传性耳聋基因的致病突变(表 2),包括常染色体显性遗传和隐性遗传以及X连锁遗传等非综合征型耳聋基因,从而初步确定MYH9基因与该家系耳聋表型的相关性。
| 基因 | SNP数据库 | 突变位点 | SIFT_Pred | PolyPhen2_Pred | LRT_Pred | MutationTaster_Pred |
| MYH9 | NA | c.G4546C:p.V1516L | T | P | D | D |
| GJB2 | rs3751385 | UTR3 A > G | NA | NA | NA | NA |
| WFS1 | rs1801213 | c.C684G:p.R228R | NA | NA | NA | NA |
| MYO3A | rs3824700 | c.G956A:p.R319H | T | B | N | P |
| CCDC50 | rs2028574 | c.T773A:p.I258N | T | B | N | P |
| TECTA | rs526433 | c.G5171A:p.S1724N | T | NA | N | N |
| MYO15A | rs146754758 | c.G3658A:p.G1220R | T | B | NA | N |
| COL4A6 | rs2295912 | c.C3402T:p.A1134A | NA | NA | NA | NA |
| SIFT_Pred:SIFT数据库计算的致病性;T无致病性;PolyPhen2_Pred:PolyPhen2数据库计算的致病性;P:可能有致病性;B:无致病性;LRT_Pred:LRT数据库计算的致病性;D:有致病性;N:无致病性;MutationTaster_Pred:MutationTaster数据库计算的致病性;D:有致病性(预测);N:无致病性(预测);P:无致病性且有已知数据支持;NA:缺失值 | ||||||
2.5 Sanger测序结果
Sanger测序结果显示2例耳聋患者MYH9基因均存在c.G4546C:p.V1516L突变(图 4),从家系及基因突变分析,确定MYH9基因p.V1516L致病突变可能是引起该家系患者耳聋症状的原因。
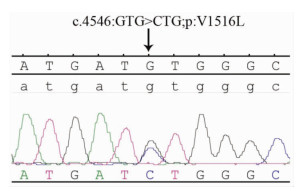
|
| 图 4 MYH9基因第32号外显子c.G4546C:p.V1516L突变位点Sanger测序图 |
3 讨论
本研究MYH9综合征家系规模大、患病人数多,所有患者具有典型的MYH9三联征。先证者母亲(Ⅱ-1)还有白内障、高脂血症、转氨酶中度升高,先证者妹妹(Ⅲ-4)由于月经量多表现出轻至中度贫血。该家系其他MYH9综合征患者部分患有青光眼、白血病、心律不齐、心房早搏、进行性肌营养不良以及不同程度的转氨酶升高、蛋白尿和高脂血症。因此,本研究MYH9综合征家系患者临床表型复杂多样,不同患者之间临床表型具有较大差异性。
听力损失是MYH9综合征最常见、发生频率最高的一种非先天性临床表现,随着年龄增长大多数患者可能出现耳聋,而且耳聋特点通常是向前进展的;对伴有严重耳聋的MYH9综合征患者进行人工耳蜗植入术,大多数患者恢复了正常的听力和语言沟通能力,无并发症发生[7-9]。迟发型听力损失发病年龄是均匀分布的,36%在20岁之前出现听力损失,33%在20~40岁出现,31%在40岁之后出现[10]。本研究先证者母亲于52岁时出现轻度听力损失,目前为双耳中高频听力重度感音神经性聋,低频听力中度损失;先证者妹妹于23岁时出现轻度听力损失,目前为双耳中高频听力中度感音神经性聋,低频听力正常;但该家系内其他患病人员听力正常。在该家系中,MYH9综合征患者出现听力损失的百分比是12%。VERVER等[11]报道一个p.R705H突变的家系,该家系共4个MYH9综合征患者,且都有耳聋表型,耳聋特征是对称性高频听力受损,然后随着年龄增长迅速进展为极重度的全频听力受损,听力损失所占百分比为100%。WASANO等[12]报道一个p.D1424N突变的家系,该家系共5个MYH9综合征患者,其中先证者和先证者父亲为耳聋患者,先证者在29岁时出现耳聋,特征为双侧中重度高频听力损失,低频和中频听力轻度损失;先证者父亲在40岁时出现耳聋,特征为高频听力受损,54岁进展为极重度耳聋;听力损失所占百分比是40%。因此,本研究家系不同患者之间听力损失表型具有差异性,与其他MYH9综合征家系患者的听力损失表型也具有差异性。
高通量测序技术包括目标区域平行测序、全外显子组测序和全基因组测序等类型。此项技术使得筛查所有耳聋相关基因变得简单、快速准确,成为耳聋基因研究和诊断的主要技术,且第二种技术对所有基因无偏倚,是一种较为全面的基因检测技术[13-14]。因此,本研究采用全外显子组测序技术对2例耳聋患者进行耳聋基因突变的检测,并应用Sanger测序对可疑突变进行验证。筛查出8个突变位点:MYH9 (c.G4546C:p.V1516L)、GJB2 (UTR3 A>G)、WFS1 (c.C684G:p.R228R)、MYO3A (c.G956A:p.R319H)、CCDC50 (c.T773A:p.I258N)、TECTA(c.G5171A:p.S1724N)、MYO15A (c.G3658A:p.G1220R)、COL4A6 (c.C3402T:p.A1134A)。根据生物信息学分析结果可知GJB2为非编码区突变,WFS1、COL4A6为同义突变,MYO3A、CCDC50、TECTA及MYO15A 为错义突变,但以上突变均不致病;而3个数据库支持MYH9基因c.G4546C:p.V1516L突变致病。但全外显子组测序技术有一定的局限性,不能有效检测出较长片段插入或缺失突变、致病突变或调控序列位于内含子上的基因以及遗漏极高GC含量的编码区基因等。
MYH9基因位于22号染色体,编码NMMHC-ⅡA;MYH9基因在人和小鼠耳蜗组织中广泛表达,尤其在毛细胞静纤毛上高度表达,通过小鼠模型推断MYH9基因突变破坏毛细胞静纤毛结构的完整性导致耳聋形成[15]。WU等[16]发现MYH9基因p.E1256K突变导致非综合征性SNHL;DANTAS等[17]报道MYH9基因p.R705H突变为DFNA17型耳聋的致病基因;VERVER等[11]确认MYH9基因p.R705H突变引起的DFNA17不仅是一种常染色体显性非综合征型聋,还是MYH9综合征不同表型中的一种类型。
本研究2例患者耳聋特征是语后性、迟发型和渐进性听力下降,以中高频听力损失为主的感音神经性耳聋。耳聋特点不同于VERVER和WASANO等[11-12]报道的MYH9综合征家系,可能与突变位点不同有关。同时与其他遗传性耳聋基因引起的耳聋特点也有差别,例如:GJB2是国内引起遗传性耳聋最常见的基因,耳聋大部分表现为语前聋、双侧对称性重度耳聋,小部分则与发病年龄相关[18];CCDC50突变主要影响低频及中频听力[19]。进一步证实GJB2非编码区突变和CCDC50 c.T773A:p.I258N突变不引起本家系耳聋症状。结合家系耳聋患者临床特征和基因突变结果分析,该家系患者耳聋表型可能与MYH9致病突变p.V1516L相关。
本研究不足之处在于2例耳聋患者开始出现听力损失时未对其进行详细的听力检测,因而前后不能进行明确对比来确定听力损失起病、进展情况。目前MYH9基因突变导致耳聋的分子机制尚缺乏直接证据,后续我们将继续随访研究该家系,为深入探索耳聋遗传学机制及研究MYH9综合征家系耳聋患者临床特点提供理论基础。
综上所述,本研究运用全外显子组测序技术鉴定了该家系耳聋表型的可能致病基因,为耳聋患者的遗传咨询工作提供基因方面的依据,为产前诊断和基因治疗等临床应用奠定基础。
| [1] | KELLEY M J, JAWIEN W, ORTEL T L, et al. Mutation of MYH9, encoding non-muscle myosin heavy chain A, in May-Hegglin anomaly[J]. Nat Genet, 2000, 26(1): 106–108. DOI:10.1038/79069 |
| [2] | KUNISHIMA S, KOJIMA T, MATSUSHITA T, et al. Mutations in the NMMHC-A gene cause autosomal dominant macrothrombocytopenia with leukocyte inclusions (May-Hegglin anomaly/Sebastian syndrome)[J]. Blood, 2001, 97(4): 1147–1149. DOI:10.5050/KSNVE.2010.20.12.1153 |
| [3] |
石理华, 刘乾, 刘沙, 等. 我国部分汉族人群MYH9多态性与终末期肾病的关联研究[J].
中国免疫学杂志, 2016, 32(1): 79–82, 89.
SHI L H, LIU Q, LIU S, et al. Association of MYH9 SNPs with end-stage renal disease in Chinese Han population[J]. Chin J Immunol, 2016, 32(1): 79–82, 89. DOI:10.3969/j.issn.1000-484X.2016.01.017 |
| [4] | PECCI A, BⅡNO G, FIERRO T, et al. Alteration of liver enzymes is a feature of the MYH9-related disease syndrome[J]. PLoS ONE, 2012, 7(4): e35986. DOI:10.1371/journal.pone.0035986 |
| [5] | PECCI A, MA X F, SAVOIA A, et al. MYH9: Structure, functions and role of non-muscle myosin ⅡA in human disease[J]. Gene, 2018, 664: 152–167. DOI:10.1016/j.gene.2018.04.048 |
| [6] | ZHANG S F, ZHOU X Y, LIU S N, et al. MYH9-related disease: description of a large Chinese pedigree and a survey of reported mutations[J]. Acta Haematol, 2014, 132(2): 193–198. DOI:10.1159/000356681 |
| [7] | PECCI A, VERVER E J, SCHLEGEL N, et al. Cochlear implantation is safe and effective in patients with MYH9-related disease[J]. Orphanet J Rare Dis, 2014, 9: 100. DOI:10.1186/1750-1172-9-100 |
| [8] | CANZI P, PECCI A, MANFRIN M, et al. Severe to profound deafness may be associated with MYH9-related disease: report of 4 patients[J]. Acta Otorhinolaryngol Ital, 2016, 36(5): 415–420. DOI:10.14639/0392-100X-702 |
| [9] | VERVER E J, TOPSAKAL V, KUNST H P, et al. Nonmuscle myosin heavy chain ⅡA mutation predicts severity and progression of sensorineural hearing loss in patients with MYH9-related disease[J]. Ear Hear, 2016, 37(1): 112–120. DOI:10.1097/AUD.0000000000000198 |
| [10] | PECCI A, KLERSY C, GRESELE P, et al. MYH9-related disease: A novel prognostic model to predict the clinical evolution of the disease based on genotype-phenotype correlations[J]. Hum Mutat, 2014, 35(2): 236–247. DOI:10.1002/humu.22476 |
| [11] | VERVER E, PECCI A, DE ROCCO D, et al. R705H mutation of MYH9 is associated with MYH9-related disease and not only with non-syndromic deafness DFNA17[J]. Clin Genet, 2015, 88(1): 85–89. DOI:10.1111/cge.12438 |
| [12] | WASANO K, MATSUNAGA T, OGAWA K, et al. Late onset and high-frequency dominant hearing loss in a family with MYH9 disorder[J]. Eur Arch Otorhinolaryngol, 2016, 273(11): 3547–3552. DOI:10.1007/s00405-016-3954-0 |
| [13] | WEI Q J, ZHU H M, QIAN X L, et al. Targeted genomic capture and massively parallel sequencing to identify novel variants causing Chinese hereditary hearing loss[J]. J Transl Med, 2014, 12: 311. DOI:10.1186/s12967-014-0311-1 |
| [14] | WANG C C, YUAN H J. Application and progress of high-throughput sequencing technologies in the research of hereditary hearing loss[J]. Hereditas, 2017, 39(3): 208–219. DOI:10.16288/j.yczz.16-376 |
| [15] | EBRAHIM S, FUJITA T, MILLIS B A, et al. NMⅡ forms a contractile transcellular sarcomeric network to regulate apical cell junctions and tissue geometry[J]. Curr Biol, 2013, 23(8): 731–736. DOI:10.1016/j.cub.2013.03.039 |
| [16] | WU C C, LIN Y H, LU Y C, et al. Application of massively parallel sequencing to genetic diagnosis in multiplex families with idiopathic sensorineural hearing impairment[J]. PLoS ONE, 2013, 8(2): e57369. DOI:10.1371/journal.pone.0057369 |
| [17] | DANTAS V G, LEZIROVITZ K, YAMAMOTO G L, et al. c.G2114A MYH9 mutation (DFNA17) causes non-syndromic autosomal dominant hearing loss in a Brazilian family[J]. Genet Mol Biol, 2014, 37(4): 616–621. DOI:10.1590/S1415-47572014005000025 |
| [18] | KECSKEMÉTI N, SZÖNYI M, GÁBORJÁN A, et al. Analysis of GJB2 mutations and the clinical manifestation in a large Hungarian cohort[J]. Eur Arch Otorhinolaryngol, 2018, 275(10): 2441–2448. DOI:10.1007/s00405-018-5083-4 |
| [19] | XIA W J, LIU F, MA D. Research progress in pathogenic genes of hereditary non-syndromic mid-frequency deafness[J]. Front Med, 2016, 10(2): 137–142. DOI:10.1007/s11684-016-0449-8 |



