2. 400014 重庆,重庆医科大学附属儿童医院:儿童发育疾病研究省部共建教育部重点实验室,儿科学重庆市重点实验室,重庆市儿童发育重大疾病诊治与预防国际科技合作基地
2. Key Laboratory of Child Development and Disorders Cofounded by Chongqing and Ministry of Education, Chongqing Key Laboratory of Pediatrics, Chongqing International Science and Technology Cooperation Center for Child Development and Disorders, Children's Hospital, Chongqing Medical University, Chongqing, 400014, China
干细胞具有自我更新及多向分化潜能,已被广泛应用于再生医学和肿瘤治疗等多个领域的研究中[1-2]。干细胞移植后瘤变是干细胞基础研究临床应用转化的重大阻碍之一[3-4]。因此,有必要利用影像学方法对干细胞进行监测以便及时发现瘤变并采取干预措施。PEG3(progression elevated gene-3)是一种广谱的肿瘤特异性基因,在人癌细胞系中明显高表达,而在正常组织细胞中极少表达[5]。本研究通过构建肿瘤特异性PEG3启动子控制磁共振成像(MRI)报告基因铁蛋白重链(ferritin heavy chain, FTH1)表达的慢病毒载体,并感染大鼠骨髓间充质干细胞(mesenchymal stem cells, MSCs),用间接共培养法诱导MSCs瘤变,检测MSCs诱导前后FTH1基因表达及MRI信号改变,探讨利用PEG3启动子控制的MRI报告基因在干细胞瘤变过程中特异性表达的可行性,为干细胞瘤变的早期监测提供一种新的影像学策略。
1 材料与方法 1.1 材料4周龄SD大鼠,体质量约100 g,10%水合氯醛溶液(0.3 mL/100 g)深度麻醉后剥离股骨,冲洗骨髓腔得到骨髓细胞,采用细胞贴壁筛选法得到原代MSCs[6-8]。大鼠脑胶质瘤细胞株(C6)由儿科学重庆市重点实验室提供;PEG3启动子、FTH1基因、慢病毒载体及包装系统由汉恒生物有限公司合成;胎牛血清及DF12培养基购自美国Gibco公司;枸橼酸铁铵(ferri ammonii citras, FAC)购自美国Sigma公司,普鲁士蓝染色试剂盒购自北京天根生物有限公司,细胞流式抗体PE control、FITC control、CD29、CD34、CD45、CD90购自美国BD公司,FTH1抗体购自美国Cell Signaling Technology公司,β-actin抗体购自Poteintech公司,CCK-8购自日本同仁化学研究所。
1.2 方法 1.2.1 细胞培养MSCs、C6细胞接种于含10%胎牛血清(FBS)DF12培养基中,37 ℃、5%CO2、95%湿度条件下培养,待细胞融合度达90%,0.25%胰酶消化并按1 :3传代。
1.2.2 病毒构建及感染PEG3启动子、FTH1基因(汉恒生物有限公司合成)与载体pHBLV-CMV-MCS-3flag-EF1-ZSgreen-puro通过酶切、扩增、连接得到pHBLV-PEG3-FTH1-3flag-EF1-ZSgreen-puro,测序鉴定构建成功后与质粒pSPAX2、pMD2G同时感染293T细胞,于感染后48、72 h分别收集病毒液,离心得到病毒并标记为PEG3-FTH1-LV,病毒分装后-80 ℃保存。同时构建CMV-FTH1-LV作为阳性对照,并将未感染病毒的MSCs作为阴性对照组。待MSCs细胞融合度达30%~40%时,以MOI 20、polybrene 4 μg/mL的无血清培养基感染,24 h后更换为新鲜10%FBS培养基,感染48 h后荧光显微镜下观察绿色荧光蛋白表达。细胞融合度达80%时加入2 μg/mL嘌呤霉素筛选7 d,1 μg/mL嘌呤霉素筛选3 d,构建稳定表达株MSCs-PEG3-FTH1、MSCs-CMV-FTH1,期间每3~4天更换1次培养基。
1.2.3 诱导瘤变用MSCs相同培养基培养大鼠脑胶质瘤细胞C6 24 h后收集培养基,并以0.4 μm滤器过滤后,按1 :1加入新鲜培养基分别培养MSCs、MSCs-PEG3-FTH1、MSCs-CMV-FTH1细胞,每天更换培养基,持续诱导2周后,细胞标记为TMSCs、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1。
1.2.4 流式细胞仪检测MSCs及TMSCs细胞胰酶消化后制成100 μL含106个细胞的悬液,小鼠血清封闭20 min,PBS洗涤,加入小鼠抗大鼠PE control、FITC control、PE-CD29、FITC-CD45、PE-CD34、FITC-CD90单克隆抗体(200×g离心5 min后使用)常温孵育30 min,PBS洗涤后进行流式细胞仪检测。
1.2.5 CCK-8检测将MSCs、MSCs-PEG3-FTH1、MSCs-CMV-FTH1、TMSCs、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1 6种细胞分别以103/mL初始密度接种于96孔板内,设置5个复孔,24 h后每孔加100 μL含有10% CCK-8无血清培养基孵育4 h,使用酶标仪在450 nm波长处检测各孔光密度值[D(450)],连续检测6 d,绘制细胞增殖曲线。
1.2.6 细胞迁移实验使用100~150 μL无血清培养基,将105个如1.2.5所述6种细胞分别接种于孔径为8 μm的Transwell小室上层,小室下层加入600~800 μL含20% FBS的DF12培养基,常规培养12 h后,PBS洗涤2遍,4%多聚甲醛固定30 min,结晶紫染色1 h,棉签擦掉上层细胞后,显微镜观察并计数9个视野细胞数。
1.2.7 裸鼠成瘤实验将至少2×106个MSCs、MSCs-PEG3-FTH1、MSCs-CMV-FTH1、TMSCs、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1细胞分别接种到裸鼠颈背部皮下,每组3只。于种植后第1、2、3、4周观察裸鼠种植部位成瘤情况,记录肿瘤组织直径大小,制作肿瘤组织生长曲线,并于第4周取出肿瘤组织,HE染色后显微镜观察。
1.2.8 Western blot检测细胞分组如1.2.7所述,胰酶消化收集各组细胞,提取全蛋白,-80 ℃保存备用,BCA法检测蛋白含量,电泳,转膜,封闭,FTH1抗体(1 :1 000)、β-actin(1 :1 000)孵育过夜,二抗室温孵育1 h,凝胶成像系统显影获取图像。
1.2.9 MRI观察各组细胞(约5×106个)经0.5 mmol/L FAC处理72 h, PBS洗涤3次,收集细胞,待细胞自然沉淀后行3.0 T MRI(荷兰Ingenia, Philips)自旋回波(SE)T2WI扫描。检测参数如下:FOV(FH=100 mm, RL=100 mm, AP=10 mm),层厚=0.5 mm,层间距=0.2 mm,TR=2 200 ms, TE=80 ms。
1.2.10 普鲁士蓝染色含0.5 mmol/L FAC培养基培养细胞72 h,消化细胞并制备细胞爬片,待细胞贴壁后, PBS洗涤3次,4%多聚甲醛固定30 min,PBS洗涤,普鲁士蓝染试剂A1、A2等比例混合,加入500 μL混合液染色15~ 30 min,ddH2O洗涤2次,加入500 μL普鲁士蓝染试剂B,染色5~30 min,ddH2O洗涤并迅速擦干,中性树脂封片,光学显微镜观察拍照。
1.2.11 透射电镜观察106个细胞经0.5 mmol/L FAC处理72 h,洗涤3次收集细胞,离心弃上清,2.5%戊二醛固定,4 ℃保存,电镜室制片、染色、脱水、封片拍照。
1.3 统计学分析数据以x ±s表示。采用GraphPad Prism 5.01软件进行数据分析。多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 MSCs鉴定及TMSCs瘤变评估 2.1.1 MSCs诱导前后形态学改变镜下观察原代细胞呈梭形或三角形,旋涡状生长,TMSCs细胞体积较MSCs小, 呈长梭形,细胞排列混乱(图 1)。

|
| A:MSCs;B:MSCs-PEG3-FTH1;C:MSCs-CMV-FTH1;D:TMSCs;E:TMSCs-PEG3-FTH1;F:TMSCs-CMV-FTH1 图 1 MSCs诱导前后细胞形态变化 |
2.1.2 MSCs诱导前后表面抗原表达
MSCs细胞表面抗原CD29、CD34、CD45、CD90表达率分别为99.90%、0.43%、1.57%、99.80%,表明成功分离出原代MSCs。TMSCs细胞表面抗原CD29、CD34、CD45、CD90表达率分别为100.00%、1.38%、19.10%、16.80%,较诱导前CD34、CD45表达升高,CD90表达降低(P < 0.05,图 2)。
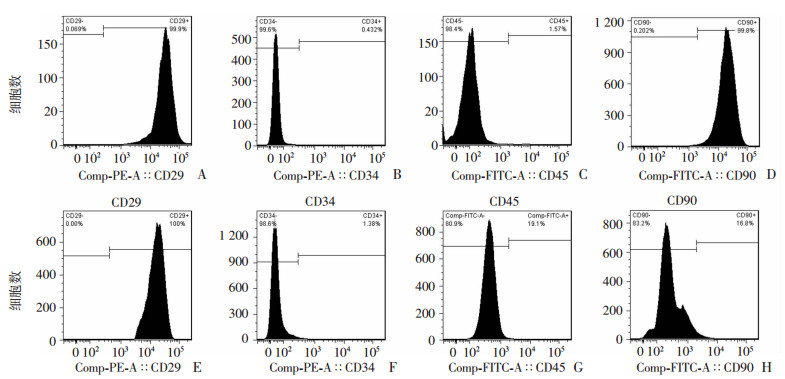
|
| A~D:分别为MSCs细胞表面抗原CD29、CD34、CD45和CD90表达;E~H:分别为TMSCs细胞表面抗原CD29、CD34、CD45和CD90表达 图 2 流式细胞仪检测MSCs诱导前后细胞表面抗原表达 |
2.1.3 MSCs诱导前后细胞迁移率及增殖率
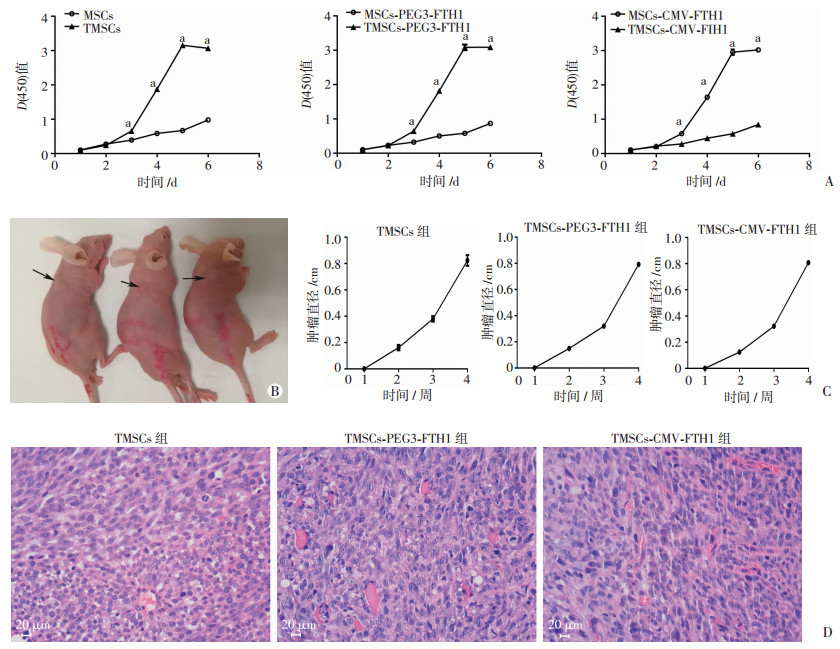
CCK-8检测结果显示:诱导后较诱导前细胞增殖速度加快,符合肿瘤细胞特点,细胞增殖曲线见图 3A。细胞迁移计数结果显示:MSCs、MSCs-PEG3-FTH1、MSCs-CMV-FTH1、TMSCs、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1细胞迁移率分别为(0.563±0.009)%、(0.050±0.008)%、(0.497±0.009)%、(0.110±0.013)%、(0.104± 0.010)%和(0.105±0.013)%,表明穿过小孔运动到小室下层的TMSCs较MSCs多(P < 0.05)。
|
| A:细胞增殖曲线a: P < 0.05, 与同时间点对照细胞比较;B:裸鼠皮下成瘤实验从左至右分别为TMSCs、TMSCs-CMV-FTH1、TMSCs-PEG3-FTH1组;箭头示皮下肿瘤;C:肿瘤生长曲线;D:肿瘤组织HE染色观察 图 3 MSCs诱导后瘤变评估 |
2.1.4 裸鼠成瘤实验
TMSCs、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1组细胞均于裸鼠皮下种植2周后有皮下肿瘤形成(图 3B),而MSCs、MSCs-PEG3-FTH1、MSCs-CMV-FTH1组于种植后2个月均未发现有皮下肿瘤形成,各组瘤块生长曲线见图 3C,肿瘤组织HE染色显微镜观察见图 3D。
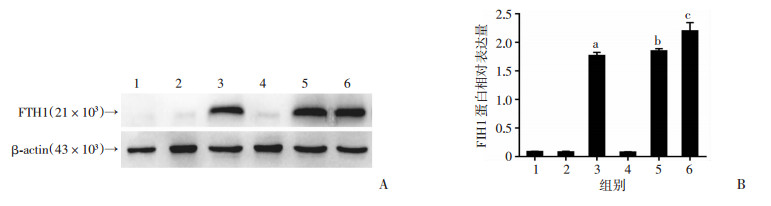
2.2 MSCs诱导前后FTH1报告基因表达Western blot检测结果显示:FTH1在MSCs、MSCs-PEG3-FTH1、TMSCs组未见明显表达,在MSCs-CMV-FTH1、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1组均显著表达(P < 0.05, 图 4)。
|
| A:Western blot检测;B:半定量分析1:MSCs组;2:MSCs-PEG3-FTH1组;3:MSCs-CMV-FTH1组;4:TMSCs组;5:TMSCs-PEG3-FTH1组;6:TMSCs-CMV-FTH1组;a: P < 0.05,与MSCs组比较;b: P < 0.05,与MSCs-PEG3-FTH1组比较; c: P < 0.05,与TMSCs组比较 图 4 Western blot检测各组细胞FTH1蛋白表达 |
2.3 MSCs诱导前后MRI信号变化
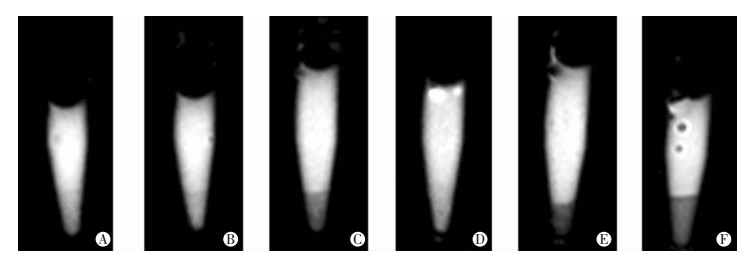
MRI扫描结果显示:MSCs-CMV-FTH1、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1组细胞在T2WI图像的信号明显较MSCs、MSCs-PEG3-FTH1、TMSCs组信号低(图 5)。
|
| A:MSCs组;B:MSCs-PEG3-FTH1组;C:MSCs-CMV-FTH1组;D:TMSCs组;E:TMSCs-PEG3-FTH1组;F:TMSCs-CMV-FTH1组 图 5 MRI观察各组细胞在T2WI上信号的变化 |
2.4 MSCs诱导前后转铁效应
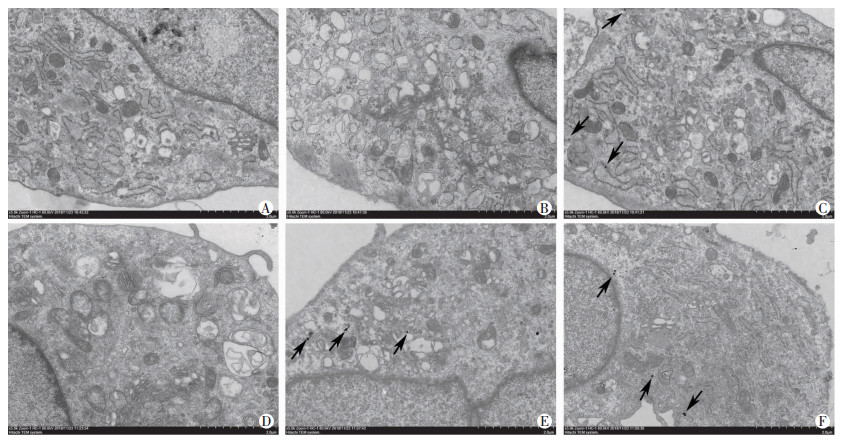
普鲁士蓝染色显示:MSCs-CMV-FTH1、TMSCs-PEG3-FTH1、TMSCs-CMV-FTH1组细胞内均可见蓝染的铁颗粒,而MSCs、MSCs-PEG3-FTH1、TMSCs组未观察到蓝染铁颗粒(图 6)。细胞透射电镜观察结果显示:MSCs-CMV-FTH1、TMSCs-PEG3-FTH1、TMSCs-CMV- FTH1组细胞内存在黑色铁粒,而MSCs、MSCs- PEG3-FTH1、TMSCs组细胞内无黑色铁颗粒(图 7)。

|
| A:MSCs组;B:MSCs-PEG3-FTH1组;C:MSCs-CMV-FTH1组;D:TMSCs组;E:TMSCs-PEG3-FTH1组;F:TMSCs-CMV-FTH1组箭头示细胞内铁颗粒 图 6 普鲁士蓝染色观察各组细胞内转铁效应 |
|
| A:MSCs组;B:MSCs-PEG3-FTH1组;C:MSCs-CMV-FTH1组;D:TMSCs组;E:TMSCs-PEG3-FTH1组;F:TMSCs-CMV-FTH1组箭头示细胞内铁颗粒 图 7 透射电镜观察各组细胞内铁颗粒(×5 000) |
3 讨论
目前对干细胞瘤变的影像学观察多局限于形态学成像,要想在分子水平上早期检出瘤变细胞,需借助报告基因以及能够驱动报告基因表达的组织特异性启动子。PEG3是一种来源于啮齿动物的能够介导肿瘤进展的基因,该基因在人类大部分不同组织结构的肿瘤中特异性表达;已有研究证实PEG3启动子可以驱动荧光素酶基因在肿瘤细胞表达[9-10],说明PEG3启动子具有驱动下游基因在肿瘤组织或细胞内特异性表达的能力。本研究将肿瘤特异性启动子与MRI报告基因相结合,成功构建了PEG3启动子驱动报告基因FTH1表达的慢病毒载体,并将其转入MSCs,通过诱导干细胞瘤变过程中PEG3启动子自动活化,来驱动MRI报告基因FTH1表达并在细胞内聚铁形成MRI图像信号差异,从而利用MRI信号变化来判断干细胞是否发生瘤变。本研究实现了MRI报告基因的自动开关功能,即在干细胞内报告基因保持沉默,而在细胞瘤变时报告基因开启表达,在体外证实了利用MRI报告基因成像监测干细胞瘤变的可行性,为进行体内干细胞移植后瘤变的影像学示踪奠定了基础。
本研究采用MSCs与C6细胞间接共培养法构建体外干细胞瘤变模型(TMSCs)。诱导前MSCs细胞呈鱼群样生长且阳性表达CD29、CD90,阴性表达CD34、CD45,表明成功分离培养出MSCs细胞[11];间接共培养2周后发现细胞形态变小,细胞增殖加快,迁移能力增加以及裸鼠皮下成瘤实验阳性均提示肿瘤微环境诱导干细胞瘤变,这些结果与文献[12-13]的研究结果类似。本研究还发现:与MSCs细胞比较,TMSCs细胞表面抗原CD34、CD45表达不同程度上调,而CD90表达明显下调。CD34是内皮激活标志物,在肿瘤血管形成中扮演重要角色[14-15];CD45是分化表面标志物,在干细胞不表达[16-17];糖基磷脂酰肌醇(gpi)-锚定糖蛋白CD90参与细胞干性维持,被证实在多种来源的间充质干细胞及肿瘤干细胞高表达[18-19]。MORAES等[20]研究表明降低MSCs的CD90表达可增加细胞的分化。以上无论是细胞形态学,还是细胞的增殖和迁移能力、细胞表面标志物的改变以及细胞裸鼠皮下成瘤实验,都不同程度地说明TMSCs细胞已经恶性分化。
Western blot检测结果显示:TMSCs-PEG3-FTH1细胞内FTH1表达较MSCs-PEG3-FTH1细胞明显上调,说明在MSCs-PEG3-FTH1瘤变为TMSCs-PEG3-FTH1的过程中,PEG3启动子活化并驱动了FTH1表达。同时,细胞普鲁士蓝染色及透射电镜观察结果均显示:经0.5 mmol/L FAC作用72 h后,TMSCs-PEG3-FTH1、MSCs-CMV-FTH1、TMSCs-CMV-FTH1细胞中铁颗粒明显多于MSCs、MSCs-PEG3-FTH1、TMSCs细胞,表明FTH1表达具有胞内聚铁作用。MRI成像显示:TMSCs-PEG3-FTH1细胞较MSCs-PEG3-FTH1和TMSCs细胞T2信号降低,说明PEG3启动子在TMSCs细胞内驱动FTH1表达,并在胞内聚铁引起MRI信号改变。以上结果表明:利用肿瘤特异性PEG3启动子控制报告基因FTH1在干细胞瘤变时特异性表达并使用MRI进行监测是可行的。本研究在细胞水平上利用影像学方法实现了干细胞瘤变的早期检出,这将有助于提高干细胞移植的安全性,对干细胞临床转化应用具有重要价值。
由于MSCs瘤变具有不确定性,本研究利用间接共培养法诱导干细胞瘤变。这种方法仅局限于体外实验,不能真实模拟干细胞移植后的自然瘤变过程,是本研究存在的主要缺陷之一。利用肿瘤特异性启动子驱动MRI报告基因表达的方法对不同种类干细胞在体内的自然瘤变进行纵向活体监测,将是我们进一步研究的目标。
| [1] | LITWINOWICZ R, KAPELAK B, SADOWSKI J, et al. The use of stem cells in ischemic heart disease treatment[J]. Kardiochir Torakochirurgia Pol, 2018, 15(3): 196–199. DOI:10.5114/kitp.2018.78446 |
| [2] | BŁOGOWSKI W, BODNARCZUK T, STARZYÑSKA T. Concise review: pancreatic cancer and bone marrow-derived stem cells[J]. Stem Cells Transl Med, 2016, 5(7): 938–945. DOI:10.5966/sctm.2015-0291 |
| [3] | KATSUKAWA M, NAKAJIMA Y, FUKUMOTO A, et al. Fail-safe therapy by gamma-ray irradiation against tumor formation by human-induced pluripotent stem cell-derived neural progenitors[J]. Stem Cells Dev, 2016, 25(11): 815–825. DOI:10.1089/scd.2015.0394 |
| [4] | CLÉMENT F, GROCKOWIAK E, ZYLBERSZTEJN F, et al. Stem cell manipulation, gene therapy and the risk of cancer stem cell emergence[J]. Stem Cell Invest, 2017, 4: 67. DOI:10.21037/sci.2017.07.03 |
| [5] | SU Z Z, SARKAR D, EMDAD L, et al. Targeting gene expression selectively in cancer cells by using the progression-elevated gene-3 promoter[J]. Proc Natl Acad Sci U S A, 2005, 102(4): 1059–1064. DOI:10.1073/pnas.0409141102 |
| [6] |
刘慧娟, 胡若愚, 戴王娟, 等. 绿色荧光蛋白转基因大鼠骨髓间充质干细胞培养及鉴定[J].
中国医学科学院学报, 2016, 38(1): 9–15.
LIU H J, HU R Y, DAI W J, et al. Culture and identification of bone marrow mesenchymal stem cells from enhanced green fluorescent protein-transgenic rats[J]. Acta Acad Med Sin, 2016, 38(1): 9–15. DOI:10.3881/j.issn.1000-503X.2016.01.002 |
| [7] | LI X Y, ZHANG Y, QI G X. Evaluation of isolation methods and culture conditions for rat bone marrow mesenchymal stem cells[J]. Cytotechnology, 2013, 65(3): 323–334. DOI:10.1007/s10616-012-9497-3 |
| [8] |
廖一凡, 蔡金华, 钟毅, 等. NSE启动子在骨髓间充质干细胞成神经分化中启动FTH1基因特异性表达及体外磁共振成像[J].
第三军医大学学报, 2018, 40(13): 1171–1178.
LIAO Y F, CAI J H, ZHONG Y, et al. Specific expression and in vitro magnetic resonance imaging of NSE-promoter in initiating FTH1 gene during neural differentiation of bone marrow mesenchymal stem cells[J]. J Third Mil Med Univ, 2018, 40(13): 1171–1178. DOI:10.16016/j.1000-5404.201712135 |
| [9] | BHANG H E, GABRIELSON K L, LATERRA J, et al. Tumor-specific imaging through progression elevated gene-3 promoter-driven gene expression[J]. Nat Med, 2011, 17(1): 123–129. DOI:10.1038/nm.2269 |
| [10] | CHAN I, LEBEDEVA I V, SU Z Z, et al. Progression elevated gene-3 promoter (PEG-Prom) confers cancer cell selectivity to human polynucleotide phosphorylase (hPNPase(old-35))-mediated growth suppression[J]. J Cell Physiol, 2008, 215(2): 401–409. DOI:10.1002/jcp.21320 |
| [11] | SONG K, HUANG M Q, SHI Q, et al. Cultivation and identification of rat bone marrow-derived mesenchymal stem cells[J]. Mol Med Rep, 2014, 10(2): 755–760. DOI:10.3892/mmr.2014.2264 |
| [12] | TAN B, SHEN L J, YANG K, et al. C6 glioma-conditioned medium induces malignant transformation of mesenchymal stem cells: Possible role of S100B/RAGE pathway[J]. Biochem Biophys Res Commun, 2018, 495(1): 78–85. DOI:10.1016/j.bbrc.2017.10.071 |
| [13] | CARETTI V, SEWING A C, LAGERWEIJ T, et al. Human pontine glioma cells can induce murine tumors[J]. Acta Neuropathol, 2014, 127(6): 897–909. DOI:10.1007/s00401-014-1272-4 |
| [14] | KONG X Y, GUAN J, MA W B, et al. CD34 over-expression is associated with gliomas' higher WHO grade[J]. Medicine (Baltimore), 2016, 95(7): e2830. DOI:10.1097/MD.0000000000002830 |
| [15] | Transcriptional gene silencing limits CXCR4-associated depletion of bone marrow CD34+ cells in HIV-1 infection: Erratum[J]. AIDS, 2018, 32(18): 2857–2858. DOI:10.1097/01.aids.0000547984.16868.93 |
| [16] | MILDMAY-WHITE A, KHAN W. Cell surface markers on adipose-derived stem cells: a systematic review[J]. Curr Stem Cell Res Ther, 2017, 12(6): 484–492. DOI:10.2174/1574888X11666160429122133 |
| [17] | KOBOLAK J, DINNYES A, MEMIC A, et al. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche[J]. Methods, 2016, 99: 62–68. DOI:10.1016/j.ymeth.2015.09.016 |
| [18] | AVRIL T, ETCHEVERRY A, PINEAU R, et al. CD90 expression controls migration and predicts dasatinib response in glioblastoma[J]. Clin Cancer Res, 2017, 23(23): 7360–7374. DOI:10.1158/1078-0432.CCR-17-1549 |
| [19] | SUKOWATI C H, ANFUSO B, TORRE G, et al. The expression of CD90/Thy-1 in hepatocellular carcinoma: an in vivo and in vitro study[J]. PLoS ONE, 2013, 8(10): e76830. DOI:10.1371/journal.pone.0076830 |
| [20] | MORAES D A, SIBOV T T, PAVON L F, et al. A reduction in CD90 (THY-1) expression results in increased differentiation of mesenchymal stromal cells[J]. Stem Cell Res Ther, 2016, 7(1): 97. DOI:10.1186/s13287-016-0359-3 |



