肺大细胞神经内分泌癌(pulmonary large cell neuroendocrine carcinoma,PLCNEC)是一种罕见的肿瘤,发病率仅占肺部肿瘤的3%左右[1]。2004年,PLCNEC被世界卫生组织(WHO)归为肺大细胞癌的亚型,在2015年则与小细胞肺癌、肺类癌一起被归为肺部神经内分泌肿瘤[2-3]。
PLCNEC发病率近十余年逐渐上升[2, 4],其侵袭性较强,是一种表现为神经内分泌形态的低分化或未分化的肺部恶性肿瘤,其病理特征与小细胞肺癌类似,常表现为大面积坏死和较高有丝分裂率[5-6]。在一个小样本(n=45)研究中,通过分析组织靶向高通量测序结果发现:18个样本具有小细胞肺癌基因特征,25个样本具有非小细胞肺癌基因特征,还有2个样本具有类癌基因特征[7],表明PLCNEC是一种异质性较高的肿瘤。目前,由于PLCNEC发生率较低,相应的队列研究都是小样本研究,对PLCNEC的认识有限。因此,本研究基于监测、流行病学和结果数据库(Surveillance, Epidemiology, and End Results,SEER)大样本,分析PLCNEC的临床特征及生存情况,探讨与预后相关的临床特征,并利用与预后相关的临床特征来建立可视化的预测患者预后的列线图(nomogram)模型。
1 资料与方法 1.1 研究对象资料来自美国SEER数据库(http://seer.cancer.gov/),该数据库收录了1973-2015年美国约27.8%的癌症患者的临床信息,最近一次更新时间是2017年11月。本研究利用SEER * Stat软件(version 8.3.5)选取2004-2013年的PLCNEC患者作为研究对象(2004年以后登记的临床信息更详细,且保证至少2年的随访时间),选取的限制条件如下:“肺和支气管”为原发部位,诊断时间为“2004-2013”,组织学代码为“8013”、“病理学确认诊断”、“仅有1个原发性肿瘤”。临床信息获取包括性别、诊断年龄、种族、肿瘤部位、基线肿瘤长径、肿瘤扩散、手术治疗、放射治疗、化疗等。初步获取数据后,再进一步剔除信息不全的病例,最终共1 656例患者纳入分析。
1.2 方法采用Kaplan-Meier法绘制生存曲线并进行生存分析, 总生存期(overall survival,OS)定义为从诊断到因任何原因死亡的时间,末次随访时间为2015年12月31日。使用Cox比例风险模型探索OS与临床特征的关系,多因素分析得到风险比(hazard ratios, HR)及相应95%置信区间(95% confident interval, 95%CI)。利用与OS相关的临床特征建立可视化列线图模型,该预后模型的区分度(discrimination)以C-index反映,校准度(calibration)采用重复抽样(每次抽样200例,重复1 000次)的方法验证。
采用双侧检验,P < 0.05为差异有统计学意义。生存分析及Cox比例风险模型多因素分析使用SPSS 21.0统计软件,可视化列线图模型的建立、C-index计算及重复抽样验证使用R软件(version3.4.4)。
2 结果 2.1 患者临床特征初步筛选出2004-2013年诊断为PLCNEC的患者2 108例,剔除无手术信息患者5例,无基线肿瘤长径信息患者410例,无肿瘤扩散信息患者3例,无肿瘤部位信息患者34例,最终共1 656例患者纳入分析。
年龄分组按照国际标准分为老年组(≥65岁)及非老年组(<65岁),基线肿瘤长径分组参考第8版TNM分期T分期标准(T1≤3 cm,3 cm < T2≤5 cm, 5 cm < T3≤7 cm,T4>7 cm),其余临床特征分组基于SEER数据库原始输出数据进行。患者的基本临床特征:男性(55.37%)多于女性(44.63%);诊断年龄<65岁(47.95%)少于≥65岁(52.05%);白种人比例较大,占84.12%;肿瘤位于左肺(40.34%)少于右肺(59.66%);基线肿瘤长径≤30 mm较多,占40.16%,>30~50 mm为28.80%,>50~70 mm为15.58%,>70 mm为15.46%;在诊断时,21.92%的患者肿瘤无扩散,10.20%的患者有邻近组织浸润,9.72%的患者有区域淋巴结浸润,7.38%的患者既有邻近组织浸润,也有区域淋巴结浸润,50.78%的患者有远处转移;40.94%的患者接受过手术治疗,37.80%的患者接受过放射治疗,51.93%的患者接受过化疗(表 1)。
| 临床特征 | 例(%) | 肺大细胞神经内分泌癌 | |
| HR(95%CI) | P值 | ||
| 性别 | |||
| 男性 | 917(55.37) | 参照 | - |
| 女性 | 739(44.63) | 0.831(0.745~0.926) | 0.001 |
| 诊断年龄/岁 | |||
| < 65 | 794(47.95) | 参照 | - |
| ≥65 | 862(52.05) | 1.320(1.183~1.473) | < 0.001 |
| 种族 | |||
| 白种人 | 1 393(84.12) | 参照 | - |
| 黑种人 | 200(12.08) | 0.787(0.666~0.930) | 0.005 |
| 其他 | 63(3.80) | 0.746(0.566~0.982) | 0.037 |
| 肿瘤部位 | |||
| 左肺 | 668(40.34) | 参照 | - |
| 右肺 | 988(59.66) | 1.034(0.927~1.152) | 0.550 |
| 基线肿瘤长径/mm | |||
| ≤30 | 665(40.16) | 参照 | - |
| >30~50 | 477(28.80) | 1.114(0.973~1.277) | 0.119 |
| >50~70 | 258(15.58) | 1.249(1.060~1.473) | 0.008 |
| >70 | 256(15.46) | 1.547(1.308~1.831) | < 0.001 |
| 肿瘤扩散 | |||
| 肿瘤无扩散 | 363(21.92) | 参照 | - |
| 邻近组织浸润 | 169(10.20) | 1.221(0.966~1.542) | 0.095 |
| 区域淋巴结浸润 | 161(9.72) | 2.071(1.642~2.613) | < 0.001 |
| 邻近组织浸润+区域淋巴结浸润 | 122(7.38) | 2.727(2.122~3.506) | < 0.001 |
| 远处转移 | 841(50.78) | 4.574(3.745~5.585) | < 0.001 |
| 手术治疗 | |||
| 否 | 978(59.06) | 参照 | - |
| 是 | 678(40.94) | 0.442(0.376~0.520) | < 0.001 |
| 放射治疗 | |||
| 否 | 1 030(62.20) | 参照 | - |
| 是 | 626(37.80) | 0.848(0.753~0.956) | 0.007 |
| 化疗 | |||
| 否 | 796(48.07) | 参照 | - |
| 是 | 860(51.93) | 0.410(0.362~0.465) | < 0.001 |
2.2 患者生存分析
PLCNEC患者生存曲线见图 1,其中位OS为11个月,1年生存率为46.5%。
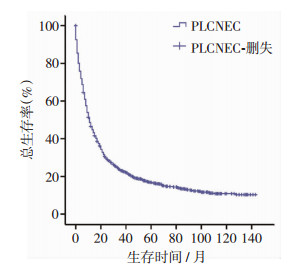
|
| 图 1 PLCNEC患者生存曲线 |
2.3 临床特征多因素分析
以OS为观察终点,用Cox比例风险模型分析与OS的相关的临床特征。多因素分析发现:女性较男性为保护因素(HR=0.831);诊断年龄≥65岁较<65岁为危害因素(HR=1.320);黑种人及其他种族较白种人为保护因素(HR分别为0.787、0.746);手术治疗、放射治疗及化疗均为保护因素,而基线肿瘤长径增大,肿瘤向邻近组织、区域淋巴结及远处部位扩散则为危害因素。不同肿瘤发生部位OS无明显差异(表 1)。
2.4 基于多因素分析的可视化列线图模型的建立及验证不同肿瘤部位患者的OS没有明显差异,故将这个指标剔除,剩下的临床指标纳入可视化列线图预后模型的建立,包括性别、诊断年龄、种族、基线肿瘤长径、肿瘤扩散、手术治疗、放射治疗及化疗。用R软件成功构建可视化列线图预后模型,赋予每个临床指标亚组之间不同的评分,根据总分可预测PLCNEC患者的1年生存率。假如某患者各临床指标总得分为200分,其1年生存率约为60%。该预后模型的C-index为0.76(图 2)。
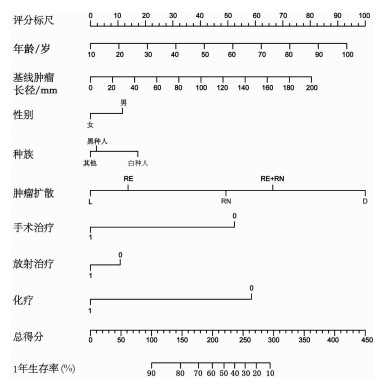
|
| L:肿瘤无扩散;RE:邻近组织浸润;RN:区域淋巴结浸润;D:远处转移 图 2 可视化列线图预后模型 |
预后模型校准度见图 3,校准曲线与标准参考曲线重叠性较高,表明该预后模型1年生存率预测值与实际值一致性较好,具有准确的预测能力。
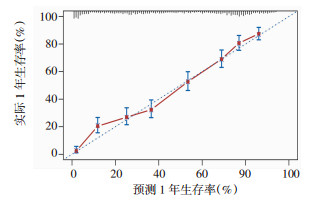
|
| 短虚线为标准参考线,长虚线为重复抽样后的校正曲线,其越接近参考线,说明预测准确性越好 图 3 预后模型校准图形 |
3 讨论
本研究采用SEER数据库的大样本数据对PLCENC这一种少见的肺部恶性肿瘤进行了全面分析,并建立了可视化列线图预后模型。发现PLCNEC患者以男性为主,平均诊断年龄约65岁,这与来自荷兰国家癌症数据库的分析结果相似:PLCNEC患者平均诊断年龄为65.5岁,以男性患者为主(占62.5%),其晚期患者占54.0%;然而其中位OS仅为8.7个月,低于本研究的11个月[4]。关于PLCNEC的临床特征、生物学特点的分析目前具有争议,如有研究显示:与小细胞肺癌相比,PLCNEC的临床特征、生物学特点与大细胞肺癌更相似[2];然而也有研究报道:相较于肺腺癌和肺鳞癌,PLCNEC部分临床特征及OS与小细胞肺癌更相似[4]。
不同的治疗方式是影响OS的关键因素,但目前PLCNEC的标准治疗方案存在很大争议。早期的PLCNEC患者仍以手术治疗为主,但是其5年生存率仅29.5%[1],而术后患者联合化疗则会明显提高生存率[8]。对于晚期PLCNEC患者,小细胞肺癌化疗方案和非小细胞肺癌化疗方案在临床上均有使用,但大多数研究都是单中心或小样本数据,其结果存在争议[9-11]。免疫治疗较传统的化疗能明显延长患者的OS[12-13],但是免疫治疗是否能应用于PLCNEC目前尚不明确。一项回顾性研究显示:76名PLCNEC患者中有17名患者肿瘤组织PD-L1表达阳性[14]。因此,PLCNEC有可能会从免疫治疗中受益,尤其是抗PD-1/PD-L1治疗,需要进一步的临床试验去探索。
晚期PLCNEC患者的不同转移模式也是影响其生存预后的一个因素。研究报道晚期PLCNEC患者的主要转移部位为肝、骨、脑,其脑转移比例较其他癌种高[4],脑是PLCNEC复发的主要转移部位[15]。因此,我们推测:对于接受化疗后完全缓解或部分缓解,以及手术完全切除后的早期PLCNEC患者,行预防性全脑照射可能会延长OS,尚需进一步临床研究验证。
本研究通过Cox风险比例模型多因素分析发现:性别、诊断年龄、种族、基线肿瘤长径、肿瘤扩散、手术治疗、放射治疗及化疗与PLCNEC生存预后相关,并以上述临床特征成功构建了可视化列线图预后模型。列线图模型是一种能够整合不同预后和决定变量,将统计预测模型简化为单个事件(如死亡或复发)发生概率的数字预测模型,根据个体患者的情况进行调整,从而生成临床事件的数字概率,并以列线图的方式可视化,被广泛应用于癌症预后[16-17]。列线图模型建立后,还需要对其性能进行验证[18],主要包括以下几个方面:首先是区分度,区分度是指该模型是否能将发生事件的病例与未发生的病例区分开来,通常以C-index反映。C-index值为0.5时表示该预测事件是完全随机的,相反,C-index值为1时表示该预测事件完全准确。本研究列线图预后模型C-index为0.76,表示有76%的可能性能将一个发生事件的患者与未发生事件的患者区分开来,具有较高的区分度。其次是校准度,校准度能评估列线图预后模型预测值与实际值是否一致,以校准图形展示。本研究预测模型校准度好,表明该预测模型的准确性好,尤其是在1年生存率为40%~80%,校准曲线与标准参考曲线重叠性较好。因此,该模型是一个相对可靠的预后模型,并且这个预测模型的优势在于基于一些基本的临床指标进行评分,区别于传统的TNM分期,在未来的临床实践中有可能会成为一个辅助预测工具。
本研究局限性在于:首先,纳入的临床特征有限,例如PS体力评分、吸烟状态、特定器官转移信息、肿瘤标志物、基因突变状态等都是与肿瘤预后相关的重要因素,更多的临床特征有助于我们更全面的认识PLCNEC,并构建出更加精确的列线图预后模型;其次,具体的治疗信息不够完善,不同的治疗方案也是影响生存预后的重要因素;最后,本研究列线图预后模型只进行了内部验证,对模型进行外部验证,最好是在多个不同的数据集、不同人群上测试模型,以获得对模型性能的估计,从而判断该模型的适用性。因此,本研究构建的列线图预后模型需要更多的临床样本去验证。
综上所述,本研究分析了PLCNEC患者的基本临床特征,发现PLCNEC的中位OS为11个月,1年生存率为46.5%。Cox风险比例模型多因素分析发现,性别、诊断年龄、种族、基线肿瘤长径、肿瘤扩散、手术治疗、放射治疗及化疗等临床特征与PLCNEC生存预后相关,并在此基础上成功构建了可视化列线图预后模型,可预测PLCNEC患者1年生存率,可以作为未来临床实践的一个辅助预测工具。
| [1] | FASANO M, DELLA CORTE C M, PAPACCIO F, et al. Pulmonary large-cell neuroendocrine carcinoma: from epidemiology to therapy[J]. J Thorac Oncol, 2015, 10(8): 1133–1141. DOI:10.1097/JTO.0000000000000589 |
| [2] | VARLOTTO J M, MEDFORD-DAVIS L N, RECHT A, et al. Should large cell neuroendocrine lung carcinoma be classified and treated as a small cell lung cancer or with other large cell carcinomas?[J]. J Thorac Oncol, 2011, 6(6): 1050–1058. DOI:10.1097/JTO.0b013e318217b6f8 |
| [3] | TRAVIS W D, BRAMBILLA E, NICHOLSON A G, et al. The 2015 world health organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9): 1243–1260. DOI:10.1097/JTO.0000000000000630 |
| [4] | DERKS J L, HENDRIKS L E, BUIKHUISEN W A, et al. Clinical features of large cell neuroendocrine carcinoma: a population-based overview[J]. Eur Respir J, 2016, 47(2): 615–624. DOI:10.1183/13993003.00618-2015 |
| [5] | TRAVIS W D. Advances in neuroendocrine lungtumors[J]. Ann Oncol, 2010, 21(Suppl 7): vii65–vii71. DOI:10.1093/annonc/mdq380 |
| [6] | DERKS J L, LEBLAY N, LANTUEJOUL S, et al. New insights into the molecular characteristics of pulmonary carcinoids and large cell neuroendocrine carcinomas, and the impact on their clinical management[J]. J Thorac Oncol, 2018, 13(6): 752–766. DOI:10.1016/j.jtho.2018.02.002 |
| [7] | REKHTMAN N, PIETANZA M C, HELLMANN M D, et al. Next-generation sequencing of pulmonary large cell neuroendocrine carcinoma reveals small cell carcinoma-like and non-small cell carcinoma-like subsets[J]. Clin Cancer Res, 2016, 22(14): 3618–3629. DOI:10.1158/1078-0432.CCR-15-2946 |
| [8] | KUJTAN L, MUTHUKUMAR V, KENNEDY K F, et al. The role of systemic therapy in the management of stage Ⅰ large cell neuroendocrine carcinoma of the lung[J]. J Thorac Oncol, 2018, 13(5): 707–714. DOI:10.1016/j.jtho.2018.01.019 |
| [9] | SARKARIA I S, IYODA A, ROH M S, et al. Neoadjuvant and adjuvant chemotherapy in resected pulmonary large cell neuroendocrine carcinomas: a single institution experience[J]. Ann Thorac Surg, 2011, 92(4): 1180–1186. DOI:10.1016/j.athoracsur.2011.05.027 |
| [10] | NAIDOO J, SANTOS-ZABALA M L, IYRIBOZ T, et al. Large cell neuroendocrine carcinoma of the lung: clinico-pathologic features, treatment, and outcomes[J]. Clin Lung Cancer, 2016, 17(5): e121–e129. DOI:10.1016/j.cllc.2016.01.003 |
| [11] | DERKS J L, VAN SUYLEN R J, THUNNISSEN E, et al. Chemotherapy for pulmonary large cell neuroendocrine carcinomas: does the regimen matter?[J]. Eur Respir J, 2017, 49(6): 1601838. DOI:10.1183/13993003.01838-2016 |
| [12] | CHEN L P, HAN X. Anti-PD-1/PD-L1 therapy of human cancer: past, present, andfuture[J]. J Clin Invest, 2015, 125(9): 3384–3391. DOI:10.1172/JCI80011 |
| [13] | HELLMANN M D, CALLAHAN M K, AWAD MM, et al. Tumor mutational burden and efficacy of nivolumab monotherapy and in combination with ipilimumab in small-cell lung cancer[J]. Cancer Cell, 2019, 35(2): 329. DOI:10.1016/j.ccell.2019.01.011 |
| [14] | EICHHORN F, HARMS A, WARTH A, et al. PD-L1 expression in large cell neuroendocrine carcinoma of the lung[J]. Lung Cancer, 2018, 118: 76–82. DOI:10.1016/j.lungcan.2018.02.003 |
| [15] | ZHAO Y Z, CASTONGUAY M, WILKE D, et al. Treatment outcomes and incidence of brain metastases in pulmonary large cell neuroendocrine carcinoma[J]. Curr Probl Cancer, 2019, 43(1): 54–65. DOI:10.1016/j.currproblcancer.2018.05.006 |
| [16] | IASONOS A, SCHRAG D, RAJ G V, et al. How to build and interpret a nomogram for cancer prognosis[J]. J Clin Oncol, 2008, 26(8): 1364–1370. DOI:10.1200/JCO.2007.12.9791 |
| [17] | WIERDA W G, O'BRIEN S, WANG X M, et al. Prognostic nomogram and index for overall survival in previously untreated patients with chronic lymphocytic leukemia[J]. Blood, 2007, 109(11): 4679–4685. DOI:10.1182/blood-2005-12-051458 |
| [18] | BALACHANDRAN V P, GONEN M, SMITH J J, et al. Nomograms in oncology: more than meets the eye[J]. Lancet Oncol, 2015, 16(4): e173–e180. DOI:10.1016/S1470-2045(14)71116-7 |



