胃癌是常见的消化道恶性肿瘤, 据国家肿瘤登记中心统计, 我国2015年胃癌新发病例约67.9万, 死亡病例约49.8万, 在我国恶性肿瘤中高居第2位[1]。由于胃癌早期检出率低, 多数患者首次就诊即被确诊为晚期, 严重影响患者预后及生存率[2]。随着内镜技术的发展及医疗技术的改善, 虽然胃癌患者5年生存率提高至90%[3-4], 但淋巴结转移限制了其治疗效果, 我国每年仍有约35万例因胃癌死亡的患者[5]。因此, 胃癌的早期预防、诊断、抗肿瘤综合治疗备受关注。
微小RNA(microRNA)是一类高度保守的非编码RNA, 广泛存在于哺乳动物、植物和线虫等生物体内, 能与靶mRNA特异性结合而调控基因转录后表达, 是近年来肿瘤领域研究的热点[6]。已有多项研究表明microRNA在肿瘤组织中表达异常, 可发挥抑制或促进肿瘤发展的作用[7-8]。其中, 微小RNA-107(microRNA-107, miR-107)已被证实可抑制癌细胞迁移和侵袭, 并且其在胃癌组织中表达显著上调[9-10]。本研究通过检测抑制miR-107表达后胃癌细胞迁移和侵袭情况, 探讨miR-107对胃癌细胞迁移和侵袭的影响及其作用机制,为胃癌的治疗提供新的靶标。
1 材料与方法 1.1 材料人胃癌细胞MKN45(批号:JN-B1855)、人胃黏膜上皮细胞GES-1(批号:JN-B1627)购自上海纪宁实业有限公司; 胎牛血清(批号:SH41288)、DMEM培养基(批号:11320033)购自美国Gibco-BRL公司; Lipofect-amineTM 2000转染试剂(批号:11668027)购自美国Invitrogen公司; TaKaRa反转录试剂盒(批号:RR047A)、TaKaRa实时荧光定量试剂盒(批号:RR820A)购自宝生物工程(大连)有限公司; BCA试剂盒(批号:PC0020)、PVDF膜(批号:BSP0161)、双荧光素酶报告基因检测试剂盒(批号:D0010)、ECL发光液(批号:PE0030)、结晶紫(批号:C8470)、4%多聚甲醛(批号:P1110)购自北京Solarbio公司; pcDNA 3.1载体(批号:60548)购自爱迪基因; 兔抗人Notch2多克隆抗体(批号:NBP1-19125)、兔抗人基质金属蛋白酶-9(matrix metalloproteinase, MMP-9)多克隆抗体(批号: PAB0982)、兔抗人GAPDH多克隆抗体(批号: LS-C108027)购自上海煊翎生物科技有限公司; Transwell小室(批号:BD-353502)购自北京明阳科华生物技术有限公司; 细胞培养箱、酶标仪购自美国Thermo公司。
1.2 细胞培养及分组取MKN45人胃癌细胞和GES-1人胃黏膜上皮细胞, 使用含10%胎牛血清的DMEM培养基于37 ℃、5%CO2饱和湿度的细胞培养箱中培养, 2~3 d换液1次。待细胞生长至对数期进行收集, 标记为MKN45组和GES-1组, 用于Real-time PCR实验。收集对数生长期的MKN45细胞, 胰酶消化并重悬, 调整细胞悬液浓度为1×106/mL并接种至6孔板, 在细胞融合度约50%时按照LipofectamineTM2000转染试剂说明书进行转染, 继续培养24 h。将转染后的MKN45细胞分为NC组(转染non-specific control序列), miR-NC组(转染NC inhibitors), miR-107 inhibitors组(转染miR-107 inhibitors), pcDNA 3.1组(转染pcDNA 3.1空载体), pcDNA 3.1-Notch2组(转染Notch2过表达载体), miR-107 inhibitors+ scrambled组(转染miR-107 inhibitors和scrambled shRNA载体), miR-107 inhibitors+shNotch2组(转染miR-107 inhibitors和shRNA-Notch2载体)。所用non-specific control、NC inhibitors、miR-107 inhibitors、scrambled、shRNA-Notch2均由上海吉玛生物科技公司设计合成。
1.3 qRT- PCR检测收集MKN45组、GES-1组、NC组、miR-NC组、miR-107 inhibitors组、pcDNA 3.1组、pcDNA 3.1-Notch2组、miR-107 inhibitors+scrambled组和miR-107 inhibitors+shNotch2组细胞, 采用TRIzol法提取总RNA。分光光度计测定RNA样品浓度及纯度后按照TaKaRa反转录试剂盒说明书将RNA反转录为cDNA, 避光配制反应体系, 每个样品重复3次。以GAPDH为内参, 所得实验数据采用2-△△Ct法计算相对表达量。所用引物及序列如下:miR-107引物,上游5′-CATACTAGTG-TCTTCTGGACAGGCTCTG-3′, 下游5′-CTTAAGCTTA-GAATCTCTCACATACACAC-3′,66 bp;Notch2引物,上游5′-AGCTGCTACTCACAGGTGAACGAA-3′, 下游5′-CCAGCCTGCATCACAGAGACA-3′,7 416 bp;MMP-9引物,上游5′-GGACGACGTGGGCTACGT-3′, 下游5′-CA-CGGTTGAAGCAAAGAAGGA-3′,1 813 bp; GAPDH引物,上游5′-CACCATTGGCAATGAGCGGTTC-3′, 下游5′-AGGTCTTTGCGGATGTCCACGT-3′,332 bp。
1.4 Western blot检测收集MKN45组、GES-1组、NC组、miR-NC组、miR-107 inhibitors组、pcDNA 3.1组、pcDNA 3.1-Notch2组细胞, 加入细胞裂解液,置于冰上裂解30 min, 4 ℃、12 000×g离心15 min, 取上清, BCA试剂盒测定蛋白样品浓度。取50 μg蛋白样品进行SDS-PAGE电泳后,电转至PVDF膜上, 5%脱脂奶粉TBST液室温封闭1 h; 分别加入兔抗人Notch2多克隆抗体(1 :2 000)、兔抗人MMP-9多克隆抗体(1 :500)、兔抗人GAPDH多克隆抗体(1 :1 000), 4 ℃孵育过夜, TBS洗膜3次, 加入辣根过氧化物酶(HRP)标记的二抗(1 :5 000),室温孵育1 h, TBS洗膜, ECL曝光显影, 实验重复3次。
1.5 Transwell实验取转染后的NC组、miR-NC组、miR-107 inhibitors组、pcDNA 3.1组、pcDNA 3.1-Notch2组、miR-107 inhibitors+scrambled组和miR-107 inhibitors+shNotch2组细胞, 胰酶消化后重悬。取200 μL细胞悬液接种于包被或未包被基质胶的Transwell小室, 放于含完全培养基的下室上, 37 ℃、5% CO2条件下培养24 h, 吸除多余培养基, 棉签擦去上层细胞。加入4%多聚甲醛固定30 min, 0.1%结晶紫染色10 min, 荧光显微镜下记录穿膜细胞数。
1.6 双荧光素酶报告基因实验收集MKN45细胞, 胰酶消化离心, 重悬后调整细胞悬液浓度为1×106/mL并接种至6孔板, 在细胞融合度约50%时使用LipofectamineTM 2000转染试剂将miR-NC、miR-107 mimics分别与pGL3空白质粒、Notch2 3’-UTR突变型质粒、Notch2 3’-UTR野生型质粒共转染至MKN45细胞, 常规培养48 h。加入细胞裂解液裂解细胞, 4 ℃、12 000×g离心10 min, 取上清进行荧光素酶活性检测。
1.7 统计学分析采用SPSS 20.0统计软件, 使用GraphPad Prism 6.0作图, 数据均以x ±s表示。两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 miR-107和Notch2在MKN45和GES-1细胞中的表达Real-time PCR检测结果表明:与GES-1细胞比较, MKN45细胞中miR-107表达上调(0.190±0.028 vs 0.067±0.019, P < 0.01), Notch2表达下调(1.06±0.40 vs 2.79±0.43,P < 0.01);进一步使用Western blot检测Notch2蛋白表达, 发现Notch2蛋白在MKN45细胞中表达量明显降低(P < 0.01,图 1)。
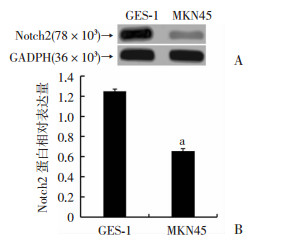
|
| A: Western blot检测MKN45和GES-1细胞中Notch2蛋白表达;B: MKN45和GES-1细胞中Notch2蛋白表达半定量分析a:P < 0.01, 与GES-1细胞比较 图 1 miR-107和Notch2在MKN45和GES-1细胞中的表达 |
2.2 抑制miR-107表达对MKN45细胞迁移和侵袭的影响
转染miR-107 inhibitors至MKN45细胞后, miR-107相对表达量明显低于NC组和miR-NC组(P < 0.01,图 2A); 与NC组和miR-NC组比较, miR-107 inhibitors组中MKN45细胞迁移和侵袭数明显减少(P < 0.01,图 2B、C);结晶紫染色结果见图 3。
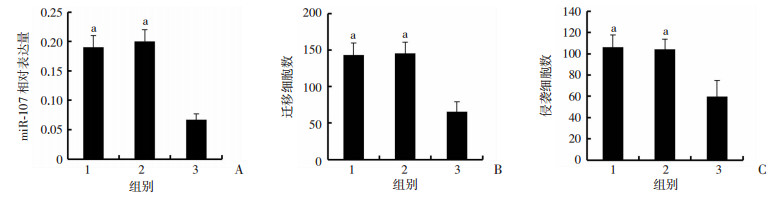
|
| A:各组细胞中miR-107表达; B:各组细胞迁移数统计; C:各组细胞侵袭数统计1: NC组; 2: miR-NC组; 3:miR-107 inhibitors组; a:P < 0.01, 与miR-107 inhibitors组比较 图 2 抑制miR-107表达对MKN45细胞迁移和侵袭的影响 |
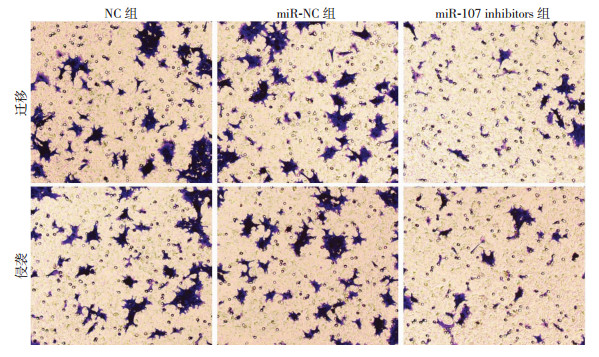
|
| 图 3 结晶紫染色观察各组细胞迁移和侵袭(×100) |
2.3 过表达Notch2抑制MKN45细胞迁移和侵袭
Western blot检测结果显示:pcDNA 3.1-Notch2组Notch2蛋白表达高于NC组和pcDNA 3.1组(P < 0.01,图 4A、B); Transwell检测细胞迁移和侵袭, 发现与NC组和pcDNA 3.1组比较,pcDNA 3.1-Notch2组细胞迁移和侵袭数明显减少(P < 0.01,图 4C、D)。
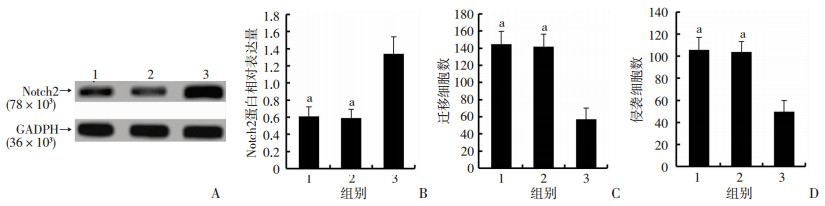
|
| A: Western blot检测各组细胞中Notch2蛋白表达;B:各组细胞Notch2蛋白表达半定量分析;C:细胞迁移数统计;D:细胞侵袭数统计1:NC组; 2:pcDNA 3.1组; 3:pcDNA 3.1-Notch2组; a:P < 0.01,与pcDNA 3.1-Notch2组比较 图 4 过表达Notch2抑制MKN45细胞迁移和侵袭 |
2.4 过表达Notch2抑制MKN45细胞中MMP-9的表达
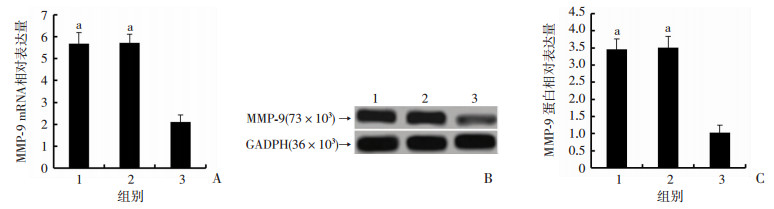
Real-time PCR和Western blot检测结果显示:过表达Notch2后,与NC组和pcDNA 3.1组相比较,pcDNA 3.1-Notch2组MMP-9的mRNA和蛋白表达显著降低(P < 0.01,图 5)。
|
| A:Real-time PCR检测各组细胞中MMP-9 mRNA表达; B:Western blot检测各组细胞中MMP-9蛋白表达;C:各组细胞中MMP-9蛋白表达半定量分析1:NC组; 2:pcDNA 3.1组; 3:pcDNA 3.1-Notch2组; a:P < 0.01, 与pcDNA 3.1-Notch2组比较 图 5 过表达Notch2的MKN45细胞中MMP-9的表达 |
2.5 Notch2是miR-107潜在的靶基因
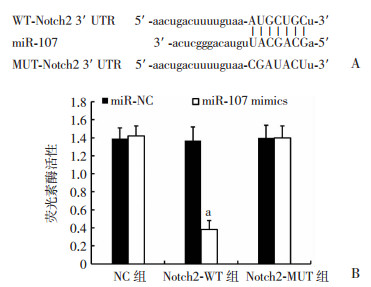
Targetscan在线预测发现:Notch2 3’-UTR上存在miR-107的结合位点(图 6A), 猜测Notch2是miR-107的潜在靶基因。为验证这一观点, 将miR-NC、miR-107 mimics分别与pGL3空白质粒、Notch2 3’-UTR突变型质粒、Notch2 3’-UTR野生型质粒共转染至MKN45细胞, 采用双荧光素酶报告基因实验进行检测, 结果(图 6B)显示:NC组细胞荧光素酶活性无明显变化, 而转染miR-107 mimics的Notch2-WT组细胞荧光素酶活性明显下降(P < 0.01),Notch2-MUT组细胞荧光素酶活性与对照无明显差异。
|
| A:Targetscan在线预测Notch2 3’-UTR与miR-107的互补序列;B:各组细胞荧光素酶活性分析a:P < 0.01, 与miR-NC组比较 图 6 miR-107靶向调控Notch2 |
2.6 沉默Notch2逆转miR-107对MKN45细胞迁移和侵袭的抑制作用
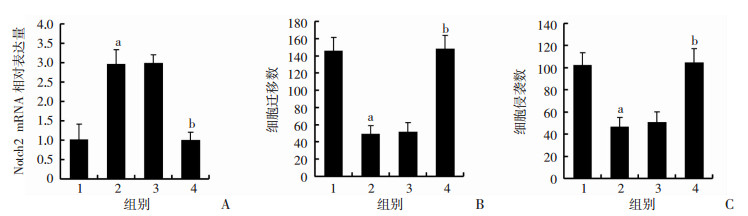
Real-time PCR和Transwell检测结果(图 7)显示, 在MKN45细胞中转染miR-107 inhibitors,Notch2表达上调(P < 0.01),细胞迁移和侵袭数减少(P < 0.01);抑制miR-107表达的同时沉默Notch2,则Notch2表达下调, 视野内迁移和侵袭细胞数明显增多(P < 0.01)。
|
| A:Real-time PCR检测各组细胞中Notch2 mRNA表达;B:各组细胞迁移数统计;C:各组细胞侵袭数统计1: miR-NC组;2: miR-107 inhibitors组;3: miR-107 inhibitors+scrambled组;4:miR-107 inhibitors+shNotch2组;a: P < 0.01, 与miR-NC组比较;b:P < 0.01, 与miR-107 inhibitors+scrambled组比较 图 7 沉默Notch2逆转miR-107对MKN45细胞迁移和侵袭的抑制作用 |
3 讨论
胃癌的发生与饮食习惯、吸烟、饮酒和遗传等多种因素有关, 其发病机制尚未完全明确[11]。MicroRNA能调控多种下游基因表达, 参与生物体几乎所有的生命活动, 与肿瘤的发生、发展密切相关。文献[12-13]报道miR-148a、miR-130a能够调节肝癌、乳腺癌多种肿瘤细胞增殖、凋亡、迁移和侵袭等生物过程, 在肿瘤发生的分子机制中起关键作用, 是癌症治疗的新靶点。
MiR-107首次发现于人宫颈癌细胞, 能够靶向多种下游基因表达, 参与调节细胞应激、脂质代谢、血管生成、血管内皮因子分泌和损伤修复, 可抑制或诱导2型糖尿病、阿尔茨海默病和肿瘤等疾病的发生[14]。在肿瘤的相关研究中, STVCKRATH等[15]研究发现:miR-107在乳腺癌患者血浆中表达异常, 调节miR-107表达能抑制乳腺癌细胞迁移和侵袭;LIU等[16]研究表明:下调miR-107表达能通过抑制细胞增殖和促进细胞凋亡减缓结直肠癌的发展,提示miR-107可能是癌症治疗的新靶点。为研究miR-107对胃癌发展是否具有抑制作用,FENG等[17]进行了胃癌细胞的体外实验, 发现miR-107能够抑制细胞周期蛋白依赖性激酶表达, 诱导细胞周期停滞, 抑制癌细胞增殖。本研究发现miR-107在人胃癌细胞MKN45中相对表达水平高于人胃黏膜上皮细胞GES-1(P < 0.01);在MKN45细胞中转染miR-107 inhibitors, 视野内细胞迁移和侵袭数减少(P < 0.01);采用Targetscan在线预测发现:Notch2 3’-UTR上存在miR-107的结合位点;双荧光素酶报告基因实验结果表明:Notch2是miR-107的潜在靶基因, 抑制miR-107可促进Notch2表达。
上皮-间质转化(epithelial-mesenchymal transition, EMT)指上皮细胞失去原有极性, 获得抗凋亡、高迁移和侵袭的能力, 转化为间质细胞的过程[18]。肿瘤细胞具有向周围组织浸润的能力, 通过淋巴管、血管转移并成长为实体瘤, 而EMT的发生使MMP-9表达上调, 细胞间连接减弱, 增强细胞迁移能力, 促进肿瘤发展[19-20]。Notch信号通路是诱导EMT的重要调节者, 广泛参与细胞分化、增殖及凋亡过程[21]。Notch信号通路包含Notch1、Notch2、Notch3和Notch4 4种受体, 多种肿瘤细胞EMT的发生常伴有Notch通路的激活, 激活Notch1可增强细胞迁移能力, 促进EMT发生[22-23]。此外, 多项研究表明激活Notch2可诱导肿瘤细胞EMT, 促进肿瘤转移[24-25]。本研究采用Real-time PCR检测发现:Notch2在MKN45人胃癌细胞中相对表达水平低于GES-1人胃黏膜上皮细胞(P < 0.01), 过表达Notch2, 则MKN45细胞迁移和侵袭能力下降(P < 0.01), MMP-9表达下调(P < 0.01)。在MKN45细胞中沉默Notch2表达, 可逆转miR-107对胃癌细胞迁移和侵袭的抑制作用。
综上所述, 在胃癌细胞中, miR-107高表达,而Notch2低表达;抑制miR-107可促进Notch2表达, 从而上调MMP-9水平, 抑制胃癌细胞迁移和侵袭。这一研究结果有望为胃癌临床治疗提供新靶点。
| [1] | CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] |
于震, 王海江. 进展期胃癌的外科治疗进展[J].
医学综述, 2018, 24(9): 1714–1718.
YU Z, WANG H J. Progress in the surgical treatment of advanced gastric cancer[J]. Med Recapitulate, 2018, 24(9): 1714–1718. DOI:10.3969/j.issn.1006-2084.2018.09.010 |
| [3] | REN G, CAI R, ZHANG W J, et al. Prediction of risk factors for lymph node metastasis in early gastric cancer[J]. World J Gastroenterol, 2013, 19(20): 3096–3107. DOI:10.3748/wjg.v19.i20.3096 |
| [4] | SAITO T, KUROKAWA Y, TAKIGUCHI S, et al. Accuracy of multidetector-row CT in diagnosing lymph node metastasis in patients with gastric cancer[J]. Eur Radiol, 2015, 25(2): 368–374. DOI:10.1007/s00330-014-3373-9 |
| [5] |
宋杰, 陈凤格, 赵伟, 等. 胃癌的发病率现状与治疗研究进展[J].
中国慢性病预防与控制, 2016, 24(9): 704–707.
SONG J, CHEN F G, ZHAO W, et al. Progress in the current status and treatment of gastric cancer[J]. Chin J Prevent Control Chronic Dis, 2016, 24(9): 704–707. DOI:10.16386/j.cjpccd.issn.1004-6194.2016.09.019 |
| [6] | RUPAIMOOLE R, SLACK F J. MicroRNA therapeutics: towards a new era for the management of cancer and other diseases[J]. Nat Rev Drug Discov, 2017, 16(3): 203–222. DOI:10.1038/nrd.2016.246 |
| [7] | ZHANG Y, XU X M, ZHANG M, et al. MicroRNA-663a is downregulated in non-small cell lung cancer and inhibits proliferation and invasion by targeting JunD[J]. BMC Cancer, 2016, 16: 315. DOI:10.1186/s12885-016-2350-x |
| [8] | MIAN C, PENNELLI G, FASSAN M, et al. MicroRNA profiles in familial and sporadic medullary thyroid carcinoma: preliminary relationships with RET status and outcome[J]. Thyroid, 2012, 22(9): 890–896. DOI:10.1089/thy.2012.0045 |
| [9] | XIA H, LI Y, LV X. MicroRNA-107 inhibits tumor growth and metastasis by targeting the BDNF-mediated PI3K/AKT pathway in human non-small lung cancer[J]. Int J Oncol, 2016, 49(4): 1325–1333. DOI:10.3892/ijo.2016.3628 |
| [10] | WANG S Z, LV C, JIN H, et al. A common genetic variation in the promoter of miR-107 is associated with gastric adenocarcinoma susceptibility and survival[J]. Mutat Res, 2014, 769: 35–41. DOI:10.1016/j.mrfmmm.2014.07.002 |
| [11] |
邹文斌, 吴浩, 蔡全才, 等. 胃癌危险因素研究进展[J].
中国实用内科杂志, 2014, 34(4): 415–420.
ZOU W B, WU H, CAI Q C, et al. Research advance on risk factors of gastric cancer[J]. Chin J Pract Intern Med, 2014, 34(4): 415–420. |
| [12] | LI Y, DENG X Y, ZENG X M, et al. The role of mir-148a in cancer[J]. J Cancer, 2016, 7(10): 1233–1241. DOI:10.7150/jca.14616 |
| [13] | ZHANG H D, JIANG L H, SUN D W, et al. The role of miR-130a in cancer[J]. Breast Cancer, 2017, 24(4): 521–527. DOI:10.1007/s12282-017-0776-x |
| [14] |
阮杰, 翁亚光, 刘新光. miRNA-107与衰老相关疾病[J].
中国老年学杂志, 2015, 35(24): 7263–7266.
RUAN J, WENG Y G, LIU X G. miRNA-107 and aging-related diseases[J]. Chin J Gerontol, 2015, 35(24): 7263–7266. DOI:10.3969/j.issn.1005-9202.2015.24.142 |
| [15] | STÜCKRATH I, RACK B, JANNI W, et al. Aberrant plasma levels of circulating miR-16, miR-107, miR-130a and miR-146a are associated with lymph node metastasis and receptor status of breast cancer patients[J]. Oncotarget, 2015, 6(15): 13387–13401. DOI:10.18632/oncotarget.3874 |
| [16] | LIU F, LIU S J, AI F Y, et al. Mir-107 promotes proliferation and inhibits apoptosis of colon cancer cells by targeting prostate apoptosis response-4 (par4)[J]. Oncol Res, 2017, 25(6): 967–974. DOI:10.3727/096504016X14803476672380 |
| [17] | FENG L, XIE Y, ZHANG H, et al. MiR-107 targets cyclin-dependent kinase 6 expression, induces cell cycle G1 arrest and inhibits invasion in gastric cancer cells[J]. Med Oncol, 2012, 29(2): 856–863. DOI:10.1007/s12032-011-9823-1 |
| [18] | ACLOQUE H, ADAMS M S, FISHWICK K, et al. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease[J]. J Clin Invest, 2009, 119(6): 1438–1449. DOI:10.1172/JCI38019 |
| [19] | MICALIZZI D S, FARABAUGH S M, FORD H L. Epithelial-mesenchymal transition in cancer: parallels between normal development and tumor progression[J]. J Mammary Gland Biol Neoplasia, 2010, 15(2): 117–134. DOI:10.1007/s10911-010-9178-9 |
| [20] | WANG Z W, LI Y W, KONG D J, et al. The role of Notch signaling pathway in epithelial-mesenchymal transition (EMT) during development and tumor aggressiveness[J]. Curr Drug Targets, 2010, 11(6): 745–751. DOI:10.2174/138945010791170860 |
| [21] | TALBOT L J, BHATTACHARYA S D, KUO P C. Epithelial-mesenchymal transition, the tumor microenvironment, and metastatic behavior of epithelial malignancies[J]. Int J Biochem Mol Biol, 2012, 3(2): 117–136. |
| [22] | GÜNGÖR C, ZANDER H, EFFENBERGER K E, et al. Notch signaling activated by replication stress-induced expression of midkine drives epithelial-mesenchymal transition and chemoresistance in pancreatic cancer[J]. Cancer Res, 2011, 71(14): 5009–5019. DOI:10.1158/0008-5472.CAN-11-0036 |
| [23] | GAO X J, LIU J W, ZHANG Q G, et al. Nobiletin inhibited hypoxia-induced epithelial-mesenchymal transition of lung cancer cells by inactivating of Notch-1 signaling and switching on miR-200b[J]. Pharmazie, 2015, 70(4): 256–262. |
| [24] | HUANG Y P, HOQUE M O, WU F, et al. Midkine induces epithelial-mesenchymal transition through Notch2/Jak2-Stat3 signaling in human keratinocytes[J]. Cell Cycle, 2008, 7(11): 1613–1622. DOI:10.4161/cc.7.11.5952 |
| [25] | KIM R K, KAUSHIK N, SUH Y, et al. Radiation driven epithelial-mesenchymal transition is mediated by Notch signaling in breast cancer[J]. Oncotarget, 2016, 7(33): 53430–53442. DOI:10.18632/oncotarget.10802 |



