2. 150040 哈尔滨, 黑龙江中医药大学药物安全评价中心
2. Center of Drug Safety and Evaluation, Heilongjiang University of Chinese Medicine, Harbin, Heilongjiang Province, 150040, China
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是肝脏中脂代谢紊乱引起的全世界发病率较高的肝病之一。2015年,美国NAFLD的病例数量约为总人口的25%,预计到2030年,会增长到1亿左右[1]。我国发达地区如上海和香港特别行政区,NAFLD发病率已增长到15%左右[2]。NAFLD的特征是过多的脂肪滴(lipid droplets,LDs)弥漫性积聚。LDs是调节脂质储存和降解的高度动态的细胞器,其核心组分为甘油三酯(TG)和胆固醇(TC),该脂质核心外侧被单层磷脂膜包围,膜上镶嵌的PAT家族蛋白(包括PLIN1、PLIN2、PLIN3、PLIN4和PLIN5)在LDs的生物合成与稳定中发挥关键作用[3]。
莱菔硫烷(sulforaphane, SFN)是一种异硫氰酸盐类植物化学物,以其前体物硫代葡萄糖苷的形式存在于十字花科蔬菜中,例如绿花椰菜,卷心菜等。硫代葡萄糖苷在黑芥子酶的作用下,水解成以SFN为代表的异硫氰酸盐类。SFN具有抗癌、抗炎和抗氧化等多种生物学功能[4]。已发现SFN对脂代谢紊乱引起的疾病,如肥胖、糖尿病有改善作用。SFN可减轻高脂膳食诱导的小鼠体质量增加,并减少肾周和附睾脂肪组织质量[5],可抑制脂肪细胞分化并促进脂肪分解[6]。另外,SFN能够刺激葡萄糖摄取和氧化利用,增加脂肪分解并上调脂肪酸氧化途径,同时抑制TG的合成[6]。但是SFN是否可以调控LDs的形成,减少其在肝细胞中的积累,尚不清楚。内质网是脂质生物合成和中性脂质储存的关键细胞器。内质网中存在多种催化TC和TG合成的关键酶,如二酯酰甘油酰基转移酶2(DGAT2)和酰基辅酶A胆固醇酰基转移酶(ACAT1)[7-8]。PAT家族中各个蛋白的功能有所不同:PLIN2可以维持TG的含量,PLIN3能保护LDs免受脂解作用,PLIN5亦可防止LDs分解[9-10],PLIN1仅存在于某些细胞(如脂肪细胞和脂肪肝细胞)中,但它易于降解[9-10],PLIN4与脂质代谢相关的功能尚需探明。本研究建立高脂膳食诱导大鼠肝脏脂肪变性模型,观察SFN对LDs的中性脂质核心合成的调控以及对PAT家族蛋白的影响,旨在阐明SFN防治NAFLD的作用机制。
1 材料与方法 1.1 主要试剂和仪器SFN(纯度≥97%,分子量为177.29 g/mol)购自美国LKT公司,配制成100 mmol/L的储备液,分装于1 mL EP管中,放置于-20 ℃冰箱中,避光长期保存备用,反复冻融5次以上弃用。胞浆蛋白提取试剂盒购自北京索莱宝生物技术有限公司,BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所。PLIN1、PLIN5、DGAT2及ACAT1抗体购自美国Santa Cruz公司;PLIN2、PLIN3和GAPDH抗体购自美国Proteintech公司。RNA提取试剂盒、反转录试剂盒以及Real-time PCR试剂盒购自北京全式金生物技术有限公司。
1.2 高脂膳食诱导大鼠肝脏脂肪变性模型本动物实验经过黑龙江中医药大学伦理委员会批准(批准号:20151101)。SPF级雄性Wistar大鼠60只(4周龄,体质量150~200 g)购于北京维通利华实验动物技术有限公司[大鼠合格证号SCXK(京)2014-0009],于黑龙江中医药大学药物安全评价中心SPF级动物房中饲养,12 h :12 h明暗交替,环境温度为(22±2)℃,空气湿度为(55±5)%。高脂饲料委托北京维通利华实验动物有限公司合成。大鼠维持级饲料(SPF级60Co辐照灭菌级)购自北京科澳协力饲料有限公司。实验周期内,大鼠自由饮水、摄食。SFN和阳性药物多烯磷脂酰胆碱[PPC,228 mg, 赛诺菲(北京)制药有限公司]均使用灌胃针按体质量每周灌胃3次进行干预。垫料和饮水均经过高压灭菌,每周更换。动物适应性喂养1周后,进行正式实验。根据体质量按照随机数表法为6组(n=10):正常食物组(NOM组)、高脂饲料组(HFD组)、高脂饲料+高剂量SFN(20 mg/kg)处理组(SFN高剂量组)、高脂饲料+中剂量SFN(10 mg/kg)处理组(SFN中剂量组)、高脂饲料+低剂量SFN(5 mg/kg)处理组(SFN低剂量组)和高脂饲料+阳性药物PPC(30 mg/kg)组(PPC组),实验进行10周。实验过程中,高脂组和中剂量SFN组各有1只大鼠死亡。
1.3 酶偶联比色法检测大鼠肝组织中TG和TC的含量采用TG和TC含量测定试剂盒(南京建成生物工程研究所)检测大鼠肝脏中TG和TC含量,按照试剂盒说明书操作,按照说明书公式计算各样品TG和TC含量。
1.4 肝脏油红O染色观察大鼠肝脏内脂滴形态取大鼠肝脏组织做冰冻切片,用60%异丙醇浸洗2 min,油红O工作液染色,60%异丙醇脱色。委托哈尔滨医科大学病理学实验室完成,于倒置光学显微镜下观察并拍照。采用Image J软件,利用Freehand工具测量并计算脂滴所占面积。
1.5 Real-time PCR检测PLIN1、PLIN2、PLIN3、PLIN5 mRNA的表达RNA提取与反转录按照试剂盒说明操作,采用TransStart® Top Green qPCR SuperMix试剂盒进行Real-time PCR反应。采用ABI 7300系统完成Real-time PCR程序:94 ℃ 30 s,94 ℃ 5 s,60 ℃ 30 s,40个循环。每个标本做3个平行。根据引物的溶解曲线和扩增曲线确定引物特异性及有效性。以β2-microglobulin作为内参基因,对照组为校验因子,用2-ΔΔCt法计算mRNA相对表达量。
1.6 Western blot检测大鼠肝脏中DGAT2和ACAT1蛋白的表达提取胞浆蛋白,测定浓度。配制分离胶与浓缩胶,上样电泳。浓缩胶电泳,电压80 V,30 min;分离胶电泳,电压120 V,1.5 h。半干转膜,20 V,30 min;转膜结束后,用1%~3%的BSA常温封闭1 h。加入稀释的一抗,4 ℃过夜孵育。TBST洗膜3次,加入稀释的二抗。室温下孵育1 h,TBST洗3次。用BCIP和NBT显色,双蒸水终止显色,拍照。Image J软件分析蛋白密度。
1.7 免疫组化观察大鼠肝脏脂滴外周蛋白PLIN1、PLIN2、PLIN3、PLIN5的表达大鼠肝组织用石蜡包埋切片,二甲苯脱蜡,无水酒精水化。PBS冲洗2~3次,每次5 min。切片置于0.01 mol/L枸橼酸缓冲液(pH=6.0)中,120 ℃修复5 min。自然冷却20 min以上,再用冷水冲洗,抗原修复。滴加正常山羊血清封闭液,室温孵育2 h。滴加一抗,4 ℃过夜。在37 ℃条件下,复温45 min,PBS冲洗3次。滴加二抗,37 ℃孵育1 h。用PBS冲洗3次,DAB显色5~10 min,用纯水冲洗终止反应。苏木精染细胞核,PBS冲洗。无水酒精梯度脱水,二甲苯透明,中性树胶封片。邀请黑龙江中医药大学的病理学专家阅片,免疫组化切片在200倍镜下拍照,参照MANE等[11]的方法,用Image J软件分析。
1.8 统计学分析实验数据以x ±s的形式表示。采用GraphPad Prism 6和EXCEL软件进行绘图、计算和分析。符合正态分布的数据采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 SFN改善大鼠肝脏脂肪变性HFD组大鼠喂养10周后,与NOM组比较,HFD组大鼠体质量明显增加;与HFD组比较,不同剂量SFN和PPC均能显著降低大鼠体质量(P < 0.01, 图 1A)。HFD显著增加了大鼠体质量,与HFD组比较,各剂量SFN和PPC明显降低了大鼠体质量增加量(P < 0.01, 图 1B)。
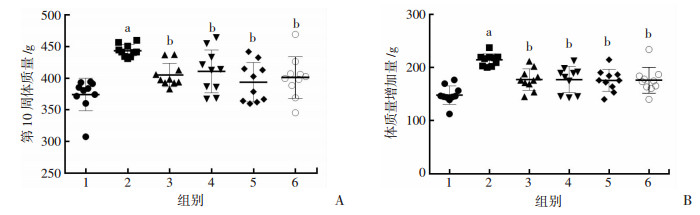
|
| A:大鼠体质量;B:大鼠体质量增加量1:NOM组;2:HFD组;3:SFN低剂量组;4:SFN中剂量组;5:SFN高剂量组;6:PPC组;a:P < 0.01,与NOM组比较;b:P < 0.01,与HFD组比较 图 1 实验10周后各组大鼠体质量的变化 |
大鼠喂养10周后,观察肝细胞中LDs形成情况和肝脏中TG与TC含量。与NOM组比较,HFD使肝细胞内充满LDs,弥漫分散,且体积增大,LDs所占面积比例明显提高(P < 0.01);与HFD组比较,中剂量和高剂量SFN明显降低LDs所占面积比例,且LDs体积较小(图 2)。与NOM组比较,HFD组肝脏中TG和TC含量明显增加(P < 0.01);与HFD组比较,中剂量和高剂量SFN能显著降低肝脏TG和TC含量(P < 0.01,图 3)。
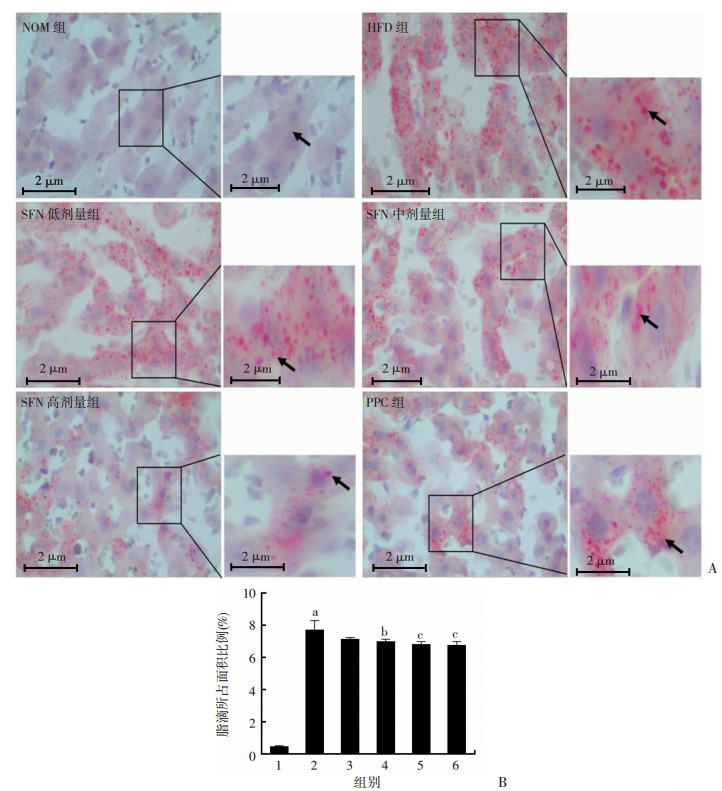
|
| A:各组大鼠肝脏油红O染色观察箭头示脂滴;B:大鼠肝脏中脂滴所占面积比例1:NOM组;2:HFD组;3:SFN低剂量组;4:SFN中剂量组;5:SFN高剂量组;6:PPC组; a:P < 0.01,与NOM组比较;b:P < 0.05,c:P < 0.01,与HFD组比较 图 2 油红O染色观察各组大鼠肝脏脂滴蓄积程度 |
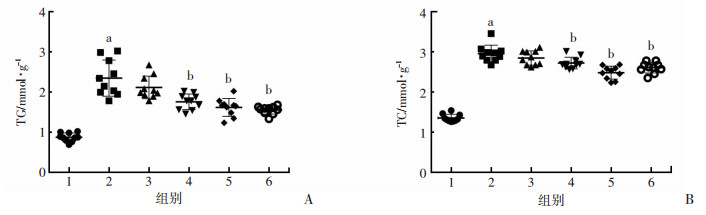
|
| 1:NOM组;2:HFD组;3:SFN低剂量组;4:SFN中剂量组;5:SFN高剂量组;6:PPC组;a:P < 0.01,与NOM组比较;b:P < 0.01,与HFD组比较 图 3 酶偶联比色法检测大鼠肝脏中TG(A)和TC(B)含量 |
2.2 SFN抑制TG和TC关键合成酶DGAT2和ACAT1蛋白的表达
HFD显著提高了肝脏中DGAT2和ACAT1蛋白的表达,分别是NOM组表达量的2.06倍(P < 0.01)和1.68倍(P < 0.01)。与HFD组比较,各剂量SFN均显著下调了大鼠肝脏中DGAT2和ACAT1蛋白的表达(P < 0.01,图 4)。

|
| A:Western blot检测;B:半定量分析1:NOM组;2:HFD组;3:SFN低剂量组;4:SFN中剂量组;5:SFN高剂量组;6:PPC组;a:P < 0.01,与NOM组比较;b:P < 0.01,与HFD组比较 图 4 Western blot检测大鼠肝脏中DGAT2和ACAT1蛋白表达 |
2.3 SFN抑制PLIN2和PLIN5基因的表达
与NOM组比较,HFD显著上调了PLIN2、PLIN3和PLIN5 mRNA的表达,分别是NOM组的1.44倍(P < 0.01)、1.25倍(P < 0.01)和1.28倍(P < 0.01);与HFD组比较,SFN仅对PLIN2和PLIN5的表达有显著抑制作用,高剂量SFN降低PLIN2 mRNA的表达(P < 0.01),中剂量和高剂量SFN则明显抑制PLIN5 mRNA的表达(P < 0.05,图 5)。
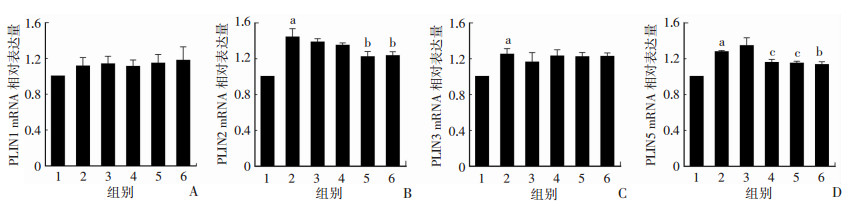
|
| A:PLIN1;B:PLIN2;C:PLIN3;D:PLIN5 1:NOM组;2:HFD组;3:SFN低剂量组;4:SFN中剂量组;5:SFN高剂量组;6:PPC组;a:P < 0.01,与NOM组比较;b:P < 0.01,c:P < 0.05,与HFD组比较 图 5 Real-time PCR检测大鼠肝脏PLIN1、PLIN2、PLIN3、PLIN5 mRNA表达 |
2.4 SFN抑制PLIN2和PLIN5蛋白的表达
采用免疫组化观察PLIN1、PLIN2、PLIN3和PLIN5在肝组织的定位和表达。PAT家族蛋白阳性表达呈黄褐色,均表达于胞浆内;与NOM组比较,HFD组大鼠肝脏中PLIN2、PLIN3和PLIN5表达上调,分别是NOM组的6.35倍(P < 0.01)、3.03倍(P < 0.01)和6.76倍(P < 0.01);与HFD组比较,高剂量SFN组大鼠的肝组织中PLIN2和PLIN5表达则明显下调(P < 0.05,图 6、7)。
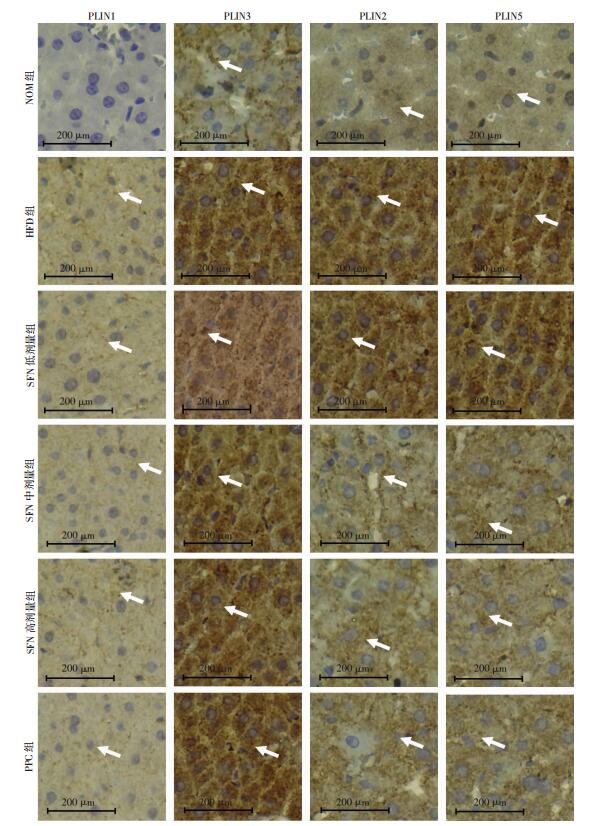
|
| 箭头示阳性表达 图 6 免疫组化染色观察大鼠肝脏PLIN1、PLIN2、PLIN3和PLIN5蛋白表达(S-P) |
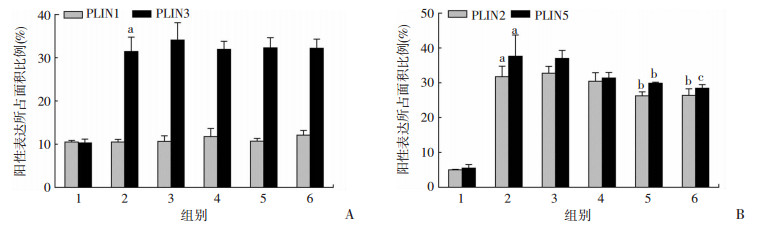
|
| A: PLIN1、PLIN3蛋白表达;B:PLIN2、PLIN5蛋白表达1:NOM组;2:HFD组;3:SFN2低剂量组;4:SFN中剂量组;5:SFN高剂量组;6:PPC组;a:P < 0.01,与NOM组比较;b:P < 0.05,c:P < 0.01,与HFD组比较 图 7 PLIN1、PLIN2、PLIN3和PLIN5蛋白阳性表达所占面积比例 |
3 讨论
大量脂滴在肝脏中堆积是NAFLD较明显的特征之一,改善并减少脂滴的积累是防治NAFLD的研究重点。植物化学物对于改善脂质代谢有较为明显的作用,如一项涉及1 938名健康成年人的流行病学研究发现:摄入较多的植物化学物能明显降低体质量和体脂量[12]。研究表明SFN可促进白色脂肪的褐变,促进脂肪分解[6],SFN能改善四氯化碳所致的小鼠肝脏中转氨酶升高和脂质过氧化过程[13]。本课题组前期研究表明SFN能够改善急性酒精性肝损伤[14]。本研究采用高脂膳食诱导大鼠肝脏脂肪变性模型,研究SFN对于LDs积累的改善作用,结果显示:SFN不仅能够减少大鼠肝脏中LDs的核心—TG和TC的积累,下调合成TG和TC的关键酶DGAT2和ACAT1蛋白的表达,还可以降低LDs外周蛋白PLIN2和PLIN5的表达。这表明SFN既减少了LDs的脂肪核心,又下调了外周蛋白的表达,最终达到减少LDs的作用。
DGAT2定位于LDs和内质网之间的结合区域以催化甘油二酯合成TG并促进LDs的形成。在离体培养的哺乳动物细胞中,DGAT1和DGAT2的缺失会使脂肪细胞中LDs明显减少[15],这表明DGAT1和DGAT2可以促进LDs形成。研究表明SFN作用离体培养的脂肪细胞48 h,可以下调DGAT1的表达[6]。本研究中,SFN降低了肝脏中TG含量并抑制了DGAT2的表达,这提示SFN可能通过下调DGAT2抑制TG的合成。ACAT1是游离胆固醇转化为胆固醇酯的关键酶。ACAT1过量表达能增加肝脏总胆固醇和酯化胆固醇的含量[16]。ACAT1是调节脂质代谢的目标靶点之一,本研究中,SFN可以下调大鼠肝脏中ACAT1的表达。综上所述,SFN不仅抑制了LDs中性脂肪核心(TG和TC)的含量,而且下调了TG和TC的关键合成酶的表达。
PLINs蛋白是LDs单层磷脂膜上镶嵌的主要功能蛋白质。研究表明PLIN2有助于保持细胞TG的含量,这可能是由于其对脂肪分解的阻碍作用[10]。在HFD诱导PLIN2基因敲除小鼠脂肪变的模型中,肝细胞脂肪变性程度明显降低[17]。本研究发现SFN可以降低HFD诱导的大鼠肝脏中PLIN2的表达,该结果提示SFN可能通过抑制PLIN2的表达减少LDs的形成。研究表明PLIN5可能比PLIN2具有更强的抗脂解保护作用,其表达促进TG的积累。在肌肉中,PLIN5促进脂质储存并限制脂肪酸氧化,但是PLIN5在肝脏中的这种脂质保护作用尚未确定[18-19]。本研究发现SFN下调了高脂膳食诱导的大鼠肝脏中PLIN5的表达,这提示SFN可能通过对PLIN5的调控作用抑制LDs的形成。
综上所述,SFN作为一种具有多种生物学功能的植物化学物质,不仅可以降低高脂膳食诱导的大鼠肝脏中TG和TC的积累,而且下调了其关键合成酶DGAT2和ACAT1的表达。更重要的是,SFN还下调了LDs外周重要功能蛋白PLIN2和PLIN5的表达。今后的研究将围绕SFN对PLIN2和PLIN5表达调控的作用机制展开。
| [1] | FRIEDMAN S L, NEUSCHWANDER-TETRI B A, RINELLA M, et al. Mechanisms of NAFLD development and therapeutic strategies[J]. Nat Med, 2018, 24(7): 908–922. DOI:10.1038/s41591-018-0104-9 |
| [2] |
付丽娜, 张秋瓒. 非酒精性脂肪性肝病治疗进展[J].
实用医学杂志, 2017, 33(13): 2075–2078.
FU L N, ZHANG Q Z. Progress in the treatment of nonalcoholic fatty liver disease[J]. J Pract Med, 2017, 33(13): 2075–2078. DOI:10.3969/j.issn.1006-5725.2017.13.002 |
| [3] | GLUCHOWSKI N L, BECUWE M, WALTHER T C, et al. Lipid droplets and liver disease: from basic biology to clinical implications[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(6): 343–355. DOI:10.1038/nrgastro.2017.32 |
| [4] | ZHANG J C, YAO W, DONG C, et al. Prophylactic effects of sulforaphane on depression-like behavior and dendritic changes in mice after inflammation[J]. J Nutr Biochem, 2017, 39: 134–144. DOI:10.1016/j.jnutbio.2016.10.004 |
| [5] | CHOI K M, LEE Y S, KIM W, et al. Sulforaphane attenuates obesity by inhibiting adipogenesis and activating the AMPK pathway in obese mice[J]. J Nutr Biochem, 2014, 25(2): 201–207. DOI:10.1016/j.jnutbio.2013.10.007 |
| [6] | ZHANG H Q, CHEN S Y, WANG A S, et al. Sulforaphane induces adipocyte browning and promotes glucose and lipid utilization[J]. Mol Nutr Food Res, 2016, 60(10): 2185–2197. DOI:10.1002/mnfr.201500915 |
| [7] | HARRIS C A, HAAS J T, STREEPER R S, et al. DGAT enzymes are required for triacylglycerol synthesis and lipid droplets in adipocytes[J]. J Lipid Res, 2011, 52(4): 657–667. DOI:10.1194/jlr.M013003 |
| [8] | ZHU Y Y, CHEN C Y, LI J J, et al. In vitro exploration of ACAT contributions to lipid droplet formation during adipogenesis[J]. J Lipid Res, 2018, 59(5): 820–829. DOI:10.1194/jlr.M081745 |
| [9] | PLOEN D, HAFIRASSOU M L, HIMMELSBACH K, et al. TIP47 is associated with the hepatitis C virus and its interaction with Rab9 is required for release of viral particles[J]. Eur J Cell Biol, 2013, 92(12): 374–382. DOI:10.1016/j.ejcb.2013.12.003 |
| [10] | SZTALRYD C, KIMMEL A R. Perilipins: lipid droplet coat proteins adapted for tissue-specific energy storage and utilization, and lipid cytoprotection[J]. Biochimie, 2014, 96: 96–101. DOI:10.1016/j.biochi.2013.08.026 |
| [11] | MANE D R, KALE A D, BELALDAVAR C. Validation of immunoexpression of tenascin-C in oral precancerous and cancerous tissues usingImageJ analysis with novel immunohistochemistry profiler plugin: an immunohistochemical quantitative analysis[J]. J Oral Maxillofac Pathol, 2017, 21(2): 211–217. DOI:10.4103/jomfp.JOMFP_234_16 |
| [12] | MIRMIRAN P, BAHADORAN Z, GOLZARAND M, et al. Association between dietary phytochemical index and 3-year changes in weight, waist circumference and body adiposity index in adults: tehran lipid and glucose study[J]. Nutr Metab (Lond), 2012, 9(1): 108. DOI:10.1186/1743-7075-9-108 |
| [13] | BAEK S H, PARK M, SUH J H, et al. Protective effects of an extract of young radish (Raphanus sativus L) cultivated with sulfur (sulfur-radish extract) and of sulforaphane on carbon tetrachloride-induced hepatotoxicity[J]. Biosci Biotechnol Biochem, 2008, 72(5): 1176–1182. DOI:10.1271/bbb.70545 |
| [14] |
李宝龙, 田思聪, 谭洁, 等. 绿花椰菜片剂中莱菔硫烷含量测定及对急性酒精性肝损伤的保护作用[J].
浙江大学学报(农业与生命科学版), 2013, 39(2): 197–202.
LI B L, TIAN S C, TAN J, et al. Quantitative determination of sulforaphane from broccoli extract tablets and its role in the protection of acute liver injury induced by ethanol[J]. J Zhejiang Univ(Agr Life Sci), 2013, 39(2): 197–202. DOI:10.3785/j.issn.1008-9209.2012.11.613 |
| [15] | HUNG Y H, CARREIRO A L, BUHMAN K K. Dgat1 and Dgat2 regulate enterocyte triacylglycerol distribution and alter proteins associated with cytoplasmic lipid droplets in response to dietary fat[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2017, 1862(6): 600–614. DOI:10.1016/j.bbalip.2017.02.014 |
| [16] | YANG W, BAI Y B, XIONG Y, et al. Potentiating the antitumour response of CD8(+) T cells by modulating cholesterol metabolism[J]. Nature, 2016, 531(7596): 651–655. DOI:10.1038/nature17412 |
| [17] | MCMANAMAN J L, BALES E S, ORLICKY D J, et al. Perilipin-2-null mice are protected against diet-induced obesity, adipose inflammation, and fatty liver disease[J]. J Lipid Res, 2013, 54(5): 1346–1359. DOI:10.1194/jlr.M035063 |
| [18] | FENG Y Z, LUND J, LI Y C, et al. Loss of perilipin 2 in cultured myotubes enhances lipolysis and redirects the metabolic energy balance from glucose oxidation towards fatty acid oxidation[J]. J Lipid Res, 2017, 58(11): 2147–2161. DOI:10.1194/jlr.M079764 |
| [19] | LAURENS C, BOURLIER V, MAIRAL A, et al. Perilipin 5 fine-tunes lipid oxidation to metabolic demand and protects against lipotoxicity in skeletal muscle[J]. Sci Rep, 2016, 6: 38310. DOI:10.1038/srep38310 |



