2. 221004 江苏 徐州,徐州医科大学生物学教研室
2. Department of Biology, Xuzhou Medical University, Xuzhou, Jiangsu Province, 221004, China
胚胎干细胞(embryonic stem cell,ES细胞)具有自我更新、无限增殖和多分化潜能等特点,其可分化为外胚层,进而分化为神经胶质细胞等几乎所有类型的细胞[1-2]。据报道,将ES细胞凝聚成拟胚体并置于含生长因子等适当微环境中培养,可诱导其分化为星形胶质细胞和神经元等[3]。神经细胞是一种高度分化的细胞,一旦损伤便难以恢复,而在神经退行性疾病、中风等疾病发生时常伴随着神经细胞的凋亡[4]。因此,通过定向诱导胚胎干细胞分化为神经细胞在神经退行性疾病治疗的研究中备受关注。已有研究表明:多种小分子物质可通过调节细胞分化相关信号转导途径,调控小鼠ES细胞的定向分化[5-6]。异补骨脂甲素(isobavachin,IBA)是一种异戊烯基黄酮类化合物,具有促进小鼠ES细胞分化成神经元和星形胶质细胞的作用[7]。八聚体转录因子4(octamer transcription factor-4,OCT4)为Pou家族的一员,为维持调控胚胎干细胞的全能型及自我更新中最重要的转录因子[8]。神经微丝H(neurofilament-H,NFH)在神经元胞体或轴突近胞体侧轴突中堆积被视为运动神经元疾病和神经元轴突降解的标志物[9-10]。BTB型锌指蛋白在进化上高度保守,如今将含有BTB结构域的锌指蛋白命名为C2H2型锌指家族,其通过与其他转录或辅助转录的因子形成复合物,参与转录的调节[11]。锌指蛋白18(zinc finger and BTB domain containing 18, ZBTB18)为该家族基因中的一员,其在神经分化中具有至关重要的作用[12-13]。但IBA诱导ES细胞向神经细胞分化与ZBTB18之间的作用关系尚不明确。本研究采用qRT-PCR和免疫荧光染色等方法检测IBA诱导的小鼠J1胚胎干细胞(J1细胞)中miR-124表达的变化,观察miR-124及其靶基因ZBTB18对J1细胞OCT4和NFH表达的影响,以探讨IBA诱导J1细胞向神经细胞分化的潜在分子机制。
1 材料与方法 1.1 材料小鼠J1胚胎干细胞购自美国ATCC,IBA纯度为95%~99%,购自成都普瑞法科技开发公司;胎牛血清、非必需氨基酸、DMEM高糖培养基、胰蛋白酶购自美国Gibco公司;巯基乙醇、DAPI染色剂、谷氨酰胺购自美国Sigma公司;TRIzol总RNA提取试剂盒、LipofectamineTM 2000转染试剂购自美国Invitrogen公司;TaKaRa反转录试剂盒(批号:RR047A)、TaKaRa实时荧光定量试剂盒(批号:RR820A)购自宝生物工程(大连)有限公司;PVDF膜、ECL发光液、RIPA裂解液、结晶紫、4%多聚甲醛购自北京Solarbio公司;双荧光素酶检测试剂盒购自美国Promega公司;ZBTB18 3′-UTR野生型及突变型质粒由上海汉恒生物有限公司构建;兔抗ZBTB18多克隆抗体购自上海煊翎生物科技公司;兔抗人β-actin多克隆抗体购自上海信帆生物科技有限公司;shRNA-ZBTB18和pcDNA-ZBTB18质粒由金瑞斯生物科技公司构建;control mimics、miR-124 mimics、control mimics、miR-124 mimics由上海吉玛公司设计合成;MCO-18AC型CO2培养箱购自日本SANYO公司;NanoDrop微量核酸测定仪购自上海创萌生物科技有限公司;荧光显微镜购自上海炳宇光学仪器有限公司。
1.2 细胞培养与转染J1细胞使用含15%胎牛血清、2 mmol/L谷氨酰胺、100 μmol/L巯基乙醇、1%非必需氨基酸的DMEM培养基于37 ℃、5% CO2饱和湿度条件下培养,每天更换新鲜培养基。取对数生长期的细胞,0.25%胰酶消化后离心收集,以1×105/mL接种于24孔板,按照Lipofect-amineTM 2000转染试剂说明书分别将control inhibitors、miR-124 inhibitors、control mimics、miR-124 mimics、pcDNA 3.1空载体、pcDNA 3.1- ZBTB18过表达载体、miR-124 inhibitors和scrambled shRNA、miR-124 inhibitors和ZBTB18 shRNA转染至J1细胞后,加入IBA并调整终浓度为1×10-7 mol/L,继续培养24 h,依次标记为anti-miR-con组、anti-miR-124组、miR-con组、miR-124组、pcDNA组、pcDNA-ZBTB18组、anti-miR-124+shRNA组和anti-miR-124+shZBTB18组;未转染的J1细胞培养基中加入0.1%的溶剂DMSO继续培养,记为DMSO组;未转染的J1细胞培养基中含终浓度为1×10-7 mol/L的IBA继续培养,记为IBA组。
1.3 qRT-PCR检测收集DMSO组、IBA组、anti-miR-con组、anti-miR-124组细胞,加入TRIzol试剂,提取总RNA,微量核酸测定仪检测RNA纯度和浓度。按照TaKaRa反转录试剂盒说明书将RNA反转录成cDNA并使用TaKaRa荧光定量试剂盒配制反应体系,以β-actin为内参,置于ABI-7300实时荧光定量PCR仪上进行扩增,每个样品重复3次,实验结果分析采用2-△△Ct法。β-actin引物:上游5′-AGTGTGACGTGGACATCCGCAAAG-3′,下游5′-ATCCACATCTGCTGGAAGGTGGAC-3′,139 bp;miR-124引物:上游5′-GCTTAAGGCACGCGGT-3′,下游5′-GTGCAGGGTCCGAGGT-3′, 155 bp。
1.4 免疫荧光染色观察各组细胞使用-20 ℃预冷甲醇固定15 min,含10%胎牛血清的PBS封闭1 h,加入一抗(1 :100),4 ℃孵育过夜;PBS洗涤3次,每次5 min;加入罗丹明标记的二抗(1 :100),室温孵育2 h,PBS洗涤;加入DAPI染色剂染色1 min后荧光显微镜观察,激发光472 ~475 nm,拍照记录。
1.5 双荧光素酶报告基因检测收集J1细胞,按照LipofectamineTM2000转染试剂说明书将ZBTB18 3′-UTR野生型或突变型质粒分别与control mimics和miR-124 mimics共转染,常规培养48 h。加入细胞裂解液裂解后4 ℃、12 000×g离心10 min,收集上清液并检测荧光素酶活性,相对荧光强度=萤火虫荧光强度/海肾荧光强度。
1.6 Western blot检测收集anti-miR-con组、anti-miR-124组、miR-con组、miR-124组、pcDNA组、pcDNA-ZBTB18组、anti-miR-124+shRNA组和anti-miR-124+shZBTB18组细胞,加入RIPA裂解液于冰上裂解30 min,4 ℃、12 000×g离心15 min取上清。将蛋白样品进行SDS-PAGE电泳后转至PVDF膜上,5%脱脂奶粉封闭液室温封闭1 h;分别加入兔抗ZBTB18多克隆抗体(1 :1 000)、兔抗人β-actin多克隆抗体(1 :1 000),4 ℃孵育过夜;TBST洗膜,加入辣根过氧化物酶(HRP)标记的二抗(1 :5 000)室温孵育2 h;TBST洗膜后ECL曝光显影,实验重复3次。
1.7 统计学分析采用SPSS 22.0统计软件,数据以x ±s表示,两组间数据比较采用Student-t检验,多组间数据比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 IBA对J1细胞中miR-124、OCT4和NFH表达的影响免疫组化染色结果(表 1,图 1)表明:IBA组细胞OCT4阳性表达率降低,NFH阳性表达率升高(P < 0.01)。qRT-PCR检测结果显示:经IBA处理的细胞中miR-124表达显著高于DMSO组(P < 0.01, 表 1)。
| 组别 | miR-124表达 | OCT4阳性率(%) | NFH阳性率(%) |
| DMSO组 | 0.62±0.14 | 82.16±6.91 | 4.56±0.91 |
| IBA组 | 4.67±0.51 | 3.42±0.72 | 85.16±5.16 |
| t值 | 13.264 | 19.631 | 26.644 |
| P值 | < 0.001 | < 0.001 | < 0.001 |
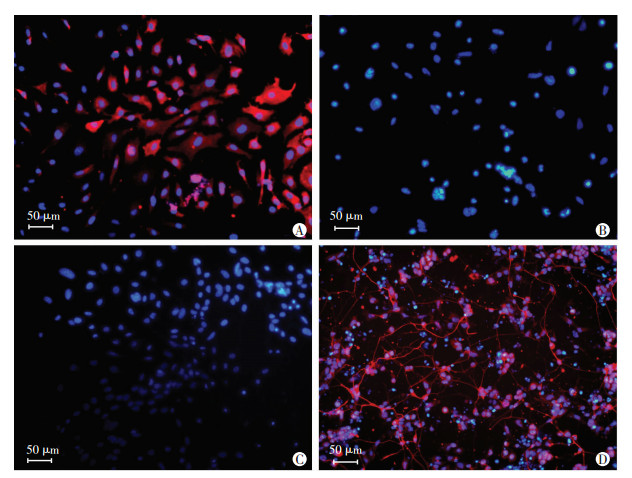
|
| A、B:分别为DMSO组细胞中OCT4、NFH表达;C、D:分别为IBA组细胞中OCT4、NFH表达 图 1 免疫荧光观察OCT4和NFH在J1细胞中的表达 |
2.2 抑制miR-124表达对IBA干预的J1细胞中OCT4和NFH表达的影响
将miR-124 inhibitors转染至J1细胞进行预处理后,IBA处理的J1细胞中miR-124表达下调,OCT4阳性表达率显著升高,NFH阳性表达率显著降低(P < 0.01,表 2)。
| 组别 | miR-124表达 | OCT4阳性率(%) | NFH阳性率(%) |
| anti-miR-con组 | 1.00±0.11 | 4.75±0.82 | 86.17±9.24 |
| anti-miR-124组 | 0.23±0.04 | 76.28±8.46 | 6.49±0.88 |
| t值 | 11.394 | 14.576 | 14.869 |
| P值 | < 0.001 | < 0.001 | < 0.001 |
2.3 miR-124靶向调控ZBTB18表达
Targetscan在线预测发现:ZBTB18 3′-UTR上存在miR-124的结合位点(图 2A),采用Western blot和双荧光素酶报告基因实验验证miR-124和ZBTB18的靶向关系,结果表明:在J1细胞中,miR-124可负向调控ZBTB18蛋白表达(图 2B,表 3);共转染miR-124 mimics和ZBTB18 3′-UTR WT的细胞荧光素酶活性(0.37±0.05)显著低于共转染control mimics和ZBTB18 3′-UTR WT的细胞(1.00±0.12,t=8.394,P < 0.05),miR-124 mimics或control mimics与ZBTB18 3′-UTR MUT共转染后,两组细胞荧光素酶活性分别为(0.99±0.13)和(0.93±0.15),差异无统计学意义(t=0.524,P>0.05)。
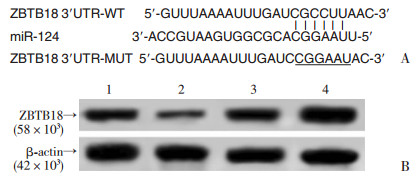
|
| A: Targetscan在线预测miR-124与ZBTB18的结合位点;B: Western blot检测各组细胞中ZBTB18蛋白表达1:miR- con组;2;miR-124组;3:anti-miR-con组;anti-miR-124组 图 2 miR-124靶向调控ZBTB18的蛋白表达 |
| 组别 | ZBTB18蛋白表达 |
| miR-con组 | 1.00±0.12 |
| miR-124组 | 0.39±0.08a |
| anti-miR-con组 | 1.16±0.12 |
| anti-miR-124组 | 1.67±0.17b |
| F值 | 52.075 |
| P值 | < 0.001 |
| a:P < 0.05,与miR-con组比较; b:P < 0.05与anti-miR-con组比较 | |
2.4 过表达ZBTB18对IBA干预的J1细胞中OCT4和NFH表达的影响
将pcDNA 3.1-ZBTB18过表达载体转染至J1细胞进行预处理后,IBA干预的J1细胞中ZBTB18蛋白表达和OCT4阳性表达率显著升高,NFH阳性表达率显著降低(P < 0.05,图 3、4,表 4)。
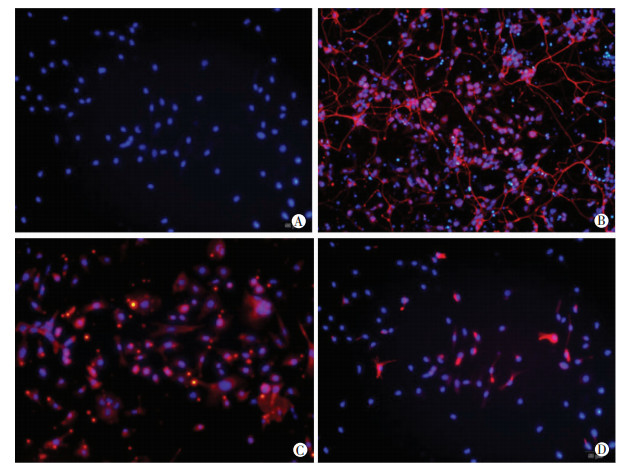
|
| A、B:分别为pcDNA组细胞中OCT4、NFH表达;C、D:分别为pcDNA-ZBTB18组细胞中OCT4、NFH表达 图 3 免疫荧光观察过表达ZBTB18对IBA干预的J1细胞OCT4和NFH表达的影响(×100) |

|
| 1: pcDNA组; 2: pcDNA-ZBTB18组 图 4 Western blot检测各组细胞中ZBTB18蛋白表达 |
| 组别 | ZBTB18蛋白表达 | OCT4阳性率(%) | NFH阳性率(%) |
| pcDNA组 | 1.00±0.10 | 6.27±0.86 | 88.77±7.34 |
| pcDNA-ZBTB18组 | 1.84±0.36 | 81.44±6.18 | 5.73±0.72 |
| t值 | 3.894 | 20.867 | 19.502 |
| P值 | 0.018 | < 0.001 | < 0.001 |
2.5 过表达miR-124和敲减ZBTB18对IBA处理J1细胞中OCT4和NFH表达的影响
在IBA干预的J1细胞中抑制miR-124表达后,ZBTB18蛋白表达和OCT4阳性表达率显著升高(P < 0.05),NFH阳性表达率显著降低(P < 0.05);沉默ZBTB18可在一定程度上减弱miR-124对IBA干预的J1细胞中ZBTB18、OCT4和NFH蛋白表达的调控作用(P < 0.05,图 5, 表 5)。

|
| 1: anti-miR-con组;2:anti-miR-124组;3:anti-miR-124+shRNA组;4:anti-miR-124+shZBTB18组 图 5 Western blot检测各组细胞中ZBTB18蛋白表达 |
| 组别 | ZBTB18蛋白表达 | OCT4阳性率(%) | NFH阳性率(%) |
| anti-miR-con组 | 1.00±0.10 | 5.34±0.78 | 85.71±8.29 |
| anti-miR-124组 | 1.79±0.06a | 74.23±8.36a | 8.94±1.04a |
| anti-miR-124+shRNA组 | 1.83±0.08 | 78.19±7.08 | 8.69±0.96 |
| anti-miR-124+shZBTB18组 | 1.59±0.07b | 35.47±3.16b | 54.61±6.59b |
| F值 | 70.695 | 109.515 | 148.809 |
| P值 | < 0.001 | < 0.001 | < 0.001 |
| a:P < 0.05,与anti-miR-con组比较; b:P < 0.05,与anti-miR-124+shRNA组比较 | |||
3 讨论
微小RNA(miRNA)是一种普遍存在于真核细胞中的内源性非编码RNA分子,能够通过与靶mRNA 3′非编码区(3′-UTR)结合,调节下游靶基因的表达,参与胚胎发育、机体生长和疾病发生等生命活动[14]。近年来,越来越多的研究表明miRNA在神经系统发育及神经元分化过程中起重要的调节作用[15]。miR-124是一种特异表达于脑组织的RNA分子,在人大脑皮层中含量最高,约占脑组织miRNA总量的25%~48%[16]。miR-124在神经元发育过程中具有促进干细胞向神经元分化和神经元突起延伸的作用,并且能够减轻神经损伤,促进损伤后修复[17-18]。JIANG等[19]研究发现:miR-124能够促进小鼠内耳神经干细胞向神经元分化和突起生长;WANG等[20]检测结果表明:miR-124可通过调节神经元特异性烯醇化酶和胶质细胞原纤维酸性蛋白表达,促进脂肪间充质干细胞分化为神经细胞。OCT4是维持ES细胞自我更新和多分化潜能的关键分子,特异表达于全能ES细胞[21];NFH是含量丰富的神经元细胞骨架蛋白,对神经元结构完整性的维持至关重要[22]。本研究中,IBA干预的J1细胞中miR-124和NFH表达上调,OCT4表达下调,且抑制miR-124表达可减弱IBA对J1细胞OCT4表达的抑制及NFH表达的促进作用。进一步使用Targetscan在线预测、双荧光素酶报告基因实验及Western blot验证发现:miR-124可靶向调控ZBTB18蛋白表达。
ZBTB属于锌指蛋白(zinc-finger protein)家族,锌指蛋白家族是一类含“手指状”结构域的转录因子,广泛存在于真核生物中,在基因表达、细胞分化、胚胎发育等生物过程中起重要的调节作用[23]。ZBTB亚族成员在N端含有一个BTB结构域、在C端含有一个或多个C2H2型锌指(ZF)结构域,包含ZBTB17、ZBTB20、ZBTB32等多个成员,是进化上高度保守的转录因子[24]。BTB结构域可与BCL-6共抑制因子样蛋白、C-末端结合蛋白1和核受体辅助抑制因子1/2等相互作用,从而调节染色质重塑和基因表达[25];而ZF结构域能够识别特异性DNA序列[26]。据报道,ZBTB38有助于ES细胞维持分化潜能,促进胚胎细胞分化等作用;而ZBTB20在新生海马神经元细胞中高表达,ZBTB20的缺失能够引起海马发育障碍[27-28]。COHEN等[29]通过检测发现:在智力残疾患者中ZBTB18基因发生突变或缺失;ZBTB18基因突变易引起大脑胼胝体及小脑发育异常[30]。本研究结果表明:过表达ZBTB18可使IBA干预的J1细胞中OCT4阳性表达率升高,NFH阳性表达率降低;敲减ZBTB18可在一定程度上减弱miR-124对IBA干预的J1细胞中OCT4和NFH表达的调控作用。
综上所述,IBA可诱导小鼠J1细胞向神经细胞分化,其机制可能与调控miR-124/ZBTB18通路有关,这一研究结果为IBA在临床的应用奠定了理论基础。
| [1] | YANG P H, CHEN X, KAUSHAL S, et al. High glucose suppresses embryonic stem cell differentiation into cardiomyocytes[J]. Stem Cell Res Ther, 2016, 7: 187. DOI:10.1186/s13287-016-0446-5 |
| [2] | HU J, YANG Z Y, WANG J B, et al. Zinc chloride transiently maintains mouse embryonic stem cell pluripotency by activating stat3 signaling[J]. PLoS ONE, 2016, 11(2): e0148994. DOI:10.1371/journal.pone.0148994 |
| [3] | ANTONOV S A, MANUILOVA E S, DOLOTOV O V, et al. Effect of nerve growth factor on neural differentiation of mouse embryonic stem cells[J]. Bull Exp Biol Med, 2017, 162(5): 679–683. DOI:10.1007/s10517-017-3686-1 |
| [4] | GUIDOLIN D, TORTORELLA C, MARCOLI M, et al. Neuroglobin, a factor playing for nerve cell survival[J]. Int J Mol Sci, 2016, 17(11): E1817. DOI:10.3390/ijms17111817 |
| [5] | LIU Z J, JIANG Y Y, LI X Y, et al. Embryonic stem cell-derived peripheral auditory neurons form neural connections with mouse central auditory neurons in vitro via the α2δ1 receptor[J]. Stem Cell Rep, 2018, 11(1): 157–170. DOI:10.1016/j.stemcr.2018.05.006 |
| [6] | HUANG M L, MICHALAK A L, FISHER C J, et al. Small molecule antagonist of cell surface glycosaminoglycans restricts mouse embryonic stem cells in a pluripotent state[J]. Stem Cells, 2018, 36(1): 45–54. DOI:10.1002/stem.2714 |
| [7] | WANG D Y, HU Y Z, KONG S S, et al. Promoting effects of isobavachin on neurogenesis of mouse embryonic stem cells were associated with protein prenylation[J]. Acta Pharmacol Sin, 2011, 32(4): 425–432. DOI:10.1038/aps.2011.5 |
| [8] | WANG X, ZHAO Y N, XIAO Z F, et al. Alternative translation of OCT4 by an internal ribosome entry site and its novel function in stress response[J]. Stem Cells, 2009, 27(6): 1265–1275. DOI:10.1002/stem.58 |
| [9] | CHIN T K, HARDING S E, EAGLES P A. Characterization of two proteolytically derived soluble polypeptides from the neurofilament triplet components NFM and NFH[J]. Biochem J, 1989, 264(1): 53–60. DOI:10.1042/bj2640053 |
| [10] |
李建宁, 任维, 刘一辉. 外周神经系统中神经微丝蛋白研究现状[J].
山东医药, 2012, 52(27): 88–90.
LI J N, REN W, LIU Y H. Current status of research on neurofilament proteins in peripheral nervous system[J]. Shandong Med J, 2012, 52(27): 88–90. DOI:10.3969/j.issn.1002-266X.2012.27.035 |
| [11] | CARRO M S, LIM W K, ALVAREZ M J, et al. The transcriptional network for mesenchymal transformation of brain tumours[J]. Nature, 2010, 463(7279): 318–325. DOI:10.1038/nature08712 |
| [12] | TATARD V M, XIANG C M, BIEGEL J A, et al. ZNF238 is expressed in postmitotic brain cells and inhibits brain tumor growth[J]. Cancer Res, 2010, 70(3): 1236–1246. DOI:10.1158/0008-5472.CAN-09-2249 |
| [13] | XIANG C, BAUBET V, PAL S, et al. RP58/ZNF238 directly modulates proneurogenic gene levels and is required for neuronal differentiation and brain expansion[J]. Cell Death Differ, 2012, 19(4): 692–702. DOI:10.1038/cdd.2011.144 |
| [14] | GULYAEVA L F, KUSHLINSKIY N E. Regulatory mechanisms of microRNA expression[J]. J Transl Med, 2016, 14: 143. DOI:10.1186/s12967-016-0893-x |
| [15] | YANG H, ZHANG L L, AN J, et al. MicroRNA-mediated reprogramming of somatic cells into neural stem cells or neurons[J]. Mol Neurobiol, 2017, 54(2): 1587–1600. DOI:10.1007/s12035-016-0115-9 |
| [16] | GONZÁLEZ-GIRALDO Y, CAMARGO A, LÓPEZ-LEÓN S, et al. A functional SNP in MIR124-1, a brain expressed miRNA gene, is associated with aggressiveness in a Colombian sample[J]. Eur Psychiatry, 2015, 30(4): 499–503. DOI:10.1016/j.eurpsy.2015.03.002 |
| [17] |
杨俊娜, 何丽, 徐陶, 等. miR-124在神经系统发育、损伤及修复中作用的研究进展[J].
山东医药, 2018, 58(20): 100–103.
YANG J N, HE L, XU T, et al. Update of miR-124 in the development, injury and repair of nervous system[J]. Shandong Med J, 2018, 58(20): 100–103. DOI:10.3969/j.issn.1002-266X.2018.20.034 |
| [18] | WANG C M, WEI Z J, JIANG G H, et al. Neuroprotective mechanisms of miR-124 activating PI3K/Akt signaling pathway in ischemic stroke[J]. Exp Ther Med, 2017, 13(6): 3315–3318. DOI:10.3892/etm.2017.4424 |
| [19] | JIANG D, DU J T, ZHANG X M, et al. MiR-124 promotes the neuronal differentiation of mouse inner ear neural stem cells[J]. Int J Mol Med, 2016, 38(5): 1367–1376. DOI:10.3892/ijmm.2016.2751 |
| [20] | WANG Y, WANG D S, GUO D W. MiR-124 promote neurogenic transdifferentiation of adipose derived mesenchymal stromal cells partly through RhoA/ROCK1, but not ROCK2 signaling pathway[J]. PLoS ONE, 2016, 11(1): e0146646. DOI:10.1371/journal.pone.0146646 |
| [21] | RIZZINO A, WUEBBEN E L. Sox2/Oct4: A delicately balanced partnership in pluripotent stem cells and embryogenesis[J]. Biochim Biophys Acta, 2016, 1859(6): 780–791. DOI:10.1016/j.bbagrm.2016.03.006 |
| [22] | LI D W, SHEN D C, TAI H F, et al. Neurofilaments in CSF as diagnostic biomarkers in motor neuron disease: a meta-analysis[J]. Front Aging Neurosci, 2016, 8: 290. DOI:10.3389/fnagi.2016.00290 |
| [23] |
王伟英, 李海明, 戴艺民, 等. 植物锌指蛋白的功能研究进展[J].
中国园艺文摘, 2016, 32(7): 3–5, 12.
WANG W Y, LI H M, DAI Y M, et al. Advances on the function of plant zinc finger protein[J]. Chin Hort Abstr, 2016, 32(7): 3–5, 12. DOI:10.3969/j.issn.1672-0873.2016.07.002 |
| [24] | ZHU C, CHEN G, ZHAO Y, et al. Regulation of the development and function of B cells by ZBTB transcription factors[J]. Front Immunol, 2018, 9: 580. DOI:10.3389/fimmu.2018.00580 |
| [25] | MATHEW R, SEILER M P, SCANLON S T, et al. BTB-ZF factors recruit the E3 ligase cullin 3 to regulate lymphoid effector programs[J]. Nature, 2012, 491(7425): 618–621. DOI:10.1038/nature11548 |
| [26] | MAEDA T. Regulation of hematopoietic development by ZBTB transcription factors[J]. Int J Hematol, 2016, 104(3): 310–323. DOI:10.1007/s12185-016-2035-x |
| [27] |
赵倩倩, 班博, 邵倩. 锌指蛋白ZBTB38调控生长发育相关研究进展[J].
中国儿童保健杂志, 2018, 26(1): 44–47.
ZHAO Q Q, BAN B, SHAO Q. Research advances on zinc finger protein ZBTB38 regulating growth and development[J]. Chin J Child Health Care, 2018, 26(1): 44–47. |
| [28] |
刘淦, 陈李斌佶, 谢志芳, 等. 锌指蛋白ZBTB20生物学功能的研究进展[J].
第二军医大学学报, 2015, 36(5): 525–529.
LIU G, CHEN L, XIE Z F, et al. Biological functions of zinc finger protein ZBTB20: recent advance[J]. Acad J Second Mil Med Univ, 2015, 36(5): 525–529. DOI:10.3724/SP.J.1008.2015.00525 |
| [29] | COHEN J S, SRIVASTAVA S, FARWELL HAGMAN K D, et al. Further evidence that de novo missense and truncating variants in ZBTB18 cause intellectual disability with variable features[J]. Clin Genet, 2017, 91(5): 697–707. DOI:10.1111/cge.12861 |
| [30] | VAN DER SCHOOT V, DE MUNNIK S, VENSELAAR H, et al. Toward clinical and molecular understanding of pathogenic variants in the ZBTB18 gene[J]. Mol Genet Genomic Med, 2018, 6(3): 393–400. DOI:10.1002/mgg3.387 |



