平原人群快速进入海拔2 500 m以上高原地区时,会出现急性高原病,其中高原肺水肿(high altitude pulmonary edema,HAPE)是一种严重威胁急进高原人群健康的危急重症。HAPE一般在进入高原72 h之内发生,如果救治不及时,可在短时间内发展成为呼吸衰竭,甚至死亡,是急进高原人群最主要的死亡原因[1]。在急进海拔3 700 m以上地区的人群中,HAPE的发病率可达0.4%~2%[2]。研究表明,HAPE的发生存在明显的种族差异性和遗传易感性,提示遗传因素在HAPE的发生机制中发挥了重要作用[3]。目前,HAPE的遗传易感标志物是研究的前沿与热点,但现有研究多为以候选基因多态性为基础的风险关联研究,其具体机制尚未阐明。
与核基因组相比,线粒体拥有自己独立的DNA遗传体系,其DNA变异也显著影响着线粒体功能的正常发挥。本课题组前期研究发现,线粒体DNA(mitochondrion DNA,mtDNA)变异与中国汉族人群HAPE的遗传易感性显著相关。mtDNA3010位点是中国汉族人群HAPE的易感位点,A等位基因在汉族人群中的频率为22.9%,是HAPE的保护因素,而G等位基因在汉族人群中的频率为77.1%,是HAPE的危险因素[4]。为进一步探索mtDNA3010A/G变异在HAPE发生中的机制,本研究旨在以无线粒体细胞(ρ0206细胞)为载体,构建血小板-线粒体融合细胞并建立融合细胞急性缺氧模型,通过分析活性氧(reactive oxygen species, ROS)、线粒体膜电位(mitochondrial membrane potential,MMP)、三磷酸腺苷(adenosine triphosphate,ATP)含量、线粒体拷贝数、电压依赖性阴离子通道蛋白-1(voltage-dependent anion channel1, VDAC1)和Bax蛋白以及能量代谢相关基因等功能变化来探讨mtDNA3010A/G变异对线粒体功能的影响,为后期深入探索线粒体在肺水肿发病机制中的作用提供新的思路和靶点。
1 材料与方法 1.1 主要材料全血基因组提取试剂盒购于美国Omega公司,细胞总RNA提取试剂盒TRIzol购于美国Invitrogen公司,RNA逆转录试剂盒、SYBR Green与普通PCR试剂盒购于TaKaRa公司;DMEM高糖培养基(不含丙酮酸钠)购于美国康宁公司,丙酮酸钠和尿嘧啶购于美国Sigma公司,胎牛血清购于德国PAN公司,透析型胎牛血清(dialyzed fetal bovine serum,DFBS)购于美国Gibco公司,聚乙二醇(PEG)购于美国Roche公司;BCA蛋白测定试剂盒购于江苏凯基生物技术股份有限公司;兔抗人VDAC1抗体、兔抗人Bax蛋白抗体、兔抗人β-actin抗体以及HRP标记的羊抗兔二抗均购于美国Abcam公司;ECL化学发光试剂购于美国Millipore公司;细胞ROS测定试剂、ATP含量测定试剂以及MMP测定试剂均购于上海碧云天生物技术有限公司。
1.2 方法 1.2.1 mtDNA3010基因型筛选在评价mt3010位点变异的功能时,需要mt5178和mt10400两个位点为同一基因型。按照mt3010、mt5178和mt10400的顺序,筛选的mtDNA目的单倍型组合为A-C-C与G-C-C。根据线粒体基因组序列设计目的位点的扩增引物以及测序引物,见表 1。
| 位点 | 引物(5′→3′) | 扩增位置 | 产物长度/bp |
| 3010 | 上游:GTCCTAAACTACCAAACCTGC | 2 797~5 193 | 2 396 |
| 下游:GTGTTAGTCATGTTAGCTTG | |||
| 测序:ATGATGGCTAGGGTGACTTC | |||
| 5178 | 上游:AGCAGTTCTACCGTACAACC | 5 061~7 497 | 2 436 |
| 下游:TTTGAAAAAGTCATGGAGGCC | |||
| 测序:AGCAGTTCTACCGTACAACC | |||
| 10400 | 上游:TCCCACTCCTAAACACATCC | 9 611~12 111 | 2 500 |
| 下游:AAACCCGGTAATGATGTCGG | |||
| 测序:TCCCACTCCTAAACACATCC |
采用Omega试剂盒提取志愿者的静脉全血基因组DNA。采用普通PCR试剂盒和预先设计的扩增引物,扩增mt3010、mt5178和mt10400位点,产物经电泳鉴定后交由上海生工生物工程技术有限公司测序鉴定,根据测序结果确定进一步纳入实验的志愿者。
1.2.2 血小板介导的转线粒体模型制备细胞系及培养:ρ0206细胞由浙江大学管敏鑫教授惠赠。ρ0206细胞完全培养基为高糖DMEM(不含丙酮酸钠),含有10%FBS、1 mmol/L的丙酮酸钠与50 μg/mL的尿嘧啶。普通培养基为高糖DMEM(不含丙酮酸钠)与10%FBS。选择培养基为高糖DMEM(不含丙酮酸钠)与10%的DFBS。ρ0206细胞在常氧条件下培养,每2~3天换液1次,根据细胞生长状态及密度每周传代1~2次。细胞鉴定:取对数期生长的细胞传代,接种于3 cm的培养皿中培养,分别加入含/不含尿嘧啶的培养基。1 d后未加尿嘧啶的细胞全部死亡,而加入尿嘧啶的细胞正常生长。为进一步鉴定细胞,取对数期生长的ρ0206细胞提取全基因组DNA。鉴定采用mtDNA编码的NADH脱氢酶亚基1 (ND1)基因,上游5′-ATACAACTACGCAAAGGCCCCA-3′,下游5′-AATAGGAGGCCTAGGTTGAGGT-3′;内参选用β-actin,上游5′-CGGGAAATCGTGCGTGACAT-3′;下游5′-GAAGGAAGGCTGGAAGAGTG-3′。SYBR Green扩增ρ0206细胞全基因组DNA。可见β-actin基因的CT值为8,而ND1基因的CT值为30以上,表明细胞符合细胞融合要求,可以进行后续实验。人外周血小板分离:实验组为mtDNA3010-5178-10400(A-G-G)单倍型,对照组为mtDNA3010-5178-10400(G-G-G)单倍型。抽取志愿者的静脉全血10 mL,EDTA抗凝,12 ℃条件下1 100 r/min离心20 min,收集上3/4富含血小板的血浆,并在15 ℃条件下4 000 r/min离心20 min,去除上清,沉淀即为血小板,室温备用。细胞融合:收集50×104左右的ρ0206细胞,用2 mL无血清DMEM重悬,加到上一步获得的血小板沉淀上。室温900 r/min离心10 min,去上清。快速加入37 ℃预热的42%PEG溶液100 μL,轻柔吹打混匀1 min,室温静置30 s。加入10 mL ρ0206细胞完全培养基,重悬后将其分装至培养皿中继续培养。培养第3天换用选择培养基,未成功融合的细胞在换用选择培养基之后会迅速死亡。筛选时每3~5天用选择培养基换液,在第10~12天见到融合细胞增殖后,换用普通培养基继续培养,并分离快速生长的细胞克隆,使用普通培养基继续培养。融合细胞鉴定:提取两种融合细胞全基因组DNA,分别扩增mtDNA的3010、5178和10400位点,产物经电泳后交公司测序鉴定。测序结果表明成功构建了mtDNA3010-5178-10400(A-C-C与G-C-C)单倍型融合细胞,用于后续实验。
1.2.3 融合细胞缺氧后ROS、MMP和ATP含量测定两种融合细胞计数后, 取20×104的细胞接种于培养皿中,经1%O2缺氧培养24 h后,建立细胞急性缺氧模型。流式细胞仪测定ROS:mtDNA变异会影响ROS生成,进而影响线粒体功能[5]。本研究分析了mtDNA3010A/G变异对ROS的影响。按照ROS试剂盒说明书,分别设定阳性对照和测试细胞,处理完毕后统一上机检测。488 nm测定荧光强度以反映细胞内ROS水平,实验重复3次。流式细胞仪测定线粒体MMP:mtDNA变异同样会导致MMP的变化,影响线粒体的功能[5]。按照MMP试剂盒说明书,分别设定阳性对照和测试细胞,处理完毕后统一上机检测。488 nm测定荧光强度,并与阳性细胞对比,最终结果以百分比表示,实验重复3次。化学发光法测定ATP含量:根据ATP检测试剂盒说明书,配制ATP检测工作液和不同浓度梯度的标准品,冰上静置备用。BCA试剂盒测定两种融合细胞蛋白浓度。绘制ATP标准曲线后,将20 μL待测样品与100 mL ATP检测工作液混合,间隔2 s后置于化学发光检测仪分析,与标准曲线对比换算ATP含量,实验重复3次。
1.2.4 mt3010A基因型和mt3010G基因型融合细胞线粒体拷贝数测定按1.2.3方法建立细胞急性缺氧模型,分别测定其线粒体拷贝数。使用Omega试剂盒提取两种融合细胞的全基因组DNA。以ND1基因作为线粒体目的基因,内参引物选用β-actin,引物序列同1.2.2。具体方法见参考文献[6-7],实验重复3次。
1.2.5 Western blot检测融合细胞Bax蛋白和VDAC1蛋白表达水平VDAC1蛋白位于线粒体外膜,在调控细胞能量代谢和线粒体功能方面发挥着重要作用。VDAC1蛋白能与Bax蛋白结合影响线粒体膜的通透性,进而调控线粒体功能[8]。按1.2.3方法建立细胞急性缺氧模型。蛋白样品上样量50 μg,转膜后用特异的抗VDAC1(1:1 000)、抗Bax(1:1 000)和抗β-actin(1:2 000)于4 ℃条件下孵育过夜。TBST洗膜后,将膜放入二抗溶液中,其中羊抗兔二抗VDAC1(1:2 000)、Bax(1:2 000)和β-actin(1:5 000),室温下摇床孵育2 h。TBST洗膜3次后ECL曝光,Bio-Rad显像,实验重复3次。
1.2.6 RT-PCR检测融合细胞能量代谢基因表达按1.2.3方法建立细胞急性缺氧模型。TRIzol提取细胞总RNA,以1 μg RNA逆转录为cDNA。设计ERK(MAPK1)、JNK(MAPK8)、TFAM、ATP5A1和ATP5I上下游引物,以β-actin为内参基因,每个样品设置3个复孔。采用SYBR Green试剂盒,反应体系20 μL。ERK上游5′-TACACCAACCTCTCGTACATCG-3′,下游5′-CATGTCTGAAGCGCAGTAAGATT-3′;JNK上游5′-TCTGGTATGATCCTTCTGAAGCA-3′,下游5′-TCCTCCAAGTCCATAACTTCCTT-3′;TFAM上游5′-ATGGCG-TTTCTCCGAAGCAT-3′,下游5′-TCCGCCCTATAAGCATCTTGA-3′;ATP5A1上游5′-TGCTATTGGTCAAAA- GAGATCCA-3′,下游5′-GTAGCCGACACCACAATGG-3′;ATP5I上游5′-GAGCCACGCGCTACAATTAC-3′,下游5′-GCCAATTCTCTGGCAATCCG-3′。Bio-Rad的CFX96TM定量PCR仪扩增:95 ℃预热2 min,95 ℃ 15 s,60 ℃ 1 min,共反应40个循环。以Ct值为结果,按照2-△△Ct法计算分析mt3010A和mt3010G融合细胞缺氧后基因表达差异。每组实验重复3次。
1.3 统计学分析数据以x±s表示,采用SPSS20.0统计软件分析。两样本均数比较,当符合正态分布时,采用两独立样本t检验;不符合正态分布时,采用秩和检验。检验为双侧,以P < 0.05为差异具有统计学意义。
2 结果 2.1 供体志愿者筛选和融合细胞鉴定经PCR扩增和测序鉴定后,筛选出mtDNA3010-5178-10400(A-C-C与G-C-C)单倍型的志愿者,见图 1。以血小板作为线粒体供体,融合后经测序验证与供体图一致。

|
| 左图:A-C-C;右图:G-C-C 图 1 mtDNA3010A/G志愿者基因测序图 |
2.2 mt3010A基因型和mt3010G基因型融合细胞ROS、MMP、ATP及线粒体拷贝数分析
经1%O2处理24 h后:mt3010A基因型和mt3010G基因型融合细胞荧光强度差异无统计学意义(Z=-0.162,P=0.107,图 2);mt3010A基因型融合细胞MMP为(65.73±18.45)%,mt3010G基因型融合细胞MMP为(72.70±9.36)%,两组差异无统计学意义(Z=-0.365,P=0.715,图 3);mt3010A和mt3010G基因型融合细胞ATP含量分别为15.03±2.28、14.58±2.23 μmol/μg,两组差异无统计学意义(t=-0.24,P=0.822);mt3010A和mt3010G基因型融合细胞线粒体拷贝数分别为26.56± 1.32、27.91±3.66,两组差异无统计学意义(t=-0.695,P=0.513)。表明mtDNA3010位点A/G变异并未影响急性缺氧后细胞内ROS、MMP、ATP含量以及线粒体的拷贝数。
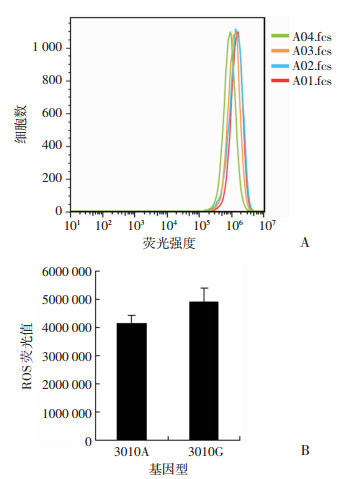
|
| A:流式细胞仪分析ROS荧光强度;B:mt3010A基因型和mt3010G基因型融合细胞荧光值分析 图 2 两种基因型融合细胞缺氧后ROS含量流式分析 |
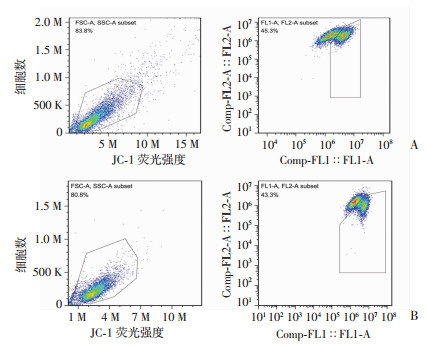
|
|
左图为流式细胞仪分选可纳入后续分析的细胞比例;右图为通道1与通道2荧光峰面积对比 A:mt3010A基因型融合细胞;B:mt3010G基因型融合细胞 图 3 两种基因型融合细胞缺氧后MMP流式分析 |
2.3 mt3010A基因型和mt3010G基因型融合细胞VDAC1和Bax蛋白表达分析
经1%O2处理24 h后,所获得的蛋白条带丰度与β-actin对比:mt3010A基因型融合细胞VDAC1相对表达量为(1.88±0.64),mt3010G基因型融合细胞VDAC1蛋白相对表达量为(2.04±0.60),两组差异无统计学意义(t=-0.365,P=0.728);3010A融合细胞Bax蛋白相对表达量为(6.58±0.47),3010G融合细胞Bax蛋白相对表达量为(6.69±0.98),两组差异无统计学意义(P>0.05,图 4)。提示mtDNA3010位点A/G变异并未影响急性缺氧后细胞内线粒体相关蛋白VDAC1和Bax的表达。
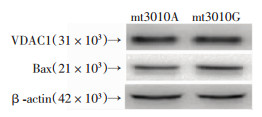
|
| 图 4 两种基因型融合细胞缺氧后VDAC1和Bax蛋白的表达 |
2.4 融合细胞能量代谢相关基因表达
经1%O2处理24 h后,ERK、JNK、TFAM、ATP5A1和ATP5I在3010A融合细胞的表达量显著高于在3010G融合细胞的表达(图 5),提示mtDNA3010位点A变异促进细胞能量代谢的作用高于mt3010G基因型变异,在缺氧条件下mt3010A基因型能够促进更多的能量生成,以抵御缺氧带来的损伤。
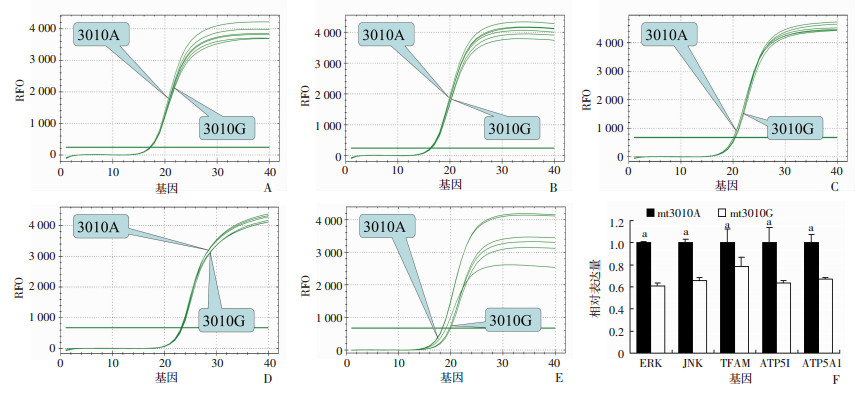
|
| A:ATP5A1扩增曲线;B:ATP5I扩增曲线;C:ERK扩增曲线;D:JNK扩增曲线;E:TFAM扩增曲线;F:mt3010A基因型和mt3010G基因型融合细胞各基因的表达a:P < 0.01,与mt3010G基因型比较 图 5 两种基因型融合细胞能量代谢相关基因ERK、JNK、TFAM、ATP5A1和ATP5I的表达差异 |
3 讨论
与核基因相比,线粒体具有独特的遗传结构,是一种半自主性细胞器,而且是严格的母系遗传。线粒体基因无内含子,其编码区有13个与氧化磷酸化有关的多肽基因、2个rRNA基因和22个tRNA基因。由于mtDNA没有组蛋白保护,而且靠近线粒体氧化磷酸化部位,故在复制过程中极易受到自由基的攻击而出现复制错误,影响线粒体携带的遗传信息,导致线粒体结构和功能的变化,进而引起疾病的发生[9]。本课题组前期研究发现,在mtDNA的M单倍群中,HAPE患者的mt5351G和mt6680C基因型频率显著高于健康移居人群[10]。此外,还发现mt3397G和mt3552A基因型是汉族人群HAPE的高危因素[11]。表明mtDNA变异与HAPE的发生具有明显的相关性,而线粒体的功能变化与mtDNA序列密切相关,提示mtDNA变异导致的线粒体功能变化参与了HAPE的发生。在前期发现mtDNA3010A/G基因型变异对线粒体不同易感性的基础上,本研究深入探索该位点变异致HAPE发生的遗传学机制。成功构建融合细胞后,本研究发现mtDNA3010位点变异并不影响融合细胞急性缺氧后的ROS、MMP、ATP以及拷贝数变化,也不影响VDAC1蛋白和Bax蛋白表达,但是显著影响线粒体能量代谢相关基因ERK、JNK、TFAM、ATP5A1和ATP5I的变化。作为保护因素的3010A基因型,其能量代谢基因表达水平显著高于3010G基因型,提示mtDNA3010变异导致的能量代谢变化可能是HAPE发病的重要机制之一。
与mt10609C基因型相比,mtDNA10609T基因型显著增加细胞内的ROS含量[12]。我们预测mtDNA3010 A/G基因型变异也有可能导致ROS的变化,但两种融合细胞经缺氧处理后其ROS含量并未出现差异。mtDNA3010位于线粒体基因RNR2区域,编码16SrRNA。研究表明,mtDNA3010A/G变异会影响线粒体的功能,导致细胞对乳酸的代谢发生变化,出现高乳酸血症[13]。无氧酵解是缺氧时细胞的主要能量代谢方式,而乳酸是糖无氧酵解的重要产物。mtDNA3010变异会显著影响乳酸代谢,而mtDNA3010也是汉族人群HAPE的易感位点,考虑可能是选择的功能方向不适合使得本实验中并未观察到ROS差异。此外,尚无乳酸在HAPE发病中的作用研究,这也是后期在高原现场研究中要值得关注的地方。
人类ERK(MAPK1)基因位于22号染色体,JNK(MAPK8)基因位于10号染色体,两者编码的蛋白属于丝裂原激活的蛋白激酶家族。作为细胞代谢的重要整合点,参与了细胞增殖、分化、转录调控以及发育等多种代谢过程,而且主要通过线粒体途径调控细胞的增殖与凋亡[14-15]。人类TFAM基因位于10号染色体,是由核基因编码的线粒体转录调控核心因子,能够调控线粒体的所有代谢过程。本研究显示,经急性缺氧后mt3010A基因型融合细胞的ERK(MAPK1)、JNK(MAPK8)以及TFAM基因表达水平显著高于mt3010G基因型融合细胞。ERK、JNK和TFAM的不同表达会导致下游一系列的基因表达出现差异,提示携带mt3010G基因型的个体,其线粒体功能在低氧环境下较mt3010A基因型个体可能会出现重大变化,进而导致了疾病的发生。人类ATP5A1基因18号染色体,编码ATP合酶的α亚基,而ATP5I基因位于4号染色体,编码ATP合酶跨膜复合体F0的e亚基,两者在维持ATP的正常生成和保证线粒体的正常功能方面发挥着重要作用。研究表明,能量代谢在急性高原病的发生过程中发挥了重要作用[16-18]。本实验结果显示,mt3010A基因型融合细胞的ATP5A1和ATP5I基因表达显著高于mt3010G基因型融合细胞,这两个基因可能是ERK与JNK的下游靶基因。在缺氧刺激后,mt3010A基因型能够提高能量代谢,增加能量生成水平,保证细胞在缺氧状态下继续发挥正常功能,抑制缺氧损伤。
本研究显示,经1%O2处理24 h后,mt3010A基因型和mt3010G基因型融合细胞在ROS、MMP、ATP、线粒体拷贝数、VDAC1蛋白和Bax蛋白含量方面差异无统计学意义,表明在急性缺氧时,上述指标未受到mtDNA3010A/G基因型变异的影响,提示该位点变异导致HAPE的机制可能是其他途径,尤其是细胞的能量代谢状态。为进一步评估mtDNA3010A/G变异导致的功能变化,应在高原地区选取mt3010G基因型的HAPE患者和mt3010A基因型的正常人群,结合表达谱芯片等方式,分析其线粒体功能变化,尤其是能量代谢相关基因表达和细胞整体能量代谢水平的变化,以及microRNA与lncRNA的变化,综合深入探讨mtDNA3010A/G变异在HAPE发生中的作用。本研究从能量代谢角度阐明了mtDNA3010A/G基因型变异可能导致HAPE的发生机制和作用,为HAPE的防治提供参考。
| [1] | PENNARDT A. High-altitude pulmonary edema[J]. Curr Sports Med Rep, 2013, 12(2): 115–119. DOI:10.1249/jsr.0b013e318287713b |
| [2] |
罗勇军, 高钰琪. 高原肺水肿遗传易感性机制的研究进展[J].
中华结核和呼吸杂志, 2011, 34(2): 135–137.
LUO Y J, GAO Y Q. Progress in the study of gene polymorphisms and high altitude pulmonary edema susceptibility[J]. Chin J Tubercul Respir Dis, 2011, 34(2): 135–137. DOI:10.3760/cma.j.issn.1001-0939.2011.02.018 |
| [3] | LUO Y J, ZOU Y L, GAO Y Q. Gene polymorphisms and high-altitude pulmonary edema susceptibility: A 2011 update[J]. Respiration, 2012, 84(2): 155–162. DOI:10.1159/000336625 |
| [4] | LUO Y J, GAO W X, LI S Z, et al. Mitochondrial haplogroup D4 confers resistance and haplogroup B is a genetic risk factor for high-altitude pulmonary edema among Han Chinese[J]. Genet Mol Res, 2012, 11(4): 3658–3667. DOI:10.4238/2012.october.9.1 |
| [5] | LI D, SUN Y P, ZHUANG Q Q, et al. Mitochondrial dysfunction caused by m.2336T>C mutation with hypertrophic cardiomyopathy in cybrid cell lines[J]. Mitochondrion, 2018. DOI:10.1016/j.mito.2018.08.005 |
| [6] |
罗勇军, 刘福玉, 陈丽, 等. 高原习服适应中白细胞线粒体DNA拷贝数的变化规律[J].
第三军医大学学报, 2011, 33(4): 359, 375.
LUO Y J, LIU F Y, CHEN L, et al. Changes in mitochondrial DNA copy number of leukocytes in high altitude adaptation[J]. J Third Mil Med Univ, 2011, 33(4): 359, 375. DOI:10.16016/j.1000-5404.2011.04.002 |
| [7] |
罗勇军, 刘昕. 实时荧光定量PCR标准品的制备及应用[J].
重庆医学, 2005, 34(3): 414–415.
LUO Y J, LIU X. The method of preparation for the standard plasmids of real-time PCR and its application in the experiments[J]. Chongqing Med, 2005, 34(3): 414–415. DOI:10.3969/j.issn.1671-8348.2005.03.045 |
| [8] | LIU Y Q, LI Y, ZHU C, et al. Mitochondrial biogenesis dysfunction and metabolic dysfunction from a novel mitochondrial tRNAMet 4467 C>A mutation in a Han Chinese family with maternally inherited hypertension[J]. Sci Rep, 2017, 7(1): 3034. DOI:10.1038/s41598-017-03303-w |
| [9] | SMEETS H J, SALLEVELT S C, DREESEN J C, et al. Preventing the transmission of mitochondrial DNA disorders using prenatal or preimplantation genetic diagnosis[J]. Ann N Y Acad Sci, 2015, 1350(1): 29–36. DOI:10.1111/nyas.12866 |
| [10] |
罗勇军, 高文祥, 刘福玉, 等. 线粒体单倍群M中mtDNA 5351G和6680C基因型与高原肺水肿易感性的关联[J].
中国呼吸与危重监护杂志, 2011, 10(1): 50–53.
LUO Y J, GAO W X, LIU F Y, et al. Associations between mt5351g and mt6680c genotypes in mtDNA haplogroup M and susceptibility to high altitude pulmonary edema among the Hans[J]. Chin J Respir Crit Care Med, 2011, 10(1): 50–53. DOI:10.3969/j.issn.1671-6205.2011.01.012 |
| [11] | LUO Y J, GAO W X, CHEN Y, et al. Rare mitochondrial DNA polymorphisms are associated with high altitude pulmonary edema (HAPE) susceptibility in Han Chinese[J]. Wilderness Environ Med, 2012, 23(2): 128–132. DOI:10.1016/j.wem.2012.02.003 |
| [12] | JIANG C H, CUI J H, LIU F Y, et al. Mitochondrial DNA 10609T promotes hypoxia-induced increase of intracellular ROS and is a risk factor of high altitude polycythemia[J]. PLoS ONE, 2014, 9(1): e87775. DOI:10.1371/journal.pone.0087775 |
| [13] | GOYER I, ISEPPON M, THIBAULT C, et al. Lactic acidosis with chloramphenicol treatment in a child with cystic fibrosis[J]. J Popul Ther Clin Pharmacol, 2017, 24(1): 40–45. DOI:10.22374/1710-6222.24.1.5 |
| [14] | HUANG C Y, CHEN J Y, KUO C H, et al. Mitochondrial ROS-induced ERK1/2 activation and HSF2-mediated AT1R upregulation are required for doxorubicin-induced cardio-toxicity[J]. J Cell Physiol, 2018, 233(1): 463–475. DOI:10.1002/jcp.25905 |
| [15] | BANOTH B, CASSEL S L. Mitochondria in innate immune signaling[J]. Transl Res, 2018, 202: 52–68. DOI:10.1016/j.trsl.2018.07.014 |
| [16] | MURRAY A J, MONTGOMERY H E, FEELISCH M, et al. Metabolic adjustment to high-altitude hypoxia: from genetic signals to physiological implications[J]. Biochem Soc Trans, 2018, 46(3): 599–607. DOI:10.1042/bst20170502 |
| [17] | MURRAY A J. Energy metabolism and the high-altitude environment[J]. Exp Physiol, 2016, 101(1): 23–27. DOI:10.1113/ep085317 |
| [18] | MURRAY A J, HORSCROFT J A. Mitochondrial function at extreme high altitude[J]. J Physiol(Lond), 2016, 594(5): 1137–1149. DOI:10.1113/jp270079 |



