2. 810008 西宁,青海师范大学化学化工学院环境科学系;
3. 100049 北京,中国科学院大学;
4. 264005 山东 烟台,烟台大学生命科学学院线粒体与健康衰老研究中心
2. Department of Environmental Science, College of Chemistry and Chemical Engineering, Qinghai Normal University, Xining, Qinghai Province, 810008;
3. University of Chinese Academy of Sciences, Beijing, 100049;
4. Center for Mitochondria and Healthy Aging, College of Life Sciences, Yantai University, Yantai, Shandong Province, 264005, China
Rho0细胞也称为ρ0细胞(mitochondrial DNA depleted cells),是一类细胞线粒体内mtDNA被完全清除、不能编码相应的线粒体呼吸链酶复合物亚单位、失去氧化磷酸化功能、主要由糖酵解途径提供能量而存活的细胞系。ρ0细胞是研究细胞核与线粒体关系、线粒体相关疾病、线粒体呼吸功能、mtDNA突变及药物、毒物作用机制的理想细胞模型[1-3]。细胞活力测定是检测细胞存活、增殖及化合物对细胞毒性的便捷方法,是化合物体外毒性评价的基础。细胞活力测定常用的方法有MTT法、CCK-8法、SRB法和XTT法等[4-7],其中MTT法、CCK-8法和XTT法都基于线粒体内琥珀酸脱氢酶的作用。MTT法自1983年开发以来,因经济和方便,应用最为广泛,其原理为MTT能被活细胞线粒体内的琥珀酸脱氢酶还原而形成不溶性的蓝色甲臜,甲臜的生成量在一定范围内与细胞数呈线性关系。C6ρ0细胞为mtDNA被清除的大鼠胶质瘤C6细胞,mtDNA清除后线粒体功能受损,生长代谢缓慢,使用基于线粒体内琥珀酸脱氢酶的MTT法评价C6ρ0细胞活力存在灵敏性低、可重复性差等弊端,不能真实反应细胞的生理状态。为此,在研究化合物对C6ρ0细胞活力影响的高通量筛选中找到一种灵敏,方便的评价手段非常重要。
刃天青也叫阿拉玛蓝(Alamar blue),是一种非荧光水溶性染料,在活细胞多种还原酶作用下,可将蓝色的刃天青还原为粉红色,具有强荧光的试卤灵,可作比色和荧光定量分析。据报道,刃天青常被用于检测牛奶中的细菌、真菌污染及抗菌药物的抑菌活性筛选[8-10],还可快速检测真菌孢子的活力,用于生物安全检测[11]。国内外也有用作细胞增殖和细胞活力测定的报道[12-13]。因此,本研究尝试使用刃天青染料做指示剂,探索一种能灵敏、快速分析mtDNA缺失C6ρ0细胞活力及细胞毒测定的方法。
1 材料与方法 1.1 仪器和试剂HF 151 UV CO2细胞培养箱购自上海力申科学仪器有限公司,SpectraMax Paradigm多功能酶标仪购自美国Molecular Devices Corporation公司,AE31倒置显微镜购自麦克奥迪实业集团有限公司,C6胶质瘤细胞购自中国科学院上海细胞库。
刃天青购自阿拉丁试剂有限公司,MTT、二甲基亚砜(DMSO)、溴化乙锭(EB)及扎西他滨(ddC)、Nutrient Mixture F-12 Ham培养基均购自美国Sigma-Aldrich公司,胎牛血清和马血清分别购自浙江天杭生物科技有限公司和天津康源生物科技有限公司,青霉素和链霉素购自美国Corning Incorporated公司,其他试剂购自国药集团化学试剂有限公司。刃天青和MTT用PBS(pH=7.4)分别配制为0.15、5.00 mg/mL的储备液,熊果酸(UA)由本课题组分离自鸢尾科植物马蔺,经HPLC-MS鉴定含量≥98%,DMSO配制为50 mmol/L母液。
1.2 方法 1.2.1 细胞培养C6胶质瘤细胞培养于含15%马血清(HS)、2%胎牛血清(FBS)、1%青链霉素的F-12 Ham培养基中,置于37 ℃、5% CO2饱和湿度的培养箱中培养传代。将对数生长期的C6细胞在含终浓度为5 μmol/L溴化乙啶(EB)、8 μmol/L扎西他滨(ddC)、0.1 mg/mL丙酮酸和50 μg/mL尿嘧啶的F-12 Ham培养基中培养,每日换液,持续处理42 d后,经单克隆培养得到能稳定传代的C6ρ0细胞系。经PCR鉴定及营养缺陷型培养证实为mtDNA缺失的单克隆C6ρ0,在添加0.1 mg/mL丙酮酸和50 μg/mL尿嘧啶的F-12 Ham培养基中稳定培养传代。
1.2.2 细胞数与荧光强度的关系取对数生长期的C6、C6ρ0细胞,血细胞计数板计数,调整细胞数为2.5×105/mL备用。以逐级稀释法分别以0、2 500、5 000、10 000、15 000、30 000、60 000、80 000/孔的细胞铺96孔板,使每孔体积为100 μL,每个浓度设5个重复。经37 ℃、5% CO2培养24 h,待细胞贴壁、铺展,弃去原培养基,每孔加入100 μL含25 μg/mL刃天青的F-12 Ham新培养基,开盖避光,37 ℃、5% CO2孵育2 h后以Ex/Em=560/590 nm酶标仪检测荧光强度(fluorescence intensity,FLU),以无细胞含25 μg/mL刃天青的培养基为空白对照,作为检测背景,确定最佳的细胞接种密度。
1.2.3 刃天青浓度及不同孵育时间对荧光强度的影响取对数生长期的C6ρ0细胞,血细胞计数板计数,以1×104/孔铺96孔板,使每孔体积为100 μL,每个浓度设5个重复。经37 ℃、5% CO2培养24 h,待细胞贴壁、铺展,弃去原培养基,分别加入F-12 Ham培养基配制的终浓度为100.0、50.0、25.0、14.0、9.4 μg/mL的刃天青溶液。开盖避光,37 ℃、5% CO2孵育2 h后,以Ex/Em=560/590 nm酶标仪检测荧光强度,确定最佳的刃天青使用浓度。
鉴于0~30 000/孔的细胞数量与荧光强度线性关系最好,以0、2 500、5 000、10 000、15 000、30 000/孔铺96孔板,贴壁后加入含25 μg/mL刃天青的F-12 Ham新培养基,分别在孵育1、2、3、4、12、24 h后,以Ex/Em=560/590 nm测定荧光强度,根据结果选择最佳孵育时间。
1.2.4 刃天青法与MTT法比较细胞数量与荧光强度或光密度值的关系分别取对数生长期的C6和C6ρ0细胞以1×104/孔铺96孔板,经24 h培养后,分别以刃天青法和MTT法分别测定细胞数与荧光强度或光密度值的关系。刃天青组弃原培养基后加入含25 μg/mL的刃天青溶液100 μL,37 ℃、5% CO2孵育2 h,测定荧光强度。MTT组每孔加入0.5 mg/mL的MTT 10 μL, 37 ℃、5% CO2孵育4 h,移除培养基后加入100 μL的DMSO溶解甲臜,37 ℃震荡孵育30 min,490 nm波长处测定光密度值[D(490)]。分别以细胞数量和荧光值或光密度值做散点图并拟合曲线,分析细胞数量与光密度值的关系。
1.2.5 刃天青法测定UA对C6和C6ρ0细胞活力的影响将对数生长期的C6和C6ρ0细胞以1.5×104/孔铺96孔板,37 ℃、5% CO2孵育24 h后,分别加入终浓度为0、0.1、1.0、10.0、25.0、50.0 μmol/L的UA处理24 h,然后按1.3.4描述方法测定荧光强度。实验分3组:阴性对照组(无细胞,含刃天青的培养液)、无药对照组(无UA,含细胞和刃天青的培养液)和UA处理组(不同浓度UA处理)。细胞活力=(UA处理组-阴性对照组)/(无药对照组-阴性对照组)× 100%,依回归曲线,计算IC50。
1.3 统计学分析采用Graphpad prism 6.0进行分析,数据以x ±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 细胞数与荧光强度的关系细胞数与生成的荧光强度呈正相关。如图 1A所示:当细胞数在0~80 000/孔,随着细胞数的增加,荧光强度逐渐增强。当细胞数在0~30 000/孔时,细胞数量与荧光强度之间线性关系最好,细胞数>30 000/孔后,荧光强度随细胞数增加的趋势降低,而细胞数>60 000/孔后,进入平台期,荧光强度不再随细胞数的增多而增强,mtDNA完整的C6细胞甚至出现下降。图 1B显示:随细胞数增加,肉眼即可观察到溶液颜色由蓝色逐步变为粉红色,颜色的变化与荧光强度的增加相一致。随细胞数增加,C6ρ0颜色变化的幅度明显小于C6细胞,可能与C6ρ0细胞mtDNA清除后线粒体功能受损、生长代谢缓慢和产生的还原性脱氢酶较少有关。
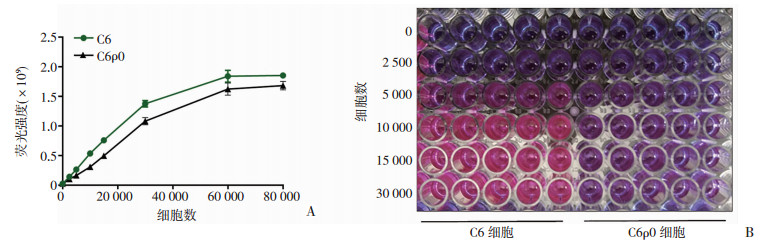
|
| A:不同细胞数荧光强度的变化;B:颜色观察 图 1 C6ρ0和C6细胞的细胞数与荧光强度的关系 |
2.2 刃天青含量与不同孵育时间对荧光强度的影响
使用不同浓度的刃天青孵育C6ρ0细胞,分析可用于测定细胞活力的最佳刃天青浓度。随着刃天青浓度的增加,荧光强度呈浓度依赖性增强,但当刃天青浓度>50 μg/mL时,荧光强度反而下降,与25 μg/mL比较差异有统计学意义(P < 0.05,图 2)。故刃天青的浓度应控制在25~50 μg/mL,综合考虑25 μg/mL刃天青浓度最为合适。
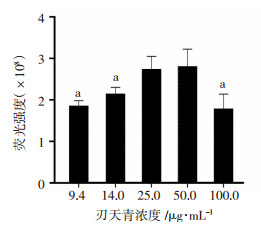
|
| a:P < 0.01, 与25 μg/mL比较 图 2 不同浓度刃天青对荧光强度的影响 |
不同浓度的细胞需在不同的时间内将刃天青还原为肉眼可见、颜色对比明显的粉红色试卤灵。C6ρ0细胞数少于5 000/孔,由蓝色转为红色的趋势不明显,但荧光强度增加依然明显。在较高细胞密度下,1 h内即可观察到明显的颜色变化,区分度非常明显,1~4 h孵育都可作为检测的时间。如图 3所示:细胞数在0~30 000/孔时,随着孵育时间的延长,荧光强度逐渐增大,细胞数越多,荧光强度增加越明显,所需孵育时间越短,当细胞数>10 000/孔,孵育时间超过12 h,荧光强度反而下降,细胞数越多,下降越明显。
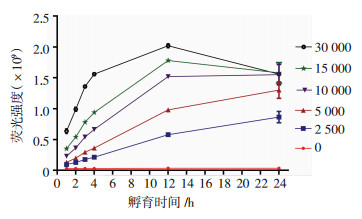
|
| 图 3 不同密度细胞孵育时间与荧光强度的关系(n=5) |
2.3 MTT法和刃天青法测定不同细胞数与光密度值或荧光强度的关系
采用MTT法测定C6ρ0和C6细胞数与其光密度值的关系(图 4)。C6ρ0的光密度值随细胞数量的增加有所增加,但增加幅度较小,细胞数在2 500~30 000/孔时,光密度值只增加了0.127 6±0.017 3,灵敏性较低,无法真实反映细胞数变化与光密度值间的关系。特别是细胞数在10 000/孔以下时,灵敏性严重下降,测定光密度值变异幅度很大,细胞数与光密度值间线性关系极弱。细胞数在0~30 000/孔时与光密度值无线性相关性,光密度值的变化不能真实反映C6ρ0细胞数的变化,故MTT法不能作为C6ρ0细胞活力、细胞毒的测定方法。而线粒体功能正常的C6细胞数与光密度值之间具有较好的线性相关,可用MTT法作为评价其细胞活力的方法。
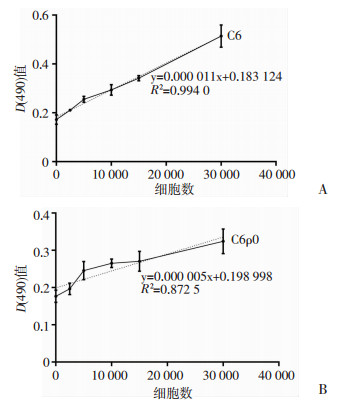
|
| A:C6细胞;B:C6ρ0细胞 图 4 MTT法测定不同数量细胞的光密度值的变化(n=5) |
刃天青法测定C6及C6ρ0细胞数与荧光强度变化的关系见图 5。C6和C6ρ0荧光强度均随细胞数变化,二者间具有很好的线性关系,荧光强度随细胞数增加而增强的趋势明显,回归曲线斜率较大,灵敏性强。因此,刃天青法可作为化合物对C6ρ0细胞活力影响及细胞毒作用的评价手段。
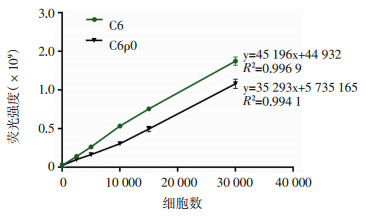
|
| 图 5 刃天青法测定细胞数与荧光强度的回归曲线(n=5) |
2.4 刃天青法测定UA对C6ρ0和C6细胞活力及增殖抑制率的影响
以不同浓度的UA处理C6ρ0和C6细胞24 h后,10 μmol/L以上浓度组出现明显的细胞形态学改变和细胞死亡、漂浮现象,细胞毒作用显著。刃天青法测定不同浓度UA处理后的细胞活力(图 6A),结果显示:随UA浓度升高,细胞活力依赖性下降且具有细胞间差异性。UA对两种细胞的细胞毒作用具有明显差异,C6ρ0细胞表现为更强的耐受性,细胞活力测定结果与光镜下观察结果一致。将UA浓度的反对数值与细胞活力做回归曲线,计算得C6ρ0和C6的IC50值分别为20.82、14.62 μg/mL(图 6B、C)。
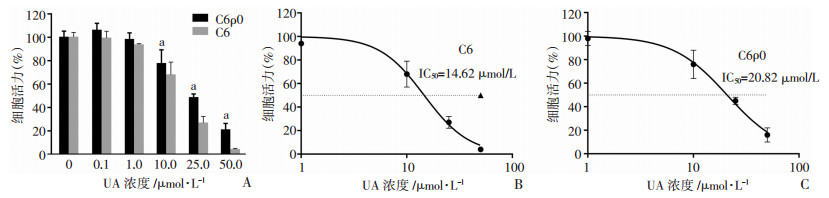
|
| A:两种细胞的活力比较a:P < 0.05,与C6细胞比较;B:C6细胞的IC50值;C:C6ρ0的IC50值 图 6 刃天青法测定不同浓度UA对C6和C6ρ0细胞活力的影响(n=5) |
3 讨论
本研究开发了以刃天青做指示剂评价mtDNA缺失C6ρ0细胞增殖、细胞活力测定的方法。测定最佳条件为:细胞数控制在0~30 000/孔,经药物处理一定时间后弃原培养基,加入25 μg/mL不含血清的刃天青培养基,开盖避光,5% CO2、37 ℃孵育1~4 h,之后以Ex/Em =560/590 nm酶标仪检测荧光强度,细胞数及细胞活力与荧光强度呈良好线性关系。
刃天青法孵育时间短,更适用于细胞数量较少状况下细胞活力的测定。本研究结果表明:刃天青浓度超过50 μg/mL或孵育时间超过12 h,荧光强度反而下降,可能的机制是孵育时间过长后刃天青的还原产物带荧光的粉红色试卤灵会转化成无荧光、无色的二氢试卤灵。细胞数量越多,代谢越旺盛,所需孵育的时间越短。C6ρ0细胞孵育时间在1~4 h时,荧光强度随细胞数量的变化非常明显,对于线粒体功能正常的细胞,孵育时间更可以缩短至60 min内(数据未展示),而MTT法孵育时间一般在3~4 h,故刃天青法可作为快速检测试剂使用;当细胞数少于5 000/孔,荧光强度随细胞数增加明显,呈现良好的线性关系,而细胞数量较少时,MTT法测得的光密度值随细胞数的变化相关性较低,变动幅度大,故MTT法不能用作C6ρ0细胞的增殖测定,而刃天青法能较好地满足需求。
刃天青法灵敏度高,能更真实反映低代谢活动细胞在化合物作用下的增殖及细胞活力变化。MTT法虽能够满足正常C6细胞增殖的测定,但由于C6ρ0细胞内mtDNA被清除,代谢率较低,故不能用MTT法研究其增殖情况,也无法用MTT法开展化合物对C6ρ0毒性的高通量筛选和细胞活力的测定。HAMID等[14]以MTT法和刃天青法对117个化合物进行高通量筛选,结果也表明刃天青法所得药物浓度随细胞活力的变化曲线更加平缓,变化更灵敏,特别是在低浓度药物下可避免MTT法光密度信号明显大于不加药物的对照组的问题。另有研究报道:MTT法作为抗胶质瘤药物的细胞毒评价手段,表现出非特异性还原,其中细胞形态改变,前凋亡蛋白增加,抗凋亡蛋白减少,但MTT未能检测出变化,低估了细胞毒性[15]。刃天青法以荧光强度变化作为测定指标,对细胞内还原酶敏感,能敏锐地检测到细胞内的变化。
刃天青法可用于多种细胞的增殖和细胞活力测定。已有研究报道:刃天青已被用于纤维母细胞、小鼠和人淋巴细胞、大鼠肝细胞、神经元、HepG2、胶质瘤细胞及其他多种肿瘤细胞的细胞毒性测定[16]。该方法不仅可作为mtDNA缺失的C6ρ0细胞增殖及细胞毒分析,也完全适用于正常细胞的增殖及细胞毒性测定,荧光强度的变化随细胞种类的不同而不同。本研究结果显示:由于C6ρ0细胞生长及代谢较慢,故其荧光强度随细胞数的增多而增加的趋势较缓,这与前人类似研究结果相一致。
刃天青作为细胞代谢活力及健康状况的测定指标,已用作3D培养肿瘤细胞增殖及细胞活力测定。因为3D细胞的培养更能模拟组织中细胞真实的生长状态,更能反映化合物对细胞的作用[17],引起了人们更大的兴趣。细胞3D培养时通过十字孢碱等细胞毒化合物处理,可使刃天青的利用增加,故刃天青法不仅可以用于细胞活力的测定,还可用于区分细胞毒化合物和细胞生长抑制剂[18]。
此外,刃天青法具有安全、无毒、可连续监测、干扰少、价格便宜和适用范围广的优势。刃天青为水溶性染料,对细胞无诱变、无毒性,用刃天青法测定后,可连续监测细胞活力的变化,比使用副板采用终点法测定省时、省力;检测后经冲洗,细胞可用于其他指标的检测。再者,刃天青法测定细胞活力对血清、药物和酚红不敏感,可减少干扰,增加适用范围。刃天青法与MTT、XTT和CCK-8等方法相比,价格便宜,使用量极少,5 g的刃天青量即可配制40 L的刃天青孵育液,经济划算。
综上所述,刃天青法灵敏、简单、安全无毒、经济便宜、重复性好,不仅特别适用于C6ρ0细胞,也可用于细胞数较少或其他代谢缓慢细胞系细胞增殖测定、细胞活力及细胞毒高通量筛选,值得进一步推广和应用。
| [1] | YOON Y G, OH Y J, YOO Y H. Rapid isolation of mitochondrial DNA-depleted mammalian cells by ethidium bromide and dideoxycytidine treatments[J]. J Appl Biol Chem, 2014, 57(3): 259–265. DOI:10.3839/jabc.2014.042 |
| [2] | SPADAFORA D, KOZHUKHAR N, CHOULJENKO V N, et al. Methods for efficient elimination of mitochondrial DNA from cultured cells[J]. PLoS ONE, 2016, 11(5): e0154684. DOI:10.1371/journal.pone.0154684 |
| [3] |
戴纪刚, 闵家新, 张国强, 等. 线粒体DNA缺失细胞系的建立[J].
第三军医大学学报, 2005, 27(6): 570–571.
DAI J G, MIN J X, ZHANG G Q, et al. Establishment of mitochondrial DNA-depleted cell lines[J]. J Third Mil Med Univ, 2005, 27(6): 570–571. DOI:10.16016/j.1000-5404.2005.06.037 |
| [4] | LUAN G X, WANG Y W, WANG Z H, et al. Flavonoid glycosides from fenugreek seeds regulate glycolipid metabolism by improving mitochondrial function in 3T3-L1 adipocytes in vitro[J]. J Agric Food Chem, 2018, 66(12): 3169–3178. DOI:10.1021/acs.jafc.8b00179 |
| [5] | CAO C, WANG W P, LU L L, et al. Inactivation of Beclin-1-dependent autophagy promotes ursolic acid-induced apoptosis in hypertrophic scar fibroblasts[J]. Exp Dermatol, 2018, 27(1): 58–63. DOI:10.1111/exd.13410 |
| [6] | SHI Z Z, HODGES V M, DUNLOP E A, et al. Erythropoietin-induced activation of theJAK2/STAT5, PI3K/Akt, and Ras/ERK pathways promotes malignant cell behavior in a modified breast cancer cell line[J]. Mol Cancer Res, 2010, 8(4): 615–626. DOI:10.1158/1541-7786.MCR-09-0264 |
| [7] | MESSNER B, ZELLER I, PLONER C, et al. Ursolic acid causes DNA-damage, p53-mediated, mitochondria- and caspase-dependent human endothelial cell apoptosis, and accelerates atherosclerotic plaque formation in vivo[J]. Atherosclerosis, 2011, 219(2): 402–408. DOI:10.1016/j.atherosclerosis.2011.05.025 |
| [8] |
王丹, 杨峰, 李新圃, 等. 奶牛乳房炎病原菌诊断技术研究进展[J].
中国畜牧兽医, 2017, 44(6): 1811–1817.
WANG D, YANG F, LI X P, et al. Research progress on diagnosis technology of dairy cow mastitis pathogens[J]. China Anim Husband Vet Med, 2017, 44(6): 1811–1817. DOI:10.16431/j.cnki.1671-7236.2017.06.033 |
| [9] |
袁高庆, 黎起秦, 秦健, 等. 噻唑蓝法和刃天青法检测植物成分对两种病原细菌的抑菌活性[J].
植物保护学报, 2011, 38(4): 306–312.
YUAN G Q, LI Q Q, QIN J, et al. Methythiazol tetrazolium and resazurin assays for detection of antibacterial activities of plant constituents against two bacterial pathogens[J]. Acta Phytophylacica Sinica, 2011, 38(4): 306–312. DOI:10.13802/j.cnki.zwbhxb.2011.04.014 |
| [10] | ZHAO P, ZHANG X J, DU P C, et al. Susceptibility profiles of Nocardia spp. to antimicrobial and antituberculotic agents detected by a microplate Alamar blue assay[J]. Sci Rep, 2017, 7: 43660. DOI:10.1038/srep43660 |
| [11] | BARUA P, YOU M P, BAYLISS K, et al. A rapid and miniaturized system using Alamar blue to assess fungal spore viability: implications for biosecurity[J]. Eur J Plant Pathol, 2017, 148(1): 139–150. DOI:10.1007/s10658-016-1077-5 |
| [12] | MCMILLIAN M K, LI L, PARKER J B, et al. An improved resazurin-based cytotoxicity assay for hepatic cells[J]. Cell Biol Toxicol, 2002, 18(3): 157–173. DOI:10.1023/A:1015559603643 |
| [13] | O'BRIEN J, WILSON I, ORTON T, et al. Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity[J]. Eur J Biochem, 2000, 267(17): 5421–5426. DOI:10.1046/j.1432-1327.2000.01606.x |
| [14] | HAMID R, ROTSHTEYN Y, RABADI L, et al. Comparison of alamar blue and MTT assays for high through-put screening[J]. Toxicol In Vitro, 2004, 18(5): 703–710. DOI:10.1016/j.tiv.2004.03.012 |
| [15] | JO H Y, KIM Y, PARK H W, et al. The unreliability of MTT assay in the cytotoxic test of primary cultured glioblastoma cells[J]. Exp Neurobiol, 2015, 24(3): 235–245. DOI:10.5607/en.2015.24.3.235 |
| [16] | KUMAR P, NAGARAJAN A, UCHIL P D. Analysis of cell viability by the alamar blue assay[J]. Cold Spring Harb Protoc, 2018, 2018(6): pdb.prot095489. DOI:10.1101/pdb.prot095489 |
| [17] | EILENBERGER C, KRATZ S R A, ROTHBAUER M, et al. Optimizedalamar Blue assay protocol for drug dose-response determination of 3D tumor spheroids[J]. Methods X, 2018, 5: 781–787. DOI:10.1016/j.mex.2018.07.011 |
| [18] | WALZL A, UNGER C, KRAMER N, et al. The resazurin reduction assay can distinguish cytotoxic from cytostatic compounds in spheroid screening assays[J]. J Biomol Screen, 2014, 19(7): 1047–1059. DOI:10.1177/1087057114532352 |



