全腹腔镜远端胃癌根治术(total laparoscopic distal gastrectomy,TLDG)是当前临床治疗可切除胃癌的重要手段,术后多需行消化道重建,但目前关于最佳重建术式仍未有定论。由于消化道重建将直接影响食物消化途径及消化能力,且将影响胃肠道激素的分泌,对机体胰岛素代谢具有一定的影响,而临床中不乏胃癌合并2型糖尿病(T2DM)患者,不同消化道重建方式对其糖代谢有何影响尚不明确[1]。Billroth-Ⅰ式吻合是TLDG后经典吻合技术,已有诸多研究证实其疗效良好,在提高患者生活质量方面具有重要作用[2]。三角吻合术是由日本学者Kanaya等率先报道的新型消化道重建技术,具有操作简便、耗时短、创伤小及并发症少等优势,逐渐被日、韩等国外科医生所认可,但在我国应用时间尚短[3]。既往研究对Billroth-Ⅰ和三角吻合术的研究多集中于创伤、并发症及生活质量方面,缺乏针对胃癌合并T2DM患者术后糖代谢转归的观察。本研究对比分析了三角吻合术与Billroth-Ⅰ式吻合对胃癌合并T2DM患者术后糖代谢及相关指标的影响,旨在为临床合理选择术式提供参考。
1 资料与方法 1.1 一般资料研究对象为90例2015年3月至2018年3月在我院确诊并住院接受TLDG手术治疗的进展期胃癌合并T2DM患者。纳入标准:①术前影像学检查及内镜活检诊断为远端胃癌,且经术后病理组织学检查证实;②具备TLDG手术指征,未出现远处转移;③符合T2DM的诊断标准,即具有T2DM典型症状且任意血糖≥11.1 mmol/L,或空腹血糖(FPG)≥7.0 mmol/L,或口服葡萄糖耐量试验(OGTT)后2 h血糖(2hPG)≥11.1 mmol/L,且除外自身免疫性疾病及其他恶性肿瘤性糖尿病;④ASA分级为Ⅰ~Ⅱ级;⑤术前未接受放化疗;⑥临床资料完整。排除标准:①合并严重器质性疾病而不耐受麻醉及手术者,如脑梗死、冠心病、肝肾功能障碍、凝血功能障碍及中重度贫血等;②T2DM晚期、胰岛功能衰竭及严重糖尿病性胃瘫者;③出现肿瘤远处转移或广泛转移者;④合并其他恶性肿瘤及其他消化系统疾病者;⑤非胃癌因素行胃切除术与消化道重建者,如难治性胃溃疡。根据患者的意愿及适应证分为两组:36例行三角吻合术为观察组(剔除十二指肠较短者或第一段活动度较差者),54例行Billroth-Ⅰ式吻合术为对照组。患者均知情且签署知情同意书,研究获得本院伦理委员会审核批准。
1.2 手术方法 1.2.1 术前准备两组均由同一组麻醉和手术医师完成手术。常规术前准备:根据内分泌科专家会诊意见予以口服降糖药物或使用胰岛素控制血糖水平,如血糖控制不理想,则在术前7 d予以速效胰岛素。
1.2.2 TLDG方法患者取头高脚低仰卧位并分开双腿,采用气管插管全身麻醉。经脐下0.5 cm处行弧形切口,建立12 mmHg CO2气腹。经脐下切口置入10 mm穿刺鞘作为观察孔,探查肿瘤位置、大小及与周围脏器(如肝、脾、胰腺和主要血管等)的解剖关系。在腔镜引导下经左侧腋前线肋缘下1 cm部位穿刺置入10 mm穿刺鞘作为主操作孔,再分别经左、右侧锁骨中线与脐水平交点部位置入10 mm与5 mm穿刺鞘,经肋缘下1 cm与右侧腋前线较差部位置入5 mm穿刺鞘作为辅助操作孔。参照《日本胃癌协会指南》实施TLDG并淋巴结清扫,严格遵循根治性操作原则,即无瘤原则、切缘充足、淋巴结清扫彻底及切口保护。
1.2.3 消化道重建三角吻合术:完成淋巴结清扫后,充分游离十二指肠并预留充分的残端,将其逆时针旋转90°(图 1A)后以腔内直线切割闭合器切断,于肿瘤上缘5 cm部位以之线切割闭合器将胃体切断,以超声刀将胃及十二指肠残端切开1 cm左右,将直线切割闭合器分别置入胃腔内及十二指肠腔内,逆时针旋转十二指肠,顺时针旋转胃体,并将十二指肠及胃体靠拢、切割,注意吻合口与胃切缘距离2 cm左右(图 1B)。将直线切割闭合器取出,注意观察吻合口局部有无出血与吻合口漏,吻合满意后再置入鼻空肠营养管直至屈氏韧带远端10 cm空肠内(图 1C、D)。采用可吸收缝线将残胃与十二指肠共同开口前、中、后分别缝合1针,并以60 mm直线切割闭合器将共同开口封闭,完成三角吻合消化道重建(图 1E、F)。采用生理盐水进行腹腔内冲洗,经右侧穿刺鞘孔引出引流管,逐层缝合切口,术毕。
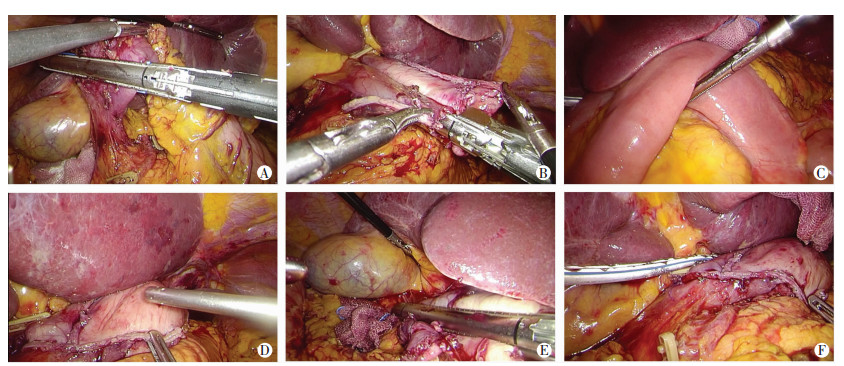
|
| A:十二指肠顺时针旋转90°;B:胃十二指肠吻合;C:鼻空肠营养管置于屈氏韧带以远空肠内;D:放置鼻空肠营养管;E:关闭共同开口;F:三角吻合 图 1 三角吻合术操作过程 |
Billroth-Ⅰ式吻合术:解除气腹后,于上腹部正中建立7~8 cm切口进腹,常规游离十二指肠,在距离幽门下3 cm切断十二指肠,于十二指肠残端置入吻合器砧座,实施荷包缝线收口。在与肿瘤距离6 cm左右的大弯侧钳夹并切断胃组织约4 cm,再以直线切割闭合器将残胃关闭并切断。于胃大弯侧切口处置入吻合器完成吻合,探查吻合口无出血,常规留置鼻空肠营养管后将残胃闭合,完成重建,逐层缝合切口,术毕。
1.2.4 术后处理术后常规监护生命体征,予以止血、抑酸、抗炎及营养支持等。术后3~4 d将腹腔引流管拔除,术后7 d左右拆除缝线。术后7 d内,根据患者的血糖状况应用降糖药物控制血糖,如FPG>7.0 mmol/L或2hPG>10.0 mmol/L则应用速效胰岛素控制,出院后遵医嘱维持原降糖治疗方案。
1.3 观察指标① 围手术期情况:统计两组患者的切口长度、手术时间、术中出血量、术后肛门排气时间及术后住院时间;②并发症:统计两组并发症发生情况,如切口感染、吻合口狭窄及吻合口瘘等;③糖代谢相关:测定FPG、2hPG、糖化血红蛋白(HbAlc)及胰岛素抵抗指数(HOMA-IR),同时记录体质指数(BMI)和胰岛素用量;分别于术前测定基础值,并于术后1、3、6个月时复测;④其他指标:术前及术后1、3、6个月时测定血清肿瘤坏死因子α(TNF-α)、白介素-6(IL-6)、网模素-1(omentin-1)、脂联素(adiponectin)、抑胃肽(gastric inhibitory peptide, GIP)、胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)及GIP/GLP-1。
1.4 统计学分析采用SPSS19.0统计软件,符合正态分布的计量资料以x ±s表示,年龄、BMI、病程、肿瘤直径及围手术期指标等组间比较经独立样本t检验,同一指标不同时间点比较经重复测量资料方差分析,进一步两两比较经LSD-t检验;计数资料以百分率(%)表示,行χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料两组性别、年龄、BMI、肿瘤直径、T2DM病程及TNM分期比较,差异无统计学意义(表 1)。
| 组别 | n | 性别(男/女, 例) | 年龄/岁(x ±s) | BMI/kg·m-2(x ±s) | T2DM病程/年(x ±s) | 肿瘤直径/ cm(x ±s) | TNM分期(例) | ||
| Ⅰ期 | Ⅱ期 | Ⅲ期 | |||||||
| 观察组 | 36 | 21/15 | 56.13±6.71 | 24.42±3.97 | 5.42±1.36 | 4.12±0.89 | 27 | 5 | 4 |
| 对照组 | 54 | 34/20 | 55.49±6.15 | 24.06±3.69 | 5.11±1.04 | 3.92±0.81 | 40 | 10 | 4 |
| χ2/t值 | 0.195 | 0.466 | 0.440 | 1.223 | 1.103 | 0.614 | |||
| P值 | 0.659 | 0.642 | 0.661 | 0.224 | 0.273 | 0.736 | |||
2.2 围手术期情况
观察组的切口长度、手术时间、术中出血量、术后排气时间及住院时间均显著低于对照组(P < 0.05, 表 2)。
| 组别 | n | 切口长度/cm | 手术时间/min | 术中出血量/mL | 术后排气时间/d | 术后住院时间/d |
| 观察组 | 36 | 4.52±0.47 | 214.43±30.21 | 90.21±16.45 | 2.56±0.71 | 10.21±2.13 |
| 对照组 | 54 | 6.15±1.02 | 256.14±36.47 | 186.14±40.21 | 3.42±0.96 | 12.29±3.04 |
| t值 | 8.962 | 5.682 | 13.558 | 4.598 | 3.561 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.001 |
2.3 术后并发症
观察组术后并发症发生率为5.56%,低于对照组的14.81%,但差异无统计学意义(χ2=1.875,P=0.171, 表 3)。
| 组别 | n | 吻合口狭窄 | 吻合口瘘 | 感染 | 肠梗阻 | 胃排空障碍 | 倾倒综合征 | 合计 |
| 观察组 | 36 | 0(0) | 1(2.78) | 1(2.78) | 0(0) | 0(0) | 0(0) | 2(5.56) |
| 对照组 | 54 | 1(1.85) | 2(3.70) | 2(3.70) | 1(1.85) | 1(1.85) | 1(1.85) | 8(14.81) |
2.4 术后用药及血糖控制情况
观察组3例血糖未控制;11例用药减量,血糖维持正常;22例无需用药,血糖维持正常。对照组14例血糖未控制;29例用药减量,血糖维持正常;11例无需用药,血糖维持正常。两组间比较差异具有统计学意义(P < 0.05)。
2.5 治疗前后BMI及糖代谢相关指标两组术前BMI、FPG、2hPG、HbAlc及HOMA-IR比较差异无统计学意义;术后观察组上述指标均有显著降低(P < 0.05),术后3个月时达到谷值;对照组BMI变化不明显,FPG、2hPG、HbAlc及HOMA-IR明显降低(P < 0.05);两组间各时间点的BMI、FPG、2hPG及HbAlc比较差异有统计学意义(P < 0.05),而HOMA- IR仅在术后1个月时显著低于对照组(P < 0.05,表 4)。
| 组别 | n | BMI/kg·m-2 | FPG/mmol·L-1 | 2hPG/mmol·L-1 | HbAlc(%) | HOMA-IR |
| 观察组 | 36 | |||||
| 术前 | 24.42±3.97 | 13.42±3.17 | 16.34±2.82 | 10.14±1.02 | 1.98±0.51 | |
| 术后1个月 | 22.61±1.17ab | 9.13±3.02ab | 10.42±2.51ab | 8.58±0.91ab | 1.40±0.43ab | |
| 术后3个月 | 22.41±1.05ab | 8.57±2.84ab | 9.83±2.18ab | 7.02±0.75ab | 1.36±0.36a | |
| 术后6个月 | 22.54±1.12ab | 8.61±2.91ab | 9.97±2.26ab | 7.14±0.76ab | 1.37±0.38a | |
| F值 | 2.923 | 3.691 | 4.215 | 4.211 | 3.712 | |
| P值 | 0.004 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
| 对照组 | 54 | |||||
| 术前 | 24.06±3.69 | 13.21±3.05 | 15.89±2.76 | 10.06±0.98 | 1.96±0.50 | |
| 术后1个月 | 23.45±1.58 | 11.32±2.95a | 11.79±2.64a | 9.11±0.94a | 1.59±0.45 | |
| 术后3个月 | 23.01±1.43 | 10.71±2.74a | 11.42±2.53a | 8.66±0.87a | 1.45±0.39 | |
| 术后6个月 | 23.12±1.25 | 11.15±2.81a | 11.53±2.56a | 8.11±0.89a | 1.44±0.40 | |
| F值 | 0.313 | 2.646 | 2.871 | 3.012 | 0.119 | |
| P值 | 0.156 | 0.012 | 0.009 | 0.004 | 0.106 | |
| a:P < 0.05,与本组术前比较;b:P < 0.05,与对照组同时间点比较 | ||||||
2.6 两组手术前后血清相关因子水平比较
两组术前血清TNF-α、IL-6、网模素-1、脂联素、GIP、GLP-1及GIP/GLP-1水平比较差异无统计学意义(P>0.05);术后两组GLP-1均无明显变化,而TNF-α、IL-6及GIP及GIP/GLP-1较术前有明显降低,网模素-1及脂联素较术前明显提高(P < 0.05),且观察组显著优于对照组(P < 0.05,表 5)。
| 组别 | TNF-α/mmol·L-1 | IL-6/ng·L-1 | 网模素-1/μg·L-1 | 脂联素/mg·L-1 | GIP/pmol·L-1 | GLP-1/pmol·L-1 | GIP/GLP-1 |
| 观察组(n=36) | |||||||
| 术前 | 4.89±0.67 | 52.21±10.34 | 16.71±5.71 | 8.75±2.06 | 12.71±3.45 | 2.09±0.55 | 6.08±0.85 |
| 术后1个月 | 2.85±0.43ab | 40.13±6.12ab | 20.13±6.12ab | 10.94±3.12ab | 5.71±1.21ab | 2.13±0.45 | 2.69±0.45ab |
| 术后3个月 | 2.71±0.31ab | 36.21±5.54ab | 22.26±6.65ab | 11.26±3.23ab | 5.49±1.02ab | 2.30±0.46 | 2.39±0.42ab |
| 术后6个月 | 2.55±0.24ab | 30.02±5.17ab | 24.69±6.87ab | 12.04±3.61ab | 5.11±0.93ab | 2.26±0.43 | 2.26±0.36ab |
| F值 | 7.121 | 15.540 | 4.369 | 4.132 | 4.756 | 0.289 | 10.841 |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.143 | < 0.001 |
| 对照组(n=54) | |||||||
| 术前 | 4.86±0.62 | 50.85±9.74 | 16.43±5.91 | 8.82±2.14 | 12.56±3.27 | 2.12±0.56 | 5.92±0.87 |
| 术后1个月 | 4.15±0.53a | 46.02±8.11a | 18.01±6.04a | 8.65±2.23a | 8.17±1.32a | 2.21±0.43 | 3.69±0.54a |
| 术后3个月 | 3.92±0.51a | 42.74±7.08a | 20.04±6.19a | 8.57±2.19a | 7.64±1.55a | 2.40±0.46 | 3.18±0.44a |
| 术后6个月 | 3.61±0.49a | 38.87±5.44a | 22.13±6.26a | 8.51±2.14a | 6.72±1.43a | 2.39±0.43 | 2.81±0.41a |
| F值 | 3.015 | 7.782 | 3.106 | 1.313 | 4.013 | 0.251 | 7.144 |
| P值 | 0.005 | < 0.001 | 0.004 | 0.206 | < 0.001 | 0.150 | < 0.001 |
| a:P < 0.05,与本组术前比较;b:P < 0.05,与对照组同时间点比较 | |||||||
3 讨论
BillrothⅠ是TLDG消化道重建的经典术式,只经上腹部小切口操作即可完成消化道重建,创伤相对较小,对老年患者可能更具优势,但其视野及操作空间受限也可能增加操作难度,可能增加吻合口相关并发症[4]。全腹腔镜下三角吻合的吻合口状态及吻合后胃部形态均与经典BillrothⅠ式重建存在较大差异,术中采用直线切割闭合器建立共同开口,替代了传统吻合器吻合,可保留更充分的内腔,有利于降低吻合口狭窄发生风险[5]。本研究结果显示:观察组的切口长度、手术时间、术中出血量、术后排气时间及住院时间均显著低于对照组(P < 0.05)。在并发症方面,两组的总并发症发生率虽与对照组相比差异无统计学意义,但仍有降低趋势。认为在TLDG中应用三角吻合术具有创伤小、吻合安全等优势,这对年老体弱患者而言可能更具优势。可能是由于三角吻合术无需进行腹部以外的其他切口辅助操作,可减少创伤[6]。但实施消化道重建势必影响食物的消化途径及其在肠道内的吸收,可能在一定程度上影响机体代谢而影响血糖水平,进而影响手术安全性及术后康复质量[7]。因此,在胃癌伴T2DM患者的手术治疗,讨论上述两种消化道重建方式对患者血糖控制的影响具有重要价值。
本研究结果显示:观察组术后多经减少用药量甚至不用药即可控制血糖水平(91.67%),而对照组中有25.93%血糖控制不满意。糖代谢指标监测显示:观察组患者术后1个月时FPG、2hPG、HbAlc水平及BMI均有不同程度的下降,术后3个月时达到谷值,术后6个月时略有回升,而在各个监测时间点时观察组的FPG、2HPG、HbAlc水平及BMI均显著低于对照组(P < 0.05)。提示三角吻合可能较经典BillrothⅠ式吻合对胃癌伴T2DM患者的血糖控制效果更具优势。但研究中两组的HOMA-IR差异不大,仅在术后1个月时观察组表现出更低的HOMA-IR,可能与样本较少有关。
虽已有诸多研究报道胃癌根治术后实施消化道重建能在一定程度上改善T2DM病情或有利于血糖的控制,但其机制并不明确,既往多认为与术后胃容积缩小及食物摄入量减少有关[8-9]。还有研究发现能量代谢异常、应激状态、脂肪因子及神经内分泌改变等对非糖尿病胃癌患者术后糖代谢亦具有一定的影响[10]。炎症介质学说亦认为炎症因子不仅是手术创伤程度的重要反应,同时可诱导肾上腺皮质激素的生成,而后者可作用于胰岛素受体而引起糖耐量异常,进而导致血糖水平升高[11]。由此推测:手术应激反应及其经体液传导所致炎症因子异常分泌可能对胃癌伴T2DM患者的糖代谢亦具有一定的影响。TNF-α是由单核细胞等分泌的一种多效生物学效应性细胞因子,能够启动IL-6等炎性因子的合成与释放,从而介导炎症级联反应,还可通过对胰岛素信号通路产生作用而调节胰岛素,抑制其信号传导[12]。炎性因子IL-6不仅可通过“下丘脑-垂体-肾上腺轴”,还可直接对肾上腺细胞上分布的IL-6受体作用而影响机体内分泌。动物实验研究结果显示:IL-6可降低糖原合成酶的活性并可提高糖原磷酸化酶的活性,从而增加肝细胞糖原分解能力而降低合成能力[13]。脂肪因子网模素-1主要由网膜脂肪组织分泌,与胰岛素分泌及胰岛素抵抗具有负相关性,在T2DM患者中明显降低[14]。脂联素则是维持糖代谢及血糖稳态的重要调节因子,能够调节肝糖异生,在T2DM患者中有利于降低血糖和胰岛素抵抗[15]。“肠-胰岛轴”学说则认为抗-肠促胰岛素及肠促胰岛素在血糖调节中具有重要作用。其中,抗-肠促胰岛素GIP可诱导IR的发生而导致血糖升高,肠促胰岛素GLP-1则可增强胰岛素敏感性而降低血糖,两者在正常情况下处于平衡状态[16-17]。本研究结果亦显示:两组患者术后血清TNF-α、IL-6、GIP及GIP/GLP-1均呈现逐渐降低趋势,网模素-1及脂联素则呈升高趋势,且观察组的改善幅度较对照组更为明显(P < 0.05)。进一步证实可能三角吻合较经典BillrothⅠ式吻合更有利于术后T2DM的病情控制。可能是与三角吻合的创伤更小,应激作用更轻,对机体内分泌的影响更小有关。但两组术后GLP-1水平并无明显变化,可能是由于消化道重建后食物能够正常进入远端回肠和空肠,不影响GLP-1的分泌与产生,这也是导致GIP/GLP-1比值下降而促使血糖降低的重要原因[18]。
综上所述,相比于经典BillrothⅠ式吻合,在胃癌伴T2DM患者的TLDG消化道重建中应用三角吻合术具有创伤小、并发症少的优势,可能更有利于改善患者的糖代谢状态,提高术后血糖控制效果。但本研究样本较小且属于回顾性研究,术后用药等可能导致研究结果存在一定的偏倚,且该术式存在一定的手术适应证,其对胃癌患者术后糖代谢的具体影响及机制有待进一步研究。
| [1] |
滕达, 李松岩, 宁宁, 等. 胃癌合并2型糖尿病患者行腹腔镜与开腹全胃切除术的疗效比较[J].
解放军医学院学报, 2013, 34(3): 208–210.
TENG D, LI S Y, NING N, et al. Curative effect of laparoscopic gastrectomy and total gastrectomy for patients with gastric cancer accompanying type 2 diabetes mellitus[J]. Acad J PLA Postgrad Med School, 2013, 34(3): 208–210. DOI:10.3969/j.issn.2095-5227.2013.03.003 |
| [2] |
杨凯, 侯远发, 宋耀明, 等. 不同消化道重建方式对远端进展期胃癌患者生活质量的影响[J].
中国肿瘤临床与康复, 2014, 21(4): 392–394.
YANG K, HOU Y F, SONG Y M, et al. Effects of different procedures of alimentary tract reconstruction radical operation on the life quality of the patients with distal gastric cancer[J]. Chin J Clin Oncol Rehabil, 2014, 21(4): 392–394. DOI:10.13455/j.cnki.cjcor.2014.04.03 |
| [3] |
杨海涛, 匡荣康. 全腹腔镜下三角吻合术进行胃癌远端胃切除术消化道重建的安全性和可行性[J].
实用癌症杂志, 2017, 32(10): 1738–1740.
YANG H T, KUANG R K. Safety and feasibility of total laparoscopic triangular anastomosis for reconstruction of digestive tract in distal gastrectomy for gastric cancer[J]. Pract J Cancer, 2017, 32(10): 1738–1740. DOI:10.3969/j.issn.1001-5930.2017.10.053 |
| [4] |
汪运节, 陈益鸣, 张智平. 胃大部分切除术后消化道重建对2型糖尿病患者脂肪因子紊乱的影响[J].
广东医学, 2016, 37(20): 3086–3089.
WANG Y J, CHEN Y M, ZHANG Z P. Effect of digestive tract reconstruction after major resection of the stomach on adipokines disorder in patients with type 2 diabetes[J]. Guangdong Med J, 2016, 37(20): 3086–3089. DOI:10.3969/j.issn.1001-9448.2016.20.030 |
| [5] |
王建锋, 孙培春, 吴刚, 等. 全腹腔镜远端胃切除术后三角吻合术在消化道重建中的应用效果[J].
重庆医学, 2018, 47(16): 2229–2231.
WANG J F, SUN P C, WU G, et al. Application effect of triangular anastomosis after total laparoscopic distal gastrectomy in digestive tract reconstruction[J]. Chongqing Med, 2018, 47(16): 2229–2231. DOI:10.3969/j.issn.1671-8348.2018.16.030 |
| [6] | KIM B S, YOOK J H, CHOI Y B, et al. Comparison of early outcomes of intracorporeal and extracorporeal gastroduodenostomy after laparoscopic distal gastrectomy for gastric cancer[J]. J Laparoendosc Adv Surg Tech A, 2011, 21(5): 387–391. DOI:10.1089/lap.2010.0515 |
| [7] |
李海, 游红勇, 陈智敏, 等. 腹腔镜辅助胃癌D2端根治术治疗胃癌合并2型糖尿病的效果及其对炎症因子和免疫功能的影响[J].
中国医药导报, 2016, 13(11): 100–103.
LI H, YOU H Y, CHEN Z M, et al. Clinical curative effects of laparoscopic assisted D2 radical resection on patients with gastric cancer and type 2 diabetes and its influence on inflammation factors and immune function[J]. China Med Herald, 2016, 13(11): 100–103. |
| [8] | ZHU Z X, SHAN X D, CHENG Y J, et al. Clinical course of diabetes after gastrectomy according to type of reconstruction in patients with concurrent gastric cancer and type 2 diabetes[J]. Obes Surg, 2015, 25(4): 673–679. DOI:10.1007/s11695-014-1426-4 |
| [9] | KIM J W, KIM K Y, LEE S C, et al. The effect of long Roux-En-Y gastrojejunostomy in gastric cancer patients with type 2 diabetes and body mass index & 35 kg/m2: preliminary results[J]. Ann Surg Treat Res, 2015, 88(4): 215. DOI:10.4174/astr.2015.88.4.215 |
| [10] |
叶圳, 李炯, 杨吉勇, 等. 自拟养阴活血益胃汤联合胰岛素强化治疗对非糖尿病胃癌根治术后应激性高血糖患者糖代谢、应激状态、能量代谢的影响[J].
现代中西医结合杂志, 2018, 27(9): 913–917.
YE Z, LI J, YANG J Y, et al. Effects of Yangyin Huoxue Yiwei Decoction combined with intensive insulin therapy on glucose metabolism, stress state and energy metabolism in patients with stress hyperglycemia after radical gastrectomy for non-diabetic gastric cancer[J]. Mod J Integr Tradit Chin Western Med, 2018, 27(9): 913–917. DOI:10.3969/j.issn.1008-8849.2018.09.001 |
| [11] |
杨志红, 钟历勇, 王惠. 创伤应激对糖尿病大鼠TNF-α、IL-6、NO及氧化应激的影响[J].
内科急危重症杂志, 2004, 10(4): 197–199, 211.
YANG Z H, ZHONG L Y, WANG H. Effects of injury-induced stress on serum TNF-α, IL-6, NO and oxidative stress in diabetes rats[J]. J Intern Intensive Med, 2004, 10(4): 197–199, 211. DOI:10.3969/j.issn.1007-1024.2004.04.006 |
| [12] |
张华, 刘利祥, 刘智. 糖尿病合并高血压患者血清IL-6、IL-10、TNF-α水平变化及意义[J].
山东医药, 2015, 55(19): 79–80.
ZHANG H, LIU L X, LIU Z. Changes and significance of serum IL-6, IL-10 and TNF-α levels in patients with diabetes mellitus complicated with hypertension[J]. Shandong Med J, 2015, 55(19): 79–80. DOI:10.3969/j.issn.1002-266X.2015.19.030 |
| [13] |
陈雨, 郑少雄, 郝杰, 等. 白介素6在2型糖尿病大鼠胰岛素抵抗中的作用[J].
中国临床医学, 2011, 18(1): 32–34.
CHEN Y, ZHENG S X, HAO J, et al. The role of interleukin-6 on insulin resistant in type 2 diabetes mellitus rats[J]. Chin J Clin Med, 2011, 18(1): 32–34. DOI:10.3969/j.issn.1008-6358.2011.01.010 |
| [14] | WITTENBECHER C, MENZEL J, CARSTENSEN-KIRBERG M, et al. Omentin-1, adiponectin, and the risk of developing type 2 diabetes[J]. Diabetes Care, 2016, 39(6): e79–e80. DOI:10.2337/dc15-2702 |
| [15] | RANHEIM T, HAUGEN F, STAFF A C, et al. Adiponectin is reduced in gestational diabetes mellitus in normal weight women[J]. Acta Obstet Gynecol Scand, 2004, 83(4): 341–347. DOI:10.1111/aog.2004.83.issue-4 |
| [16] | FRIAS J P, BASTYR E J rd, VIGNATI L, et al. The sustained effects of a dual GIP/GLP-1 receptor agonist, NNC0090-2746, in patients with type 2 diabetes[J]. Cell Metab, 2017, 26(2): 343–352. DOI:10.1016/j.cmet.2017.07.011 |
| [17] | CONGET I, MAURICIO D, ORTEGA R, et al. Characteristics of patients with type 2 diabetes mellitus newly treated with GLP-1 receptor agonists (CHADIG Study): a cross-sectional multicentre study in Spain[J]. BMJ Open, 2016, 6(7): e010197. DOI:10.1136/bmjopen-2015-010197 |
| [18] |
金育德, 戴闯, 朱炜, 等. 胃大部切除术后不同消化道重建对T2DM患者血糖的影响及机制研究[J].
中华内分泌外科杂志, 2017, 11(6): 463–466, 475.
JIN Y D, DAI C, ZHU W, et al. The influence of different digestive tract reconstruction methods on blood sugar of T2DM patients after subtotal gastrectomy[J]. Chin J Endocr Surg, 2017, 11(6): 463–466, 475. DOI:10.3760/cma.j.issn.1674-6090.2017.06.006 |



