正常骨代谢及骨量的维持需要成骨细胞介导的骨形成与破骨细胞介导的骨吸收偶联的动态平衡[1]。破骨细胞是由造血干细胞的单核/巨噬细胞谱系融合分化而成,是迄今为止发现的唯一具有骨吸收功能的细胞,对于骨骼稳态的维持发挥重要作用[2]。破骨细胞分化及其所致骨吸收的过度增强是骨质疏松、风湿性关节炎和肿瘤骨转移等骨代谢疾病的病理基础。成骨细胞能够分泌如RANKL、OPG等多种细胞因子调控破骨细胞分化[3]。生理情况下骨髓处于低氧的微环境中,其氧体积分数约6.6%。骨折、炎症和肿瘤等诸多导致骨内血流或供氧减少的因素均会使骨微环境处于更为明显的病理性低氧状态[4-5]。
缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)是依赖于低氧而存在的转录因子,能够与多个靶基因调控序列中的HRE相结合,参与调控其转录,从而介导机体对缺氧产生适应性反应[6-7]。目前已确定的HIF-1α靶基因近50种,包括转铁蛋白、VEGF和EPO等对细胞生命活动具有重要调控作用的基因[8]。氧浓度是调节HIF-1α的重要因素,常氧条件下,机体通过pVHL介导聚泛素化使HIF-1α被蛋白酶降解;而低氧可使pVHL等相关蛋白失活,HIF-1α降解减少,进而发挥其促转录功能[9]。
据报道,缺氧可通过HIF-1α介导调控NRP-1的表达[10];而破骨前体细胞表面的NRP-1受体,通过与成骨细胞分泌的Sema3A特异性结合,能够抑制ITAM共刺激信号通路,进而抑制破骨细胞分化[11]。RAW264.7细胞是小鼠源性单核巨噬细胞,来自Abelson小鼠白血病病毒诱导BALB/c小鼠所产生的肿瘤,形态以类圆形和不规则多边形为主,一般含1~2个核,有伪足,细胞胞体较小。其可作为一种破骨前体细胞,通过特定细胞因子的诱导在体外能够获得成熟破骨细胞[12]。MC3T3-E1细胞系来源于小鼠锁骨细胞,是小鼠胚胎成骨细胞前体细胞,可作为体外研究成骨细胞模型的常用细胞[13]。本研究观察缺氧刺激下RAW264.7细胞中HIF-1α和NRP-1的表达变化,阐明缺氧通过HIF-1α介导的NRP-1表达上调能够抑制破骨细胞的分化成熟。
1 材料与方法 1.1 材料与试剂小鼠RAW264.7细胞和MC3T3-E1细胞均购自上海中科院细胞库。高糖DMEM培养基、α-MEM培养基和胎牛血清(FBS)均购自美国Gibco公司,RANKL购自美国PEPROTECH公司,抗坏血酸、β-甘油磷酸钠、CoCl2和抗酒石酸酸性磷酸酶(TRAP)染色试剂盒均购自美国Sigma公司。PCR引物购自上海生工生物工程股份有限公司(表 1)。携带针对HIF-1α基因和NRP-1基因的shRNA及阴性对照(negative control,NC)-shRNA的慢病毒载体均购自上海吉玛制药技术有限公司,RNA具体序列如下:5′-GCAGGAAUUGGAACAUUAUdTdT-3′(HIF-1α-shRNA), 5′-GCCCGAA-TGTTCTC AGAACTACTCGAGTAGTTCTGAGAACATTCG- GGCTTTTT-3′(NRP1-shRNA)。RNAisoPlus、PrimeScript®反转录试剂盒和荧光染料SYBR® PremixEXTaqTMⅡ试剂盒购自日本TaKaRa公司。兔抗鼠HIF-1α、NRP-1多克隆抗体购自英国Abcam公司;抗β-actin鼠单克隆抗体以及辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记山羊抗小鼠IgG均购自北京中杉金桥公司。青霉素-链霉素溶液、谷氨酰胺溶液、细胞组织快速裂解液(RIPA裂解液)、SDS-PAGE凝胶试剂盒均购自中国碧云天生物技术研究所。聚偏二氟乙烯(PVDF)膜购自德国Millipore公司。
| 基因 | 引物序列(5’→3’) | 长度/bp |
| β-actin | 上游:TCACTATTGGCAACGAGCGGTTC 下游:GCACTGTGTTGGCATAGAGGTCTT |
153 |
| TRAP | 上游:ACTTGCGACCATTGTTAGCCACAT 下游:ACACCGTTCTCGTCCTGAAGATACT |
91 |
| Cath K | 上游:AGGATATGCTCTCTTGGCTCGGAAT 下游:GCTGGCTGGCTGGAATCACATC |
91 |
| MMP-9 | 上游:CGTGGATAAGGAGTTCTCTGGTGTG 下游:GTGGTGGTGGTGGTGGTCTCTA |
257 |
| HIF-1α | 上游:GCTTGCTCATCAGTTGCCACTTC 下游:GTCCATCTGTGCCTTCATCTCATCT |
151 |
| NRP-1 | 上游:TACAGCATCCAATCAAGCCGACAG 下游:ATCTTCTCATCTCCCAGGTCCACTT |
141 |
1.2 方法 1.2.1 细胞培养、实验分组及病毒感染
小鼠成骨前体细胞MC3T3-E1以α-MEM完全培养基于37 ℃,5%CO2孵箱中培养,2~3 d换液。待细胞融合面积达90%时,吸去培养基,更换为成骨诱导培养基(OM)(α-MEM- 10%FBS+10 mmol/L β-甘油磷酸钠+50 μg/mL抗坏血酸),37 ℃,5%CO2孵箱中培养,每48 h换液。21 d后弃去培养基,用PBS洗细胞3次,并更换为新的含1%FBS的DMEM培养液继续培养48 h,收集细胞上层清液,1 200 r/min离心10 min以去除细胞碎屑成分,0.22 μm的一次性滤器过滤除菌,-80 ℃保存作为条件培养基(conditioned medium,CM)备用。
在37 ℃,体积分数5%CO2孵箱中,用含体积分数10%胎牛血清的DMEM高糖培养基(含1%青霉素、1%链霉素)培养小鼠单核/巨噬细胞(RAW264.7)。每3天更换培养基,至细胞融合70%~80%后,对细胞进行胰酶消化并传代。在观察缺氧对破骨细胞分化的影响时将细胞分3组,对照组:仅RAW264.7细胞;分化组:RAW264.7细胞+RANKL(100 ng/mL)+50%CM(即成骨细胞条件培养基与常规培养液DMEM-10%FBS按照体积比为1 :1比例配制);缺氧组:RAW264.7细胞+RANKL(100 ng/mL)+50%CM+100 μmol/L氯化钴(CoCl2)。研究HIF-1α沉默对RAW264.7细胞分化的影响时分4组:分化组,缺氧组,缺氧+HIF-1α-NC组及缺氧+HIF-1α-shRNA干扰组。而研究NRP-1表达的沉默对RAW264.7细胞分化的影响时分4组:分化组,缺氧组,缺氧+NRP-1-NC组及缺氧+NRP-1-shRNA干扰组。取处于对数生长期的RAW264.7细胞,按10×104/孔接种于6孔板。次日向各组细胞中分别添加相应的适量慢病毒溶液(感染复数均为30)和终浓度为5 μg/mL的聚凝胺,进行病毒感染。24 h后换液,72 h后加入2 μg/mL嘌呤霉素筛选细胞。待细胞生长至融合度为80%时,行常规传代培养。对照组加入正常培养基,分化组加入含100 ng/mL RANKL和50%成骨细胞CM的培养基,缺氧组加入含100 μmol/L CoCl2、100 ng/mL RANKL和50%成骨细胞CM的培养基。
1.2.2 抗酒石酸酸性磷酸酶(TRAP)染色TRAP是破骨细胞特异性酶,是破骨细胞重要的酶组化识别标志。RAW264.7细胞以2×104/孔接种于12孔板,置于37 ℃ 5%CO2培养箱中培养过夜后,按上述分组分别给予相应处理。培养6 d后将上述细胞用4%多聚甲醛固定后,行TRAP染色(具体操作按说明书进行)并计数。细胞浆呈玫瑰红且细胞核数≥3为TRAP+破骨细胞。显微镜下随机取5个视野,计算每个视野中TRAP阳性破骨细胞的平均数目。
1.2.3 RT-PCRRAW264.7细胞以5×104/孔接种于6孔板,置于37 ℃ 5%CO2培养箱中培养过夜后,按上述分组分别给予相应处理。培养4 d后按说明书提取细胞总RNA,合成cDNA并进行RT-PCR反应。RT-PCR反应采用两步法,反应条件:95 ℃ 5 s、60 ℃ 30 s,40个循环。以β-actin为内参,根据2-ΔΔCt计算各基因的相对表达量。
1.2.4 Western blotRAW264.7细胞以5×104/孔接种于6孔板,置于37 ℃ 5%CO2培养箱中培养过夜后,按上述分组分别给予相应处理。培养4 d后用RIPA裂解液收集各组细胞的总蛋白,BCA法测定蛋白浓度。取各组总蛋白40 μg,行6%SDS-PAGE以分离蛋白,电泳结束后将蛋白转印至PVDF膜,5%脱脂牛奶溶液封闭1 h;加入兔抗鼠HIF-1α(1 :500)和兔抗鼠NRP-1(1 :1 000)多克隆抗体及β-actin(1 :1 000)单克隆抗体,4 ℃反应过夜,TBST漂洗10 min×3次;再分别加入辣根过氧化物酶标记的山羊抗小鼠IgG及山羊抗兔IgG,室温反应2 h,TBST漂洗10 min×3次;最后以化学发光法显色,用美国GE公司的IAS4010型超灵敏凝胶成像仪显像。ImageJ软件对条带进行灰度值分析,计算各蛋白质的相对表达量。
1.2.5 统计学处理采用SPSS19.0统计学软件对实验数据进行分析。实验均独立重复3次,计量资料以x±s表示,两组间比较采用独立样本t检验;多组间比较采用方差分析。检验水准α=0.05。
2 结果 2.1 CoCl2诱导的缺氧可以抑制RAW264.7细胞向成熟破骨细胞分化6 d时TRAP染色结果(图 1A)显示,与对照组比较,分化组可见大量细胞浆呈玫瑰红且细胞核数≥3的形态典型TRAP+成熟破骨细胞,而缺氧组中成熟破骨细胞数量(9.60±3.77)明显低于分化组(62.60±7.55),差异具有统计学意义(P < 0.05),且细胞体积减小,形态不典型。
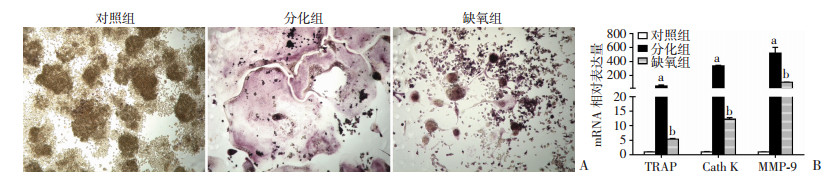
|
| A:TRAP染色检测RAW264.7细胞向成熟破骨细胞分化情况(×100);B:实时荧光定量PCR法检测破骨细胞分化标志基因TRAP、Cath K、MMP-9 mRNA的表达水平(n=3,x±s);a:P < 0.05,与对照组比较;b:P < 0.05,与分化组比较 图 1 缺氧抑制RAW264.7细胞向成熟破骨细胞分化 |
实时荧光定量PCR结果(图 1B)显示,与对照组比较,分化组中破骨细胞分化标志基因TRAP、Cath K、MMP-9 mRNA的表达量均明显升高(P < 0.05),而缺氧组中上述3个基因的表达量均明显低于分化组(P < 0.05)。
2.2 CoCl2诱导的缺氧能够增强RAW264.7细胞分化过程中HIF-1α及NRP-1的表达实时荧光定量PCR结果(图 2A)显示,与对照组比较,分化组及缺氧组中HIF-1α mRNA的表达量无明显变化,而分化组NRP-1 mRNA的表达量明显下调(P < 0.05),且缺氧组中NRP-1 mRNA的表达量明显高于分化组(P < 0.05)。
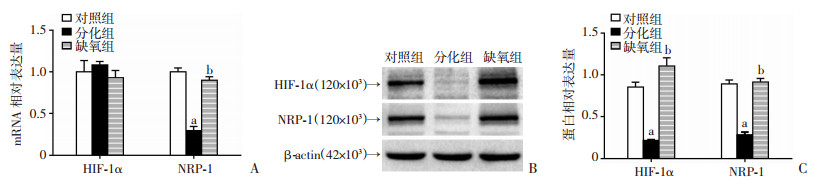
|
| A:实时荧光定量PCR法检测HIF-1α和NRP-1 mRNA的表达水平(n=3,x±s);B、C:Western blot检测HIF-1α和NRP-1蛋白的表达水平(n=3,x±s);a:P < 0.05,与对照组比较;b:P < 0.05,与分化组比较 图 2 缺氧上调RAW264.7细胞HIF-1α、NRP-1的表达 |
Western blot结果(图 2B、C)显示,与对照组比较,分化组HIF-1α及NRP-1的蛋白表达量均明显下调(P < 0.05),而缺氧组中HIF-1α及NRP-1的蛋白表达量均明显高于分化组(P < 0.05)。
2.3 沉默RAW264.7细胞中HIF-1α表达可以减弱CoCl2诱导的缺氧对破骨细胞分化的抑制Western blot结果(图 3A、B)显示,与分化组相比,缺氧组中HIF-1α及NRP-1的蛋白表达量明显上调(P < 0.05),与缺氧+HIF-1α-NC组相比较,缺氧组中HIF-1α及NRP-1的蛋白表达量无明显变化,而缺氧+HIF-1α-shRNA干扰组中HIF-1α及NRP-1的蛋白表达量均明显下降(P < 0.05)。
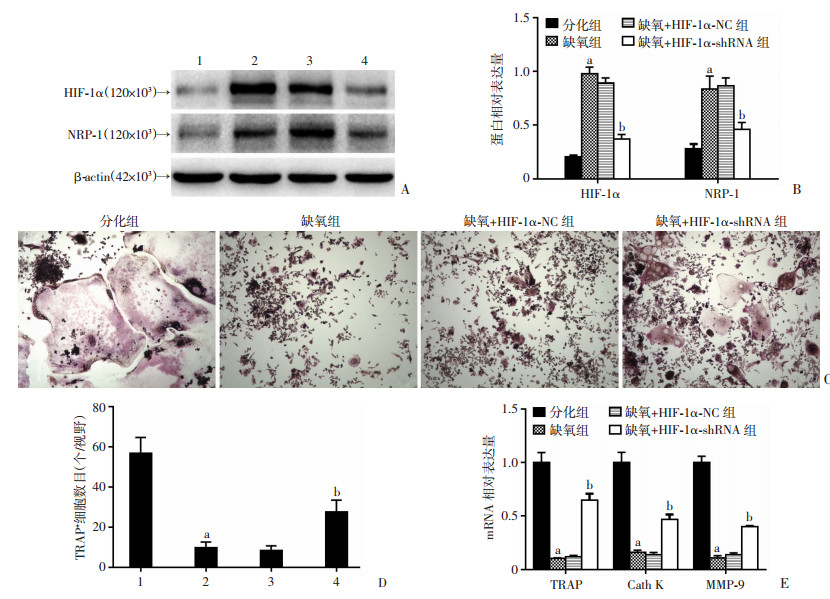
|
| A、B:Western blot检测HIF-1α和NRP-1蛋白的表达水平(n=3,x±s);C、D:TRAP染色检测RAW264.7细胞向成熟破骨细胞分化情况(×100);E:实时荧光定量PCR法检测破骨细胞分化标志基因TRAP、Cath K、MMP-9 mRNA的表达水平(n=3,x±s);1:分化组; 2:缺氧组; 3:缺氧+HIF-1α-NC组; 4:缺氧+HIF-1α-shRNA组;a:P < 0.05,与分化组比较;b:P < 0.05,与缺氧+HIF-1α-NC组比较 图 3 下调RAW264.7细胞的HIF-1α能够降低NRP-1的表达并影响其向破骨细胞分化 |
TRAP染色结果(图 3C、D)显示,分化组中可见大量细胞浆呈玫瑰红且细胞核数≥3的形态典型TRAP+成熟破骨细胞,与之相比,缺氧组中成熟破骨细胞数量明显减少(P < 0.05),体积减小,且形态不典型。与缺氧+HIF-1α-NC组相比较,缺氧组中的破骨细胞分化程度无明显改变,而缺氧+HIF-1α-shRNA干扰组中破骨细胞分化明显增强(P < 0.05)。
实时荧光定量PCR结果(图 3E)显示,与分化组相比,缺氧组中破骨细胞分化标志基因TRAP、Cath K、MMP-9 mRNA的表达量均明显下降(P < 0.05),与缺氧+HIF-1α-NC组相比较,缺氧组中上述3个分化标志基因的表达量无明显变化,而缺氧+HIF-1α-shRNA干扰组中上述3个分化标志基因的表达量均明显上升(P < 0.05)。
2.4 沉默RAW264.7细胞中NRP-1表达可以减弱CoCl2诱导的缺氧对破骨细胞分化的抑制Western blot结果(图 4A、B)显示,与分化组相比,缺氧组中NRP-1的蛋白表达量明显上调(P < 0.05);与缺氧+NRP-1-NC组相比较,缺氧组中NRP-1的蛋白表达量无明显变化,而缺氧+NRP-1-shRNA干扰组中NRP-1的蛋白表达量明显下降(P < 0.05)。

|
| A、B:Western blot检测NRP-1蛋白的表达水平(n=3,x±s);C、D:TRAP染色检测RAW264.7细胞向成熟破骨细胞分化情况(×100);E:实时荧光定量PCR法检测破骨细胞分化标志基因TRAP、Cath K、MMP-9 mRNA的表达水平(n=3,x±s);1:分化组; 2:缺氧组; 3:缺氧+NRP-1-NC组; 4:缺氧+NRP-1-shRNA组;a:P < 0.05,与分化组比较;b:P < 0.05,与缺氧+NRP-1-NC组比较 图 4 下调RAW264.7细胞NRP-1的表达能够影响其向破骨细胞分化 |
TRAP染色结果(图 4C、D)显示,与分化组相比,缺氧组中成熟破骨细胞数量明显减少(P < 0.05)。与缺氧+NRP-1-NC组相比较,缺氧组中的破骨细胞分化程度无明显改变,而缺氧+NRP-1-shRNA干扰组中破骨细胞分化明显增强(P < 0.05)。
实时荧光定量PCR结果(图 4E)显示,与分化组相比,缺氧组中破骨细胞分化标志基因TRAP、Cath K、MMP-9 mRNA的表达量均明显下降(P < 0.05);与缺氧+NRP-1-NC组相比,缺氧组中上述3个分化标志基因的表达量无明显变化,而缺氧+NRP-1-shRNA干扰组中上述3个分化标志基因的表达量均明显上升(P < 0.05)。
3 讨论骨骼是人体的重要器官,在生理状态下,破骨细胞引起的骨质吸收和成骨细胞介导的骨形成在一系列因子调控下维持动态平衡,使骨组织不断进行自我更新和重塑。任何破坏骨吸收与骨形成之间动态平衡的原因,都会引发各种骨代谢疾病。故越来越多的研究将破骨细胞作为骨破坏性疾病的治疗靶点,希望通过抑制破骨细胞数量及功能从而减轻各种病理状态下的骨质破坏,最大限度地保留骨及骨关节的功能。然而各种骨质破坏的发病基础及其诱导破骨细胞分化的具体分子机制并不一致,存在许多尚未明确的地方,因此仍需要进一步探索,为其防治提供新的策略。机体内破骨细胞在分化过程中主要受骨髓基质细胞或成骨细胞分泌的RANKL、OPG、M-CSF、Sema3A等多种细胞因子调控[14]。目前的破骨细胞分化模型多为单纯通过RANKL诱导,不能很好地模拟机体内环境。本研究在以往的模型基础上加入了50%的成骨细胞条件培养基,更加接近机体内破骨细胞分化的微环境,实验结果更加真实可靠。
既往研究[15]发现,与野生型小鼠相比,Vhl基因缺失型小鼠的骨髓腔是密闭的,骨量增加。因此,我们推测低氧/低氧诱导因子(HIF)-1通路可能在成骨细胞与破骨细胞分化调节机制中起调控作用。研究表明,骨吸收部位形成的缺氧环境有利于破骨细胞的分化及其骨吸收功能[16]。然而,也有研究表明缺氧环境可抑制破骨细胞形成[17]。本研究结果表明:CoCl2诱导的缺氧可以抑制RAW264.7细胞向成熟破骨细胞分化。这可能与破骨细胞分化诱导方法的不同有关,本研究在以往诱导方法的基础上加入了50%的成骨细胞条件培养基,可能存在不同的分子机制调控破骨细胞分化。
本研究结果证实:CoCl2诱导的缺氧能够上调RAW264.7细胞分化过程中HIF-1α蛋白的表达,并且通过短发夹RNA(short hairpin RNA,shRNA)病毒沉默RAW264.7细胞中内源性HIF-1α表达能够部分逆转缺氧对破骨细胞分化的抑制。然而HIF-1α介导缺氧抑制破骨细胞分化的具体分子机制尚不清楚。据文献报道,在人纤维肉瘤HT1080细胞中,缺氧可通过上调HIF-1α促进NRP-1的表达[10]。本研究显示:在RAW264.7细胞分化过程中,CoCl2诱导的缺氧同样以HIF-1α依赖的方式上调NRP-1的表达;通过短发夹RNA(short hairpin RNA,shRNA)病毒沉默RAW264.7细胞中NRP-1表达能够部分逆转缺氧对破骨细胞分化的抑制,说明NRP-1介导了缺氧对破骨细胞分化的调控,其分子机制可能为破骨前体细胞表面的NRP-1受体与成骨细胞分泌的配体Sema3A特异性结合,通过将PlxnA1与TREM2隔离抑制ITAM共刺激信号通路,下调PLCγ和钙流,从而抑制破骨细胞分化,并通过NRP-1-PlxnA抑制RhoA活化抑制破骨细胞前体细胞迁移[11],但具体机制有待进一步研究。
综上所述,本研究阐明了缺氧能够通过HIF-1α介导的NRP-1表达上调抑制RAW264.7细胞向成熟破骨细胞分化,为寻找新的分子靶点治疗骨吸收性疾病提供新的实验证据。但本研究只在体外细胞模型中进行了研究,尚需运用动物模型进一步探索,以明确HIF-1α-NRP-1轴在体内对破骨细胞分化调控的具体机制。
| [1] | UPADHYAY J, FARR O M, MANTZOROS C S. The role of leptin in regulating bone metabolism[J]. Metab Clin Exp, 2015, 64(1): 105–113. DOI:10.1016/j.metabol.2014.10.021 |
| [2] | YAGI M, MIYAMOTO T, TOYAMA Y, et al. Role of DC-STAMP in cellular fusion of osteoclasts and macrophage giant cells[J]. J Bone Miner Metab, 2006, 24(5): 355–358. DOI:10.1007/s00774-006-0697-9 |
| [3] |
陈莉丽, 黄玫, 雷利红, 等. OPG/RANKL/RANK系统参与牙槽骨吸收及重建过程作用初探[J].
第三军医大学学报, 2013, 35(4): 288–292.
CHEN L L, HUANG M, LEI L H, et al. Role of OPG/RANKL/RANK system during alveolar bone resorption and remodeling[J]. J Third Mil Med Univ, 2013, 35(4): 288–292. |
| [4] | KOLAR P, GABER T, PERKA C, et al. Human early fracture hematoma is characterized by inflammation and hypoxia[J]. Clin Orthop Relat Res, 2011, 469(11): 3118–3126. DOI:10.1007/s11999-011-1865-3 |
| [5] | NOMURA T, AOYAMA M, WAGURI-NAGAYA Y, et al. Tumor necrosis factor stimulates osteoclastogenesis from human bone marrow cells under hypoxic conditions[J]. Exp Cell Res, 2014, 321(2): 167–177. DOI:10.1016/j.yexcr.2013.11.020 |
| [6] | SCHÖNENBERGER M J, KOVACS W J. Hypoxia signaling pathways: modulators of oxygen-related organelles[J]. Front Cell Dev Biol, 2015, 3: 42. DOI:10.3389/fcell.2015.00042 |
| [7] | WENGER R H. Cellular adaptation to hypoxia: O2-sensing protein hydroxylases, hypoxia-inducible transcription factors, and O2-regulated gene expression[J]. The FASEB J, 2002, 16(10): 1151–1162. DOI:10.1096/fj.01-0944rev |
| [8] |
王东江, 段莉, 谭包生. 低氧条件下HIF调控破骨细胞分化的分子机制研究进展[J].
口腔颌面修复学杂志, 2016, 17(5): 313–315.
WANG D J, DUAN L, TAN B S. Molecular mechanisms of regulation of osteoclast differentiation by HIF under hypoxic condition[J]. Chin J Prosthodont, 2016, 17(5): 313–315. DOI:10.3969/j.issn.1009-3761.2016.05.016 |
| [9] | WANG Y, WAN C, GILBERT S R, et al. Oxygen sensing and osteogenesis[J]. Ann N Y Acad Sci, 2007, 1117: 1–11. DOI:10.1196/annals.1402.049 |
| [10] | MISRA R M, BAJAJ M S, KALE V P. Vasculogenic mimicry of HT1080 tumour cells in vivo: critical role of HIF-1α-neuropilin-1 axis[J]. PLoS ONE, 2012, 7(11): e50153. DOI:10.1371/journal.pone.0050153 |
| [11] | HAYASHI M, NAKASHIMA T, TANIGUCHI M, et al. Osteoprotection by semaphorin 3A[J]. Nature, 2012, 485(7396): 69–74. DOI:10.1038/nature11000 |
| [12] | MORISHIMA S, MORITA I, TOKUSHIMA T, et al. Expression and role of mannose receptor/terminal high-mannose type oligosaccharide on osteoclast precursors during osteoclast formation[J]. J Endocrinol, 2003, 176(2): 285–292. DOI:10.1677/joe.0.1760285 |
| [13] | QUARLES L D, YOHAY D A, LEVER L W, et al. Distinct proliferative and differentiated stages of murine MC3T3-E1 cells in culture: an in vitro model of osteoblast development[J]. J Bone Miner Res, 1992, 7(6): 683–692. DOI:10.1002/jbmr.5650070613 |
| [14] | KARTSOGIANNIS V, NG K W. Cell lines and primary cell cultures in the study of bone cell biology[J]. Mol Cell Endocrinol, 2004, 228(1/2): 79–102. DOI:10.1016/j.mce.2003.06.002 |
| [15] | WANG Y, WAN C, DENG L, et al. The hypoxia-inducible factor alpha pathway couples angiogenesis to osteogenesis during skeletal development[J]. J Clin Invest, 2007, 117(6): 1616–1626. DOI:10.1172/JCI31581 |
| [16] | MORTEN K J, BADDER L, KNOWLES H J. Differential regulation of HIF-mediated pathways increases mitochondrial metabolism and ATP production in hypoxic osteoclasts[J]. J Pathol, 2013, 229(5): 755–764. DOI:10.1002/path.4159 |
| [17] | KNOWLES H J, ATHANASOU N A. Acute hypoxia and osteoclast activity: a balance between enhanced resorption and increased apoptosis[J]. J Pathol, 2009, 218(2): 256–264. DOI:10.1002/path.2534 |



