壁外血管侵犯(extramural venous invasion,EMVI)是指胃肠道肿瘤肠壁固有肌层外的血管出现肿瘤浸润。31%的直肠癌可发生EMVI[1], 并与局部复发、远处转移、预后不良、总体生存率密切相关[2-3]。因此,术前准确评估直肠癌EMVI状态对制定治疗策略和判断患者预后具有重要的临床意义。磁共振成像(magnetic resonance imaging,MRI)增强扫描可连续观察肠壁外血管走行及管腔内信号改变,是目前术前评估直肠癌EMVI的主要检查手段,但其敏感性较低,为28.2%~ 62.0%[4-5], 且很难对管径小于3 mm的壁外血管进行准确评估[6]。动态增强MRI(dynamic contrast-enhanced MRI,DCE-MRI)可通过参数量化血流动力学变化,从而反映肿瘤微血管生成及通透性改变,目前已被广泛应用于肝脏、前列腺、乳腺等部位的研究中[7-9]。针对直肠癌,DCE-MRI参数已被证实与T分期、N分期、肿瘤血管生成及生物侵袭性密切相关[10-11],但目前应用DCE-MRI参数术前评估直肠癌EMVI的研究鲜有报道。因此,本研究旨在探讨DCE-MRI定量及半定量参数在直肠癌EMVI术前评估中的应用价值。
1 资料与方法 1.1 一般资料回顾性分析2016年11月至2018年6月在本院行直肠常规MRI和DCE-MRI检查并经病理证实的直肠癌患者。纳入标准:①经手术病理证实为直肠癌,且病理报告包含壁外血管侵犯相关情况;②手术前未经任何放、化疗等非手术治疗。排除标准:①病理资料不完整,未判断壁外血管是否受侵或诊断不明确;②MR图像质量差;③DCE-MRI扫描序列不完整。本研究通过本院医学伦理委员会批准[2016年科伦审第(28)号],受试者均签署知情同意书。
1.2 MRI检查方法采用1.5T磁共振扫描仪(GE HDXT2012,美国),配以8通道腹部专用线圈。检查前禁食12 h,叮嘱患者排空肠内容物。磁共振检查前10 min肌注20 mg山莨菪碱(10 mg/mL)。先行常规MRI序列扫描,然后进行多翻转角扫描(2°、5°、8°、12°、15°),最后进行DCE-MRI扫描,动态增强翻转角为15°,每期扫描52层,共32期,扫描时长约5 min 10 s,常规MRI和DCE-MRI扫描参数见表 1。对比剂选用钆双胺注射液(Gd-DTPA,欧乃影,GE药业有限公司),由高压注射器在第3期扫描时经肘静脉注射,剂量为0.2 mmol/kg,流率为2.5 mL/s,注射完毕后连接管道及静脉用20 mL生理盐水冲洗。
| 序列 | TR/ms | TE/ms | 层厚/mm | 层间距/mm | FOV/cm×cm | 矩阵 |
| 轴位T1FSE | 800 | 8.8 | 6 | 1 | 26×26 | 320×192 |
| 矢状位T2FSE | 4 500 | 102 | 3 | 0 | 26×26 | 320×192 |
| 斜轴位T2CUBE | 2 000 | 103 | 2 | 0 | 26×26 | 224×224 |
| 轴位动态增强T1 3D-LAVA | 3.9 | 1.4 | 5 | -2.5 | 40×32 | 224×160 |
1.3 图像分析及数据处理
常规MRI图像由两名具有5年以上腹部MRI诊断经验的医师分析。所有DCE-MRI原始数据以DICOM格式导入Omni Kinetic v1.1工作站(GE,美国),由另外两名有经验的腹部诊断医师在无病理结果和临床诊断的情况下对所有图像进行分析。首先导入5个不同的翻转角序列及DCE-MRI序列,然后选取左侧髂外动脉血管中心,勾画圆形感兴趣区(region of interest,ROI),得到动脉输入函数曲线(arterial input function,AIF),ROI范围不得超过血管壁。选择Extended-Tofts双室模型,逐层绘制肿瘤实质部分ROI,尽量避开肉眼可见的血管、出血、坏死及肠腔内容物,然后融合所有层面的ROI,得到肿瘤全容积ROI,并计算得到定量参数:容量转移常数(volume transfer constant, Ktrans)、速率常数(rate constant, Kep)、血管外细胞外容积分数(volume fraction of extravascular extracellular space, Ve)、血浆容积分数(volume fraction of plasma, Vp)。半定量参数:曲线下初始面积(initial area under curve,iAUC)、达峰时间(time to peak,TTP)、上升斜率(Max Slope)、对比剂最大浓度(Max Conc)。两名医师分别勾画每个病灶,并取平均值为各参数值。
1.4 手术及病理患者均行全直肠系膜筋膜切除术(total mesorectal excision,TME),病理报告内容包括肿瘤病理学类型、分化程度、侵犯深度、直肠系膜淋巴结是否转移(阳性数/总数)、壁外血管是否侵犯。EMVI阳性标准:HE染色观察到肿瘤细胞包绕、侵犯肠壁周围脂肪组织内或浆膜下血管壁,或肿瘤细胞侵入肠壁外血管管腔内形成瘤细胞栓子,诊断不明确时,结合免疫组化(CD34阳性)判断。
1.5 统计学分析采用SPSS 23.0统计软件,两名医师提取参数的一致性检验采用组内相关系数(intraclass correlation coefficient,ICC)。分类变量采用卡方检验或Fisher精确检验,连续性变量采用Kolmogorov-Smirnov检验进行正态性检验,Levene检验进行方差齐性检验。以x±s表示正态分布且方差齐性的参数,组间比较采用两独立样本t检验;以中位数及四分位数间距表示非正态分布或方差不齐的参数,组间比较采用Mann Whitney U检验。绘制受试者工作特性曲线ROC并计算曲线下面积(area under the curve,AUC)评估各参数的诊断效能。各参数与EMVI的相关性采用Spearman相关性分析。ROC曲线下面积通过MedCalc软件采用DeLong法进行比较。检验水准α=0.05。
2 结果 2.1 病例资料结果76例直肠癌患者纳入研究,其中EMVI阳性21例(图 1),EMVI阴性55例(图 2),系膜淋巴结N分期在EMVI阳性与阴性组间具有统计学差异(P < 0.05),患者性别、年龄、病理类型、分化程度、侵犯深度、CEA、CA-125和CA-199在EMVI阳性与阴性组间无统计学差异(P>0.05)。
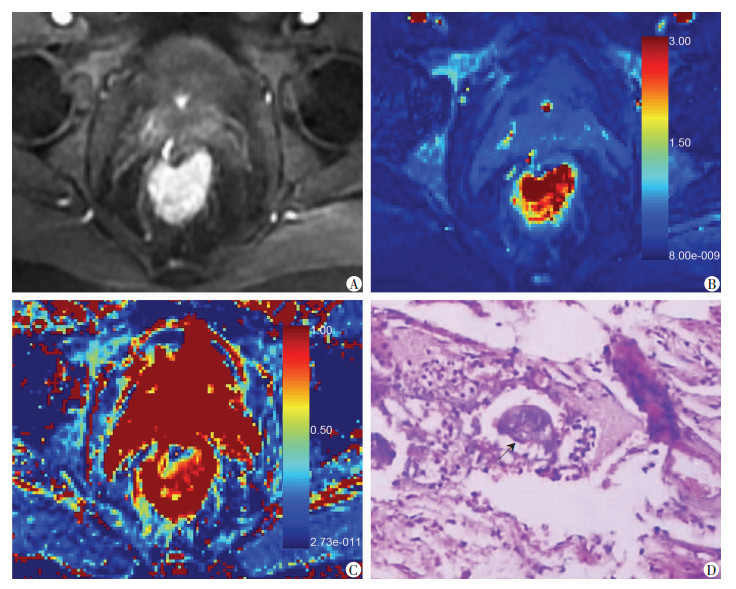
|
| A:动态增强直肠下段肿瘤明显强化;B: Ktrans伪彩图; C: Ve伪彩图; D: HE染色(×200)示壁外血管腔内癌栓形成(↑),EMVI(+) 图 1 直肠癌伴EMVI患者(男,63岁)MRI影像分析及病理学观察 |
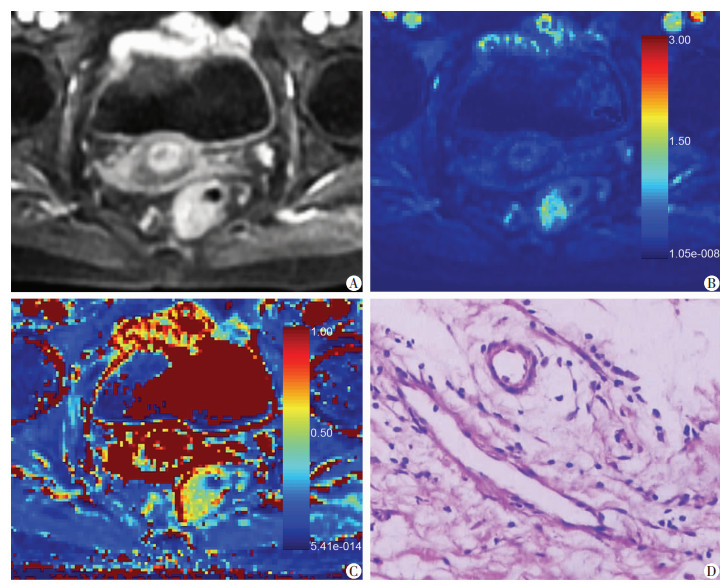
|
| A:动态增强直肠下段肿瘤明显强化;B:Ktrans伪彩图;C:Ve伪彩图;D:HE染色(×200)壁外血管未见侵犯,EMVI(-) 图 2 直肠癌不伴EMVI患者(女,59岁)MRI影像分析及病理学观察 |
2.2 EMVI阳性组与阴性组DCE-MRI定量及半定量参数的比较
两名医师测量DCE-MRI定量及半定量参数的一致性好,Ktrans、Kep、Ve、Vp、iAUC、TTP、Max Slope、Max Conc的组内相关系数分别为0.81、0.84、0.90、0.77、0.86、0.81、0.79、0.80。直肠癌EMVI阳性组与阴性组间DCE-MRI定量及半定量参数的比较见表 2。DCE-MRI定量参数中Ktrans和Ve值在EMVI阳性组显著大于阴性组,差异具有统计学意义(P < 0.05),Kep和Vp值在两组间无统计学差异。半定量参数在EMVI阳性组和阴性组间均无统计学差异。
| 组别 | Ktrans/min-1 | Kep/min-1 | Ve | Vp | iAUC | TTP | Max Slope | Max Conc |
| EMVI阳性组 | 1.120(0.238, 1.874) | 1.293±0.711 | 0.708±0.317 | 0.422±0.397 | 6.318(3.605, 9.486) | 2.787(2.549, 3.605) | 3, 550(2.431, 4.451) | 1.944(1.182, 2.518) |
| EMVI阴性组 | 0.262(0.115, 0.645) | 1.287±0.973 | 0.390±0.266 | 0.389±0.361 | 6.028(5.108, 8.830) | 2.857(2.554, 1.429) | 3.484(2.842, 4.261) | 1.904(1.429, 2.511) |
| t/z值 | -3.061 | 0.461 | 1.2 | 0.513 | -0.378 | -0.285 | -0.784 | -0.552 |
| P值 | 0.002 | 0.69 | <0.001 | 0.733 | 0.706 | 0.776 | 0.433 | 0.581 |
2.3 DCE-MRI参数诊断效能分析
EMVI阳性组与阴性组间比较有意义的参数Ktrans和Ve纳入诊断效能分析,Ktrans、Ve及Ktrans联合Ve对EMVI的诊断效能良好(表 3、图 3),Ktrans诊断直肠癌EMVI具有较高的特异性。DeLong分析显示,Ktrans、Ve及Ktrans联合Ve曲线下面积差异无统计学意义。
| 参数 | AUC | P值 | 95% CI | 临界值 | 敏感性 | 特异性 |
| Ktrans | 0.728 | 0.002 | 0.576~0.881 | 0.870 | 66.7% | 90.9% |
| Ve | 0.769 | <0.001 | 0.633~0.905 | 0.556 | 76.2% | 78.2% |
| Ktrans+Ve | 0.779 | <0.001 | 0.641~0.917 | 0.304 | 76.2% | 80.0% |
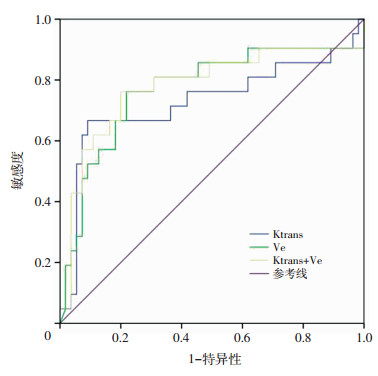
|
| 图 3 DCE-MRI定量参数Ktrans、Ve及Ktrans+Ve的ROC曲线 |
2.4 DCE-MRI定量及半定量参数与EMVI相关性分析
DCE-MRI定量参数中Ktrans、Ve与EMVI具有一定的相关性(Ktrans:r=0.353, P=0.002;Ve:r=0.417, P < 0.001),半定量参数iAUC、TTP、Max Slope、Max Conc与EMVI呈弱相关(P>0.05)。
3 讨论直肠癌TNM分期系统是目前临床制定治疗方案最重要的参考标准,EMVI虽未包含于该系统中,但因其在术前预测局部复发、生存率、无病生存期及术后评估中表现出的独立预测作用[2, 12],现已被推荐为制定治疗决策时的另一重要参考标准,尤其是在选择新辅助治疗时[12]。直肠癌EMVI阳性组的T分期显著高于阴性组,且较阴性组更易发生淋巴结转移,但肿瘤分化程度在两组间差异无统计学意义[1]。本研究显示,肿瘤的病理学类型、分化程度、T分期在EMVI阳性组与阴性组间差异无统计学意义,仅N分期在两组间差异有统计学意义,与文献[1]报道部分符合。但目前术前准确评估直肠癌N分期的标准不一,且诊断EMVI效能相对较低。因此,利用临床病理资料术前判断EMVI仍然存在一定的难度。
DCE-MRI通过药物代谢动力学模型对病变内对比剂浓度的变化进行量化,从而反映肿瘤微血管生成及通透性。Ktrans是DCE-MRI参数中最常用的参数,代表单位时间内对比剂从血管内向细胞外血管外间隙(extracellular extravascular space,EES)扩散的速度,反映肿瘤局部微血管血流状态及其表面渗透面积。Ve代表对比剂从血管内渗漏到EES的容积与整个EES容积的百分数,其大小可以反映EES中对比剂的容量。多项研究证实Ktrans、Ve与直肠癌肿瘤分化程度呈负相关,与T分期呈正相关,并且在有淋巴结转移的直肠癌中,Ktrans值和Ve值也显著高于非转移组[10, 13-14]。本研究也显示,Ktrans和Ve值在EMVI阳性组显著高于阴性组,并与EMVI表现出一定的正相关,提示Ktrans和Ve与肿瘤的血管侵袭密切相关。肿瘤血管生成是肿瘤生长、浸润与转移的重要条件之一,肿瘤内不成熟的新生血管因细胞增殖旺盛而增多,肿瘤细胞分泌血管内皮因子使肿瘤血管通透性增大,同时释放大量的分裂素、趋化因子和胞外基质降解酶等细胞因子,进一步加重肿瘤新生血管壁的破坏和缺陷,导致对比剂外渗速率增加,漏入EES的对比剂增多,从而使Ktrans值和Ve值增大。当发生EMVI时,肿瘤血管内皮因子和多种细胞因子可进一步作用于壁外血管,导致壁外血管壁的破坏和缺陷,从而造成EMVI阳性组Ktrans值和Ve值显著上升。
与Ktrans相反,Kep代表单位时间内对比剂从EES回流入微血管内的转移速率, Kep值也可以反映肿瘤微血管的生长状态。然而,Kep并不是独立存在,其值的大小与Ktrans和Ve相关,Kep=Ktrans/Ve。受血流在时间与空间上的分布不平衡和肿瘤异质性等因素的影响,Kep并不一定与肿瘤恶性程度相关,这一观点在国内外关于DCE-MRI参数与直肠癌分化程度的研究中得以证实[10, 13, 15-16]。由于本研究未就肿瘤的病理学类型、瘤体体积进行分类研究,也可能导致EMVI阳性组与阴性组Kep值差异无统计学意义。Vp代表血浆内对比剂百分比,国内外关于Vp的研究相对较少。本研究显示,Vp在EMVI阳性组与阴性组间差异无统计学意义,可能与本研究选择的药代动力学计算模型有关。TOFTS等[17]认为微血管容积在组织中所占比例很小,常低于5%,许多PK模型在计算时默认血管内对比剂比例的改变对组织整体影响相对较小。因此,Kep和Vp在评估EMVI中的作用仍需进一步证实。
最近研究发现,DCE-MRI定量与半定量参数间具有较强的相关性[18]。国内部分学者认为,iAUC在直肠癌肿瘤分化程度和T分期上的差异具有统计学意义,可以作为评价直肠癌病理情况的影像生物学标记物[10, 16]。而本研究显示,在EMVI阳性组与阴性组间半定量参数差异均无统计学意义,考虑可能影响因素有:半定量参数是综合反映肿瘤微血管灌注情况,而壁外血管侵犯与否的微循环灌注差异可能只表现为局部参数的改变。因此,半定量参数不能准确反映发生EMVI时局部微循环的变化。此外,半定量参数依赖于信号强度、对比剂浓度和扫描参数。这些因素均可能影响半定量参数的一致性。因此,半定量参数在评估EMVI时具有一定的局限性,其作用尚需更多的研究证实。
根据诊断效能分析结果,当Ktrans值>0.870或Ve值>0.556时对直肠癌EMVI具有良好的诊断价值(AUC=0.728,0.769),但诊断效能仍相对稍低,可能与我们采用全容积法进行EMVI评估有关。YAO等[15]研究发现Ktrans值在T1~T3期呈逐渐增大,但在T4期时反而降低,其原因可能是晚期肿瘤增大,肿瘤内坏死增多,肿瘤的异质性增大所致。本研究T4期肿瘤占了一定比例(12/76,15.8%),虽然在绘制ROI时尽量避开坏死、囊变和出血区,但仍然无法避开肉眼难以识别的坏死、囊变和出血。同时,考虑到肉眼无法识别EMVI发生的具体层面,本研究采用了绘制肿瘤全容积ROI的方法,然后取DCE-MRI参数的平均值进行评估,上述因素都可能在一定程度上降低了Ktrans与Ve对EMVI的诊断效能。但Ktrans特异性较高(90.9%),对排除EMVI具有较大的参考价值。此外,本研究还发现Ktrans联合Ve诊断EMVI与单一参数比较诊断效能并没有显著提升,推测可能是因为Ktrans与Ve并不随肿瘤恶性程度增高、侵袭深度加深而无限制升高,当EES内对比剂浓度达到一定程度时,微血管内外压力差减少,影响微血管内对比剂向EES扩散的速率,两者间可能相互关联和制约。
本研究仍然存在一定的局限性。首先,受限于部分壁外血管管径细小,术前无法评估EMVI的具体层面,我们提取的是直肠癌肿瘤全容积的DCE-MRI参数,获得的是整个肿瘤的平均参数值,造成参数的诊断效能可能低于壁外血管侵犯区参数的实际诊断能力。其次,DCE-MRI扫描技术、药代动力学模型的选择亦缺乏统一标准,这些因素可能限制DCE-MRI技术的推广应用。最后,DCE-MRI扫描在尽量提高时间分辨率的同时一定程度上降低了软组织分辨率,需要技师尽量平衡时间分辨率和软组织分辨率的关系。
综上所述,DCE-MRI定量参数Ktrans和Ve能有效评估EMVI,其中Ktrans在排除EMVI上具有较高的特异性,为临床术前判断直肠癌EMVI状态、制定治疗决策和评估患者预后提供了重要的参考价值。
| [1] | JHAVERI K S, HOSSEINI-NIK H, THIPPHAVONG S, et al. MRI detection of extramural venous invasion in rectal cancer: correlation with histopathology using elastin stain[J]. Am J Roentgenol, 2016, 206(4): 747–755. DOI:10.2214/AJR.15.15568 |
| [2] | TRIPATHI P, RAO S X, ZENG M S. Clinical value of MRI-detected extramural venous invasion in rectal cancer[J]. J Dig Dis, 2017, 18(1): 2–12. DOI:10.1111/1751-2980.12439 |
| [3] | ZHANG X Y, WANG S, LI X T, et al. MRI of extramural venous invasion in locally advanced rectal cancer: relationship to tumor recurrence and overall survival[J]. Radiology, 2018, 289(3): 677–685. DOI:10.1148/radiol.2018172889 |
| [4] | SOHN B, LIM J S, KIM H, et al. MRI-detected extramural vascular invasion is an independent prognostic factor for synchronous metastasis in patients with rectal cancer[J]. Eur Radiol, 2015, 25(5): 1347–1355. DOI:10.1007/s00330-014-3527-9 |
| [5] | SMITH N J, BARBACHANO Y, NORMAN A R, et al. Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer[J]. Br J Surg, 2008, 95(2): 229–236. DOI:10.1002/bjs.5917 |
| [6] | BROWN G, RADCLIFFE A G, NEWCOMBE R G, et al. Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging[J]. Br J Surg, 2003, 90(3): 355–364. DOI:10.1002/bjs.4034 |
| [7] | CHEN B B, HSU C Y, YU C W, et al. Dynamic contrast-enhanced mr imaging of advanced hepatocellular carcinoma: comparison with the liver parenchyma and correlation with the survival of patients receiving systemic therapy[J]. Radiology, 2016, 281(2): 454–464. DOI:10.1148/radiol.2016152659 |
| [8] |
余加懿, 郭大静, 罗银灯, 等. 磁共振动态对比增强直方图分析在前列腺癌鉴别诊断中的价值[J].
第三军医大学学报, 2017, 39(22): 2206–2213.
YU J Y, GUO D J, LUO Y D, et al. Value of histogram analysis of quantitative parameters in dynamic contrastenhanced magnetic resonance imaging in diagnosis of prostate cancer[J]. J Third Mil Med Univ, 2017, 39(22): 2206–2213. DOI:10.16016/j.1000-5404.201708017 |
| [9] | KIM S Y, CHO N, PARK I A, et al. Dynamic contrast-enhanced breast MRI for evaluating residual tumor size after neoadjuvant chemotherapy[J]. Radiology, 2018, 289(2): 327–334. DOI:10.1148/radiol.2018172868 |
| [10] |
沈浮, 陆建平, 陈录广, 等. 动态增强磁共振成像在直肠癌术前诊断中的应用研究[J].
中国医学计算机成像杂志, 2016, 22(1): 39–43.
SHEN F, LU J P, CHEN L G, et al. Value of dynamic contrast-enhanced magnetic resonance imaging in the preoperative diagnosis of rectal cancer[J]. Chin Comput Med Imag, 2016, 22(1): 39–43. DOI:10.19627/j.cnki.cn31-1700/th.2016.01.009 |
| [11] | YEO D M, OH S N, JUNG C K, et al. Correlation of dynamic contrast-enhanced MRI perfusion parameters with angiogenesis and biologic aggressiveness of rectal cancer: Preliminary results[J]. J Magn Reson Imaging, 2015, 41(2): 474–480. DOI:10.1002/jmri.24541 |
| [12] | CHAND M, BHANGU A, WOTHERSPOON A, et al. EMVI-positive stage Ⅱ rectal cancer has similar clinical outcomes as stage Ⅲ disease following pre-operative chemoradiotherapy[J]. Ann Oncol, 2014, 25(4): 858–863. DOI:10.1093/annonc/mdu029 |
| [13] |
张文文, 黄刚, 周星, 等. DCE-MRI定量参数与直肠癌病理分期及分级的相关性研究[J].
临床放射学杂志, 2016, 35(7): 1058–1061.
ZHANG W W, HUANG G, ZHOU X, et al. Dynamic contrast enhanced MRIof rectal cancer: a study of the correlations between quantitative parameters and pathological stage and grades[J]. J Clin Radiol, 2016, 35(7): 1058–1061. DOI:10.13437/j.cnki.jcr.2016.07.018 |
| [14] | YU X P, WEN L, HOU J, et al. Discrimination of metastatic from non-metastatic mesorectal lymph nodes in rectal cancer using quantitative dynamic contrast-enhanced magnetic resonance imaging[J]. J Huazhong Univ Sci Technol Med Sci, 2016, 36(4): 594–600. DOI:10.1007/s11596-016-1631-6 |
| [15] | YAO W W, ZHANG H, DING B, et al. Rectal cancer: 3D dynamic contrast-enhanced MRI; correlation with microvascular density and clinicopathological features[J]. Radiol Med, 2011, 116(3): 366–374. DOI:10.1007/s11547-011-0628-2 |
| [16] | SHEN F, LU J P, CHEN L G, et al. Diagnostic value of dynamic contrast-enhanced magnetic resonance imaging in rectal cancer and its correlation with tumor differentiation[J]. Mol Clin Oncol, 2016, 4(4): 500–506. DOI:10.3892/mco.2016.762 |
| [17] | TOFTS P S, BRIX G, BUCKLEY D L, et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols[J]. J Magn Reson Imaging, 1999, 10(3): 223–232. |
| [18] | DIJKHOFF R A P, MAAS M, MARTENS M H, et al. Correlation between quantitative and semiquantitative parameters in DCE-MRI with a blood pool agent in rectal cancer: can semiquantitative parameters be used as a surrogate for quantitative parameters?[J]. Abdom Radiol (NY), 2017, 42(5): 1342–1349. DOI:10.1007/s00261-016-1024-0 |



