2. 610500 成都,成都医学院:生物技术学院实验教学中心
2. Experimental Teaching Center, School of Biotechnology College, Chengdu Medical College, Chengdu, Sichuan Province, 610500, China
将化疗药物以物理包裹或化学接枝的方式携载至聚合物载体上制备的载药纳米粒子,可被动或主动靶向至肿瘤组织,提高化疗药物的疗效,降低药物对正常组织的毒性[1]。被动靶向主要依靠实体瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR)等机制将纳米粒子阻止在肿瘤内部发挥疗效[2],主动靶向则可依靠纳米粒子表面接枝的抗体[3]、核酸适体[4]等可特异性识别肿瘤细胞表面的受体分子,通过受体介导的内吞作用将药物输送至肿瘤细胞内部,从而提高药物生物利用度。
纳米粒子这一类载药系统仍然存有多种缺陷:一方面肿瘤内部缺氧的微环境[5]导致这类靶向制剂难以渗透至肿瘤内部的缺氧区域。研究表明,经静脉注射纳米粒子12 h后,仅有不到2%聚集在肿瘤部位[6]。另一方面,这类纳米粒子主要依靠血液循环进入肿瘤内部,除了依靠自身的扩散之外,尚缺乏一定的驱动机制[7]。
随着生物技术的发展,细菌如沙门氏菌、生孢梭菌、双歧杆菌和某些大肠杆菌能靶向定植于肿瘤内部的低氧区域[8]。其中,沙门氏菌已经被用于临床Ⅰ期癌症治疗研究[9-10]。革兰阴性菌大肠杆菌(Escherichia coli Nissle 1917, EcN)是一种非乳酸类益生菌,无毒,可与肠上皮细胞及肠道其他微生物相互作用,常被用于肠道性疾病的预防和治疗[11]。近期研究表明,EcN对血清敏感的特性有助于其对肿瘤组织的特殊嗜好,进入机体后能被其他组织迅速清除;此外,EcN对厌氧菌盲区,即肿瘤活性区和坏死区之间的过渡区有特殊偏好,具有较强的肿瘤靶向性,对实验动物没有毒性[12-13]。
因此,本研究假设,将EcN细菌连接在聚合物载药微球的表面,可将载药聚合物微粒输送至肿瘤低氧部位,增强载药微粒在肿瘤组织内的渗透,提高药物的富集。采用EDC-NHS催化反应方法使EcN表面的氨基和聚苯乙烯马来酸酐(poly styrene-co-maleic anhydride, PSMA)载药微粒表面的酸酐结构发生共价结合,同时,为保证药物的有效释放,选用生物可降解的聚乳酸-聚乙二醇的共聚物[poly (DL-Lactic acid) and poly ethyleneglycol block copolymer, PELA]与PSMA混合,制备携载化疗药物阿霉素(Dox)的PSMA/PELA载药微粒,标记为DMP,并通过体外和体内实验初步研究EcN共价结合的聚合物载药微粒靶向肿瘤低氧区域的效果。
1 材料与方法 1.1 实验材料聚苯乙烯马来酸酐PSMA(重均分子量Mw=150×103)购于上海兆成科技有限公司;聚乳酸-聚乙二醇共聚物PELA(含有10%的PEG-2000,Mw=23.8×103)采用二氯化锡为引发剂,通过开环聚合的方法由本实验室自行合成;盐酸阿霉素(Dox-HCL)购于大连美仑生物制药有限公司;聚乙烯醇PVA(聚合度1799,分析纯)、二氯甲烷、三乙胺等化学试剂购自成都科龙化工试剂厂;DAPI染料购自南京碧云天生物科技有限公司;异硫氰酸荧光素(FITC)购于赛国生物科技有限公司;1-3-二甲氨基丙基-3-乙基碳二亚胺盐酸盐EDC(纯度99%),N-羟基琥珀酰亚胺NHS购于上海阿拉丁生化科技有限公司。
1.2 实验方法 1.2.1 PSMA/PELA空白和载药微粒的制备采用溶剂挥发法制备载阿霉素微球。分别称取不同质量比的PSMA和PELA聚合物(5 :5,7 :3)溶于50 mL二氯甲烷作为分散相,然后配置5%的PVA水溶液200 mL作为连续相。将盐酸阿霉素(Dox·HCL)经三乙胺脱盐酸制备得到Dox,准确称取一定量的Dox(50 mg),加少量DMSO溶解后,缓慢滴加至上述分散相中,得到投药量为5%的聚合物溶液。然后将载药聚合物溶液缓慢滴加到PVA水溶液中,设定机械搅拌器搅拌转速为600 r/min,搅拌30 min后转入磁力搅拌器进一步搅拌24 h后搜集乳液,离心(45 000 r/min)30 min后收集沉淀物,去离子水洗涤5次,冷冻干燥24 h后得到载药微粒,标记为DMP5/5和DMP7/3。同样的方法制备空白7 :3混合的PSMA/PELA聚合物微粒,标记为BMP7/3。
1.2.2 载药微粒的表征采用激光纳米粒度仪(Nano ZS90,英国马尔文仪器有限公司)测定DMP5/5和DMP7/3的粒径;倒置相差显微镜(Ⅸ51,日本Olympus)观察纳米粒子的形貌;由于Dox具有自发荧光的特性,因此采用荧光显微镜(XSP-C17,MicroDemo有限公司)观察药物的包裹情况。另取少量微球,表面喷金处理后,扫描电子显微镜(SEM,QUANTA 200,荷兰FEI公司)表征其形貌。
1.2.3 Dox标准曲线的建立及载药量和包裹效率测定准确称取1 mg Dox,置于1.5 mL的离心管中,加入DMSO配置成浓度为1 mg/mL的母液,PBS倍比稀释成10 ng/mL至10 μg/mL的不同浓度的Dox溶液。参考文献方法[14],采用荧光分光光度计(FL-7000,日本日立公司),设定激发为480 n,发射波长550 nm,测定不同浓度的阿霉素的荧光强度,以横坐标为浓度,纵坐标为荧光强度,绘制标准曲线。
分别称取5 mg的DMP5/5和DMP7/3载药微球置于50 mL塑料离心管中,加入1 mL二氯甲烷溶解完全后,加入10 mL PBS至离心管中,旋涡震荡仪混合5 min后,室温静置分离10 min,收集水相PBS。相同方法重复萃取5次。同时称取1 mg Dox和5 mg空白聚合物,共同溶解至1 mL二氯甲烷中,重复上述操作校正萃取效率,实验重复3次。参考上述方法,测定萃取液中Dox的荧光强度,根据标准曲线计算Dox的含量,并按以下公式计算PSMA/PELLA载药微粒的载药量和包裹效率。
 |
(1-1) |
 |
(1-2) |
称取一定质量的DMP5/5和DMP7/3载药微粒分别分散在PBS中,配置成终浓度为1 mg/mL悬液,置于透析袋(截留分子量为3 000×103)内,然后将透析袋放入盛有40 mL PBS的塑料离心管中,置于摇床,设置转速为100 r/min,温度为37 ℃,于不同的时间点取出1 mL PBS,同时补充新鲜的等体积PBS,参考1.2.3方法测定不同时间点释放的药物的光密度值,并计算药物累积释放量。
1.2.5 EcN共价PSMA/PELA载药微粒的制备和表征收集对数生长期的EcN细菌,并采用FITC进行标记。调整EcN浓度为1×107CFU/mL,无菌条件下与浓度为1 mg/mL的DMP7/3等体积混合后,加入EDC和NHS(0.5 mg/mL)及0.1 mL三乙胺,置于摇床缓慢震荡30 min(80 r/min),使EcN表面的氨基和PSMA/PELA载药微粒(EcN@DMP)表面的酸酐发生共价反应。采用激光共聚焦显微镜(CLSM)对接枝后的EcN@DMP进行表征。
1.2.6 接枝后EcN生长情况测定将上述制备得到的EcN@BMP7/3、EcN@DMP7/3和自由EcN分别接种于LB培养基中,生长一定时间后,挑取各组中单个菌落分别接种于25 mL玻璃试管中,每只加入6 mL液体培养基,按1 :200的比例将菌液培养至D(600)值为0. 6左右后分别接种到14支试管中,1支不接种,作为阴性对照。将15支试管于37 ℃、220 r/min的恒温摇床中培养,分别于培养的不同时间内,吸取3 mL菌液,测定D(600)值,然后以培养时间为横坐标,以D(600)值为纵坐标,绘出各组中EcN的生长曲线。
1.2.7 体外渗透实验收集对数生长期的HepG2细胞,参考文献[15]的方法构建3D肿瘤细胞球体组织,将浓度为10 μg/mL等量Dox的EcN@DMP7/3和DMP7/3分别与HepG2细胞球共同孵育4 h后,小心吸取球体,PBS洗涤3遍后,多聚甲醛固定,采用DAPI对肿瘤组织进行染色,CLSM对细胞球以扫描距离15 μm进行光学层扫,观察EcN@DMP7/3和DMP7/3在瘤体中的分布。
1.2.8 体内分布实验 1.2.8.1 肿瘤模型的建立将H22细胞复苏,调整细胞浓度为1×107/mL后,将0.2 mL细胞悬液经腹腔注射接种至小鼠腹腔内,待7~9 d形成腹水后,小心抽取腹水1 mL,PBS洗涤3次,调整细胞浓度至1×107/mL,于SPF级BALB/c小鼠(18~22 g,雌性,30只,购自四川达硕生物科技有限公司)左侧腋下处注射100 μL细胞悬液,使其自然成瘤。
1.2.8.2 实验分组及处理该研究内容和过程所涉及的动物实验经成都医学院伦理委员会审批(20181013),符合实验动物伦理要求,符合《动物保护法》相关规定。待上述肿瘤生长至100 mm3时,采用完全随机化分组方法将荷瘤小鼠分为2组,每组15只。经尾静脉分别注射100 μL含等剂量Dox(2 mg/kg)的EcN@DMP7/3和DMP7/3悬液,于注射后4、12 h和24 h,行安乐术处死小鼠(n=5),取小鼠的心、肝、脾、肺、肾和肿瘤组织,用生理盐水清洗后,滤纸吸取表面残留的生理盐水后准确称重。采用组织匀浆器匀浆后,加入一定体积的冰醋酸,4 ℃过夜酸化组织后,于每组样品中加入一定量的DMF和甲醇(4 :1)的混合溶剂沉淀蛋白,并同时萃取出样品中Dox,于4 ℃(4 000 r/min)离心10 min后,采用荧光分光光度计检测上清液中Dox荧光强度,计算各组织中Dox浓度。
1.3 统计学分析所有统计分析采用IBM SPSS statistics 20.0软件完成,计量资料以x±s表示,组间比较采用单因素方差分析。检验水准α=0.05。
2 结果 2.1 粒径结果分析采用动态光散射(DLS)测量两种不同聚合物比例的载药微球粒径,如图 1所示,DMP7/3和DMP5/5平均粒径分别为750 nm和704 nm,尺寸无明显差异,说明聚合物的比例对微球的粒径影响较小。DMP7/3和DMP5/5两种载药微球的粒径分布均一,分散系数(PDI)分别为0.31和0.13。
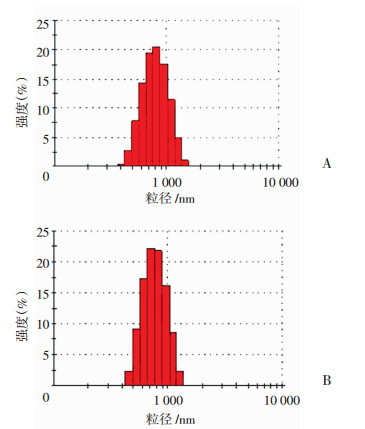
|
| A:DMP7/3;B:DMP5/5 图 1 不同比例PSMA/PELA载药微粒粒径分析 |
2.2 载药量和包裹效率的测定
采用荧光分光光度计分别测得DMP7/3和DMP5/5实际载药量分别为(4.27±0.19)%和(3.94±0.11)%,包裹效率分别为(85.4±2.6)%和(78.8±3.5)%,DMP5/5的载药量和包裹效率略低于DMP7/3,两种比例聚合物微球的载药量和包裹效率差异无统计学意义。
2.3 载药微粒形貌表征由于DMP7/3和DMP5/5粒径分布都较为均一,因此选用DMP7/3进行形貌的表征。光镜结果(图 2A)显示,采用乳液法制备得到的微球形貌规则,呈现均一的球形。由于Dox可以自发红色荧光,因此,采用荧光显微镜观察药物在聚合物纳米粒子中的分布,如图 2B所示,药物成功地附着在DMP7/3微粒表面。SEM(图 2C)结果表明,DMP7/3呈现规则的球形,且球体表面光滑。

|
| A:光镜(×400);B:荧光显微镜(×400);C:扫描电镜(×5 000) 图 2 载药微球(DNP7/3)的形貌表征 |
2.4 Dox的标准曲线和释放行为
图 3A为Dox的标准曲线,拟合方程为:Y=26.35x+ 0.079 8(R2=0.999 7),表明Dox在10 ng/mL至10 μg/mL浓度范围内线性关系良好。药物的有效释放有利于肿瘤内部的药物长时间维持在有效的治疗浓度,从而提高治疗效果。如图 3B所示,DMP7/3和DMP5/5中Dox在早期无明显的突释,且较长时间内的释放速度极为缓慢。在30 d内,Dox从DMP5/5中的释放略快于DMP7/3,分别累积释放5.6%和7.2%,差异无统计学意义。
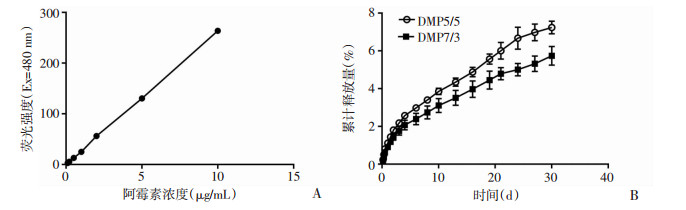
|
| A:Dox标准曲线;B:Dox从不同聚合物比例的载药微粒中的释放曲线 图 3 Dox的标准曲线及释放行为研究 |
2.5 CLSM表征接枝效果
为了牢固将EcN固定在PSMA/PELA载药微粒上,采用EDC-NHS催化EcN表面的氨基和DMP表面的酸酐发生共价反应。CLSM对反应后的EcN@DMP进行表征,结果如图 4所示。FITC标记的EcN菌体呈绿色,DMP由于Dox自发荧光的特性呈红色,绝大多数DMP7/3和EcN以1:1发生结合反应,即1个细菌可接枝一个纳米粒子,这可能是由于EcN和纳米粒子的尺寸相当,导致表面可供结合的区域较少引起的。
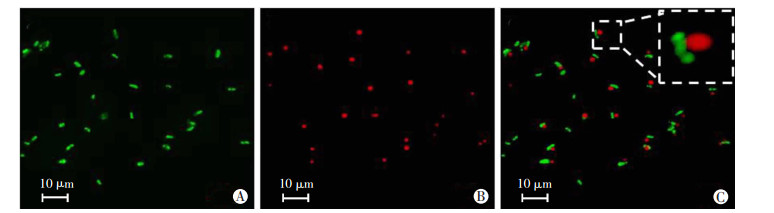
|
| A:FITC标记的EcN(绿色);B:DMP7/3(红色);C:EcN@DMP7/3;方框中为EcN接枝微球的CLSM放大图 图 4 激光共聚焦显微镜观察EcN与微球的接枝效果 |
2.6 EcN生长曲线测定
EcN与载药微粒结合后,能否维持其固有的生物学活性,对于实现细菌驱动载药微粒靶向至肿瘤低氧部位具有至关重要的作用。图 5为EcN@BMP7/3、EcN@DMP7/3和自由EcN的生长曲线,可见化学方法接枝后的EcN与自由EcN的生长规律极为相似,具有迟缓期、对数期和稳定期,可维持其良好的增殖和分裂能力。说明采用EDC-NHS方法可将EcN接枝到PSMA/PELA聚合物微粒的表面,且不会改变细菌的生长活性。

|
| 图 5 接枝空白纳米粒子和载药纳米粒子后EcN的生长曲线 |
2.7 体外渗透实验结果
采用人HepG2肝癌细胞系体外构建3D肿瘤模型,验证EcN的聚合物纳米粒子的渗透效果。图 6为EcN@DMP7/3和DMP7/3分别与HepG2细胞球体共同孵育4 h的激光共聚焦显微镜扫描结果。EcN@DMP7/3与肿瘤球体共同作用后,球体的中央和周围部位Dox的荧光强度较强,而DMP7/3处理后的肿瘤球体,仅在瘤体周围检测到Dox的富集,说明EcN@DMP7/3具有较好的靶向肿瘤缺氧部位的能力,能增强载药纳米粒子在肿瘤内部的渗透性。
|
| EcN@DMP7/3(A)和DMP7/3(B)与HepG2肿瘤球体孵育4h的CLSM层扫图,箭头代表携载Dox的PSMA/PELA微粒所在肿瘤中的部位 图 6 体外靶向肿瘤低氧环境分析 |
2.8 体内分布实验结果
图 7为静脉注射EcN@DMP7/3、DMP7/3 4 h和24 h后,药物在小鼠体内各组织中的分布结果。如图所示,EcN@DMP7/3和DMP7/3两种载药微粒在肝脏、脾脏和肺组织中含量较高。随着时间的延长,两组载药微粒在心、肝、脾、肺、肾脏组织中的含量都有所降低,这可能是由于部分载药微粒被机体清除导致。然而,肿瘤组织中药物的含量随着时间的延长反而有所增加,且EcN@DMP7/3治疗组中DOX浓度明显高于DMP7/3治疗组。静脉注射24 h后,EcN@DMP7/3治疗组的肿瘤组织内DOX浓度明显高于DMP7/3治疗组,差异具有统计学意义(P < 0.01)。表明将具有肿瘤靶向性的EcN与PSMA/PELA载药微粒共价结合后,可以驱动载药微粒到达肿瘤组织内部,从而提高肿瘤内部药物的含量。
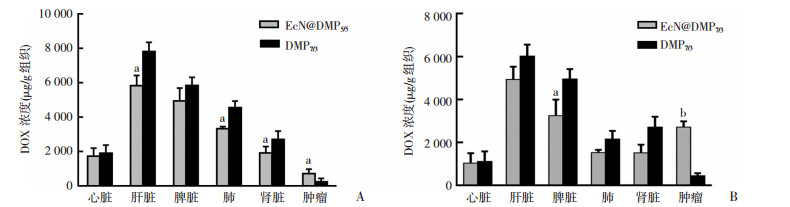
|
| a:P < 0.05,b:P < 0.01,与DMP7/3比较 图 7 EcN修饰和未修饰的载药纳米粒子经尾静脉注射4 h(A)和24 h(B)后的体内分布情况分析 |
3 讨论
低氧是绝大多数肿瘤组织微环境中一个重要的特征,可导致传统化疗药物和靶向制剂难以渗透至肿瘤内部,从而诱导肿瘤多耐药性产生,引起肿瘤细胞向远端转移[5]。因此,如何提高化疗药物及靶向药物载体在肿瘤组织中的渗透性,使药物能同时抑制肿瘤内部低氧区和表面有氧区的细胞增殖和转移,成为亟待解决的问题。随着生物医学工程的进展,利用细菌输送药物至肿瘤内部显示出了广阔的前景[16]。
目前利用细菌输送药物至肿瘤低氧部位的研究主要集中在利用基因工程技术对细菌进行改造,使得改造后的细菌能够通过酶类药物的激活或分泌活性分子达到抑制肿瘤的目的。然而,一方面,细菌在体内对外源药物蛋白的表达量不易受到控制,且基因改造后的细菌存在着潜在的安全问题;另一方面,将细菌和前体药物分别注射至体内,会导致前体药物很难释放至缺氧肿瘤部位。如何利用细菌靶向肿瘤低氧区域的优越特性,提高药物在肿瘤部位的渗透成为亟需要解决的关键问题。LIU等[17]将B.breve UCC2003厌氧菌接枝到二氧化硅纳米颗粒上,可显著提高二氧化硅载药纳米粒子的渗透性。FELFOUL等[7]利用一种磁靶向的细菌MC-1携载载药纳米脂质体,研究结果表明,该方法可有效地将脂质体输送至肿瘤无氧区域,为提高载药纳米粒子在肿瘤缺氧区域的渗透性提供了新的思路。但这类研究仍然存在局限性,比如专属厌氧菌只有到达无氧区域才能发挥作用,却无法定植在肿瘤组织内部无氧区域和厌氧区域之间的过渡区域。
因此,本研究选用EcN作为靶向厌氧区域的动力,通过EcN与载药微粒共价结合,以期EcN驱动载药纳米粒子渗透至肿瘤部位,实现全方位的药物富集。首先,采用溶剂挥发法制备携载Dox的PSMA/PELA纳米粒子并对其进行形貌、载药量及释放行为的研究,由于DMP5/5载药微粒中PELA含量的增加提高了的材料的亲水性,从而降低了与疏水性药物之间的作用,从而导致包裹效率偏低[18]。DMP5/5和DMP7/3两种载药微粒中的药物均可持续缓慢地释放,但整体释放太慢,这主要是因为PSMA分子主链极为疏水,导致水分子难以渗透至聚合物载药微粒内部,从而延缓了聚合物的降解,阻碍了药物的释放[17],下一步可以改进聚合物的混合比例,改善其亲水性,从而调节药物的释放速度。
研究表明,细菌可以通过物理吸附、EDC-NHS催化的共价结合反应、或者生物凝集素粘合等方法固定在含氨基或者羧基的固体物质的表面,且不影响其正常的生物学特性[19]。本研究采用EDC和NHS催化EcN表面的氨基和PSMA/PELA载药微粒表面的酸酐发生共价接合,可将EcN成功地固定在PSMA/PELA载药微粒的表面,且固定后的EcN具有生长活性。与2D肿瘤细胞模型相比,3D肿瘤细胞模型更能有效模拟体内实体瘤的细胞生长行为、代谢和病理生理等特征,因此被广泛用于研究生理、病理和药物检测[20]及缺氧诱导肿瘤细胞迁移机制等[21]。为了验证EcN靶向肿瘤缺氧环境的能力,构建3D肿瘤细胞球体,研究表明EcN共价接合的PSMA/PELA微粒可以渗透至肿瘤细胞球的内部。体内实验研究证实,两种载药微粒在肝脏、脾脏和肺组织中含量较高,这是由于载药微粒进入血液循环后,很容易被肝脏、脾脏的网状内皮系统中的巨噬细胞所吞噬[22]。此外,肺组织药物含量较高,这可能与制备的载药微粒的尺寸有关[23]。由于EcN靶向肿瘤低氧部位的特性,导致EcN修饰的PSMA/PELA纳米粒子在肿瘤部位具有较高的浓度。综上所述,本研究制备的EcN共价接合的PSMA/PEL聚合物微粒能有效渗透至肿瘤内部,提高药物在肿瘤部位的富集,为细菌联合药物治疗肿瘤提供了新的思路。但EcN和药物之间是否存在相互作用,且该制剂进入体内后的动力学过程及毒副作用如何,还需要后续进一步验证。
| [1] | PEREIRA M C, RESHETNYAK Y K, ANDREEV O A. Advanced targeted nanomedicine[J]. J Biotechnol, 2015, 202: 88–97. DOI:10.1016/j.jbiotec.2015.01.009 |
| [2] | PRABHU R H, PATRAVALE V B, JOSHI M D. Polymeric nanoparticles for targeted treatment in oncology: current insights[J]. Int J Nanomedicine, 2015, 10: 1001–1018. DOI:10.2147/IJN.S56932 |
| [3] | SHA H, ZOU Z, XIN K, et al. Tumor-penetrating peptide fused EGFR single-domain antibody enhances cancer drug penetration into 3D multicellular spheroids and facilitates effective gastric cancer therapy[J]. J Control Release, 2015, 200: 188–200. DOI:10.1016/j.jconrel.2014.12.039 |
| [4] | DAS M, DUAN W, SAHOO S K. Multifunctional nanoparticle-EpCAM aptamer bioconjugates:A paradigm for targeted drug delivery and imaging in cancer therapy[J]. Nanomedicine, 2015, 11(2): 379–389. DOI:10.1016/j.nano.2014.09.002 |
| [5] | DHANI N, FYLES A, HEDLEY D, et al. The clinical significance of hypoxia in human cancers[J]. Semin Nucl Med, 2015, 45(2): 110–121. DOI:10.1053/j.semnuclmed.2014.11.002 |
| [6] | HONG M, ZHU S, JIANG Y, et al. Efficient tumor targeting of hydroxycamptothecin loaded PEGylated niosomes modified with transferrin[J]. J Control Release, 2009, 133(2): 96–102. DOI:10.1016/j.jconrel.2008.09.005 |
| [7] | FELFOUL O, MOHAMMADI M, TAHERKHANI S, et al. Magneto-aerotactic bacteria deliver drug-containing nanoliposomes to tumour hypoxic regions[J]. Nat Nanotechnol, 2016, 11(11): 941–947. DOI:10.1038/nnano.2016.137 |
| [8] | ZHOU S B, GRAVEKAMP C, BERMUDES D, et al. Tumour-targeting bacteria engineered to fight cancer[J]. Nat Rev Cancer, 2018, 18(12): 727–743. DOI:10.1038/s41568-018-0070-z |
| [9] | THAMM D H, KURZMAN I D, KING I, et al. Systemic administration of an attenuated, tumor-targeting Salmonella typhimurium to dogs with spontaneous neoplasia: phase I evaluation[J]. Clin Cancer Res, 2005, 11(13): 4827–4834. DOI:10.1158/1078-0432.CCR-04-2510 |
| [10] | TOSO J F, GILL V J, HWU P, et al. Phase I study of the intravenous administration of attenuated Salmonella typhimurium to patients with metastatic melanoma[J]. J Clin Oncol, 2002, 20(1): 142–152. DOI:10.1200/JCO.2002.20.1.142 |
| [11] | SOUZA É L, ELIAN S D, PAULA L M, et al. Escherichia coli strain Nissle 1917 ameliorates experimental colitis by modulating intestinal permeability, the inflammatory response and clinical signs in a faecal transplantation model[J]. J Med Microbiol, 2016, 65(3): 201–210. DOI:10.1099/jmm.0.000222 |
| [12] | STRITZKER J, WEIBEL S, HILL P J, et al. Tumor-specific colonization, tissue distribution, and gene induction by probiotic Escherichia coli Nissle 1917 in live mice[J]. Int J Med Microbiol, 2007, 297(3): 151–162. DOI:10.1016/j.ijmm.2007.01.008 |
| [13] | ZHOU S N, ZHANG M X, WANG J S. Tumor-targeted delivery of TAT-Apoptin fusion gene using Escherichia coli Nissle 1917 to colorectal cancer[J]. Med Hypotheses, 2011, 76(4): 533–534. DOI:10.1016/j.mehy.2010.12.010 |
| [14] | SHI C L, GUO X, QU Q Q, et al. Actively targeted delivery of anticancer drug to tumor cells by redox-responsive star-shaped micelles[J]. Biomaterials, 2014, 35(30): 8711–8722. DOI:10.1016/j.biomaterials.2014.06.036 |
| [15] | SIMS L B, HUSS M K, FRIEBOES H B, et al. Distribution of PLGA-modified nanoparticles in 3D cell culture models of hypo-vascularized tumor tissue[J]. J Nanobiotechnology, 2017, 15(1): 67. DOI:10.1186/s12951-017-0298-x |
| [16] | KRAMER M G, MASNER M, FERREIRA F A, et al. Bacterial therapy of cancer: promises, limitations, and insights for future directions[J]. Front Microbiol, 2018, 9: 16. DOI:10.3389/fmicb.2018.00016 |
| [17] | LIU K, CHEN W J, YANG T T, et al. Paclitaxel and quercetin nanoparticles co-loaded in microspheres to prolong retention time for pulmonary drug delivery[J]. Int J Nanomed, 2017, 12: 8239–8255. DOI:10.2147/IJN.S147028 |
| [18] | KAMALY N, YAMEEN B, WU J, et al. Degradable controlled-release polymers and polymeric nanoparticles: mechanisms of controlling drug release[J]. Chem Rev, 2016, 116(4): 2602–2663. DOI:10.1021/acs.chemrev.5b00346 |
| [19] | LOUISE MEYER R, ZHOU X F, TANG L, et al. Immobilisation of living bacteria for AFM imaging under physiological conditions[J]. Ultramicroscopy, 2010, 110(11): 1349–1357. DOI:10.1016/j.ultramic.2010.06.010 |
| [20] | WANG C, TANG Z, ZHAO Y, et al. Three-dimensional in vitro cancer models: A short review[J]. Biofabrication, 2014, 6(2): 022001. DOI:10.1088/1758-5082/6/2/022001 |
| [21] | WANG Y, MIRZA S, WU S, et al. 3D hydrogel breast cancer models for studying the effects of hypoxia on epithelial to mesenchymal transition[J]. Oncotarget, 2018, 9(63): 32191–32203. DOI:10.18632/oncotarget.25891 |
| [22] | LUO X M, JIA G Q, SONG H X, et al. Promoting antitumor activities of hydroxycamptothecin by encapsulation into acid-labile nanoparticles using electrospraying[J]. Pharm Res, 2014, 31(1): 46–59. DOI:10.1007/s11095-013-1130-4 |
| [23] | LUO C H, HUANG C T, SU C H, et al. Bacteria-mediated hypoxia-specific delivery of nanoparticles for tumors imaging and therapy[J]. Nano Lett, 2016, 16(6): 3493–3499. DOI:10.1021/acs.nanolett.6b00262 |



