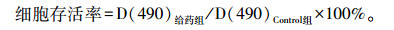2. 重庆市高校药物工程中心
2. Chongqing Collegiate Pharmaceutical Engineering Research Center, College of Pharmacy, Chongqing Medical University, Chongqing, 400016, China
吴茱萸碱(evodiamine, EVO)是《神农本草经》中记载的芸香科植物吴茱萸的天然活性成分,对众多肿瘤细胞有积极的抗肿瘤活性,如肝细胞癌[1]、胶质母细胞瘤细胞[2]、卵巢癌[3]、小细胞肺癌[4-5]等,且其机制涉及阻滞细胞周期、促进细胞凋亡促进自噬、抑制肿瘤的侵袭与转移等[6]。由于EVO水溶性差,限制其在临床上广泛应用。目前的研究均致力于改善其溶解性及体内吸收,以提高其生物利用度,从而增强抗肿瘤活性。本课题组为提高EVO的生物利用度设计了几种不同的衍生物[7-8],期望在改善其溶解度的同时增强抗肿瘤活性。本研究前期初步探究了在C10位上分别衍生硝基和氨基两种衍生物:硝基吴茱萸碱(10-nitro evodiamine derivatives, END)和氨基吴茱萸碱(10-amino evodiamine derivatives, EAD)[9],化学结构见文献[7]。发现EVO可以促进小细胞肺癌H1688和H446细胞凋亡[4-5],且END与EAD相比较于EVO溶解度和渗透性均有所改善[7]。本研究拟探索这两种衍生物抗小细胞肺癌H1688细胞肿瘤活性。
1 材料与方法 1.1 材料与试剂EVO购自武汉远成共创科技有限公司(纯度>99%);END和EAD由重庆医科大学高校药物工程中心胡雪原副教授课题组提供(纯度>99%)。人小细胞肺癌细胞株H1688购自中国科学院。
RPMI1640培养基,胰蛋白酶均购自美国HyClone公司;胎牛血清购于澳大利亚Ausgene X公司;二甲基亚砜购自美国Sigma公司;噻唑蓝(MTT)、细胞周期检测试剂盒购于鼎国昌盛生物科技有限公司;Annaxin-Ⅴ FITC/PI细胞凋亡试剂盒购于南京Vazyme公司;β-actin、Caspase3、Caspase9、Caspase12、细胞色素C(cytochome C, Cyt C)等抗体购自武汉三鹰生物技术有限公司。
1.2 MTT法检测H1688存活率取对数生长期的H1688细胞,以2 000个/孔的密度接种于96孔板中,24 h后分别更换为含药培养基(EVO、END、EAD的浓度均为0、0.625、1.25、2.5、5、10 μmol/L和20 μmol/L)。其中,Control组为正常培养细胞,给药组为DMSO、EVO、END、EAD组,0 μmol/L为含0.1% DMSO的培养基,其DMSO的含量分别与EVO、END、EAD组最高剂量相同。药物浓度根据课题组前期研究设立[4]。给药后24、48、72 h在各孔中加入MTT溶液(5 mg/mL)20 μL,置于37 ℃,5% CO2环境中培育4 h。用酶标仪(VARIOSKAN LUX, 赛默飞,美国)以490 nm激发波长检测各孔光密度。细胞存活率计算公式如下:
1.3 流式细胞术检测凋亡和周期取处于对数生长期的H1688细胞,接种于6孔板中,每孔3×105个。细胞贴壁生长24h后分别把各孔原有完全培养液替换成含EVO、END、EAD的培养基(浓度均为10 μmol/L[4]),药物浓度根据课题组前期研究设立[4];Control组替换为含0.5% DMSO的完全培养基。于培养箱中培养24 h,分别收集各孔细胞。
细胞凋亡检测:PBS洗涤收集的细胞2遍后,Annaxin-Ⅴ FITC/PI染色,流式细胞仪(CytoFLEX FCM,Beckman)检测。细胞周期检测:PBS洗涤收集的细胞2遍,用70%冰乙醇固定24 h后,碘化丙啶(propidium iodide, PI)染色流式细胞仪检测。
1.4 Western blot检测凋亡相关蛋白取对数生长期的H1688细胞接种于6孔板中细胞密度为3×105,贴壁24 h后把原培养液置换为含药培养液(EVO、END、EAD均为10 μmol/L[4],Control组为含0.5% DMSO的完全培养基),培养48 h后,提取总蛋白。药物浓度根据课题组前期研究设立[4]。沸水浴10 min致蛋白变性后,于-80 ℃保存。分离胶浓度为15% SDS-PAGE凝胶,电泳1h50 min后转至PVDF膜上。5%脱脂奶粉常温封闭1.5 h,加入抗体Caspase 9/3/12(1 :1 000)、β-actin(1 :1 000),4 ℃过夜孵育。TBST洗涤3次,5 min/次,二抗(1 :2 000)常温孵育1.5 h,TBST洗涤3次,5 min/次。再孵育辣根素过氧化物酶(HRP)发光液(1 :2 000)40 min,TBST洗涤3次,5 min/次,ECL发光成像。Image Lab计算各条带体积,各组结果与β-actin比较。
1.5 统计学分析采用SPSS 20.0统计软件分析各项结果。计量数据以x±s表示,多组之间比较采用单因素方差分析,采用SNK-q检验作两两比较,检验水准α=0.05。
2 结果 2.1 EVO、END、EAD对H1688细胞形态学的影响EVO、END、EAD处理48 h后,细胞发生形态学改变。正常H1688细胞为有触角或长拖尾,类似梭形。END、EAD处理24 h后,H1688细胞明显胀大,形态由原有的拖尾梭形变为椭圆形,且细胞中出现大量空泡,与EVO处理后形态相似。如图 1所示。
|
| A: Control;B: DMSO;C: EVO;D: END;E: EAD 图 1 DMSO、EVO、END、EAD处理后H1688细胞形态学改变(×100) |
2.2 END、EAD对H1688存活率的影响
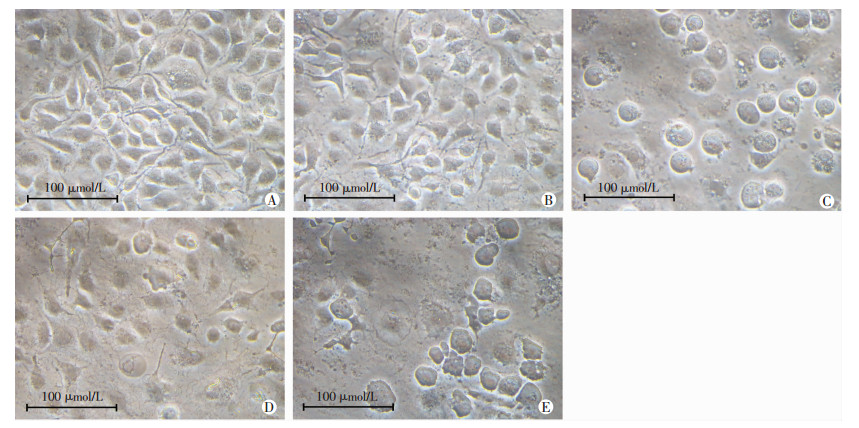
为考察衍生物END和EAD是否与EVO一样对肿瘤细胞具有时间以及剂量依赖性,分别考察了END、EAD在不同浓度(0、0.625、1.25、2.5、5、10 μmol/L和20 μmol/L)和不同时间(24、48、72 h)对H1688细胞存活率的影响。用0.625μmol/L的EVO、END、EAD处理24 h,即可观察到H1688细胞死亡。高浓度END和EAD(20 μmol/L)处理24、48、72 h后,分别与0 μmol/L相比,其存活率显著降低。24 h时EVO(P=0.038)和EAD(P=0.000)仅最高浓度(20 μmol/L)的存活率与Control组存在统计学差异,10 μmol/L给药组与Control组存活率之间未见统计学差异,而END组在处理24 h后,10 μmol/L和20 μmol/L处理组存活率与Control组间均有明显差异(P10 μmol/L=0.010,P20 μmol/L=0.000)。END、EAD对H1688的抑制作用呈现时间依赖性和剂量依赖性,20 μmol/L END处理72 h 后对H1688的抑制效果最好,存活率仅5.24%,如图 2所示。
|
| a:P < 0.05;b:P < 0.01,与0 μmol/L比较 图 2 EVO(A)、END(B)和EAD(C)对H1688细胞存活率的影响(%,x±s,n=3) |
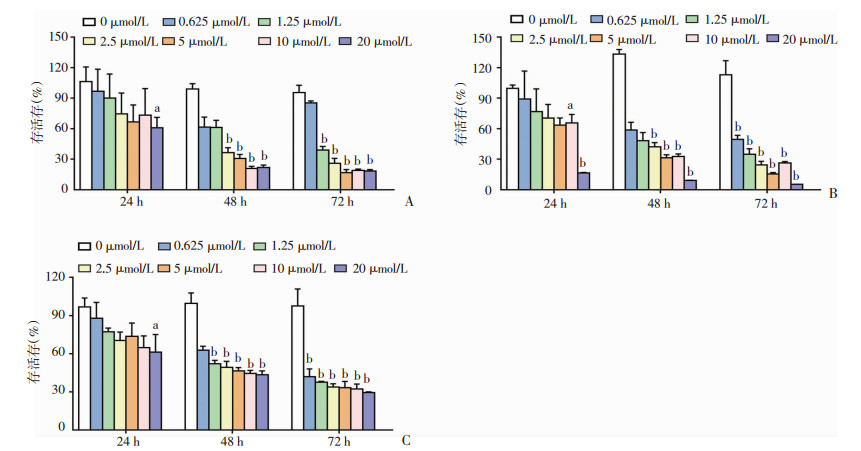
EVO、END、EAD在不同时间对H1688的IC50如图 3所示。处理24 h后,两种衍生物的IC50均较EVO降低。与EVO相比,处理72 h后,END的IC50值下降了43.5%。
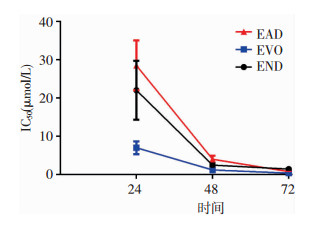
|
| 图 3 EVO、END和EAD对H1688细胞IC50的影响 |
2.3 流式细胞术检测END、EAD对H1688细胞凋亡的影响
END、EAD处理24 h后,细胞形态胀大,并出现空泡状和死亡。为进一步明确药物抗肿瘤作用是否与凋亡有关,用流式细胞仪分别检测END和EAD(浓度均为10 μmol/L)处理24 h后H1688的凋亡情况,如图 4所示。Control组细胞凋亡率仅为6.18%,EVO、END、EAD处理组凋亡率均高于Control组(PEVO=0.035,PEND=0.000,PEAD=0.029),其中END在处理24 h后,H688凋亡率是EVO处理组的2.8倍(P=0.003)。
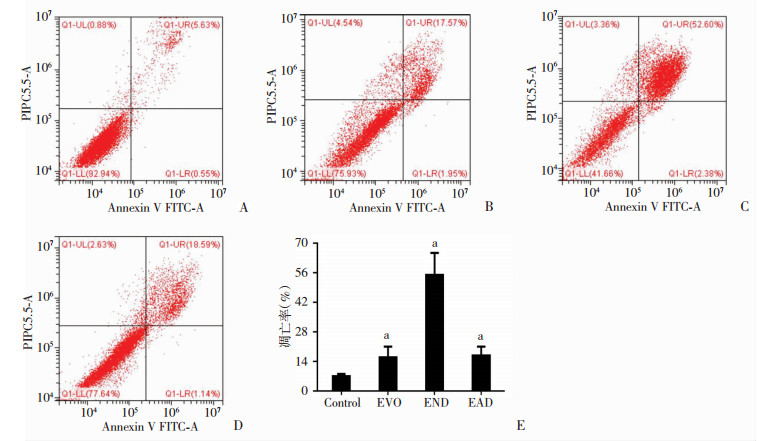
|
| A~D:流式细胞仪检测Control(A)、EVO(B)、END(C)、EAD(D)处理后H1688细胞凋亡的情况;E:凋亡率统计;a:P < 0.05,与Control组比较;b:P < 0.05,与EVO组比较 图 4 DMSO、EVO、END、EAD对H1688细胞凋亡的影响 |
2.4 流式细胞术检测END、EAD对H1688细胞周期的影响
用10 μmol/L的EVO、END、EAD分别处理24 h后,与Control组相比,各处理组处于G2/M期的细胞均明显增多:EVO组是Control组的5.09倍(P=0.002),END组是Control组的6.39倍(P=0.001),EAD组是Control组的6.23倍(P=0.001)。G1/G0期细胞数与Control组相比:END组(P=0.000)和EAD组(P=0.000)与EVO相比明显减少。见图 5。
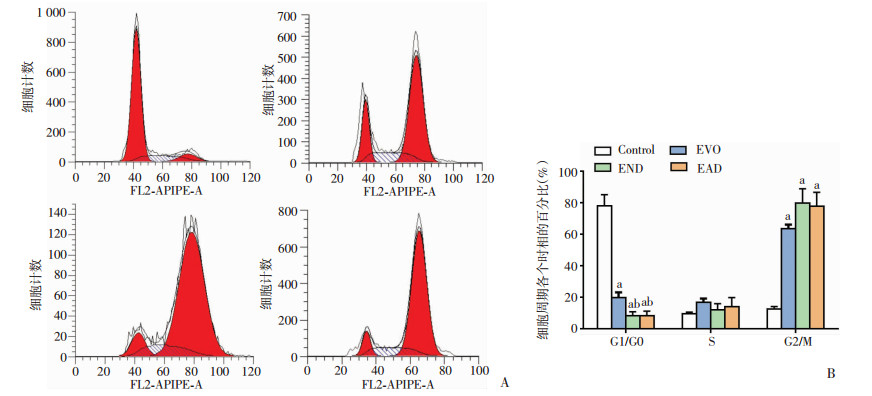
|
| A~D:流式细胞仪检测Control(A)、EVO(B)、END(C)、EAD(D)处理后H1688细胞凋亡的情况;E:H1688细胞周期统计;a:P < 0.01,与Control组比较;b:P < 0.01,与EVO组比较 图 5 DMSO、EVO、END、EAD对H1688细胞周期的影响 |
2.5 Western blot检测END、EAD对H1688凋亡相关蛋白的影响
H1688细胞用10 μmol/L的EVO、END、EAD处理48 h后,提取总蛋白,通过Western blot法检测线粒体凋亡相关蛋白Caspase 9、Caspase 12、Caspase3、Cyt C等表达。从Western blot结果可看出END、EAD处理后,H1688细胞Caspase 3、Caspase9、Caspase12、Cyt C均明显上调,如图 6、7所示。与EVO相比,END上调Caspase 3(P < 0.05)与Cyt C(P < 0.05)的作用相对增强,而EAD对Caspase家族成员与Cyt C的调节作用与EVO相比,未见明显差异。
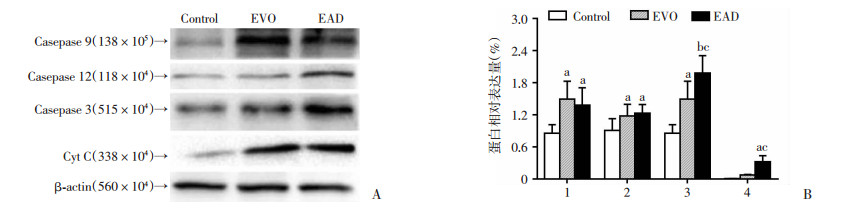
|
| A:Western blot检测END处理后H1688细胞的蛋白表达;B:END处理后H1688细胞的相对表达量;1:Caspase9, 2:Caspase 12, 3:Caspase 3, 4:Cyt C;a:P < 0.05,b:P < 0.01,与Control组比较;c:P < 0.05,与EVO组比较 图 6 10 μmol/L EVO或END分别处理H1688细胞48 h后对凋亡相关蛋白表达的影响 |
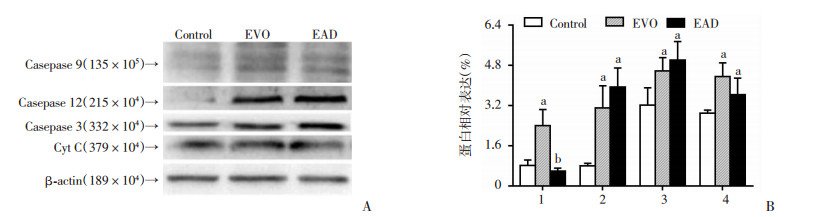
|
| A:Western blot检测EAD处理后H1688细胞的蛋白表达;B:EAD处理后H1688细胞的相对表达量;1:Caspase9, 2:Caspase 12, 3:Caspase 3, 4:Cyt C;a:P < 0.05,与Control组比较;b:P < 0.05,与EVO组比较 图 7 10 μmol/L EVO或EAD分别处理H1688细胞48 h后对凋亡相关蛋白表达的影响 |
3 讨论
EVO提取于吴茱萸或石虎的近成熟果实,是吲哚喹唑啉生物碱,目前临床主要用于镇痛、止呕、减肥等方面。近年来大量研究证实EVO具有抗肿瘤作用。由于EVO溶解度低(0.17 μg/mL),体内代谢清除快,在大鼠体内生物利用度仅为16.96%,限制其在临床的广泛使用[10-11]。为改善其物理化学性质,目前已开发了不同的衍生物,如EVO 5-羧基二胺衍生物[12]、EVO一氧化氮供体衍生物[13]、N13-取代的EVO衍生物[14]等。
李娜等[7]从EVO苯环上的C10进行衍生,合成的END、EAD,水中溶解度分别约为0.22 μg/mL和20.75 μg/mL;logP分别为1.22和1.30。EVO溶解度为0.17 μg/mL,logP 0.53,END与EAD溶解度相对EVO均有所提高,且EAD比EVO提高了1.21倍。而油水分配系数logP则相对于EVO提高了约2倍。
本研究中使用END与EAD处理小细胞肺癌细胞株H1688,与李娜前期用此两种衍生物处理结肠癌细胞株HCT-116的药效学研究结果有所不同。李娜用两种衍生物处理HCT-116后,发现EAD对其活性抑制最明显,但END体外抑制结肠癌细胞的活性甚至比EVO还低。而本研究使用该两种衍生物处理小细胞肺癌细胞株H1688后考察其存活率发现END与EAD作用24 h的抑制效果都比EVO好,且END在高浓度(20 μmol/L)处理72 h后抑制效果最好,H1688存活率仅5.24%左右。随后检测该两种衍生物以10 μmol/L浓度处理24 h后对凋亡的影响,发现两种衍生物都可以诱导H1688凋亡。且在周期检测中发现,两种衍生物都能阻滞H1688细胞在G2/M期,与FANG等[4]报道的EVO对H1688的作用一致,且END作用更显著。说明不同的肿瘤细胞对3种化合物的敏感性不同,END对小细胞肺癌更有效。
EVO对肿瘤细胞的抑制作用与多种通路相关。CHEN等[15]报道EVO通过激活人卵巢癌细胞中的JNK和PERK诱导细胞凋亡。WEI等[16]发现通过调节PI3K/Akt途径提高EVO对胰腺癌的抗肿瘤作用。FANG等[4]证实EVO对小细胞肺癌细胞的抗肿瘤作用并非通过FAS/Caspase 8的死亡受体激活途径,而是通过线粒体凋亡。EVO处理后,由于线粒体膜通透性增加,导致线粒体膜电位下降,释放出大量Cyt C,从而激活Caspase12、Caspase 9和Caspase 3的一系列凋亡级联反应。我们通过Western blot对凋亡相关蛋白Cyt C、Caspase12、Caspase 9和Caspase 3的检测发现,EAD和END也诱导以上蛋白表达,且END上调Caspase 3和Cyt C的作用明显比EVO强;结合流式细胞术检测的凋亡率,END处理24 h后达到54.98%,是EVO处理组凋亡率的2.8倍,说明END可诱导H1688细胞凋亡,且诱导凋亡的作用比EVO更好,END也通过线粒体凋亡通路抑制H1688细胞的活性,对线粒体的作用更强。END对Caspase 12的上调作用与EVO相当,说明END可能与EVO一样可以诱导内质网应激而影响细胞内钙离子浓度,导致Caspase 12上调。但END对Caspase 9的上调不如EVO强,提示END对H1688的Caspase 3影响可能还存在其他诱导凋亡的通路。另外,EAD上调Caspase 3和Caspase 12与EVO作用相近,上调Cyt C的作用弱于EVO,说明EAD也可以引起内质网应激导致的钙离子浓度变化,引起细胞凋亡,但EAD对线粒体的作用较弱。
综上所述,END和EAD对小细胞肺癌都有治疗价值,END对小细胞肺癌的抗肿瘤效应比EVO更强,而EAD的抗肿瘤活性稍弱于EVO。但与EVO相比,END与EAD的水溶性增加或油水分配系数增加,有利于药物在体内的吸收、分布以及药物制剂的制备,使药物在体内能更好地发挥抗肿瘤效应。
| [1] | YANG F, SHI L, LIANG T, et al. Anti-tumor effect of evodiamine by inducing Akt-mediated apoptosis in hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2017, 485(1): 54–61. DOI:10.1016/j.bbrc.2017.02.017 |
| [2] | WU W S, CHIEN CC, LIU K H, et al. Evodiamine prevents glioma growth, induces glioblastoma cell apoptosis and cell cycle arrest through JNK activation[J]. Am J Chin Med, 2017, 45(4): 879–899. DOI:10.1142/S0192415X17500471 |
| [3] | ZHONG Z F, TAN W, WANG S P, et al. Anti-proliferative activity and cell cycle arrest induced by evodiamine on paclitaxel-sensitive and -resistant human ovarian cancer cells[J]. Sci Rep, 2015, 5: 16415. DOI:10.1038/srep16415 |
| [4] | FANG C S, ZHANG J Q, QI D, et al. Evodiamine induces G2/M arrest and apoptosis via mitochondrial and endoplasmic reticulum pathways in H446 and H1688 human small-cell lung cancer cells[J]. PLoS ONE, 2014, 9(12): e115204. DOI:10.1371/journal.pone.0115204 |
| [5] |
祁迪, 谭群友, 王如文, 等. 吴茱萸碱抑制PI3K/AKT通路诱导小细胞肺癌H1688和H446细胞凋亡[J].
第三军医大学学报, 2016, 38(4): 330–337.
QI D, TAN Q Y, WANG R W, et al. Evodiamine induces apoptosis of small-cell lung cancer H1688 and H446 cells via inhibiting PI3K/AKT pathway[J]. J Third Mil Med Univ, 2016, 38(4): 330–337. DOI:10.16016/j.1000-5404.201508031 |
| [6] |
徐俊杰, 杨然, 杨芳景, 等. 吴茱萸碱抗肿瘤机制的研究进展[J].
上海交通大学学报(医学版), 2018, 38(5): 578–583.
XU J J, YANG R, YANG F J, et al. Recent advances in the antitumor effects of evodiamine[J]. J Shanghai Jiaotong Univ (Med Sci), 2018, 38(5): 578–583. DOI:10.3969/j.issn.1674-8115.2018.05.020 |
| [7] |
李娜.吴茱萸碱衍生物的合成及其药效学和药代动力学初步评价[D].重庆: 重庆医科大学, 2016.
LI N. The synthesis of evodiamine derivatives and preliminary evaluation of the pharmacodynamics and pharmacokinetics[D].Chongqing: Chongqing Medical University, 2016. |
| [8] |
万坤.吴茱萸碱衍生物EVB的合成及其纳米粒的初步评价[D].重庆: 重庆医科大学, 2014.
WAN K. The synthesis of evodiamine derivative and preliminary evaluation of EVB loaded with nanoparticles[D]. Chongqing: Chongqing Medical University, 2014. |
| [9] |
胡雪原, 李娜, 张景勍, 等.一种吴茱萸碱衍生物的制备方法:
CN201510725965.1[P]. 2015-12-23. HU X Y, LI N, ZHANG J Q, et al.The method for preparing a derivative of evodia officinalis: CN201510725965.1[P].2015-12-23. |
| [10] |
姚迪, 孙晶晶, 刘雷, 等. LC-MS/MS法测定大鼠血浆中的吴茱萸碱、吴茱萸次碱和吴茱萸内酯及其生物利用度的研究[J].
华西药学杂志, 2014, 29(3): 298–302.
YAO D, SUN J J, LIU L, et al. Simultaneous determination and absolute oral bioavailability of evodiamine, rutaecarpine and evodin concentration in the rat plasma by LC-MS/MS[J]. West China J Pharm Sci, 2014, 29(3): 298–302. DOI:10.13375/j.cnki.wcjps.2014.03.022 |
| [11] |
晏声蕾, 胡江波, 王薛, 等. 吴茱萸碱油包水型复合纳米乳的药代动力学和在体肠吸收[J].
第二军医大学学报, 2017, 38(2): 249–252.
YAN S L, HU J B, WANG X, et al. Pharmacokinetics and in situintestinal absorption of evodiamine complex water-in-oil nanoemulation[J]. Acad J Second Military Med Univ, 2017, 38(2): 249–252. DOI:10.16781/j.0258-879x.2017.02.0249 |
| [12] | CHRISTODOULOU M S, SACCHETTI A, RONCHETTI V, et al. Quinazolinecarboline alkaloid evodiamine as scaffold for targeting topoisomerase Ⅰ and sirtuins[J]. Bioorg Med Chem, 2013, 21(22): 6920–6928. DOI:10.1016/j.bmc.2013.09.030 |
| [13] | ZHAO N, TIAN K T, CHENG K G, et al. Antiproliferative activity and apoptosis inducing effects of nitric oxide donating derivatives of evodiamine[J]. Bioorg Med Chem, 2016, 24(13): 2971–2978. DOI:10.1016/j.bmc.2016.05.001 |
| [14] | SONG S, CHEN Z, LI S, et al. Design, synthesis and evaluation of N13-substituted evodiamine derivatives against human cancer cell lines[J]. Molecules, 2013, 18(12): 15750–15768. DOI:10.3390/molecules181215750 |
| [15] | CHEN T C, CHIEN CC, WU M S, et al. Evodiamine from Evodia rutaecarpa induces apoptosis via activation of JNK and PERK in human ovarian cancer cells[J]. Phytomedicine, 2016, 23(1): 68–78. DOI:10.1016/j.phymed.2015.12.003 |
| [16] | WEI W, CHEN H, WANG Z, et al. Enhanced antitumor efficacy of gemcitabine by evodiamine on pancreatic cancer via regulating PI3K/Akt pathway[J]. Int J Biol Sci, 2012, 8(1): 1–14. DOI:10.7150/ijbs.8.1 |