2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院全军肿瘤研究所
2. Cancer Institute, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
肝细胞癌(hepatocellular carcinoma,HCC)是一类具有典型组织学特征的肝癌,其所占比例达到了原发性肝癌的80%左右[1]。HCC细胞具有高度的增殖能力,但到目前为止,调控HCC细胞增殖的相关机制尚不清楚。
三结构域蛋白(tripartite motif,TRIM)是一类具有高度保守结构域的蛋白家族,其在细胞内发挥着重要的生物学作用,参与细胞的多条信号通路[2-3]。同时,TRIM的表达水平与癌症的发生、发展密切相关,尤其对肿瘤细胞的增殖调控发挥着重要作用[4]。
TRIM21也称之为Ro52(Ro protein 52)或者RNF81 (ring finger protein 81),具有E3连接酶活性[5]。研究表明,TRIM21与诸多肿瘤如食道癌[6]、乳腺癌[7]的发生、发展紧密相关,但TRIM21与肿瘤细胞增殖间的关系尚不清楚。尤其关于TRIM21与HCC的关系以及TRIM21能否调控HCC细胞的增殖目前尚少见报道。
本研究以HCC细胞为对象,探讨TRIM21对HCC细胞增殖的调控作用及可能机制,旨在深入揭示HCC细胞的增殖调控机制,为探索以TRIM21为靶标的HCC治疗新策略提供理论依据。
1 材料与方法 1.1 材料人HCC细胞系HepG2细胞和SMMC7721细胞由本校基础医学院生物化学与分子生物学教研室保存。胎牛血清和高糖DMEM培养基购自美国Thermo Fisher Scientific公司;Western blot 12% SDS-PAGE凝胶试剂盒购自美国Bio-Rad公司;CCK-8试剂盒、细胞裂解液RIPA、BCA蛋白定量试剂盒及蛋白酶抑制剂PMSF均购自江苏碧云天生物技术公司;抗HA标签兔多克隆抗体购自北京康为世纪生物科技有限公司,TRIM21抗体和ATG4B抗体购自美国Proteintech公司,山羊抗兔HRP标记二抗购自北京中杉金桥公司;流式FITC偶联Annexin V凋亡检测试剂盒购自美国BD公司。转染试剂Lipofectamine3000购自美国Invitrogen公司,TRIM21和ATG4B的表达质粒购自美国GeneCopoeia公司,TRIM21的小干扰RNA购自上海吉荧公司,ATG4B的小干扰RNA购自上海吉玛公司。
1.2 方法 1.2.1 细胞培养HepG2和SMMC7721细胞铺于含10%胎牛血清的DMEM高糖培养基的培养瓶中,在37 ℃、5% CO2细胞培养箱中培养。
1.2.2 细胞转染HepG2和SMMC7721细胞以每孔1×105个细胞接种于6孔板中,待细胞密度达到50%~60%时,分别转染TRIM21的表达质粒和siRNA,以及ATG4B表达的质粒和shRNA(转染用量按照转染试剂推荐用量),于转染48 h后收获细胞进行下一步实验。
1.2.3 Western blot检测HepG2和SMMC7721细胞经转染48 h后,弃去上层培养基,用含5% EDTA的胰酶将细胞消化后加入1.5 mL的EP管中,用预冷的PBS漂洗细胞2次,每次1 000 r/min离心5 min,弃去上清,在每管加入100 μL含1 mmol/L PMSF的RIPA裂解液,用移液枪反复猛烈吹打至细胞完全裂解,于冰上放置10 min,然后在4 ℃条件下12 000 r/min离心5 min,将上清收集到新的EP管中,并使用BCA法制作蛋白标准曲线并标定蛋白浓度。将测定后的蛋白样品以每孔20 μg上样,在12%SDS-PAGE凝胶中进行电泳分离,待电泳结束后将凝胶中的蛋白用半干转的方法转移到PVDF膜上,在室温条件下用含5%脱脂奶粉的PBST封闭2 h,其后用PBST浸泡PVDF膜1 min,再分别用抗HA标签兔多克隆抗体(1 :1 000稀释)、兔多克隆TRIM21抗体(1 :1 000稀释)、ATG4B抗体(1 :1 000稀释)及GAPDH抗体(1 :1 000稀释)在4 ℃冰箱中孵育过夜,第2天分别用PBST洗膜3次,每次10 min后,用山羊抗兔二抗(1 :5 000稀释)室温孵育2 h,再用PBST洗膜3次,每次10 min后用化学发光底物法置于化学发光仪中显影曝光。
1.2.4 CCK-8检测 1.2.4.1 细胞存活实验HepG2和SMMC7721细胞以每孔1×104接种于48孔板中,设置对照组(即mock组)、实验组,其中实验组按不同处理方法分别为:过表达实验分为空载组(HepG2细胞为EX-NEG-M07-3HA组,SMM7721细胞为pCMV5组)和过表达组(HepG2细胞为pEZ-M07-TRIM21-3HA组,SMM7721细胞为pCMV-ATG4B组);敲降实验分为空载组(HepG2细胞为pGPU6-shNC组,SMM7721细胞为siNC组)和敲降组(HepG2细胞为pGPU6-shATG4B-220组,SMM7721细胞为siTRIM21组)。每组设置3个复孔,于37 ℃、5%CO2细胞培养箱中培养,待细胞密度汇合至50%~60%时,分别转染TRIM21的表达质粒和siRNA,以及ATG4B的表达质粒和shRNA(转染用量按照转染试剂推荐用量),继续培养48 h后,每孔加入20 μL CCK-8试剂,37 ℃避光孵育30 min后使用全波长酶标仪检测450 nm处的每孔的光密度值D(450)。
细胞存活率=(实验组光密度值-空白孔光密度值)/(对照组光密度值-空白孔光密度值) ×100%
1.2.4.2 细胞增殖实验将6孔板中转染48 h后的不同组细胞分别收获,按每孔2 000个细胞接种于96孔板中,以空白培养基为第0天,分别于第1~3天向部分孔中每孔加入10 μL CCK-8试剂,37 ℃、5%CO2孵育2 h后,使用全波长酶标仪检测450 nm处每孔的光密度值[D(450)],每组细胞每天3个复孔。然后以时间为横坐标,光密度值为纵坐标制作细胞生长曲线。
1.2.5 细胞克隆形成实验转染48 h后的细胞消化后,按每孔1 000个细胞铺入6孔板中,继续于37 ℃、5%CO2细胞培养箱中培养7 d后,用PBS漂洗细胞表面2次,每孔加入1 mL的4%多聚甲醛室温固定15 min后,弃去多余液体,再加入1%的结晶紫染色10 min。然后用PBS冲洗培养板直到背景干净,在显微镜下计数克隆形成的集落中细胞的个数。
1.2.6 流式细胞术检测细胞凋亡用1.5 mL EP管收集转染48 h后的细胞,用预冷的PBS洗2次,1 000 r/min离心5 min,弃去上清,每管中加入100 μL 1 ×Annexin V Binding buffer,5 μL FITC-Annexin V和5 μL PI染液,室温避光孵育15 min,使用流式细胞仪进行检测。
1.2.7 流式细胞术检测细胞周期将转染48 h后的细胞收集于1.5 mL EP管中,PBS洗2次,离心弃上清,加入1 mL预冷的70%乙醇,于4 ℃固定过夜。第2天1 000 r/min离心5 min,用预冷的PBS洗2次,离心并弃上清,每个样本加入80 μL 50 μg/mL RNA酶,混匀后37 ℃水浴30 min,再加入100 μL 50 μg/mL PI染液,混匀室温孵育15 min,滤网过滤后使用流式细胞仪进行检测。
1.3 统计学分析数据以x±s表示,采用SPSS 13.0统计软件进行组间t检验。检验水准:α=0.05。
2 结果 2.1 TRIM21在HCC组织中的表达水平下调为了探究临床上TRIM21在HCC中的表达水平,本实验在TCGA数据库中找到了49例同时具有HCC组织和正常癌旁组织的患者样本数据,对其TRIM21的mRNA表达水平进行了评估。与正常组织相比,HCC组织中TRIM21的表达水平显著下调(P < 0.05,图 1)。
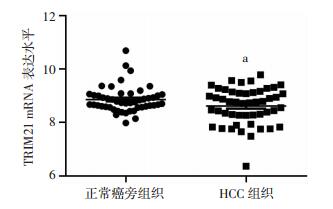
|
| a:P < 0.05,与正常癌旁组织比较 图 1 TRIM21在HCC组织中的表达水平下调 |
2.2 在HepG2和SMMC7721细胞中上调和下调TRIM21的表达水平
为了探寻TRIM21在HCC中发挥的作用,需要选择合适的HCC细胞系调控TRIM21的表达水平,Western blot检测结果显示TRIM21在HepG2细胞中相对低表达,在SMMC7721细胞中相对高表达(图 2A)。在此基础上,对HepG2细胞进行TRIM21的表达质粒转染,上调其表达;对SMMC7721细胞进行TRIM21的siRNA转染,下调其表达。Western blot验证转染后TRIM21的表达水平(图 2B、C)。
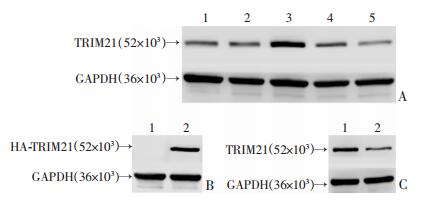
|
| A:Western blot检测HCC细胞系中TRIM21表达1:HepG2细胞;2:Hep3B细胞;3:SMMC7721细胞;4:PLC细胞;5:Huh-7细胞;B:Western blot检测质粒转染后HepG2细胞中TRIM21的蛋白水平1:EX-NEG-M07-3HA组;2:pEZ-M07-TRIM21-3HA组;C:Western blot检测siRNA转染后SMMC7721细胞中TRIM21的蛋白水平1:siNC组;2:siTRIM21组 图 2 选择合适的HCC细胞系上调和下调TRIM21 |
2.3 上调TRIM21抑制细胞存活,下调TRIM21促进细胞存活
为查明TRIM21在HCC中的功能,需要明确TRIM21在细胞学上的影响。本实验在细胞转染48 h后,采用CCK-8实验观察TRIM21的上调和下调对细胞存活率的影响。在HepG2细胞中上调TRIM21的表达后,细胞存活率显著下降(P < 0.01,图 3),而在SMMC7721细胞中下调TRIM21的表达后,细胞存活率显著上升(P < 0.05,图 3)。
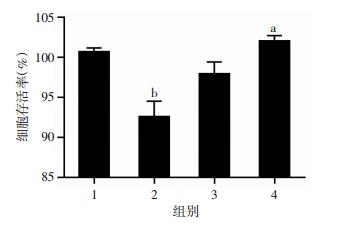
|
| 1:HepG2 EX-NEG-M07-3HA组;2:HepG2 pEZ-M07-TRIM21-3HA组;3:SMMC7721 siNC组;4:SMMC7721 siTRIM21组a:P < 0.05,与SMMC7721 siNC组比较;b:P < 0.01,与HepG2 EX-NEG-M07-3HA组比较 图 3 过表达或敲低TRIM21对HCC细胞存活的影响 |
2.4 上调TRIM21可以抑制细胞增殖,下调TRIM21可以促进细胞增殖
为进一步明确TRIM21对细胞存活率的影响是否依赖于细胞增殖的变化,本研究使用CCK-8实验和细胞克隆形成实验观察细胞的增殖能力。结果显示,在HepG2细胞中,转染质粒pEZ-M07-TRIM21-3HA组与空载EX-NEG-M07-3HA组相比,细胞在第1、2、3天的生长速率显著下降(P < 0.001),细胞克隆形成减少,克隆中的细胞数量显著减少(P < 0.01,图 4);在SMMC7721细胞中,相比siNC组,使用靶向TRIM21的siRNA组的细胞在第1、2、3天的生长速率显著升高(P < 0.001),细胞克隆形成增多,克隆中的细胞数量显著增加(P < 0.05,图 4)。
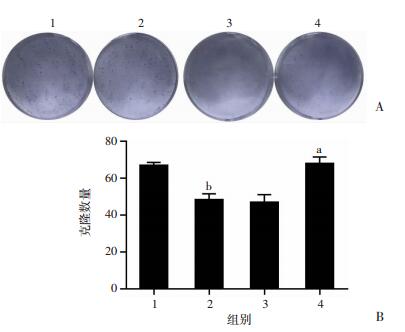
|
| A:细胞克隆形成实验检测结果;B:细胞克隆形成实验统计分析1:HepG2 EX-NEG-M07-3HA组;2:HepG2 pEZ-M07-TRIM21-3HA组;3:SMMC7721 siNC组;4:SMMC7721 siTRIM21组a:P < 0.05,与SMMC7721 siNC组比较;b:P < 0.01,与HepG2 EX-NEG-M07-3HA组比较 图 4 上调或下调TRIM21对细胞增殖的影响 |
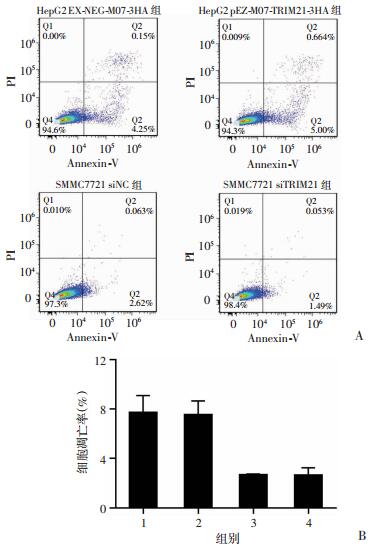
2.5 过表达或敲降TRIM21对细胞凋亡影响不明显
在证实细胞增殖的变化对细胞存活率产生影响的同时,还要进一步明确细胞凋亡的变化是否也参与了对细胞存活率的影响,本实验采用流式细胞术检测了细胞凋亡率的变化。结果显示,在两种细胞系中,过表达或敲降TRIM21,细胞凋亡的比例并没有发现明显的差异,说明TRIM21对细胞凋亡的影响并不明显(图 5)。
|
| A:流式细胞术检测结果;B:流式细胞术检测统计分析1:HepG2 EX-NEG-M07-3HA组;2:HepG2 pEZ-M07-TRIM21-3HA组;3:SMMC7721 siNC组;4:SMMC7721 siTRIM21组 图 5 过表达或敲降TRIM21对细胞凋亡的影响 |
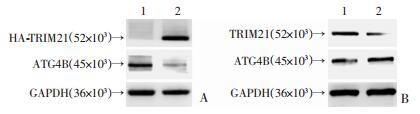
2.6 TRIM21在HCC细胞中可以负调控ATG4B的表达水平
为进一步探讨TRIM21在HCC细胞中影响细胞增殖的相关机制,结合本课题组之前关于ATG4B影响细胞增殖的研究,实验采用Western blot检测了上调TRIM21和下调TRIM21后的HepG2细胞和SMMC7721细胞中ATG4B的表达水平变化。结果表明,TRIM21在两种细胞系中可以负调控ATG4B的表达水平,体现为ATG4B的蛋白水平在HepG2细胞中随着TRIM21表达上升而下降(图 6A)和在SMMC7721细胞中随着TRIM21表达下降而上升(图 6B)。
|
| A:Western blot检测上调TRIM21后HepG2细胞中ATG4B的蛋白水平变化1:EX-NEG-M07-3HA组;2:pEZ-M07-TRIM21-3HA组;B:Western blot检测下调TRIM21后SMMC7721细胞中ATG4B的蛋白水平变化1:siNC组;2:siTRIM21组 图 6 TRIM21在HCC细胞中可以负调控ATG4B的表达水平 |
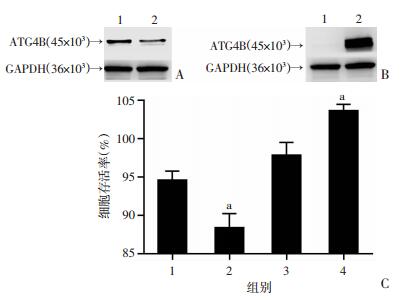
2.7 ATG4B的下调抑制细胞存活,ATG4B的上调促进细胞存活
为确定TRIM21可以通过负调控ATG4B来影响肝癌细胞增殖的作用,本研究依据之前的结果,先在HepG2细胞中使用shRNA下调了ATG4B(图 7A),在SMMC7721细胞中使用了ATG4B的表达质粒上调了ATG4B(图 7B),后通过CCK-8实验检测了细胞存活率。结果显示,在HepG2细胞中,敲降ATG4B可使细胞存活率显著下降(P < 0.05,图 7C),而在SMMC7721细胞中,过表达ATG4B可使细胞存活率显著上升(P < 0.05,图 7C),该结果再结合图 3、4和图 6的结果,表明TRIM21可通过下调ATG4B而抑制HCC细胞存活与增殖。
|
| A:Western blot检测shRNA转染后HepG2细胞中ATG4B的蛋白水平1:pGPU6-shNC组;2:pGPU6-shATG4B-220组;B:Western blot检测质粒转染后SMMC7721细胞中ATG4B的蛋白水平1:pCMV5组;2:pCMV-ATG4B组;C:CCK-8测定下调或上调ATG4B对HCC细胞存活的影响1:HepG2 pGPU6-shNC组;2:HepG2 pGPU6-shATG4B-220组;3:SMMC7721 pCMV5组;4:SMMC7721 pCMV-ATG4B组a:P < 0.05,与HepG2 pGPU6-shNC组比较,与SMMC7721 pCMV5组比较 图 7 调控ATG4B表达对HCC细胞增殖的影响 |
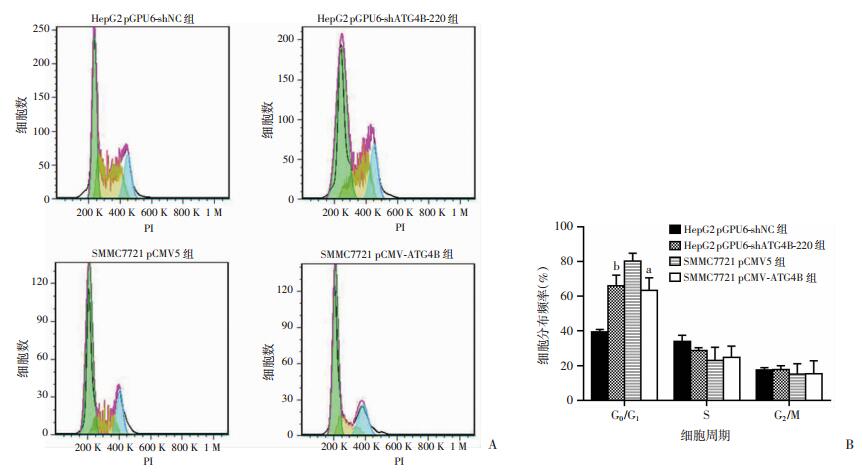
2.8 过表达或敲降ATG4B可以加快或阻滞细胞周期的G0/G1期
为进一步探明ATG4B具体影响细胞增殖的机制,使用流式细胞术检测了细胞周期中各个时期的比例,分析发现(图 8A),下调ATG4B后,细胞周期过程中G0/G1期的比例显著增多(P < 0.01),S期和G2/M期的比例下降,细胞周期进程阻滞于G0/G1期(图 8B);而上调ATG4B后,G0/G1期的比例显著下降(P < 0.05),S期和G2/M期的比例上升,细胞周期进程加快(图 8B)。
|
| A:流式细胞术检测过表达和敲降ATG4B后HCC细胞的周期变化;B:HCC细胞周期各时期的比例a: P < 0.05,与SMMC7721 pCMV5组比较;b:P < 0.01,与HepG2 pGPU6-shNC组比较 图 8 过表达或敲降ATG4B后HCC细胞周期的变化 |
3 讨论
TRIM21是一种主要分布于细胞质的蛋白,当发生炎症反应时会显著上调并转移到细胞核中发挥功能[8]。与其他诸多TRIM蛋白相似,TRIM21具有E3连接酶活性并且可以参与蛋白泛素化的过程[5]。最新的研究证明,当细胞发生病原体(如病毒、细菌)感染时,TRIM21的表达上调[9],并激活下游NF-κB(nuclear factor κB)、AP-1(activator protein 1)、IRF3(interferon regulatory factor 3)、IRF5(interferon regulatory factor 5)和IRF7(interferon regulatory factor 7)等转录因子信号通路从而为细胞提供强有力的抗病原体保护[10]。尽管很多TRIM家族蛋白被证实在癌症发生过程中起到了重要的调控作用,比如TRIM15在结直肠癌中[11],TRIM62在乳腺癌[12]和肺癌[13]中均发挥抑癌作用,TRIM35在HCC中呈下调趋势,而且它的表达水平与肿瘤的分级、肿瘤的大小以及患者血清甲胎蛋白(AFP)的水平都呈负相关性[14]。但TRIM21在HCC进程中的作用却少见报道。本研究证实了TRIM21在HCC临床样本中表达水平降低,且发现TRIM21的低表达促进了HCC细胞的存活和增殖。选择性地过表达TRIM21可以降低细胞的存活率并抑制细胞增殖,初步表明TRIM21在HCC中发挥着抑癌作用。这一结果也暗示了TRIM21作为临床上治疗HCC关键靶蛋白的可能性。
ATG4B是隶属于ATG4家族的一种半胱氨酸蛋白酶,又称自噬蛋白酶-1(autophagin-1),是存在于哺乳类动物体内的4种ATG4之一[15]。ATG4的主要功能是调节细胞自噬[16]。细胞自噬是真核细胞特有的高度保守的代谢过程,参与细胞内容物的降解和再循环。细胞通过形成双层膜结构的自噬小体可以将细胞内受损的蛋白质、细胞器等借助溶酶体途径进行降解,从而为处在压力状态下的细胞提供能量供应[17],起到促进细胞存活的作用。在哺乳动物细胞中,ATG4B一方面可以在LC3-PE(microtubule associated protein 1 light chain 3-PtdEth)结合过程中剪切LC3的前体,推动LC3和PE的结合[18],另一方面又可以在LC3-PE解离过程中切割LC3和PE[19],从而回收LC3进行下一轮的结合[20]并促进自噬体膜的延伸[21],所以ATG4B在LC3与PE之间的结合和解离过程是必不可少的。除细胞自噬外,最新研究表明,ATG4B还与肿瘤细胞的增殖密切相关,且ATG4B对肿瘤细胞增殖的调控与自噬过程无关。如下调ATG4B可以激活LKB1(liver kinase B1)-AMPK(adenosine monophosphate-activated protein kinase)信号通路从而抑制肿瘤细胞的增殖[22],ATG4B可以促进结直肠癌细胞增殖而非依赖自噬过程[23]。本课题组的前期研究也表明,ATG4B蛋白第34位丝氨酸的磷酸化可增强其线粒体转位而促进HCC细胞增殖[24]。本研究进一步证实,ATG4B的表达水平与HCC细胞增殖密切相关,而TRIM21很可能通过泛素化修饰ATG4B,调节其在细胞内的水平,从而影响HCC细胞增殖,这也与之前ATG4B可被E3连接酶RNF5泛素化修饰的相关报道符合[25]。本研究证明了TRIM21在HCC细胞中可以负调控ATG4B的表达水平,在上调或下调TRIM21的蛋白水平后,ATG4B的表达也相应地降低或升高。然而,TRIM21与ATG4B相互作用的具体方式以及TRIM21能否通过泛素化-蛋白酶体途径降解ATG4B尚需进一步研究证实。
细胞周期是细胞增殖中细胞通过控制DNA的复制和分离,最终由1个亲本细胞生成2个子代细胞的生物学过程。在哺乳类生物中,细胞周期可分为分裂期和分裂间期,根据DNA合成的情况,细胞间期可被进一步划分为DNA合成前期(G1期)、DNA合成期(S期)和DNA合成后期(G2期)。其中,G1期作为DNA复制的准备期,它的时间长度是影响细胞周期时间的关键[26]。本研究发现ATG4B的表达水平可以影响细胞周期进程。当ATG4B表达水平高时,G1期的细胞比例减少,推动细胞周期加快,细胞增殖随之增强;当ATG4B表达水平低时,G1期的细胞比例增多,细胞周期发生阻滞,细胞增殖也随之减弱。结合TRIM21对ATG4B的调控作用,说明TRIM21影响细胞增殖的重要机制就是通过负调控ATG4B改变细胞周期进程,进而对细胞增殖产生作用。
综上所述,HCC中TRIM21的低表达导致了ATG4B的水平升高,促进了细胞的增殖。在此过程中,如果特异性上调TRIM21的表达,则使得ATG4B的水平降低,细胞周期阻滞,抑制细胞的增殖。本研究揭示了TRIM21作为一种潜在的抑癌蛋白可以调控细胞增殖,从而为后续探索以其为靶标的HCC治疗新策略提供了理论和实验依据。
| [1] | TESTINO G, LEONE S, PATUSSI V, et al. Hepatocellular carcinoma: diagnosis and proposal of treatment[J]. Minerva Med, 2016, 107(6): 413–426. DOI:10.23736/s0026-4806.18.05844-5 |
| [2] | HATAKEYAMA S. TRIM proteins and cancer[J]. Nat Rev Cancer, 2011, 11(11): 792–804. DOI:10.1038/nrc3139 |
| [3] | NAPOLITANO L M, MERONI G. TRIM family: Pleiotropy and diversification through homomultimer and heteromultimer formation[J]. IUBMB Life, 2012, 64(1): 64–71. DOI:10.1002/iub.580 |
| [4] | BELL J L, MALYUKOVA A, KAVALLARIS M, et al. TRIM16 inhibits neuroblastoma cell proliferation through cell cycle regulation and dynamic nuclear localization[J]. Cell Cycle, 2013, 12(6): 889–898. DOI:10.4161/cc.23825 |
| [5] | REDDY B A, VAN DER KNAAP J A, BOT A G, et al. Nucleotide biosynthetic enzyme GMP synthase is a TRIM21-controlled relay of p53 stabilization[J]. Mol Cell, 2014, 53(3): 458–470. DOI:10.1016/j.molcel.2013.12.017 |
| [6] | KUBOSHIMA M, SHIMADA H, LIU T L, et al. Presence of serum tripartite motif-containing 21 antibodies in patients with esophageal squamous cell carcinoma[J]. Cancer Sci, 2006, 97(5): 380–386. DOI:10.1111/j.1349-7006.2006.00192.x |
| [7] | WANG J, FIGUEROA J D, WALLSTROM G, et al. Plasma autoantibodies associated with Basal-like breast cancers[J]. Cancer Epidem Biomar, 2015, 24(9): 1332–1340. DOI:10.1158/1055-9965.epi-15-0047 |
| [8] | KYRIAKIDIS N C, KAPSOGEORGOU E K, GOURZI V C, et al. Toll-like receptor 3 stimulation promotes Ro52/TRIM21 synthesis and nuclear redistribution in salivary gland epithelial cells, partially via type I interferon pathway[J]. Clin Exp Immunol, 2014, 178(3): 548–560. DOI:10.1111/cei.12432 |
| [9] | VAYSBURD M, WATKINSON R E, COOPER H, et al. Intracellular antibody receptor TRIM21 prevents fatal viral infection[J]. Proc Nat Acad Sci, 2013, 110(30): 12397–12401. DOI:10.1073/pnas.1301918110 |
| [10] | MCEWAN W A, TAM J C H, WATKINSON R E, et al. Intracellular antibody-bound pathogens stimulate immune signaling via the Fc receptor TRIM21[J]. Nat Immunol, 2013, 14(4): 327–336. DOI:10.1038/ni.2548 |
| [11] | LEE O H, LEE J, LEE K H, et al. Role of the focal adhesion protein TRIM15 in colon cancer development[J]. Biochim Biophys Acta, 2015, 1853(2): 409–421. DOI:10.1016/j.bbamcr.2014.11.007 |
| [12] | CHEN N, BALASENTHIL S, REUTHER J, et al. DEAR1, a novel tumor suppressor that regulates cell polarity and epithelial plasticity[J]. Cancer Res, 2014, 74(20): 5683–5689. DOI:10.1158/0008-5472.CAN-14-1171 |
| [13] | QUINTÁS-CARDAMA A, POST S M, SOLIS L M, et al. Loss of the novel tumour suppressor and polarity gene Trim62 (Dear1) synergizes with oncogenic ras in invasive lung cancer[J]. J Pathol, 2014, 234(1): 108–119. DOI:10.1002/path.4385 |
| [14] | JIA D, WEI L, GUO W, et al. Genome-wide copy number analyses identified novel cancer genes in hepatocellular carcinoma[J]. Hepatology, 2011, 54(4): 1227–1236. DOI:10.1002/hep.24495 |
| [15] | MARIÑO G, URÍA J A, PUENTE X S, et al. Human autophagins, a family of cysteine proteinases potentially implicated in cell degradation by autophagy[J]. J Biol Chem, 2003, 278(6): 3671–3678. DOI:10.1074/jbc.M208247200 |
| [16] | MARUYAMA T, NODA N N. Autophagy-regulating protease Atg4: structure, function, regulation and inhibition[J]. J Antibiot, 2017, 71(1): 72–78. DOI:10.1038/ja.2017.104 |
| [17] | YANG Z, KLIONSKY D J. Eaten alive: a history of macroautophagy[J]. Nat Cell Biol, 2010, 12(9): 814–822. DOI:10.1038/ncb0910-814 |
| [18] | KIRISAKO T, ICHIMURA Y, OKADA H, et al. The reversible modification regulates the membrane-binding state of Apg8/Aut7 essential for autophagy and the cytoplasm to vacuole targeting pathway[J]. J Cell Biol, 2000, 151(2): 263–276. DOI:10.1083/jcb.151.2.263 |
| [19] | ICHIMURA Y, KIRISAKO T, TAKAO T, et al. A ubiquitin-like system mediates protein lipidation[J]. Nature, 2000, 408(6811): 488–492. DOI:10.1038/35044114 |
| [20] | NAKATOGAWA H, ISHII J, ASAI E, et al. Atg4 recycles inappropriately lipidated Atg8 to promote autophagosome biogenesis[J]. Autophagy, 2012, 8(2): 177–186. DOI:10.4161/auto.8.2.18373 |
| [21] | HIRATA E, OHYA Y, SUZUKI K. Atg4 plays an important role in efficient expansion of autophagic isolation membranes by cleaving lipidated Atg8 in Saccharomyces cerevisiae[J]. PLoS ONE, 2017, 12(7): e0181047. DOI:10.1371/journal.pone.0181047 |
| [22] | LIU P F, HSU C J, TSAI W L, et al. Ablation of ATG4B suppressed autophagy and activated AMPK for cell cycle arrest in cancer cells[J]. Cell Physiol Biochem, 2017, 44(2): 728–740. DOI:10.1159/000485286 |
| [23] | LIU P F, LEUNG C M, CHANG Y H, et al. ATG4B promotes colorectal cancer growth independent of autophagic flux[J]. Autophagy, 2014, 10(8): 1454–1465. DOI:10.4161/auto.29556 |
| [24] | NI Z, HE J, WU Y, et al. AKT-mediated phosphorylation of ATG4B impairs mitochondrial activity and enhances the Warburg effect in hepatocellular carcinoma cells[J]. Autophagy, 2018, 14(4): 685–701. DOI:10.1080/15548627.2017.1407887 |
| [25] | KUANG E, OKUMURA C Y, SHEFFY-LEVIN S, et al. Regulation of ATG4B stability by RNF5 limits basal levels of autophagy and influences susceptibility to bacterial infection[J]. PLoS Genet, 2012, 8(10): e1003007. DOI:10.1371/journal.pgen.1003007 |
| [26] | MATSON J P, COOK J G. Cell cycle proliferation decisions: the impact of single cell analyses[J]. FEBS J, 2017, 284(3): 362–375. DOI:10.1111/febs.13898 |



