2. 400038 重庆,陆军军医大学(第三军医大学):基础部化学教研室;
3. 056000 河北 邯郸,解放军980医院邯郸分院药剂科
2. Department of Chemistry, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Pharmacy, Handan Branch of No. 980 Hospital of PLA, Handan, Hebei Province, 056000, China
铜绿假单胞菌(Pseudomonas aeruginosa, PA)是院内获得性肺炎的主要致病菌之一,其引起的肺部感染通常具有病程长、治愈率低及高病死率等特点[1-2]。由于PA易形成生物膜,且其外膜通透性极低,因此对多种抗生素都耐药,已成为院内感染急需解决的问题之一[3-4]。为了更好地研究PA的致病机制及药物对细菌性肺部感染的治疗作用,需要建立更接近于临床的肺部感染模型,以便进行药物作用机制、体内药效学评价等方面的研究,为指导临床用药和新药开发提供理论和实验依据。目前,常用的接种细菌的方法有气管切开术法、气管插管法、经鼻滴入法等[5-7]。气管切开术法对动物损伤较大,且可重复性差[8]。经鼻滴入法由于无法准确控制滴入量而使造模稳定性差,且同组小鼠之间细菌感染程度不一致[6]。气管插管滴注法直接将接种针插入气管进行滴注,该方法具有稳定性好、易定量等优点[9]。但是目前采用的气管插管滴注法主要是颈部切口插管法,颈部切口钢丝引导插管法会对实验动物产生一定的损伤,导致插管后小鼠死亡率较高。本研究采用一种经改良的小鼠气管插管滴注法——透射灯下经口直视插管滴注法,在不引起小鼠损伤的情况下建立小鼠铜绿假单胞菌肺部感染模型。通过肺部菌落计数和组织病理学等指标,对建立的模型进行初步评价分析。
1 材料与方法 1.1 实验材料 1.1.1 菌株来源PA临床分离菌株P727,来自于陆军军医大学第一附属医院住院患者的临床送检标本。
1.1.2 实验动物20只SPF级BALB/c小鼠,雄性,6~8周龄,体质量为18~22g,由陆军军医大学实验动物中心提供。动物实验经过陆军军医大学实验动物福利伦理审查委员会审批(2018-10-15),符合动物伦理和动物福利要求。
1.1.3 试剂、耗材及设备LB培养基(北京陆桥生物技术有限公司),哥伦比亚血琼脂平板(重庆庞通医疗器械有限公司),电子天平(日本Sakuma公司),针管回缩式静脉留置针(22G×25 mm,威海洁瑞医用制品有限公司),比浊管(中国食品药品检定研究院),恒温摇床(MaxQ4000, Thermoscientific公司),微生物培养箱(B6120,Thermoscientific公司),医用超净台(BBS-DDC,山东博科有限公司)。
1.2 方法 1.2.1 实验分组选用6~8周龄健康清洁级近交系BALB/c小鼠20只,适应环境3 d,按随机数字表法分为对照组和感染组,每组10只。小鼠置于SPF级无菌动物房内,分笼饲养,自由取食。
1.2.2 菌液制备将P727临床分离菌株接种至哥伦比亚血琼脂平板,于微生物培养箱中37 ℃倒置培养24 h。随后挑取平板上单菌落,置于10 mL LB液体培养基中,于恒温振荡摇床中180 r/min、37 ℃振荡过夜,收集P727菌液,12 000 r/min、4 ℃离心5 min。弃去上清液,用无菌生理盐水调节菌液浓度为1.0×10-8 CFU/mL(麦氏比浊法)。
1.2.3 细菌性肺部感染小鼠模型的建立采用小鼠气管菌液滴注法建立细菌肺部感染模型。具体方法为首先将小鼠经腹腔注射10%水合氯醛进行麻醉,注射剂量为3 mL/kg。待小鼠被完全麻醉后用皮筋和胶布将其固定于木板(60°斜坡)上。随后用胶带将预先注满菌液的静脉留置针的PVC软管横向固定在木板上缘,用皮筋挂住小鼠门牙,用镊子轻轻拉出小鼠舌头。待拉出小鼠舌头之后,将透射灯光源对准小鼠颈部,打开光源,用镊子夹小棉球轻轻将咽喉部分泌物擦拭干净,并调整动物倾斜角度直至通过口腔可清晰看到声门裂为宜。将留置针头(针头由内部针芯和外部软管组成)插入气道,随后退去针芯,若观察到事先注入软管内的菌液会随着呼吸左右波动,则证明插管成功。随后用留置针软管所连接的1 mL注射器向气管内缓慢滴注细菌混悬液50 μL,并保持小鼠头高足低体位,予以左右旋转,促使菌液均匀分布于小鼠左右两肺。待滴注完成后,将小鼠侧卧位放置,小鼠苏醒后放入无菌笼中, 自由取食。每日观察小鼠的进食、毛发、精神状态和存活状态等。对照组则按上述方法在小鼠气管内注入等量的无菌生理盐水。感染组和对照组分笼饲养。
1.2.4 血常规分析待小鼠细菌滴注感染7 d后进行摘眼球取血,取20 μL全血于稀释液中进行血常规分析,测定白细胞数目和中性粒细胞数目。
1.2.5 肺组织匀浆菌落计数用颈椎脱臼法处死感染组和对照组各10只小鼠,并分离右肺组织,称重,放入组织研磨管中,加入1 mL预冷生理盐水,于4 ℃冰浴下制备肺组织匀浆,用生理盐水按照10倍浓度梯度稀释组织匀浆至108。取各浓度的匀浆稀释液0.1 mL,用玻璃棒均匀涂布于哥伦比亚血琼脂平板上,每个浓度涂2个平板,放入37 ℃培养箱中孵育24 h,进行菌落计数。
1.2.6 肺组织病理学检查将小鼠通过颈椎脱臼法处死并分离出左肺,观察肺组织大体病理改变,查看肺部大小、颜色以及观察肺表面是否有出血点、结节、实变等改变。之后用4%多聚甲醛固定液固定。经脱水、石蜡包埋、切片进行苏木精-伊红(HE)染色后再进行组织病理学检查,并通过光学显微镜分析炎症的范围及程度。
1.2.7 统计学分析采用SPSS 17.0统计软件对实验数据进行分析。所有计量数据均以x ±s表示,两样本间均数比较采用独立样本t检验。检验标准α=0.05。
2 结果 2.1 生理状态考察首先考察了小鼠的活动状态、进食、饮水、毛发等生理情况,并检测了小鼠的体质量变化情况,结果如图 1所示。对照组小鼠在适应环境后表现较好的活动能力,且能正常的进行进食和饮水,毛发也较柔顺光亮,小鼠体质量出现短暂下降后迅速恢复到正常体质量。与对照组小鼠相比,感染组小鼠在感染细菌24 h后活动能力明显减弱,进食和饮水情况有所减少,毛发紊乱,并出现寒战表现,而且体质量明显下降。小鼠在感染细菌48 h后体质量继续下降,感染72 h后体质量有所恢复,但仍明显低于对照组。其原因可能是小鼠肺部感染细菌后引起肺部炎症及其他病理反应,导致各种不适,故引起小鼠食欲下降,体质量减轻。
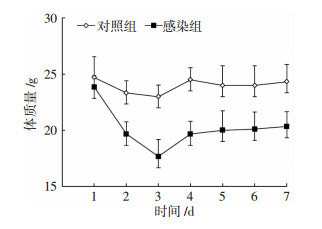
|
| 图 1 对照组和感染组小鼠体质量变化情况 |
2.2 血常规分析
小鼠感染细菌7 d后,将小鼠进行处死,取小鼠眼球血进行血常规分析,结果如图 2所示。血常规分析结果表明,感染组小鼠血液中白细胞数目和中性粒细胞数目显著高于对照组,存在统计学差异(P < 0.05),并超过了正常理论值的范围。此结果表明小鼠感染细菌后,有炎症发生,初步证实已成功构建感染模型。
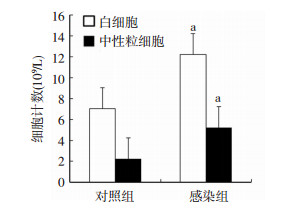
|
| a:P < 0.05,与对照组比较 图 2 对照组和感染组小鼠血液中白细胞和中性粒细胞计数(x±s) |
2.3 肺组织匀浆菌落计数
对感染组和对照组各10只小鼠肺部组织进行细菌培养实验,结果发现细菌感染组小鼠肺组织培养出乳白色、大小不等、表面光滑湿润、边缘不规则的铜绿假单胞菌菌落,而对照组则未培养出铜绿假单胞菌。同时取肺组织匀浆后进行菌落计数,以每克肺组织所含菌落数来表示肺组织匀浆菌落计数。菌落计数结果表明,感染组细菌计数为(6.15±0.64)×106 CFU/g,均超过106 CFU/g,符合急性肺部感染指征[10],而对照组在对应浓度下则未检出细菌菌落。该结果也说明通过气管插管滴注法成功建立了小鼠细菌肺部感染模型。
2.4 肺组织病理切片小鼠肺部组织切片的病理观察如图 3所示。HE染色病理切片显示,感染组小鼠肺组织可见大量炎性细胞浸润,肺泡壁结构破坏,上皮细胞脱落,肺泡壁及肺泡腔可见弥散的红细胞,而正常对照组则未见异常。另外,通过观察新取的肺部组织外观,发现感染组小鼠的肺组织有不同程度的充血、水肿及出血表现,且肺组织颜色明显加深,而对照组肺组织则无其他异常变化。该结果证明采用气管插管滴注法成功建立了肺部细菌感染模型。
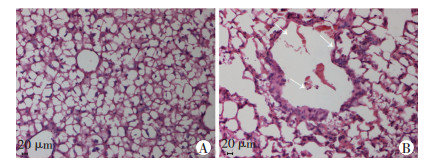
|
| A:对照组;B:感染组;箭头示肺泡壁结构破坏,炎性细胞浸润,可见弥散性红细胞 图 3 对照组和感染组小鼠肺部组织HE染色观察(×200) |
3 讨论
铜绿假单胞菌是全球公认的医院获得性感染最常见、最重要的致病菌之一[11],该菌具有易定植、感染率高,易耐药的特点。近年来由于抗生素的应用愈发广泛,该菌耐药性逐渐上升,给临床治疗带来了严峻的挑战[12]。研究表明,引起医院获得性肺炎和呼吸道感染相关肺炎常见的主要革兰阴性杆菌是铜绿假单胞菌[13-14],由其引起的呼吸道感染具有持续时间长、难治愈、容易慢性化及高病死率等特点[15]。因此建立相应的动物模型在铜绿假单胞菌肺部感染致病机制、药物治疗、抗生素耐药等研究方面都具有一定的指导意义。
目前常用的细菌性肺部感染模型建立方法包括气管切开术法、气管插管法、经鼻滴入法[16]。其中气管切开术法要求在无菌的环境下进行,对技术要求严格,如操作不当容易造成其他病原菌混合感染。经鼻滴入法存在重复性差、感染程度不一致,成功率低等缺点[6]。一般采用的气管插管法由于需要暴露气管而操作较为复杂。本研究采用的是经过改良的气管插管法--透射灯下经口直视气管插管滴注法,此方法可以避免经气管切开术法和直接气管插管法所引起的组织外伤及其诱发的继发感染。在本研究中,我们对20只小鼠进行了插管操作,其中一次性成功插管17只,仅3只未能一次性插管成功,一次性插管成功率为85%,最终成功率为95%。仅1只因麻醉程度过深而窒息死亡,而经鼻滴入法成功率仅为45%[6],其成功率和稳定性明显低于经口直视气管插管滴注法[13]。经鼻滴入法因为菌液经鼻滴入后需经过呼吸道而不是直接到达肺组织[6],并且由于菌液容易滞留于鼻腔内,不易均匀分布于两肺及有时会流入胃肠道被灭活,导致各小鼠经鼻滴入肺组织的菌液量不同,而本研究中采用的透射灯下经口直视气管插管滴注法可以将定量的菌液全部一次性直接注入肺组织,因此本方法较经鼻滴入法感染成功率高,稳定性和重复性好。此外,我们还考察了插管操作所需的时长,从小鼠固定好后开始插管进行计时,考察每次成功插管时长并计算平均值,结果显示每次插管时长为(68.39±4.80)s,相较于气管切开术法和经鼻滴入法用时短[17](时长分别为5~6 min和2 min)。因此,本方法较之前所述方法具有无创、廉价易得、快速可靠的优点,可以作为细菌性肺部感染的有效研究手段,为铜绿假单胞菌的抗菌治疗提供可靠的理论依据。血常规生化指标分析、肺组织菌落培养计数及肺部组织病理切片后HE染色分析均表明已成功建立铜绿假单胞菌肺部感染模型。值得一提的是,为了更好地建立该模型,在该模型建立过程中应注意以下几个问题:①插管时一定要将针头套好套管再进行操作,切勿盲插,以免对小鼠气管和其他脏器产生损伤;②待插入气管后应及时退出内芯,否则会导致接种菌液失败;③在滴注过程中应快速一次性注入所需菌液量,当滴注量达到100 μL时很容易造成小鼠窒息,并且使菌液溢出,导致接种量出现偏差,再结合相应的文献[18-19],因此在本实验中滴注量控制在50 μL。
综上,本研究成功建立了一个简单可靠、可重复的动物肺部感染模型,为进一步探索细菌耐药机制、抗生素的临床合理利用、新型抗菌药物的研发提供了较好的动物模型。
| [1] |
徐辉, 何晓静, 李晓冰, 等. 铜绿假单胞菌慢性肺部感染合并免疫低下大鼠模型的建立[J].
中国医院药学杂志, 2017, 37(24): 2428–2431.
XU H, HE X J, LI X B, et al. Establishment of rat models of immunosuppression combined with chronic pulmonary infection of Pseudomonas aeruginosa[J]. Chin Hosp Pharm J, 2017, 37(24): 2428–2431. DOI:10.13286/j.cnki.chinhosppharmacyj.2017.24.03 |
| [2] | MERCHANT Z, BUCKTON G, TAYLOR K M, et al. A new era of pulmonary delivery of nano-antimicrobial therapeutics to treat chronic pulmonary infections[J]. Curr Pharm Design, 2016, 22(17): 2577–2598. DOI:10.2174/1381612822666160317142139 |
| [3] | MIYOSHI-AKIYAMA T, TADA T, OHMAGARI N, et al. Emergence and spread of epidemic multidrug-resistant Pseudomonas aeruginosa[J]. Genome Biol Evol, 2017, 9(12): 3238–3245. DOI:10.1093/gbe/evx243 |
| [4] |
杨青梅, 张苹, 沈策. 铜绿假单胞菌慢性肺部感染模型的建立及评价[J].
中国呼吸与危重监护杂志, 2008, 7(1): 40–42, 56, 80.
YANG Q M, ZHANG P, SHEN C. Establishment and evaluation of a chronic pulmonary infection model due to Pseudomonas aeruginosa[J]. Chin J Resp Crit Care Med, 2008, 7(1): 40–42, 56, 80. DOI:10.3969/j.issn.1671-6205.2008.01.011 |
| [5] | LI Z, CLEMENS D L, LEE B Y, et al. Mesoporous silica nanoparticles with pH-sensitive nanovalves for delivery of moxifloxacin provide improved treatment of lethal pneumonic tularemia[J]. ACS Nano, 2015, 9(11): 10778–10789. DOI:10.1021/acsnano.5b04306 |
| [6] |
宋方, 吕欢, 何晓静, 等. 大鼠铜绿假单胞菌慢性肺部感染模型的建立与评价[J].
中国医院药学杂志, 2015, 35(9): 786–789.
SONG F, LYU H, HE X J, et al. Establishment and evaluation of rat models with chronic pulmonary infection of Pseudomonas aeruginosa[J]. Chin Hosp Pharm J, 2015, 35(9): 786–789. DOI:10.13286/j.cnki.chinhosppharmacyj.2015.09.06 |
| [7] |
许群, 眭建. 免疫抑制小鼠肺白念珠菌感染模型的建立[J].
中国老年学杂志, 2012, 32(10): 2111–2113.
XU Q, SUI J. Establishment of an immunosuppressive mouse model of Candida albicans infection[J]. Chin J Gerontol, 2012, 32(10): 2111–2113. DOI:10.3969/j.issn.1005-9202.2012.10.053.XUDOI:10.16190/j.cnki.45-1211/r.2017.04.006 |
| [8] | ZHENG X J, LYU J Y, LI K, et al. Establishment and evaluation of rat model of cerebral infarction complicated with bacterial pneumonia[J]. J Guangxi Med Univ, 2017, 34(4): 504–509. DOI:10.16190/j.cnki.45-1211/r.2017.04.006 |
| [9] |
贾晓峰, 郭新彪. 改进型快速小鼠气管滴注法——透射灯下经口直视滴注法研究[J].
环境与健康杂志, 2012, 29(3): 217–219.
JIA X F, GUO X B. Improved technique for rapid endotracheal instillation in mice: directviewing intubation through oropharynx under the trans-illumination[J]. J Environment Health, 2012, 29(3): 217–219. |
| [10] | PEARSON J P, FELDMAN M, IGLEWSKI B H, et al. Pseudomonas aeruginosa cell-to-cell signaling is required for virulence in a model of acute pulmonary infection[J]. Infect Immun, 2000, 68(7): 4331–4334. DOI:10.1128/IAI.68.7.4331-4334.2000 |
| [11] | EVANS T J. Small colony variants of Pseudomonas aeruginosa in chronic bacterial infection of the lung in cystic fibrosis[J]. Future Microbiol, 2015, 10(2): 231–239. DOI:10.2217/fmb.14.107 |
| [12] | FENG W, SUN F J, WANG Q, et al. Epidemiology and resistance characteristics of Pseudomonas aeruginosa isolates from the respiratory department of a hospital in China[J]. J Glob Antimicrob Resist, 2017, 8: 142–147. DOI:10.1016/j.jgar.2016.11.012 |
| [13] |
李美凤, 封继宏, 魏葆琳. 肺炎动物模型研究近况[J].
辽宁中医杂志, 2014, 41(3): 601–604.
LIM F, FENG J H, WEI B L. Recent research on animal models of pneumonia[J]. Liaoning J Traditional Chin Med, 2014, 41(3): 601–604. DOI:10.13192/j.issn.1000-1719.2014.03.091 |
| [14] | GRIMWOOD K, KYD J M, OWEN S J, et al. Vaccination against respiratory Pseudomonas aeruginosa infection[J]. Hum Vaccin Immunother, 2014, 11(1): 14–20. DOI:10.4161/hv.34296 |
| [15] |
佟若菲, 陈朝晖. 铜绿假单胞菌感染的抗菌药物治疗[J].
天津药学, 2012, 24(1): 70–73.
TONGR F, CHEN Z H. Antibacterial therapy for Pseudomonas aeruginosa infection[J]. Tianjin Pharm, 2012, 24(1): 70–73. DOI:10.3969/j.issn.1006-5687.2012.01.029 |
| [16] |
宋秀杰, 彭娅, 王睿. 肺炎链球菌肺炎动物模型研究进展[J].
军医进修学院学报, 2009, 30(2): 234–235.
SONG X J, PENG Y, WANG R. Progress in research of animal streptococcus pneumonia model[J]. Acad J PLA Postgrad Med School, 2009, 30(2): 234–235. |
| [17] | BERGERON Y, DESLAURIERS A M, OUELLET N, et al. Influence of cefodizime on pulmonary inflammatory response to heat-killed Klebsiella pneumoniae in mice[J]. Antimicrob Agents Chemother, 1999, 43(9): 2291–2294. DOI:10.1128/AAC.43.9.2291 |
| [18] |
张怡敏, 周雪宁, 张宏方, 等. 小鼠鲍曼不动杆菌肺感染模型的制备[J].
细胞与分子免疫学杂志, 2017, 33(10): 1392–1397.
ZHANG Y M, ZHOU X N, ZHANG H F, et al. Establishment of Acinetobacter baumannii-induced pneumonia model in mice[J]. Chin J Cell Mol Immunol, 2017, 33(10): 1392–1397. |
| [19] | SCHMIEDL A, KERBER-MOMOT T, MUNDER A, et al. Bacterial distribution in lung parenchyma early after pulmonary infection with Pseudomonas aeruginosa[J]. Cell Tissue Res, 2010, 342(1): 67–73. DOI:10.1007/s00441-010-1036-y |



