2. 637000 四川 南充,四川省医学影像学重点实验室,川北医学院附属医院放射科
2. Sichuan Key Laboratory of Medical Imaging, Department of Radiology, Affiliated Hospital of North Sichuan Medical College, Nanchong, Sichuan Province, 637000, China
急性胰腺炎(acute pancreatitis,AP)是胰腺的急性炎症反应过程,是一种高危的急腹症,尤其重症急性胰腺炎,起病急,进展快,并发症多,死亡率可高达20%以上[1]。因此,AP的早期诊断并准确判定其严重程度对提高其治愈率和降低死亡率具有重要的临床意义。临床工作中常出现临床症状和/或实验室指标提示AP,而影像学表现为阴性;以及临床症状和/或实验室指标阴性,而影像学AP表现阳性的情况,此时,对AP的早期定量诊断显得尤为的重要。
随着MR场强增高,及运动纠正技术、多通道并行采集、门控和快速回波平面成像技术的快速发展,水分子扩散加权成像(DWI)已在腹部临床及科研得到广泛应用[2-4]。磁共振扩散张量成像(DTI)和体素内不相干运动(IVIM-DWI)是在传统DWI基础上发展而来的。DTI需要在6个方向以上施加扩散敏感梯度场,从而全面反应组织在各个方向上的水分子扩散不同情况,即各向异性。FILIPPI等[5]认为由于DTI在弥散方向上提供了各向异性的附加弥散信息,故DTI能计算出较为准确的表观扩散系数(ADC)值。IVIM通过采用多b值的扩散加权成像,它可以把真性水分子弥散和毛细血管网中随机血流微循环灌注区分开来。然而,目前关于IVIM联合DTI成像对AP的诊断及严重程度分级的评估方面在国内外未见相关报道;同时,基于精准定量分析,本研究拟用IVIM和DTI成像比较实验组和对照组胰腺实质各参数值之间的差异,并与AP严重程度进行相关分析,以探讨IVIM和DTI弥散成像对AP早期诊断及严重程度的评估价值。
1 材料与方法 1.1 临床资料收集川北医学院附属医院2016年3月至2017年12月期间经临床怀疑为AP并在我院放射科做MRI检查的病例。研究对象需根据《急性胰腺炎诊治指南(2014)》纳入标准确诊为AP:①首发典型的AP临床表现:腹痛(严重、发作急、持续的上腹部疼痛,常放射至腰背部);②实验室指标:血淀粉酶或脂肪酶超过正常上限值3倍以上;③入院后3 d内行上腹部MRI检查;④患者临床及实验室相关检查均在入院第1~3天内采集。排除标准:①慢性胰腺炎或胰腺肿瘤;②低蛋白血症、全身重度感染或出血性疾病;③腹腔或腹膜后肿瘤;④病情较重难以配合检查者、图像伪影所致图像质量差者。102例患者符合纳入标准,其中17例被排除,包括3例慢性胰腺炎、2例胰腺肿瘤、2例低蛋白血症、5例腹腔或腹膜后肿瘤、5例图像质量太差。最终85例AP患者入选AP组,其中男性42例, 女性43例,年龄17~78(49.7±18.3)岁。另收集本院健康志愿者20例作为对照组,其中男性12例,女性8例,年龄27~62(27.5±4.6)岁。
本研究经川北医学院附属医院医学伦理委员会审批[2016 ER(A)025]。MRI扫描前告知患者检查内容及流程,并签订MRI检查知情同意书。
1.2 MRI扫描技术患者检查前均禁食6 h,检查前30 min进行均匀呼吸及屏气训练。采用GE Discovery MR 750 3.0T超导磁共振成像仪,体部32通道全腹部相控阵列表面线圈。检查时患者仰卧于检查床上,双臂上举,定位中心位于患者剑突下缘。经三平面定位及校准后,行MRI常规扫描,扫描序列如表 1[6]所示:主要包括横断位T1WI、T2WI、冠状位T2WI;磁共振胆胰管成像(MRCP);LAVA-Flex多期动态增强扫描,对比剂采用美国Medrad公司MR专用双管高压注射器经前臂静脉注射MR造影剂钆喷酸葡胺(Gd-DTPA,GE药业),浓度为0.5 mmol/mL,剂量0.2 mmol/kg,约20 mL,速率为3.0 mL/s,一般在5~7s注射完毕,20 mL生理盐水灌洗。每一时相采集时间13~18 s[7]。
| 序列 | TR/ms | TE/ms | 翻转角 | 层厚/mm | 层间距/mm | 矩阵 | 视野FOV/cm |
| AX 3D LAVA-Flex | 4.2 | 2.6/1.3 | 15~20° | 5 | 0 | 384×224 | 26~33 |
| AX FRFSE T2WI | 10 000~12 000 | 90~100 | 90° | 5 | 0.5 | 256×192 | 36×34 |
| COR SSFSE T2WI | 2 500~3 500 | 80~100 | 90° | 5 | 0.5 | 384×256 | 39×33 |
| AX SSFSE T2WI | 2 500~3 500 | 80~100 | 90° | 5 | 0.5 | 320×256 | 39×33 |
| MRCP | 3045 | 1 300 | 90° | 40 | 40~50 | 384×224 | 32×34 |
| AX 3D LAVA C+ | 4.2 | 2.6/1.3 | 15~20° | 5 | 0 | 384×224 | 26~33 |
| AX:横断面;COR:冠状面;FRFSE T2WI:快速恢复快速自旋回波呼吸门控T2加权;SSFSE T2WI:单次激发快速自旋回波呼吸门控T2加权 | |||||||
增强扫描前行横断位自由呼吸的IVIM和DTI屏气扫描:IVIM采用多b值的EPI平面回波成像,呼吸门控触发扫描,ASSET校正,扫描参数如下:层厚5.0 mm,层间距0 mm,频率编码方向:左右,TE minimum,弥散方向:3in1,矩阵192~256×192~256, b值为0、50、100、150、200、300、500、800、1 000、1 500 s/mm2,NEX=1 (b值0~500),NEX=2(b值800~1 500),扫描时间约2 min。DTI扫描参数:TR 2500 ms, TE minimum ms, 层厚5 mm, 层间距0 mm, FOV=28~34 cm, 带宽250 Hz, NEX=1, 矩阵192~256×192~256, 自动匀场,b值=500,弥散方向=9, 扫描时间22 s。
1.3 图像分析所有图像传至PACS工作站,由两位有5年以上工作经验的腹部放射科医师盲法阅片,判断AP类型,并依据CT/MR严重程度指数(CTSI/MRSI)评分对AP严重程度进行分级,对判断有分歧的病例,协商解决,最后达成一致。MRSI评分参照Balthazar标准[6],评分由胰腺实质、胰周的炎症改变以及胰腺坏死程度两部分组成(表 2)。胰腺坏死区域在MRI上表现为平扫呈长T1长T2改变,增强时无或轻度强化。按照MRSI分值,将AP分为轻、中、重度:0~3分为轻度,4~6分为中度,7~10分为重度[6, 8]。
| MRI表现 | MRSI评分 |
| 炎症程度 | |
| A:正常胰腺 | 0 |
| B:胰腺局部或弥漫性胰腺肿大,胰周无异常 | 1 |
| C:胰腺实质及周围炎性渗出,胰周轻度渗出 | 2 |
| D:除C级以外,有单个胰周积液 | 3 |
| E:有两个或两个以上的胰周积液区及胰外脓肿,或胰腺内及胰周出现气体 | 4 |
| 坏死程度 | |
| A:无坏死 | 0 |
| B:<30% | 2 |
| C:30~50% | 4 |
| D:>50% | 6 |
1.4 数据测量
将IVIM-DWI与DTI原始图像数据传输至GE 4.4 Workstation。应用FuncTool 2软件包中的MADC软件和DTI软件对IVIM-DWI、DTI的原始数据进行后处理,以阈值法除去周围骨、气体、脂肪等组织的影像,获得MADC、DTI图,并测量其胰腺头、体、尾处感兴趣区(Region Of Interest,ROI)下单指数模型(Standard ADC)和双指数模型的参数值Slow ADC、Fast ADC、Ff ADC(图 1),以及DTI参数值ADC、FA,取胰腺头、体、尾的平均值为以上参数值(图 2)。ROI的选取:DWI图像上呈高信号区域(以T2WI图像作为依据)选取3个相同面积ROI测量各参数值,并连续测量上下三层面计算其平均值,尽量避开主副胰管、血管和明暗伪影带等。
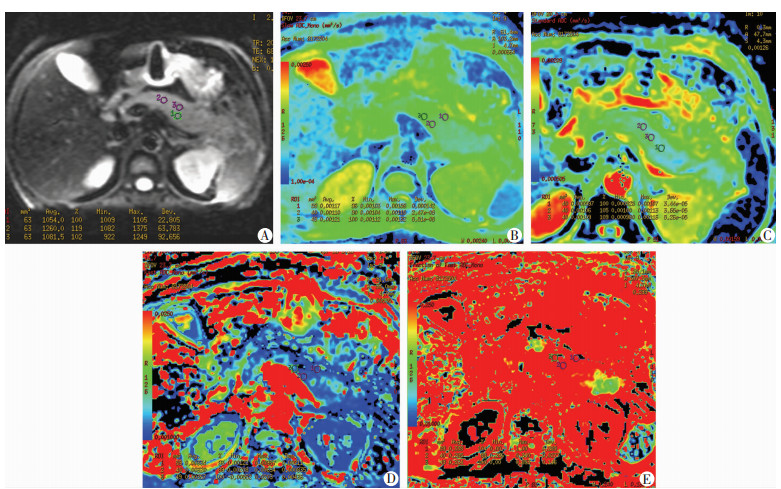
|
| A:DWI图;B:Slow ADC图;C:Standard ADC图;D:Fast ADC;E:Ff ADC在胰体放置3个大小相等的ROI测量各参数 图 1 AP患者的IVIM-DWI各参数测量图 |

|
| A:DTI图;B:ADC图;C:FA图选取胰体层面避开胰管用三个大小相等ROI测量各参数值 图 2 AP患者的DTI各参数测量图 |
1.5 统计学分析
采用SPSS 17.0软件和MedCalc软件对数据进行分析,计量资料以x±s表示。采用独立样本t检验比较AP组与对照组IVIM- DWI、DTI各参数值之间差异,利用MedCalc软件对其中有统计学差异的参数值绘制ROC曲线并比较其诊断效能。采用Sperman等级相关分析IVIM和DTI各参数值与AP严重程度MRSI评分关系。P<0.05表示差异有统计学意义。
2 结果 2.1 AP严重程度MRI评价85例AP中,糖尿病、高血压或高脂血症引起的28例,胆源性21例,饮食、饮酒19例,胆囊切除术后11例,其他6例。依据MRI表现,85例AP中间质水肿型66例(77.6 %),出血坏死型19例(22.4%),见图 3、4。依据MRSI分型:轻度32例(37.6 %),中度40例(47.05 %),重度13例(15.3%)。
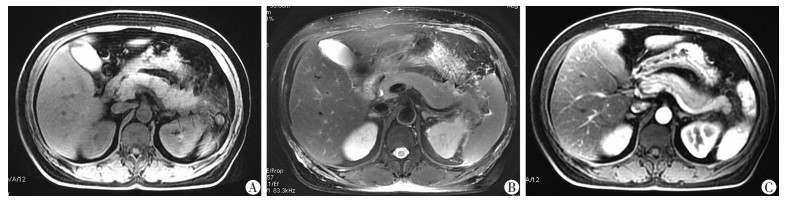
|
|
箭头示:胰腺体尾部肿胀,边缘模糊,边缘有少量渗出 A:T1WI;B:T2WI;C:T1增强胰腺实质均匀强化,未见坏死区域,MRSI评分2分,严重程度为轻度 图 3 间质水肿型AP患者(50岁女性)MRI表现 |
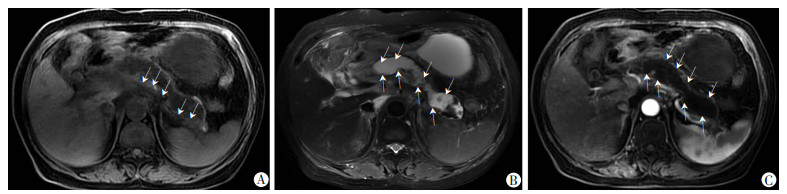
|
|
箭头示:胰腺头、体、尾大面积液性坏死,呈长T1长T2改变 A:T1WI;B:T2WI;C:增强示坏死区未见强化,MRSI评分4+6分,严重程度为重度 图 4 出血坏死型AP患者(63岁男性)MRI表现 |
2.2 IVIM/DTI弥散参数值
结果显示,AP组的standard ADC、Ff ADC、DTI的ADC及FA值均显著低于对照组(P<0.05,表 3),而两组slow ADC、fast ADC值差异无统计学意义(P>0.05,表 3)。
| 组别 | n | standard ADC ×10-3mm2/s |
slow ADC ×10-3mm2/s |
fast ADC ×10-3mm2/s |
Ff ADC ×10-3mm2/s |
DTI的ADC ×10-3mm2/s |
FA |
| AP组 | 85 | 1.38±0.36 | 1.29±0.26 | 0.069±0.03 | 0.262±0.076 | 1.92±0.54 | 0.39±0.15 |
| 对照组 | 20 | 1.74±0.51 | 1.26±0.24 | 0.076±0.04 | 0.429±0.083 | 2.19±0.49 | 0.46±0.11 |
| t值 | 3.99 | -0.209 | 0.420 | 3.593 | 2.393 | 2.595 | |
| P值 | <0.001 | 0.835 | 0.675 | 0.001 | 0.018 | 0.011 |
2.3 IVIM、DTI各弥散参数对AP诊断效能分析
利用MedCalc对其中有统计学差异的IVIM、DTI各弥散参数绘制ROC曲线并对AP的诊断效能相互比较,结果显示,standard ADC、Ff ADC、DTI的ADC及FA值的曲线下面积分别为0.692、0.707、0.676、0.669,P值分别为0.002、0.001、0.003、0.006(表 4),但各参数值之间的诊断效能差异无统计学意义(P均>0.05,表 5、图 5)。
| 参数 | AUC | SE | 95%CI | P值 |
| standard ADC | 0.692 | 0.059 | 0.577~0.807 | 0.002 |
| Ff ADC | 0.707 | 0.056 | 0.597~0.813 | 0.001 |
| DTI ADC | 0.676 | 0.053 | 0.580~0.762 | 0.003 |
| FA | 0.669 | 0.052 | 0.567~0.771 | 0.006 |
| 区域差异 | 95%CI | P值 | |
| Ff ADC vs standard ADC | 0.015 | -0.141~0.172 | 0.849 |
| Ff ADC vs DTI ADC | 0.031 | -0.118~0.180 | 0.684 |
| Ff ADC vs FA | 0.048 | -0.093~0.188 | 0.508 |
| standard ADC vs DTI ADC | 0.016 | -0.139~0.171 | 0.841 |
| standard ADC vs FA | 0.032 | -0.117~0.181 | 0.672 |
| DTI ADC vs FA | 0.017 | -0.117~0.181 | 0.672 |
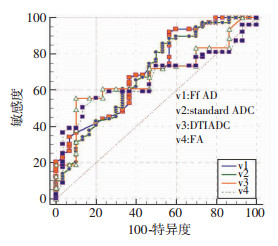
|
| 图 5 IVIM、DTI参数的ROC曲线 |
2.4 IVIM、DTI参数与MRSI严重程度分级的相关性
AP患者胰腺实质standard ADC及Ff ADC值随着MRSI评分增加而降低(R:-0.419,-0.271), 而slow ADC、fast ADC值与MRSI评分不具有相关性。DTI序列的ADC、FA值随着AP严重程度加重而降低(R:-0.339,-0.391),见表 6。
| MRSI评分 | standard ADC ×10-3mm2/s |
slow ADC ×10-3mm2/s |
fast ADC ×10-3mm2/s |
Ff ADC ×10-3mm2/s |
DTI的ADC ×10-3mm2/s |
FA |
| 轻度 | 1.73±0.43 | 1.42±0.61 | 0.067±0.047 | 0.372±0.190 | 1.93±0.59 | 0.48±0.25 |
| 中度 | 1.44±0.34 | 1.35±0.57 | 0.068±0.061 | 0.314±0.133 | 1.68±0.24 | 0.37±0.16 |
| 重度 | 1.23±0.19 | 1.22±0.17 | 0.014±0.009 | 0.212±0.119 | 1.43±0.21 | 0.25±0.14 |
| R值 | -0.419 | -0.120 | -0.197 | -0.271 | -0.339 | -0.391 |
| P值 | <0.001 | 0.257 | 0.070 | 0.012 | 0.015 | 0.009 |
3 讨论
DWI是一种观察活体组织内水分子弥散运动的无创的成像方法,通过检测生物体内水分子运动状态的改变,而间接的反应组织空间结构和病理变化[9]。ADC值作为一评估水分子布朗运动的重要量化指标,其扩散敏感因子用b值表示。研究显示,AP患者胰腺的ADC值低于正常组[9-11]。这些研究均采用单指数模型来获取ADC值(b=0/80;0/1000),其理论基础是假设人体组织是单一均匀物质,水分子弥散呈高斯分布,却忽略水分子弥散的各向异性、组织结构和病变区域特殊细胞形态的影响。因此,不能真正反映AP时微循环灌注和水分子弥散情况[3, 12]。而本研究中通过多b值DWI单指数模型获得的ADC平均值:standard ADC值,也发现AP单指数函数参数standard ADC值低于正常胰腺实质。消除了因b值选择不同而导致的ADC值差异[13],较为真实反映AP复杂的病理生理状态。
随着生物组织弥散技术不断优化,LE BIHAN等[14]最先提出了IVIM双指数模型,通过设立多b值的扩散加权成像,可以分别量化水分子的真性弥散和毛细血管网中微循环灌注。通过非线性回归函数:Sb/S0=(1-f)oexp(-boD)+foexp(-boD*)可计算出D、D*、f值,分别对应slow ADC、fast ADC、灌注分数Ff ADC。它们各代表纯扩散系数,假扩散系数及灌注分数。KANG等[15]应用多b值DWI研究正常胰腺、慢性胰腺炎、胰腺常见肿瘤,结果发现其灌注参数f值有助于区分三者。LEMKE等[16]和KLAUSS等[17]研究同样发现,灌注参数f值对胰腺疾病的诊断与鉴别方面效果好,但ADC值和D值的差异无统计学意义。石林等[18]应用DWI多指数模态评价AP的诊断价值,结果发现:DWI单指数模型参数standard ADC及双指数模型参数Ff ADC mono、Ff ADC Bi对AP有较好的诊断价值。本研究中发现AP胰腺实质的Ff ADC低于正常对照组,而slow ADC、fast ADC值差异无统计学意义(P>0.05),与以往研究相符,表明Ff ADC值可能成为诊断AP的有效指标之一。
DTI是一种利用组织中水分子弥散的各向异性的特性来探测组织微观结构的成像方法,在DWI的基础上施加6~256个非线性方向的梯度场获取的,可为临床研究提供新的结构和功能参数[19]。其参数ADC值反映体内水分子向各个方向弥散的平均值,各向异性比值(FA)为弥散各向异性指数,代表了水分子在弥散主向量轴上的运动强度[20]。目前国内外关于DTI应用与胰腺疾病的研究较少,NISSAN等[21]研究显示,胰腺癌本征值及ADC值低于正常胰腺组织,推测与肿瘤组织高细胞密度有关。本研究结果显示,AP组胰腺实质FA及ADC值低于对照组,推测AP时胰腺组织水肿、炎症细胞浸润、细胞质空泡化、腺泡细胞死亡及微观结构破坏等导致水分子各向异性扩散受限。本研究还比较了IVIM、DTI各弥散参数对AP诊断效能,结果发现:standard ADC、Ff ADC、DTI的ADC及FA值得有效能AUC分别为0.692、0.707、0.676、0.669,P均<0.05,但参数之间的诊断效能差异无统计学意义,表明IVIM、DTI均可作为诊断AP的有效指标。
MRSI评分系统是影像上常用的AP严重程度分级的评估方法,它能准确、直观的判断胰腺炎症、坏死程度及其周围改变[22]。本研究采用MRSI评分系统对AP严重程度进行分级,并与IVIM,DTI参数值之间进行相关分析,结果发现,AP患者胰腺实质IVIM的standard ADC、Ff ADC值及DTI的ADC、FA值随着MRSI评分增加而降低,笔者推断这与随着AP严重程度的加重,胰腺释放大量异常激活的特异性胰酶,导致胰腺组织微观结构破坏,水分子扩散运动受限加重密切相关,同时激活的胰酶进一步激活机体炎症细胞释放大量炎症介质,引起体内一系列炎症放大反应,导致炎症细胞浸润、细胞水肿增大死亡、细胞质空泡化以及全身毛细血管通透性增加,大量炎性渗液和组织液进入第三间隙,造成胰腺组织血流灌注的持续下降。因此,胰腺实质IVIM的standard ADC、Ff ADC值及DTI的ADC、FA值可作为AP严重程度影像分期的依据之一。
本研究的缺陷:①MRI对病情危重、年龄大的AP患者显示困难。②由于需b值的设置及数学拟合方法的选择等因素会直接影响IVIM-DWI参数的测量结果,其相关参数的选择及优化方案有待深入研究。③本研究未采用2012年新亚特兰大AP分类标准[23],其对中重度、重度器官衰竭的定义需要临床和实验室的多项、反复检查(48 h内复查),同时对检查时间要求严格,由于与临床医生及护士缺乏密切沟通,造成部分患者资料欠完整,无法对疾病严重程度的进行准确判断。④少数患者可能在发病后数日才入院,因影像分级与发病时间相关,发病时间长,治疗延误,故AP严重程度判断有所加重。
综上所述,IVIM-DWI和DTI对AP的定量诊断和AP严重程度影像分级方面具有一定评估价值。但在b值的设定,数据的准确测量以及模型拟合数学方法的选择等方面有待进一步完善与统一。但IVIM-DWI、DTI与传统的DWI技术相比,能较为准确、真实地反应疾病的病理生理改变,将拥有更为广阔的应用前景。
| [1] | LIN J, LI Z, ZHENG Y, et al. Elevated presepsin levels are associated with severity and prognosis of severe acute pancreatitis[J]. Clin Lab, 2016, 62(9): 1699–1708. DOI:10.7754/Clin.Lab.2016.160134 |
| [2] |
何为, 周延, 刘剑羽, 等. MR扩散加权成像单指数模型及体素内不相干运动模型参数诊断胰腺癌的价值[J].
中华放射学杂志, 2016, 50(6): 427–431.
HE W, ZHOU Y, LIU J Y, et al. Differentiation of pancreas carcinoma from healthy pancreas using diffusion-weighted MR imaging:comparison of apparent diffusion coefficient and intravoxel incoherent motion-derived parameters[J]. Chin J Radiol, 2016, 50(6): 427–431. DOI:10.3760/cma.j.issn.1005-1201.2016.06.006 |
| [3] | BARRAL M, SOYER P, BEN HASSEN W, et al. Diffusion-weighted MR imaging of the normal pancreas: reproducibility and variations of apparent diffusion coefficient measurement at 1.5- and 3.0-Tesla[J]. Diagn Interv Imaging, 2013, 94(4): 418–427. DOI:10.1016/j.diii.2012.12.007 |
| [4] | KELLER S, SCHMIDT T M, KIM A C, et al. Postmortem MR diffusion-weighted imaging of the liver: time-behavior of the hepatic apparent diffusion coefficient in the early death interval[J]. Int J Legal Med, 2018, 132(1): 263–268. DOI:10.1007/s00414-017-1685-4 |
| [5] | FILIPPI M, AGOSTA F. Diffusion tensor imaging and functional MRI[J]. Handb Clin Neurol, 2016, 136: 1065–1087. DOI:10.1016/B978-0-444-53486-6.00056-9 |
| [6] | LI X, ZHUANG L, ZHANG X, et al. Preliminary study of MR diffusion tensor imaging of pancreas for the diagnosis of acute pancreatitis[J]. PLoS ONE, 2016, 11(9): e0160115. DOI:10.1371/journal.pone.0160115 |
| [7] |
李兴辉, 张小明, 冀一帆, 等. 磁共振成像评价急性胰腺炎的严重程度与肾损害的相关性研究[J].
中华临床医师杂志(电子版), 2012, 6(5): 1186–1190.
LI X H, ZHANG X M, JI Y F, et al. The correlation between the severity of acute pancreatitis on MR imaging and kidney injury[J]. Chin J Clinicians (Electr Ed), 2012, 6(5): 1186–1190. DOI:10.3877/cma.j.issn.1674-0785.2012.05.025 |
| [8] | LI X H, ZHANG X M, JI Y F, et al. Renal and perirenal space involvement in acute pancreatitis: an MRI study[J]. Eur J Radiol, 2012, 81(8): e880–e887. DOI:10.1016/j.ejrad.2012.04.032 |
| [9] | THOMAS S, KAYHAN A, LAKADAMYALI H, et al. Diffusion MRI of acute pancreatitis and comparison with normal individuals using ADC values[J]. Emerg Radiol, 2012, 19(1): 5–9. DOI:10.1007/s10140-011-0983-2 |
| [10] | HOCAOGLU E, AKSOY S, AKARSU C, et al. Evaluation of diffusion-weighted MR imaging in the diagnosis of mild acute pancreatitis[J]. Clin Imaging, 2015, 39(3): 463–467. DOI:10.1016/j.clinimag.2014.10.001 |
| [11] | YENCILEK E, TELLI S, TEKESIN K, et al. The efficacy of diffusion weighted imaging for detection of acute pancreatitis and comparison of subgroups according to Balthazar classification[J]. Turk J Gastroenterol, 2014, 25(5): 553–557. DOI:10.5152/tjg.2014.6416 |
| [12] | SUMI M, VAN CAUTEREN M, SUMI T, et al. Salivary gland tumors: use of intravoxel incoherent motion MR imaging for assessment of diffusion and perfusion for the differentiation of benign from malignant tumors[J]. Radiology, 2012, 263(3): 770–777. DOI:10.1148/radiol.12111248 |
| [13] | DYVORNE H A, GALEA N, NEVERS T, et al. Diffusion-weighted imaging of the liver with multiple b values: effect of diffusion gradient polarity and breathing acquisition on image quality and intravoxel incoherent motion parameters—a pilot study[J]. Radiology, 2013, 266(3): 920–929. DOI:10.1148/radiol.12120686 |
| [14] | LE BIHAN D, BRETON E, LALLEMAND D, et al. Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging[J]. Radiology, 1988, 168(2): 497–505. DOI:10.1148/radiology.168.2.3393671 |
| [15] | KANG K M, LEE J M, YOON J H, et al. Intravoxel incoherent motion diffusion-weighted MR imaging for characterization of focal pancreatic lesions[J]. Radiology, 2014, 270(2): 444–453. DOI:10.1148/radiol.13122712 |
| [16] | LEMKE A, LAUN F B, KLAUSS M, et al. Differentiation of pancreas carcinoma from healthy pancreatic tissue using multiple b-values: comparison of apparent diffusion coefficient and intravoxel incoherent motion derived parameters[J]. Invest Radiol, 2009, 44(12): 769–775. DOI:10.1097/RLI.0b013e3181b62271 |
| [17] | KLAUSS M, LEMKE A, GRüNBERG K, et al. Intravoxel incoherent motion MRI for the differentiation between mass forming chronic pancreatitis and pancreatic carcinoma[J]. Invest Radiol, 2011, 46(1): 57–63. DOI:10.1097/RLI.0b013e3181fb3bf2 |
| [18] |
石林, 黄小华, 胡海, 等. DWI多指数模态评价急性胰腺炎的诊断价值研究[J].
中国医学计算机成像杂志, 2017, 23(3): 222–227.
SHI L, HUANG X H, HU H, et al. Diagnostic Value of Multi-b Value DWI Exponential Model for Acute Pancreatitis[J]. Chin Comput Med Imaging, 2017, 23(3): 222–227. DOI:10.3969/j.issn.1006-5741.2017.03.005 |
| [19] | TOSUN M, INAN N, SARISOY H T, et al. Diagnostic performance of conventional diffusion weighted imaging and diffusion tensor imaging for the liver fibrosis and inflammation[J]. Eur J Radiol, 2013, 82(2): 203–207. DOI:10.1016/j.ejrad.2012.09.009 |
| [20] | MENG X, JUN C, WANG Q, et al. High b-value diffusion tensor imaging of the remote white matter and white matter of obstructive unilateral cerebral arterial regions[J]. Clin Radiol, 2013, 68(8): 815–822. DOI:10.1016/j.crad.2013.03.009 |
| [21] | NISSAN N, GOLAN T, FURMAN-HARAN E, et al. Diffusion tensor magnetic resonance imaging of the pancreas[J]. PLoS ONE, 2014, 9(12): e115783. DOI:10.1371/journal.pone.0115783 |
| [22] | BOLLEN T L, SINGH V K, MAURER R, et al. Comparative evaluation of the modified CT severity index and CT severity index in assessing severity of acute pancreatitis[J]. AJR Am J Roentgenol, 2011, 197(2): 386–392. DOI:10.2214/AJR.09.4025 |
| [23] | BANKS P A, BOLLEN T L, DERVENIS C, et al. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102–111. DOI:10.1136/gutjnl-2012-302779 |



