冠状动脉无保护左主干病变(unprotected left main coronary artery disease,UPLM)是一类高风险的冠状动脉疾病,介入治疗(percutaneous coronary intervention,PCI)难度大、风险高、预后差,冠状动脉旁路移植术(coronary artery bypass grafting,CABG)一直被认为是UPLM的标准治疗方案[1-2]。随着PCI技术的不断发展及药物洗脱支架(drug eluting stent, DES)的广泛应用,UPLM介入治疗的临床预后不断改善,国内外相关研究表明,PCI和CABG治疗UPLM的近期疗效相似[3-5],但目前广泛使用的永久性聚合物涂层药物洗脱支架(permanent polymer drug eluting stent, PP-DES)仍存在晚期支架内再狭窄(in-stent restenosis,ISR)率及晚期支架内血栓形成(stent thrombosis,ST)风险增高的问题[6-8],可导致靶血管再次血运重建(target vessel revascularization, TVR)、心肌梗死(myocardial infarction, MI)、心源性死亡(cardiac death, CD)等不良事件,严重影响UPLM患者介入治疗的预后。可降解聚合物涂层支架(biodegradable polymer drug eluting stent, BP-DES)和无聚合物涂层支架(polymer free drug eluting stent, PF-DES)的出现为UPLM介入治疗方案提供了新的选择。近年来有多项研究表明,可降解聚合物涂层支架和无聚合物涂层支架与永久性聚合物涂层支架相比,能改善一般冠脉病变PCI术后的临床预后[9-10],但在UPLM介入治疗中的相关研究甚少。本研究以无保护左主干病变介入治疗的患者为研究对象,通过比较PP-DES、BP-DES及PF-DES 3种支架介入术后的临床疗效,探讨两种新型药物洗脱支架在UPLM介入治疗中的安全性及有效性。
1 对象与方法 1.1 患者纳入本研究收集2013年1月至2017年7月于陆军军医大学(第三军医大学)第二附属医院心血管内科拟诊冠心病、经冠状动脉造影明确证实为UPLM并行PCI治疗的住院患者259例,其中男性220例,女性39例,年龄(64.2±10.4)岁。纳入标准:①经冠状动脉造影明确诊断UPLM;②适合PCI治疗。排除标准:①左主干植入不同类型支架;②恶性肿瘤,严重肝、肾功能不全患者;③凝血功能障碍;④妊娠妇女;⑤严重精神疾病患者。本研究的所有入组对象及其直系亲属均知情同意并自愿参加本研究;本研究2018年已通过我院伦理委员会审查。所有研究对象根据左主干植入支架类型分为永久性聚合物涂层支架组(PP-DES组,153例)、可降解聚合物涂层组(BP-DES组,54例)和无聚合物涂层支架组(PF-DES组,52例)。PP-DES组使用支架为紫杉醇洗脱冠状动脉支架(波士顿科技,41例)、依维莫司洗脱冠状动脉支架(雅培,80例)、雷帕霉素洗脱冠脉支架(上海微创电生理医疗科技,firebird2,32例);BP-DES组使用支架为雷帕霉素洗脱冠脉支架(山东吉威,Excel,25例;赛诺医疗,Buma,29例);PF-DES组使用支架为雷帕霉素洗脱冠脉支架(乐普医疗,Nano,52例)。根据支架所载药物不同进一步行亚组分析。
1.2 手术情况手术前,所有患者均口服阿司匹林肠溶片(100 mg,1/d)+氯吡格雷(75 mg,1/d),或阿司匹林肠溶片(100 mg,1/d)+替格瑞洛(90 mg,2/d)至少3 d,不足3 d则术前口服阿司匹林肠溶片(300 mg)+氯吡格雷(300 mg)或阿司匹林肠溶片(300 mg)+替格瑞洛(180 mg)。手术后终身服用阿司匹林肠溶片(100 mg,1/d),继续服用氯吡格雷(75 mg,1/d)或替格瑞洛(90 mg,2/d)至少12个月, 血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂、β受体阻滞剂及他汀类药物根据患者具体情况选用。手术经桡动脉或股动脉径路进行,造影证实为UPLM后,采用何种支架术式根据手术医师判断;在详细向患者及家属充分告知各种支架优劣和可能存在的潜在风险后,由患者及家属自行选择。
1.3 资料采集主要采集患者的基本资料,包括性别、年龄,合并吸烟、糖尿病、高血压、高脂血症、体质指数(BMI)等冠心病高危因素,左室射血分数(LVEF)、空腹血糖(FPG)、糖化血红蛋白(HBA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)、总三碘甲状原氨酸(TT3)、总甲状腺素(TT4)等临床及生化指标,服用β受体阻滞剂(β-block)、血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)、他汀类等相关药物及不稳定型心绞痛(UA)、急性ST段抬高型心肌梗死(STEMI)、急性非ST段抬高型心肌梗死(NSTEMI)等入院诊断;糖尿病、高血压、高脂血症诊断标准分别按照《2013年版中国2型糖尿病防治指南》、《2010版中国高血压防治指南》、《2016版中国成人血脂异常防治指南》执行。同时采集冠脉病变及手术策略相关信息包括支架术式、真性分叉病变、syntax评分、最终球囊对吻及支架药物涂层等(表 1、2)。
| 组别 | n | 男性/例(%) | 年龄/岁 | BMI/(kg/m2) | 吸烟/例(%) | 糖尿病/例(%) | 高血压/例(%) |
| PP-DES | 153 | 131(85.6%) | 63.7±10.4 | 24.3±3.2 | 88(57.5%) | 40(26.1%) | 90(58.8%) |
| BP-DES | 54 | 47(87.0%) | 65.4±10.9 | 23.9±3.7 | 28(51.92%) | 18(23.4%) | 29(54.7%) |
| PF-DES | 52 | 42(80.8%) | 64.5±9.7 | 23.9±2.7 | 25(48.2%) | 10(19.2%) | 29(55.8%) |
| P值 | 0.619 | 0.567 | 0.834 | 0.450 | 0.272 | 0.788 | |
| 组别 | n | 高脂血症/例(%) | LVEF(%) | HBA1c(%) | FPG/mmol·L-1 | TC/mmol·L-1 | TG/mmol·L-1 |
| PP-DES | 153 | 19(12.4%) | 61.3±8.6 | 6.6±1.4 | 5.58±1.69 | 4.05±1.19 | 1.57±0.91 |
| BP-DES | 54 | 7(13.2%) | 60.6±8.1 | 6.4±0.9 | 5.36±1.77 | 4.32±1.06 | 1.45±0.58 |
| PF-DES | 52 | 5(9.6%) | 59.5±7.7 | 6.1±1.0 | 5.33±2.14 | 4.08±1.15 | 1.42±0.57 |
| P值 | 0.867 | 0.506 | 0.464 | 0.691 | 0.553 | 0.544 | |
| 组别 | n | HDL-C/mmol·L-1 | LDL-C/mmol·L-1 | FT3/pmol·L-1 | FT4/pmol·L-1 | TT3/nmol·L-1 | TT4/nmol·L-1 |
| PP-DES | 153 | 1.01±0.27 | 2.64±0.94 | 4.62±0.96 | 15.49±2.76 | 1.62±0.48 | 89.19±24.95 |
| BP-DES | 54 | 0.94±0.17 | 2.91±0.88 | 4.47±0.73 | 15.74±1.99 | 1.56±0.35 | 91.29±21.13 |
| PF-DES | 52 | 0.98±0.27 | 2.66±1.01 | 4.30±0.65 | 15.18±2.51 | 1.48±0.26 | 84.06±27.98 |
| P值 | 0.553 | 0.430 | 0.162 | 0.698 | 0.346 | 0.578 | |
| 组别 | n | UA | STEMI | NSTEMI | 他汀/例(%) | ACEI or ARB/例(%) | β-block/例(%) |
| PP-DES | 153 | 125(81.7%) | 18(11.8%) | 12(7.8%) | 153(100%) | 122(79.7%) | 115(75.2%) |
| BP-DES | 54 | 45(83.3%) | 6(11.1%) | 3(5.6%) | 54(100%) | 41(77.4%) | 34(63.0%) |
| PF-DES | 52 | 40(76.9%) | 7(13.5%) | 5(9.6%) | 52(100%) | 44(84.6%) | 43(82.7%) |
| P值 | 0.687 | 0.930 | 0.725 | 1.000 | 0.535 | 0.060 |
| 组别 | n | 真性分叉病变/例(%) | syntax评分 /分 |
单支架+必要时球囊对吻/例(%) | 双支架植入术 /例(%) |
最终球囊对吻 /例(%) |
紫杉醇药物涂层/例(%) | 依维莫司药物涂层/例(%) | 雷帕霉素药物涂层/例(%) |
| PP-DES | 153 | 141(92.2%) | 25.1±3.7 | 92(60.1%) | 61(39.8%) | 99(64.7%) | 41(26.8%) | 80(52.3%) | 32(20.9%) |
| BP-DES | 54 | 52(96.3%) | 26.2±3.5 | 32(59.3%) | 22(40.7%) | 35(64.8%) | - | - | 54(100%) |
| PF-DES | 52 | 51(98.1%) | 24.9±4.4 | 30(57.7%) | 22(42.3%) | 35(67.3%) | - | - | 52(100%) |
| P值 | 0.298 | 0.173 | 0.953 | 0.953 | 0.951 | <0.001 |
1.4 随访信息
从患者术后第1天起,通过电话、门诊、住院、查阅病历资料等随访方式,随访至术后12个月,主要终点事件为靶血管失败(target vessel failure, TVF),包括心源性死亡(cardiac death, CD)、靶血管相关心肌梗死(target vessel myocardial infarction, TVMI)和靶血管再次血运重建(target vessel revascularization, TVR);次要终点事件为主要心血管不良事件(major adverse cardiovascular events, MACE),包括心源性死亡(cardiac death, CD)、非致死性心肌梗死(nonfatal myocardial infarction, NFMI)、再次血运重建(revascularization)等发生情况,具体见图 1。
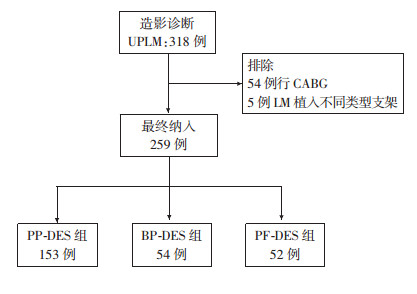
|
| UPLM:无保护左主干病变;CABG:冠状动脉旁路移植术;LM:左主干;PP-DES:永久性聚合物涂层支架;BP-DES:可降解聚合物涂层支架;PF-DES:无聚合物涂层支架 图 1 研究流程 |
1.5 终点事件定义
① 心源性死亡:无明确非心脏原因引起的死亡,视为心源性死亡;②靶血管相关心肌梗死:再次出现胸痛症状及肌钙蛋白升高,伴或不伴心电图变化,犯罪血管为既往PCI干预过的血管(左主干);③靶血管再次血运重建:再次出现胸痛,不伴肌钙蛋白升高及心电图变化,于既往PCI干预过的血管(左主干)再次行血运重建;④非致死性心肌梗死:再次出现胸痛症状及肌钙蛋白升高,伴或不伴心电图变化,但未导致死亡;⑤再次血运重建:冠状动脉任何部位的再次血运重建。
1.6 统计学分析采用SPSS 22.0统计软件进行数据分析,计数资料采用例数及百分比表示,计量资料以x±s表示,计数资料之间的比较采用卡方检验或Fisher确切概率法,计量资料的比较采用方差分析,采用Kaplan-Meier法计算不同组间的靶血管失败及主要心血管不良事件累积发生率并用Log-rank检验各组间的差异,检验水准α=0.05。
2 结果所有患者随访至术后12个月。通过统计分析,各组患者在性别、年龄、临床诊断、合并高危因素及病变类型、支架术式、真性分叉病变比例等方面的差异无统计学意义(表 1、2),术后12个月内的靶血管失败及主要心血管不良事件发生率的差异无统计学意义(表 3),各亚组术后12个月内的靶血管失败及主要心血管不良事件发生率的差异无统计学意义(表 4)。经Kaplan-Meier分析,各组患者12个月内靶血管失败(log-rank=0.270)及主要心血管不良事件(log-rank=0.098)累积发生率的差异无统计学意义(图 2);各亚组患者12个月内靶血管失败(log-rank=0.964)及主要心血管不良事件(log-rank=0.729)累积发生率的差异无统计学意义(图 3)。多因素COX回归分析显示:syntax基线评分是靶血管失败(P<0.05, HR=1.480,95%CI:1.290~1.697)及主要心血管不良事件(P<0.05, HR=1.522,95%CI:1.367~1.695)的独立预测因素。支架类型与靶血管失败及主要心血管不良事件均无显著相关性(P>0.05)。
| 组别 | n | 靶血管失败 /例(%) |
心源性死亡 /例(%) |
靶血管相关性心肌梗死/例(%) | 靶血管血运重建/例(%) | 主要心血管不良事件/例(%) | 心源性死亡 /例(%) |
非致死性心肌梗死/例(%) | 再次血运重建/例(%) |
| PP-DES | 153 | 16(10.5%) | 5(3.3%) | 4(2.6%) | 7(4.7%) | 27(17.6%) | 5(3.3%) | 12(7.8%) | 10(6.5%) |
| BP-DES | 54 | 4(7.4%) | 3(5.6%) | - | 1(1.8%) | 5(9.3%) | 3(5.6%) | - | 2(3.7%) |
| PF-DES | 52 | 3(5.7%) | 2(3.8%) | 1(1.9%) | - | 5(9.6%) | 2(3.8%) | 1(2.0%) | 2(3.8%) |
| P值 | 0.596 | 0.210 |
| 组别 | n | 靶血管失败 /例(%) |
心源性死亡 /例(%) |
靶血管相关性心肌梗死/例(%) | 靶血管血运重建/例(%) | 主要心血管不良事件/例(%) | 心源性死亡 /例(%) |
非致死性心肌梗死/例(%) | 再次血运重建 /例(%) |
| 依维莫司PP-DES | 80 | 12(15.0%) | 3(3.75%) | 3(3.75%) | 6(7.5%) | 19(23.8%) | 3(3.8%) | 8(10.0%) | 8(10.0%) |
| 紫杉醇PP-DES | 41 | 3(7.2%) | 1(2.4%) | 1(2.4%) | 1(2.4%) | 6(14.6%) | 1(2.4%) | 3(7.4%) | 2(4.8%) |
| 雷帕霉素PP-DES | 32 | 1(3.1%) | 1(3.1%) | - | - | 2(6.2%) | 1(3.1%) | 1(3.1%) | - |
| 雷帕霉素BP-DES | 54 | 4(7.4%) | 3(5.6%) | - | 1(1.8%) | 5(9.3%) | 3(5.6%) | - | 2(3.7%) |
| 雷帕霉素PF-DES | 52 | 3(5.7%) | 2(3.8%) | 1(1.9%) | - | 5(9.6%) | 2(3.8%) | 1(2.0%) | 2(3.8%) |
| P值 | 0.280 | 0.068 |
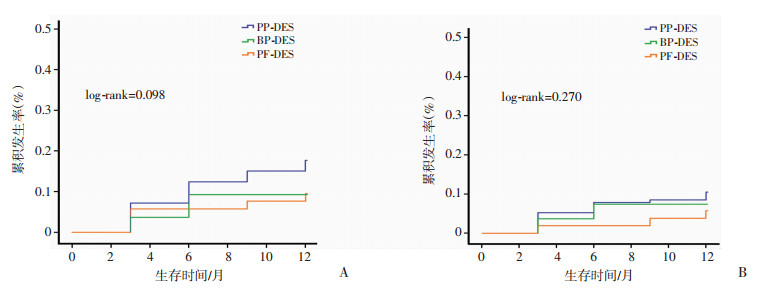
|
| 图 2 各组研究对象术后12个月内主要心血管不良事件(A)及靶血管失败(B)Kaplan-Meier分析 |
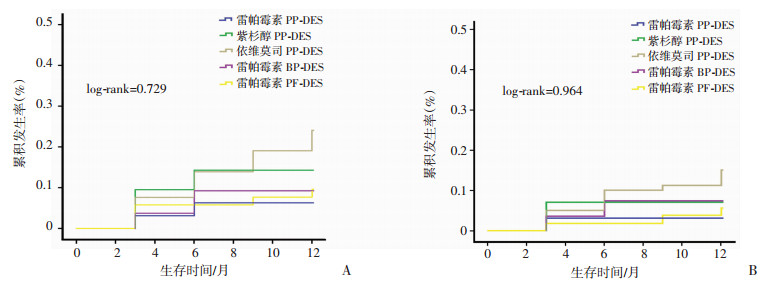
|
| 图 3 各亚组研究对象术后12个月内主要心血管不良事件(A)及靶血管失败(B)Kaplan-Meier分析 |
3 讨论
冠状动脉无保护左主干病变(unprotected left main coronary artery disease,UPLM)是一类高风险的冠状动脉疾病,是指冠状动脉左主干狭窄>50%,同时前降支及回旋支无通畅侧支循环的冠状动脉病变,约占冠状动脉造影检查的3%~5%,因其斑块负荷重、血管直径相差较大、末端分叉意义巨大等解剖学和病理学特点,介入治疗操作难度大、风险高,可导致灾难性后果,冠状动脉旁路移植术(coronary artery bypass grafting,CABG)一直被认为是UPLM的标准治疗方案[1-2]。随着冠状动脉介入治疗(percutaneous coronary intervention,PCI)技术的不断发展及药物洗脱支架(drug eluting stent, DES)的广泛应用,UPLM介入治疗的临床预后不断改善,国内外相关研究表明,PCI和CABG治疗UPLM的近期疗效相似[3-5],但目前广泛使用的永久性聚合物涂层药物洗脱支架(permanent polymer drug eluting stent, PP-DES)仍存在晚期支架内再狭窄(in-stent restenosis,ISR)率及晚期支架内血栓形成(stent thrombosis,ST)风险增高的问题[6-8]。支架内血栓形成约70%患者发生心肌梗死,病死率及致残率均较高,而晚期支架内再狭窄导致再次血运重建率增加、增加患者痛苦及介入并发症风险[11]。并且,随着冠心病患者存活率的提高及存活期的延长,PCI术后晚期支架内再狭窄及血栓形成风险累积发生更多,而对于UPLM这类高风险的冠状动脉疾病,介入术后发生支架内再狭窄或血栓形成,不仅再次血运重建难度大,患者发生心源性死亡等严重不良事件的风险较一般冠脉病变更高。所以,进一步降低支架内再狭窄率及支架内血栓形成风险,消除影响冠心病患者PCI术后长期生存的潜在风险,对UPLM患者来说意义更加重大。
目前临床上广泛使用的是永久性聚合物涂层药物洗脱支架,抗细胞增殖药物释放完全后会使支架钢梁表面的聚合物涂层暴露,引起局部炎症反应、过敏反应[12]及内皮化不全[13-14],可导致支架内新生内膜粥样硬化或动脉壁延迟愈合,所以聚合物涂层长期残留被认为是导致PCI术后晚期支架内再狭窄和血栓形成的重要因素[15-17]。为尝试消除支架相关因素介导的支架内再狭窄和血栓形成,支架制作技术不断地发展及完善,包括研制更薄的支架钢梁、更具生物相容性的聚合物涂层和使用更强的抗细胞增殖药物作为药物涂层等。
可降解聚合物涂层支架(biodegradable polymer drug eluting stent, BP-DES)和无聚合物涂层支架(polymer free drug eluting stent, PF-DES)被称为新一代药物洗脱支架,旨在解决聚合物涂层长期残留这一问题。BP-DES采用特殊生物可降解聚合物材料作为载药层,聚合物可在3~6个月内降解为水和二氧化碳,药物释放后只留下支架钢梁[18];PF-DES则弃用聚合物涂层,通过特殊微孔技术控制药物的释放[19]。这两种新型支架,从理论上说可降低因聚合物长期存在导致的晚期支架内再狭窄和血栓形成风险,改善介入治疗的长期预后,国内外已有多项研究表明,两种新型支架治疗与PP-DES聚合物相比,能降低一般冠脉病变PCI术后的不良事件发生率[9-10]。永久性聚合物涂层支架的诞生,使得介入治疗突破了无保护左主干病变的禁区,而新型支架的出现,不仅为这类高风险病变的介入方案提供了新的选择,又可能使无保护左主干病变PCI治疗预后得到进一步改善。但两种新型支架治疗无保护左主干病变的安全性及有效性究竟如何,是否能如设计理念般,在永久性聚合物涂层支架基础上进一步无保护左主干病变的临床预后,国内外相关研究甚少。
本研究以经PCI治疗的无保护左主干病变患者为研究对象,根据左主干植入支架类型的不同分为永久性聚合物涂层支架组、可降解聚合物涂层支架组和无聚合物涂层支架组,比较3组患者PCI术后的临床预后,发现:①永久性聚合物涂层支架、可降解聚合物涂层支架和无聚合物涂层支架在无保护左主干病变患者的介入治疗中临床疗效相当,即两种新型支架治疗无保护左主干病变安全有效;②随着随访时间的延长,永久性聚合物涂层支架组的靶血管失败及心血管不良事件累积发生率较可降解聚合物涂层支架组及无聚合物涂层支架有升高趋势,但差异无统计学意义;③syntax评分是指导无保护左主干血运重建策略和预测介入治疗预后的重要依据。关于可降解聚合物涂层支架在无保护左主干病变介入治疗中的研究甚少,在LEE等[20]所做的一项回顾性分析中,可降解聚合物涂层支架与永久性聚合物涂层支架在无保护左主干病变介入治疗中的安全性及有效性相当,与本研究结果相近,但本研究所纳入病例的病变复杂程度、累及末端的左主干分叉病变比例明显高于Pil Hyung Lee的研究,表明可降解聚合物涂层支架在无保护左主干分叉病变等更高风险的冠脉病变中仍有较好的疗效;目前尚未见无聚合物涂层支架在无保护左主干病变介入治疗中的相关研究。
本研究所得结论,初步验证了可降解聚合物涂层支架和无聚合物涂层支架在无保护左主干病变介入治疗中的安全性及有效性,因相关研究甚少,故本研究结果可为下一步的深入研究提供一定的临床参考价值。但引起PCI治疗术后支架内再狭窄及血栓形成的支架相关因素较多,如药物涂层、聚合物涂层、支架金属钢梁等,本研究由于样本量少、随访时间较短所限,仅考虑了聚合物涂层,且本研究为回顾性分析,不能很好地保证入选病例的随机性,故所得结论需进一步大规模、前瞻性随机对照研究,更加严格地控制和消除混杂因素来加以证实。
| [1] | WIJNS W, KOLH P, DANCHIN N, et al. Guidelines on myocardial revascularization: The task force on myocardial revascularization of the european society of cardiology (ESC) and the european association for cardio-thoracic surgery (EACTS)[J]. Eur Heart J, 2010, 31: 2501–2555. DOI:10.1093/eurheartj/ehq277 |
| [2] | LEVINE G N, BATES E R, BLANKENSHIP J C, et al. 2011 ACCF/AHA/SCAI Guideline for percutaneous coronary intervention: a report of the american college of cardiology foundation/american heart association task force on practice guidelines and the society for cardiovascular angiography and interventions[J]. Circulation, 2011, 124(23): e574–651. DOI:10.1161/CIR.0b013e31823ba622 |
| [3] | LEE P H, KANG S H, HAN S, et al. Generalizability of EXCEL and NOBLE results to a large registry population with unprotected left main coronary artery disease[J]. Coron Artery Dis, 2017, 28(8): 675–682. DOI:10.1097/MCA.0000000000000543 |
| [4] | MORICE M, SERRUYS P W, KAPPETEIN P, et al. Outcomes in patients with de novo left main disease treated with either percutaneous coronary intervention using paclitaxel-eluting stents or coronary artery bypass graft treatment in the synergy between percutaneous coronary intervention with TAXUS and cardiac surgery (SYNTAX) trial[J]. Circulation, 2010, 121: 2645–2653. DOI:10.1161/CIRCULATIONAHA.109.899211 |
| [5] | PARK D W, PARK S J. Percutaneous coronary intervention of left main disease: pre- and Post-EXCEL (evaluation of XIENCE everolimus eluting stent versus coronary artery bypass surgery for effectiveness of left main revascularization) and NOBLE (Nordic-Baltic-British left main revascularization study) era[J]. Circ Cardiovasc Interv, 2017, 10(6): pii: e004792. DOI:10.1161/CIRCINTERVENTIONS.117.004792 |
| [6] | RÄBER L, MAGRO M, STEFANINI G G, et al. Very late coronary stent thrombosis of a newer-generation everolimus-eluting stent compared with early-generation drug-eluting stents: a prospective cohort study[J]. Circulation, 2012, 125(9): 1110–1121. DOI:10.1161/CIRCULATIONAHA.111.058560 |
| [7] | DE LUCA G, DIRKSEN M T, SPAULDING C, et al. Drug-eluting vs bare-metal stents in primary angioplasty: a pooled patient-level meta-analysis of randomized trials[J]. Arch Intern Med, 2012, 172(8): 611–621. DOI:10.1001/archinternmed.2012.758 |
| [8] | LAGERQVIST B, JAMES S K, STENESTRAND U, et al. Long-term outcomes with drug-eluting stents versus bare-metal stents in Sweden[J]. N Engl J Med, 2007, 356(10): 1009–1019. DOI:10.1056/NEJMoa067722 |
| [9] | STEFANINI G G, BYRNE R A, SERRUYS P W, et al. Biodegradable polymer drug-eluting stents reduce the risk of stent thrombosis at 4 years in patients undergoing percutaneous coronary intervention: a pooled analysis of individual patient data from the ISAR-TEST 3, ISAR-TEST 4, and LEADERS randomized trials[J]. Eur Heart J, 2012, 33(10): 1214–1222. DOI:10.1093/eurheartj/ehs086 |
| [10] | WANG Y, LIU S, LUO Y, et al. Safety and efficacy of degradable vs. permanent polymer drug-eluting stents: a meta-analysis of 18, 395 patients from randomized trials[J]. Int J Cardiol, 2014, 173(1): 100–109. DOI:10.1016/j.ijcard.2014.02.023 |
| [11] | PEDERSEN S H, PFISTERER M, KAISER C, et al. Drug-eluting stents and bare metal stents in patients with NSTE-ACS: 2-year outcome from the randomised BASKET-PROVE trial[J]. EuroIntervention, 2014, 10(1): 58–64. DOI:10.4244/EIJV10I1A11 |
| [12] | MA Q, ZHOU Y, NIE X, et al. Rapamycin affects tissue plasminogen activator and plasminogen activator inhibitor Ⅰ expression: a potential prothrombotic mechanism of drug-eluting stents[J]. Angiology, 2012, 63(5): 330–335. DOI:10.1177/0003319711418219 |
| [13] | GUAGLIUMI G, SIRBU V, MUSUMECI G, et al. Examination of the in vivo mechanisms of late drug-eluting stent thrombosis: findings from optical coherence tomography and intravascular ultrasound imaging[J]. JACC Cardiovasc Interv, 2012, 5(1): 12–20. DOI:10.1016/j.jcin.2011.09.018 |
| [14] | NAKAZAWA G, FINN A V, VORPAHL M, et al. Coronary responses and differential mechanisms of late stent thrombosis attributed to first-generation sirolimus- and paclitaxel-eluting stents[J]. J Am Coll Cardiol, 2011, 57(4): 390–398. DOI:10.1016/j.jacc.2010.05.066 |
| [15] | JONER M, FINN A V, FARB A, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk[J]. J Am Coll Cardiol, 2006, 48(1): 193–202. DOI:10.1016/j.jacc.2006.03.042 |
| [16] | ABIZAID A, COSTA J R Jr. New drug-eluting stents: an overview on biodegradable and polymer-free next-generation stent systems[J]. Circ Cardiovasc Interv, 2010, 3(4): 384–393. DOI:10.1161/CIRCINTERVENTIONS.109.891192 |
| [17] | ELLIS S G, COLOMBO A, GRUBE E, et al. Incidence, timing, and correlates of stent thrombosis with the polymeric paclitaxel drug-eluting stent: a TAXUS Ⅱ, Ⅳ, Ⅴ, and Ⅵ meta-analysis of 3, 445 patients followed for up to 3 years[J]. J Am Coll Cardiol, 2007, 49(10): 1043–1051. DOI:10.1016/j.jacc.2007.01.015 |
| [18] | DANZI G B, PICCOLO R, CHEVALIER B, et al. Five-year clinical performance of a biodegradable polymer-coated biolimus-eluting stent in unselected patients[J]. Heart, 2017, 103(2): 111–116. DOI:10.1136/heartjnl-2016-309283 |
| [19] | BAQUET M, JOCHHEIM D, MEHILLI J. Polymer-free drug-eluting stents for coronary artery disease[J]. J Interv Cardiol, 2018, 31(3): 330–337. DOI:10.1111/joic.12499 |
| [20] | LEE P H, KWON O, AHN J M, et al. Safety and effectiveness of Second-Generation Drug-Eluting stents in patients with left main coronary artery disease[J]. J Am Coll Cardiol, 2018, 71(8): 832–841. DOI:10.1016/j.jacc.2017.12.032 |



