肿瘤肝转移是结直肠癌患者的主要死亡原因之一。研究报道,50%左右的结直肠癌患者就诊时或之后出现肝转移[1],不接受任何治疗的肝转移患者的中位生存期为4~21个月,有10%~20%的患者可能获得手术完整切除的机会,而获得手术完整切除的这部分患者的中位生存时间可达到28~46个月,5年的生存率可达34%~58%,表明手术彻底切除在晚期结直肠癌治疗中起着重要的作用[2-4]。而对于结直肠癌肝转移患者能否行手术完整切除,能否有机会通过手术切除实现无瘤状态(no evidence of disease,NED),达到生存获益,需要多学科团队(multidisciplinary team,MDT)进行充分评估讨论后才能确定综合治疗方案。本文即介绍1例结肠癌肝转移患者在整个治疗过程中,通过MDT诊疗模式,为患者制定个体化治疗方案,从而使患者最终达到NED,实现生存获益。提示MDT在转移性结直肠癌的诊疗中起着积极的作用。
1 初诊情况患者女性,49岁,因“外院诊断乙状结肠癌肝转移5个月,化疗后1个月”于2016年10月入陆军军医大学第一附属医院普外科。入院前6个月患者无明显诱因出现排便困难,无便血。入院前5个月在外院行肠镜结果:乙状结肠腺癌(未行基因检测),行增强CT检查提示肝脏多发转移病灶,最大直径7 cm,在外院行CapeOX方案化疗4周期。家族史:否认家族肿瘤病史。入院时体格检查:PS:0分,NRS:0分。无贫血貌,浅表淋巴结(-)。腹软,全腹无压痛、反跳痛,未触及包块,肝脾肋下未触及。心、肺、神经系统查体无异常。肛门指诊触及直肠黏膜光滑,未触及肿块及结节。辅助检查:Hb 99 g/L,肝肾功能正常。肿瘤标志物:CEA 0.65 ng/mL,AFP 7.88 ng/mL。电子结肠镜结果:结肠距肛门20 cm见环周黏膜增厚,表面充血不平,局部溃烂,镜身无法通过(图 1)。病理诊断:(乙状结肠)腺癌。PET/CT检查结果:①乙状结肠壁局部增厚,FDG摄取增高,符合乙状结肠癌表现;②肝脏密度尚均匀,肝内FDG摄取欠均匀,必要时进一步检查除外转移。诊断yT4aN0Mx(图 2)。肝脏钆塞酸二钠(Gd-EOB-DTPA)增强磁共振(MRI)扫描提示:肝Ⅰ段(1.5 cm)、Ⅲ段(0.9 cm)、Ⅳa段(1.7 cm)、Ⅴ段(0.7 cm)、Ⅷ段(1.5 cm)转移癌(图 3)。
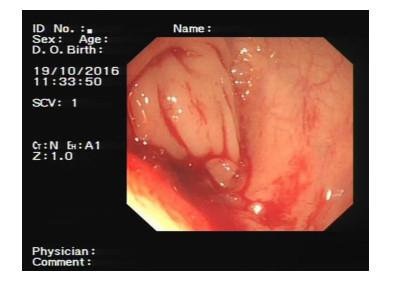
|
| 图 1 患者电子结肠镜检查结果 |
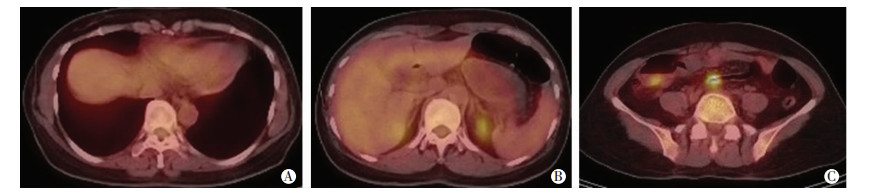
|
| A:肝脏;B:肝内FDG摄取欠均匀;C:乙状结肠局部FDG摄取增高 图 2 患者全身PET/CT检查结果(yT4aN0Mx) |
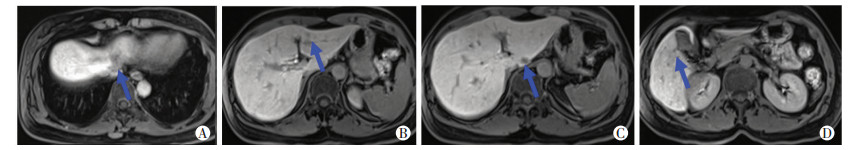
|
| A:肝Ⅳa段肝胆期;B:肝Ⅲ段肝胆期;C:肝Ⅰ段肝胆期;D:肝Ⅴ段肝胆期 图 3 患者肝脏Gd-EOB-DTPA增强MRI扫描结果 |
2 诊疗经过 2.1 第一次MDT讨论及治疗情况 2.1.1 第一次MDT讨论
2016年10月18日行第一次MDT讨论,重点评估经院外化疗后患者目前分期情况,以及普外科评估乙状结肠原发病灶能否行R0切除,肝胆外科评估肝脏转移病灶能否行R0切除,以确定患者能否达到原发及转移病灶的R0切除,得到根治治疗,实现NED,以使患者能够最大程度生存获益,同时确定后续治疗方案。
蔡萍主任医师(放射科):该患者确诊乙状结肠癌同时性肝转移,在院外行新辅助化疗后本院18F-FDG PET/CT检查,全身其他部位未见FDG摄取增高,可以排除肝外的其他转移。乙状结肠癌灶FDG摄取增高,提示肿瘤活性存在。原肝脏转移病灶FDG摄取不高的原因可能有:①肝转移病灶经新辅助化疗后肿瘤活性丧失,达到cCR状态;②转移病灶太小,对于≤1 cm的转移病灶,PET/CT检出的敏感性由78%~95%下降到36%[5];③病灶内有坏死或含黏液成分,出现PET/CT假阴性结果。肝脏Gd-EOB-DTPA增强MRI对肝转移病灶的检出率高于PET/CT(85% vs 64%),尤其是≤1 cm的小病灶。DWI结合EOB-MRI敏感性高达95.5%,高B值DWI信号越低,ADC值越大,信号越高,肿瘤退缩越好,肿瘤活性越低[6]。与外院初始影像检查比较,所有病灶均明显缩小,<2.0 cm,肝Ⅰ段和Ⅳa段病灶弥散受限,ADC呈低信号,提示存在肿瘤活性,为cPR状态;肝Ⅲ、Ⅴ、Ⅷ段病灶弥散不受限,ADC图呈等、高信号提示肿瘤退缩好,几乎达cCR,但影像上所见的cCR并不能与病理上的CR画等号。所以目前患者新辅助化疗后再分期:cyT4aN0M1a。
许森林副教授(病理科):患者既往外院曾行肠镜活检诊断乙状结肠腺癌,本次入我院行肠镜活检,病理仍然诊断乙状结肠腺癌明确,但因肠镜活检所取组织标本较少,无法行基因检测。若能行手术治疗,术后手术标本可进一步行基因检测。若不能行手术,可再次取肠镜标本或行血液基因检测。
唐波副教授(普外科):患者影像学及病理活检明确诊断乙状结肠癌同时性肝转移,本次入院影像学评估周围组织无明显粘连,未见区域淋巴结肿大,乙状结肠病灶可行完整切除。若肝胆外科评估肝脏病灶能R0切除,可行肠道原发肿瘤切除手术。若肝脏病灶无法切除,患者目前无肠梗阻、出血、穿孔等急性症状,乙状结肠病灶则考虑暂不行手术处理,建议继续行化疗。
王小军副教授(肝胆外科):患者诊断乙状结肠癌肝转移明确,肝脏病灶多发,已行4周期化疗,本次入院评估肝脏病灶较前明显缩小,共有5枚,据肿瘤大小及所在部位,残余肝体积>70%,可行肝脏转移肿瘤切除手术。本次评估患者个别病灶较小,若手术切除可能会存在术中遗留的风险,但若继续化疗,则可能病灶消失。需要向患者及家属交代及充分沟通是否同意行手术治疗。
潘凤副主任医师(肿瘤科/放疗科):患者目前乙状结肠癌同时性肝转移诊断明确,已行4周期CapeOX方案化疗,本次入院评估肝脏病灶较前明显缩小,化疗有效。若患者能行肠道原发肿瘤及肝脏转移肿瘤R0切除,患者可能达到NED,实现转化治疗。术后组织标本行基因检测以评估预后及指导后续治疗,术后可按原方案行辅助化疗。
李建军副教授(肿瘤科/放疗科)总结:患者乙状结肠癌同时性肝转移诊断明确,行4周期化疗后肝脏病灶较前缩小,目前临床分期cT4N0M1a。虽目前分期较晚,但结肠癌肝转移患者若能获得手术完整切除的机会,五年生存率和中位生存时间均可得到明显提高[7]。因此,要通过多学科协作配合尽量给患者争取行R0手术切除及达到NED机会。经多学科团队讨论后,患者乙状结肠原发病灶及肝脏转移病灶均可切除,患者可达到NED,因此下一步治疗方案确定为行乙状结肠原发病灶切除手术,肝脏转移病灶切除手术。但患者肝脏复发风险CRS评分3分,具有较高复发风险因素,需与患者及家属充分沟通。术后继续行辅助化疗。
2.1.2 治疗情况经普外科及肝胆外科充分评估患者全身情况及与患者及家属充分沟通后,确定可同时行乙状结肠原发病灶及肝脏转移病灶切除手术。于2016年10月27日行腹腔镜探查术,术中肝脏尾叶见直径约1.7 cm转移病灶,Ⅳa段可见直径约1.5 cm转移病灶;超声反复探查余肝段内未再见任何病灶。腹腔镜术中因未发现所有影像学中所见病灶,与患者家属沟通建议转行开腹手术,但患者家属坚决拒绝。遂行肝尾叶+Ⅳa段肿瘤切除术。其后行乙状结肠癌切除+Ⅰ期吻合术。术后病理结果:中分化腺癌,Ki67 30%,浸润深度:浆膜层,淋巴结:12枚淋巴结呈慢性炎症,近远切缘:(-),神经、脉管侵犯:无,送检肝脏肿瘤亦见上述癌组织,MMR结果:MLH1(+),MSH2(+),MSH6(+),PMS2(+),TRG 2级。基因检测结果:K-Ras、CDKN2A突变,N-Ras、BRAF、PIK13野生。
因患者肝脏病灶未达到R0切除,肝脏仍有残留病灶,行基因检测KRAS突变,依据NCCN指南(Version 2.2016)推荐[8],术后采用CapeOX+贝伐单抗化疗6周期,2017年6月复查MRI肝Ⅷ段病灶缩小至1.1 cm,肝Ⅴ段病灶缩小至0.5 cm,肝Ⅲ段病灶缩小至0.4 cm,肠道原发病灶未见复发。其余部位脏器无新增病灶(图 4)。
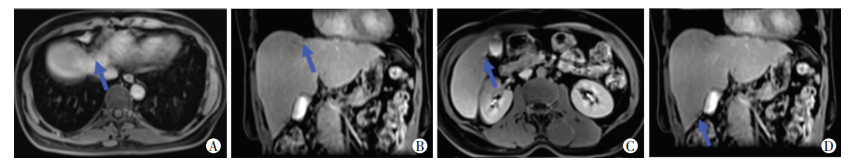
|
| A:肝Ⅷ段肝胆期;B:肝Ⅷ段肝胆期冠状位;C:肝Ⅴ段肝胆期;D:肝Ⅴ段肝胆期冠状位 图 4 2017年6月患者复查肝脏Gd-EOB-DTPA增强MRI扫描结果 |
2.2 第二次MDT讨论及治疗情况 2.2.1 第二次MDT讨论
2017年6月27日行第二次MDT讨论,因第一次MDT讨论后患者同时行乙状结肠原发病灶及肝脏转移病灶切除手术,但术中肝脏转移病灶未达到R0切除,本次讨论的重点在于评估手术及化疗后患者目前肝脏转移病灶情况,肝胆外科评估是否能行再次手术切除或局部治疗,以确定患者有无获得根治治疗、实现NED机会及确定后续治疗方案。
蔡萍主任医师(放射科):患者乙状结肠癌同时肝转移癌切除术后化疗后,肝脏Gd-EOB-DTPA增强MRI显示术中未见的肝Ⅲ、Ⅴ、Ⅷ段病灶无明显强化,弥散不受限,ADC图呈等信号,肝胆期呈稍低信号,对比剂摄取无明显缺损,提示肿瘤无活性,但影像上所见的cCR并不能与病理上的CR画等号。
王小军副教授(肝胆外科):患者肝脏转移病灶未达到R0切除,经化疗+贝伐单抗治疗后,肝脏病灶较前继续缩小。目前肝脏三枚转移病灶小,超声及手术中均无法明确定位病灶,因此手术切除及射频消融无法进行,目前全身治疗有效,建议继续行全身治疗。
唐波副教授(普外科):患者肠道病灶已切除,行化疗+贝伐单抗治疗后,本次评估原发病灶无复发,肝脏病灶较前继续缩小,同意肝胆外科意见,继续行全身治疗。
潘凤副主任医师(肿瘤科/放疗科):患者经化疗+贝伐单抗治疗后,肝脏病灶较前缩小,肝胆外科评估无手术指征,后续可行卡培他滨单药联合贝伐单抗行维持治疗。
李建军副教授(肿瘤科/放疗科)总结:患者诊断乙状结肠癌肝转移明确,已行肠道原发肿瘤切除,肝脏转移病灶未达到R0切除,目前经化疗+贝伐单抗治疗后肝脏转移病灶明显缩小,经多学科团队讨论后,肝脏病灶无法行局部处理,后续行卡培他滨+贝伐单抗维持治疗。
2.2.2 治疗情况因患者不愿继续行静脉用药,后续行单药卡培他滨口服维持治疗(1次1 250 mg/m2,2次/d),第1~14天,21 d为1个周期,治疗3个周期。2017年9月复查MRI增强肝Ⅷ段病灶缩小至0.5 cm,肝V段病灶缩小至0.3 cm,肝Ⅲ段未见明显病灶。肠道原发病灶无复发,余未见新增病灶。(图 5)。
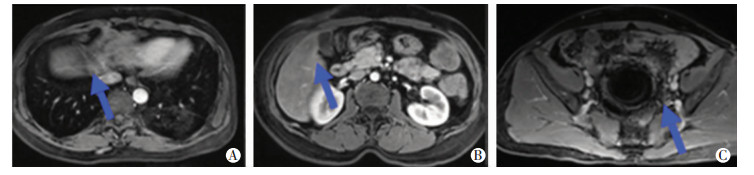
|
| A:肝Ⅷ段延时期;B:肝Ⅴ段延时期;C:盆腔吻合口层面增强 图 5 2017年9月患者复查肝脏MRI增强及盆腔MRI增强扫描结果 |
2.3 第三次MDT讨论及治疗情况 2.3.1 第三次MDT讨论
2017年9月26日行第三次MDT讨论,本次重点在于评估继续行化疗后肝脏转移病灶情况,肝胆外科评估能否行再次手术切除或局部治疗,以确定患者有无实现NED机会及确定后续治疗方案。
蔡萍主任医师(放射科):综合评估患者术前及术后经治疗后肝脏增强MRI情况(图 5、图 6),患者肝内病灶缩小无肿瘤活性,局部无复发,持续监测胸部及全腹部CT增强也未发现新病灶,目前患者的影像评估为cCR状态。
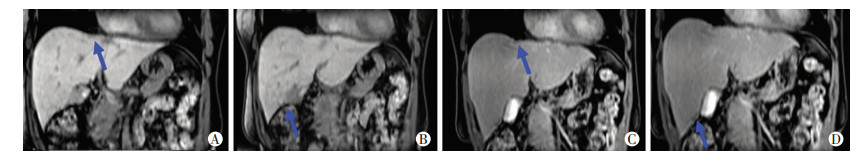
|
| A:术前肝Ⅷ段肝胆期冠状位(1.5 cm);B:术前肝Ⅴ段肝胆期冠状位(0.7 cm);C:术后8个月肝Ⅷ段肝胆期冠状位(1.1 cm);D:术后8个月肝Ⅴ段肝胆期冠状位(0.5 cm) 图 6 患者术前及术后经治疗后肝脏Gd-EOB-DTPA增强MRI扫描结果 |
王小军副教授(肝胆外科):患者经卡培他滨维持治疗后,目前复查肝脏转移病灶继续缩小,射频消融及手术均无法明确定位,且影像学评估达NED状态,建议继续行维持治疗。
唐波副教授(普外科):患者目前评估肝脏病灶继续缩小,影像学评估达NED状态,同意继续行卡培他滨维持治疗。
潘凤副主任医师(肿瘤科/放疗科):患者单药卡培他滨维持治疗后,本次复查肝脏转移病灶较前继续缩小,治疗有效。影像学评估可能达到NED状态。对于接受了转移灶和原发灶切除的实现了NED的结直肠癌肝转移患者,中位总生存期及5年的总生存率均远远优于单纯的姑息治疗[9]。通过前期多学科协作综合治疗手段,患者达到NED可能,已获得生存获益,可继续行卡培他滨维持治疗。
李建军副教授(肿瘤科/放疗科)总结:患者虽未联合贝伐单抗行维持治疗,但单药卡培他滨治疗肝脏转移灶继续减小,治疗有效,且患者未出现明显不能耐受副反应。经多学科团队讨论后,患者无复发及新增转移病灶,肝脏病灶无局部治疗指征,且影像学评估可能达NED状态,建议患者继续当前卡培他滨维持治疗。
2.3.2 治疗情况患者不愿意继续行卡培他滨维持治疗,遂停药未继续行维持治疗。2018年3月复查肝脏未见明显病灶,原发病灶无复发,余未见新增病灶(图 7)。
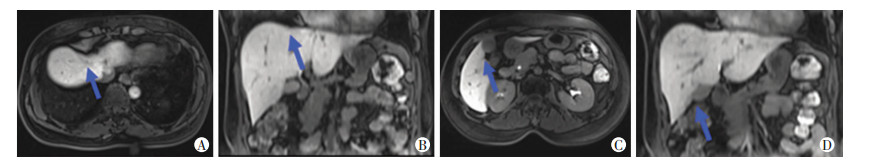
|
| A:肝Ⅷ段肝胆期;B:肝Ⅷ段肝胆期冠状位;C:肝Ⅴ段肝胆期;D:肝Ⅴ段肝胆期冠状位 图 7 2018年3月患者复查肝脏Gd-EOB-DTPA增强MRI扫描结果 |
2.4 后续随访情况
患者为外地患者,2018年3月来我院复查后未再到我院复查,2018年10月电话随访患者,自诉于2018年7月曾在当地医院复查提示无明确病情进展(具体情况不详)。患者随访时自诉无明显新增及不适症状。
3 讨论结直肠癌在诊断原发癌同时,20%~25%的患者发生肝转移,50%的患者在后期发生肝转移[10]。不接受任何治疗的肝转移患者的中位生存期不到12个月,5年生存率不到10%[11]。有10%~20%的患者可获得手术R0切除的机会,这部分患者的5年生存率可达45%,中位生存时间可以达52个月。对于接受了转移灶和原发灶切除的实现了NED的结直肠癌肝转移患者,中位总生存期及5年的总生存率均远远优于单纯的姑息治疗[9, 12-13]。
MDT指两个以上不同学科的一组相对固定的专家,在固定的时间、固定的地点聚在一起,针对患者某器官或系统疾病进行讨论,形成该患者的诊断、治疗决策,并由相应学科的MDT成员去执行治疗[14]。通过多学科协作,可以为患者找到最适合病情、多手段相结合、科学合理的诊疗方案,确保结直肠癌患者获得最佳治疗。MDT诊疗模式有利于在规范化治疗的基础上实现精准个体化治疗,提高结直肠癌患者的治愈率,延长晚期患者生存期和改善生存质量。
本例患者初诊时即在外院诊断结肠癌肝转移,因肝脏转移病灶大且数量多,分期晚,评估无手术指征,到我院就诊时已在外院行4周期化疗。为确定患者经化疗后是否达到转化治疗的目的,我们进行了第一次MDT讨论,经评估讨论后确定患者经转化治疗后肠道原发病灶及肝脏转移病灶均有R0切除可能,因此确定治疗目标为NED,可行同时性乙状结肠原发病灶及肝脏转移病灶切除手术。但在腹腔镜手术过程中出现了无法找到所有肝脏病灶的情况,即应转行开腹手术,以尽可能切除所有病灶达到R0切除,实现NED。遗憾的是经与家属沟通后家属不同意行开腹手术,使患者在手术过程中失去了肝脏病灶可能实现R0切除的机会。虽然经MDT团队的多次讨论合作配合,制定个体化治疗方案,患者最终达到NED状态,实现生存获益。但这仅是个特例,若后续化疗患者敏感度不佳,则可能无法实现NED,甚至出现疾病进展。目前,在国外的大型医院和肿瘤治疗中心,MDT已经成为疾病治疗的重要模式,我国也制定了相应的《结肠癌多学科综合治疗协作组诊疗模式专家共识》[15],最新版《中国结直肠癌肝转移诊断和综合治疗指南》也明确推荐结直肠癌肝转移的患者进入MDT治疗模式[16]。而在各种指南中都明确提出,在确定患者可能达到NED状态的情况下,需要综合运用各种方式手段尽量让患者能达到NED从而实现生存获益。这个病例提示,在MDT模式下,需要针对不同患者的具体情况,充分考虑到各种可能出现的意外状况,应用MDT模式给患者制定详细精密规范的个体化治疗方案。同时,在确定治疗方案后以及在整个治疗过程中需要对患者进行全程管理,需要和患者及家属做到充分有效的沟通。
| [1] | BABA K, OSHITA A, KOHYAMA M, et al. Successful treatment of conversion chemotherapy for initially unresectable synchronous colorectal liver metastasis[J]. World J Gastroenterol, 2015, 21(6): 1982–1988. DOI:10.3748/wjg.v21.i6.1982 |
| [2] | NEEFF HP, DROGNITZ O, HOLZNER P, et al. Outcome after repeat resection of liver metastases from colorectal cancer[J]. Int J Colorectal Dis, 2013, 28(8): 1135–1141. DOI:10.1007/s00384-013-1670-4 |
| [3] | CHAN K M, WU T H, CHENG C H, et al. Prognostic significance of the number of tumors and aggressive surgical approach in colorectal cancer hepatic metastasis[J]. World J Surg Oncol, 2014, 12(1): 155. DOI:10.1186/1477-7819-12-155 |
| [4] | PALKOVICS A, VERECAKEI A, KALMAR K N, et al. The issue of survival after colorectal liver metastasis surgery: parenchyma sparing vs. radicality[J]. Anticancer Res, 2018, 38(11): 6431–6438. DOI:10.21873/anticanres.13004 |
| [5] | DONATI O F, HANY T F, REINER C S, et al. Value of retrospective fusion of PET and MR images in detection of hepatic metastases: comparison with 18F-FDG PET/CT and Gd-EOB-DTPA-enhanced MRI[J]. J Nucl Med, 2010, 51(5): 692–699. DOI:10.2967/jnumed.109.068510 |
| [6] | DONATI F, BORASCHI P, PACCIARDI F, et al. 3T diffusion-weighted MRI in the response assessment of colorectal liver metastases after chemotherapy: Correlation between ADC value and histological tumour regression grading[J]. Eur J Radiol, 2017, 91: 57–65. DOI:10.1016/j.ejrad.2017.03.020 |
| [7] | AL BANDAR M H, KIM N K. Current status and future perspectives on treatment of liver metastasis in colorectal cancer (review)[J]. Oncol Rep, 2017, 37(5): 2553–2564. DOI:10.3892/or.2017.5531 |
| [8] | National Comprehensive Cancer Network. The NCCN colon cancer clinical practice guidelines in oncology(Version2.2016)[EB/OL]. |
| [9] | TAN H L, LEE M, VELLAYAPPAN B A, et al. The role of liver-directed therapy in metastatic colorectal cancer[J]. Curr Colorectal Cancer rep, 2018, 14(5): 129–137. DOI:10.1007/s11888-018-0409-6 |
| [10] | LEONARD G D, BRENNER B, KEMENY N E. Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma[J]. J Clin Oncol, 2005, 23(9): 2038–2048. DOI:10.1200/JCO.2005.00.349 |
| [11] | MOHAMMAD WM, BALAA FK. Surgical management of colorectal liver metastases[J]. Clin Colon Rectal Surg, 2009, 22(4): 225–232. DOI:10.1055/s-0029-1242462 |
| [12] | NATHAN H, DE JONG M C, PULITANO C, et al. Conditional survival after surgical resection of colorectal liver metastasis: an international multi-institution alanalysis of 949 patients[J]. J Am Coll Surg, 2010, 210(5): 755–766. DOI:10.1016/j.jamcollsurg.2009.12.041 |
| [13] | CHAKEDIS J, SCHMIDT C R. Surgical treatment of metastatic colorectal cancer[J]. Surg Oncol Clin N Am, 2018, 27(2): 377–399. DOI:10.1016/j.soc.2017.11.010 |
| [14] | FLEISSIG A, JENKINS V, CATT S, et al. Multidisciplinary teams in cancer care: are they effective in the UK?[J]. Lancet Oncol, 2006, 7(11): 935–943. DOI:10.1016/S1470-2045(06)70940-8 |
| [15] |
张忠涛, 蔡军. 结肠癌多学科综合治疗协作组诊疗模式专家共识[J].
中国实用外科杂志, 2017, 37(1): 44–45.
ZHANG Z T, CAI J. Expert consensus on diagnosis and treatment model for multidisplinary comprehensive treatment of colon cancer[J]. Chin J Practical Surg, 2017, 37(1): 44–45. DOI:10.19538/j.cjps.issn1005-2208.2017.01.15 |
| [16] |
中华医学会外科分会胃肠外科学组, 中华医学会外科分会结直肠外科学组, 中国抗癌协会大肠癌专业委员会, 等. 中国结直肠癌肝转移诊断和综合治疗指南(V 2018)[J].
中华结直肠疾病电子杂志, 2018, 7(4): 302–314.
Department of Gastroenterology, Chinese Medical Association Colorectal Surgery, Chinese Cancer Society, Special Committee of Chinese Cancer Society. Chinese guideline for the diagnosis and comprehensive treatment of colorectal cancer liver metastasis (2018 Edition)[J]. Chin J Colorectal Dis (Electr Ed), 2018, 7(4): 302–314. DOI:10.3877/cma.j.issn.2095-3224.2018.04.001 |



