胆汁淤积(cholestasis)是一种由不同原因导致的胆汁酸不能从肝脏正常排出,进而导致肝内胆汁酸水平升高的消化系统疾病。病变早期,肝脏会产生减少胆汁酸的摄取、降低肝内胆汁酸的合成、增高解毒酶的活性及促进肝内胆汁酸的排泌等一系列适应性变化,从而起到保护肝脏的作用[1-4]。超出代偿范围,可造成肝损伤、肝纤维化以及肝硬化,严重威胁患者的健康。
OATP3A1是一种肝细胞基底外侧膜转运蛋白,在正常肝细胞中表达较低,对转运胆汁酸、胆红素及激素结合物等多种内源性物质起到重要作用。研究表明,OATP3A1在胆汁淤积组织和大鼠中明显升高,可促进胆汁酸的外排,从而保护肝脏[5]。微小RNA(miRNA)是一种小的非编码RNA,主要通过与下游靶基因结合位点结合并降解靶基因,从而调节基因表达。miRNA参与胆汁淤积性肝病的某些病理过程和胆汁酸稳态[6-9],如酒精性肝炎、原发性胆汁性肝硬化及原发性硬化性胆管炎等[9-10]。miR-200家族主要包括miR-200a, miR-200b, miR-200c, miR-429和miR-141,miR-200b是一种前体miRNA,在细胞中被酶分解为成熟的miRNA,即miR-200b-3p和miR-200b-5p,进而调节下游靶基因的表达[11-12]。
研究表明,miR-200b与肝脏胆汁淤积密切相关。例如,miR-200b可影响肝纤维化的发生和进展[13];miR-200b可以通过PI3K/Akt信号通路促进胆汁淤积下肝细胞增殖和迁移[14];miR-200b可促进胆管细胞增殖[15]。本研究前期结果发现miR-200b-3p在阻塞性胆汁淤积患者中表达明显升高,目前尚没有对miR-200b-3p与肝细胞膜转运蛋白的相关研究。因此,本研究探讨阻塞性胆汁淤积中miR-200b-3p与OATP3A1的表达及其意义。
1 材料与方法 1.1 组织样本收集我院2012年1月至2016年6月期间在肝胆外科行肝脏手术的患者30例,其中胆汁淤积组20例,对照组10例。胆汁淤积组中胰头癌13例,十二指肠乳头状癌3例,肝内胆管结石2例,胆管癌侵犯胰腺1例及胆囊癌1例;对照组为因肝转移癌或结石而行肝脏手术的无阻塞性黄疸患者,其中肝转移癌6例,胰腺结石2例及胰管结石2例。胆汁淤积患者纳入标准[16]:①患者有典型症状,包括瘙痒、黄疸、尿色暗等;②ALP水平高于正常上限值1.5倍,GGT水平高于正常上限值3.0倍;③年龄30~70岁;④患者均签订书面知情同意书。排除标准:①患有肝脏疾病,例如自身免疫性肝病、病毒性肝炎、肝癌等;②患有其他严重肝外疾病,例如心力衰竭、肾功能衰竭等;③孕妇或哺乳期妇女。本研究通过本院伦理委员会的批准(2012)。获得肝样品并立即切成小块,储存在液氮中直至使用。两组患者年龄、性别等一般资料差异无统计学意义(P>0.05);胆汁淤积组AST、ALT、ALP、GGT、TBIL、DBIL、IBIL及TBA等肝功能明显高于对照组(P < 0.01,表 1)。
| 组别 | n | 年龄/岁 | 男/女(例) | ALT/IU·L-1 | AST/IU·L-1 | ALP/IU·L-1 | GGT/IU·L-1 | TBIL/μmol·L-1 | DBIL/μmol·L-1 | IBIL/μmol·L-1 | TBA/μmol·L-1 |
| 胆汁淤积组 | 20 | 54.13±5.59 | 13/7 | 190.93±36.50 | 145.03±19.98 | 689.82±130.09 | 821.04±165.86 | 208.91±25.59 | 103.32±13.92 | 89.47±13.24 | 104.07±21.66 |
| 对照组 | 10 | 52.30±3.53 | 6/4 | 19.65±2.63 | 20.41±1.22 | 88.20±6.05 | 25.00±4.36 | 13.82±1.88 | 2.97±0.51 | 10.85±1.42 | 6.68±1.29 |
| χ2/t值 | 0.941 | 0.072 | 3.282 | 4.389 | 3.241 | 3.362 | 5.34 | 5.051 | 4.155 | 3.163 | |
| P值 | 0.355 | 0.789 | 0.003 | < 0.001 | 0.003 | 0.002 | < 0.001 | < 0.001 | < 0.001 | 0.004 | |
| ALT:谷丙转氨酶;AST:谷草转氨酶;ALP:碱性磷酸酶;GGT:谷氨酰转肽酶;TBIL:总胆红素;DBIL:直接胆红素;IBIL:间接胆红素;TBA:总胆汁酸 | |||||||||||
1.2 实验方法 1.2.1 细胞培养、转染及炎症因子处理
HepG2细胞来源于肝母细胞瘤,是一种低分化的肿瘤,适用于肝细胞糖脂及胆汁酸代谢方面的研究,且富集性较好,是研究胆汁淤积最常用的细胞。PLC5也是早期建立的细胞系,与HepG2有较多共同特点。故本研究选用该两种细胞进行胆汁淤积的机制研究。HepG2、PLC5细胞系均获自美国菌种保藏中心(American Type Culture Collection,ATCC,美国马里兰州洛克菲勒),细胞在含有10%胎牛血清(Gibco,美国纽约州格兰德岛)的DMEM培养基(Gibco,美国马里兰州洛克维尔)中培养,置于37 ℃,5%CO2的培养箱中。细胞铺于6孔板,数量达到60%以上后,分别将miRNA mimic NC、miR-200b-3p mimic、miRNA inhibitor NC、miR-200b-3p inhibitor与无血清培养基、X-tremeGENE转染试剂(美国Roche公司)孵育20~30 min后,加入6孔板对应孔中,培养24 h后提取总RNA和蛋白。采用50 ng/mL的FGF19、IL-1β、IL-8、IP-10、TNF-α、HGF、TWEAK等因子处理HepG2细胞12 h;然后采用0、5、25、50 ng/mL的FGF19处理HepG2细胞12 h,最后采用50 ng/mL FGF19分别处理0、1、3、6、12和24 h。培养结束后,提取总RNA。
1.2.2 提取总RNA及实时荧光聚合酶链式反应(RT-PCR)按照上海普洛麦格生物技术有限公司的Eastep® Super总RNA提取试剂盒提取肝组织样品和细胞的总RNA。将1 μg总RNA按照Prime ScriptTM RT试剂盒(日本,TaKaRa公司)说明书逆转录为cDNA,样品存储于-20 ℃冰箱中。使用SYBR® prepixEx Taq TM Ⅱ试剂盒(日本,TaKaRa公司)检测miR-200b-3p、U6、OATP3A1及GAPDH的mRNA水平。U6引物和miR-200b-3p引物购于广州锐博生物技术有限公司;OATP3A1及GAPDH于北京擎科新业生物技术有限公司合成,OATP3A1上游:5′-TTGTT-GGGCTTCATCCCTCC-3′,下游:5′-TCCCCAGGTTGTCT-AGGGTC-3′;GAPDH上游:5′-GGAGTCCACTGGTG-TCTTCA-3′,下游:5′-GGGAACTGAGCAATTGGTGG-3′。qRT-PCR结果采用2-△△Ct法计算相对表达。
1.2.3 提取总蛋白及蛋白质印迹实验(Western blot)在RIPA裂解缓冲液中加入蛋白酶抑制剂和磷酸酶抑制剂配制蛋白裂解液,然后加入处理完成后的HepG2及PLC5细胞中,刮下6孔板中的细胞,放至4 ℃离心机以12 000 r/min离心10 min提取细胞总蛋白,并测量蛋白浓度,分装后存储于-80 ℃冰箱中。取40 μg总蛋白裂解液加入10% SDS-PAGE凝胶中分别以60 V和100 V电压进行蛋白浓缩和分离,然后以100 V,75 min转至PVDF膜,以10%脱脂奶粉室温封闭2 h后,分别加入一抗OATP3A1(1 :1 000,美国Santa Cruz Biotechnology)和GAPDH(1 :5 000,美国Proteintech), 4 ℃孵育过夜后,加入山羊兔抗(1 :50 000,美国Thermo Fisher Scientific)室温孵育1 h,最后通过ECL检测系统发光暴露于X射线胶片。
1.3 统计学分析通过SPSS 19.0软件和GraphPad Prism 6.0进行统计分析,计量资料均以x±s表示,两组比较采用独立样本t检验;多组比较采用单因素方差分析,并采用SNK法进行多重比较;计数资料采用χ2检验;相关性分析采用Pearson相关性线性分析法。检验水准α=0.05。
2 结果 2.1 肝组织中miR-200b-3p和OATP3A1表达及相关性分析提取两组肝组织的总RNA,逆转录为cDNA后行RT-PCR。结果显示,与对照组比较,胆汁淤积组miR-200b-3p增高1.94倍(t=2.996,P=0.006),OATP3A1升高1.5倍(t=2.399,P=0.023)。对miR-200b-3p与OATP3A1进行相关性分析,探讨两者的关系,结果呈正相关关系(r=0.478,P=0.033)。见图 1。

|
| A:RT-PCR检测两组肝组织miR-200b-3p表达;B:RT-PCR检测两组肝组织OATP3A1表达;C:Pearson相关性分析两者关系;a: P < 0.05,与对照组比较 图 1 肝组织中miR-200b-3p和OATP3A1表达及相关性分析 |
2.2 胆汁淤积患者miR-200b-3p与肝功能相关性分析
为探讨胆汁淤积患者miR-200b-3p与肝功能的关系,将其表达量与肝功能进行Pearson相关性分析。结果发现,miR-200b-3p与GGT和ALP呈明显的正相关关系(P < 0.05),与TBA呈明显负相关关系(P < 0.05);其余肝功能指标无明显相关性(P>0.05)。见图 2。
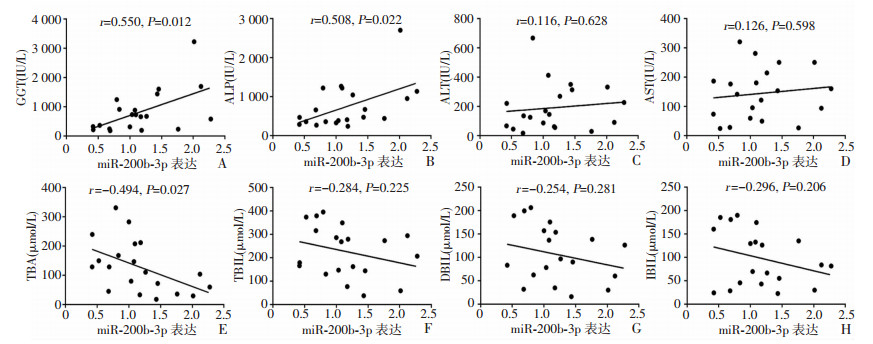
|
| A:GGT;B:ALP;C:ALT;D:AST;E:TBA;F:TBIL;G:DBIL;H:IBIL 图 2 胆汁淤积患者miR-200b-3p与肝功能相关性分析 |
2.3 多种因子处理HepG2细胞后检测miR-200b-3p表达
本研究采用50 ng/mL的FGF19, IL-1β, IL-8, IP-10, TNF-α, HGF, TWEAK等因子处理HepG2细胞12 h。结果发现,FGF19可促进miR-200b-3p升高2.6倍(P < 0.01,图 3A)。进一步探讨FGF19调节miR-200b-3p是否具有时间和量效依赖关系,采用0、5、25、50 ng/mL的FGF19处理HepG2细胞12 h,同时采用50 ng/mL FGF19分别处理0、1、3、6、12和24 h。结果发现:FGF19浓度从0~50 ng/mL逐渐增加,miR-200b-3p表达逐渐升高(P < 0.01);此外,培养时间从0~24 h逐渐延长,miR-200b-3p表达逐渐升高(P < 0.05)。FGF19上调miR-200b-3p呈显著的时间和量效依赖关系(图 3B、C)。
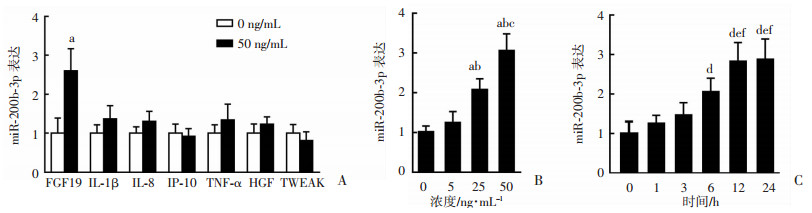
|
| A:多种因子处理HepG2细胞后RT-PCR检测miR-200b-3p表达;B:不同浓度FGF19处理HepG2细胞后RT-PCR检测miR-200b-3p表达;C:50 ng/mL FGF19在不同时间处理HepG2细胞后RT-PCR检测miR-200b-3p表达;a: P < 0.05, 与0 ng/mL FGF19组比较;b: P < 0.05, 与5 ng/mL FGF19比较;c: P < 0.05, 与25 ng/mL FGF19比较;d: P < 0.05, 与50 ng/mL FGF19处理0 h比较;e: P < 0.05, 与50 ng/mL FGF19处理1 h比较;f: P < 0.05, 与50 ng/mL FGF19处理3 h比较 图 3 多种因子处理HepG2细胞后检测miR-200b-3p表达 |
2.4 miR-200b-3p mimic转染后检测miR-200b-3p和OATP3A1表达
为探讨miR-200b-3p调控的基因,将miR-200b-3p mimics转染到HepG2,PLC5细胞后,miR-200b-3p显著升高(P < 0.001,图 4A),转染效率较好。OATP3A1的mRNA水平分别升高2.8倍(P < 0.001)和1.9倍(P < 0.01,图 4B);OATP3A1蛋白水平分别升高2.4倍和2.0倍(P < 0.01,图 4C、D)。
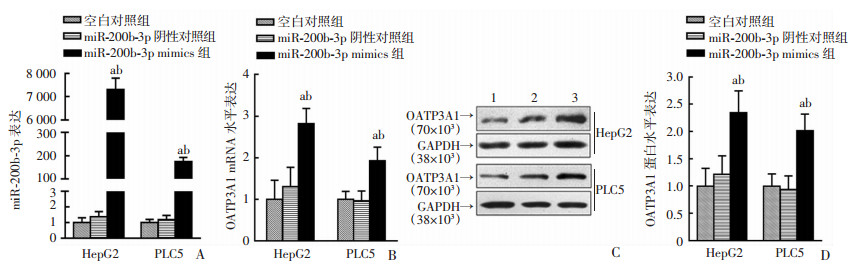
|
| A:RT-PCR检测miR-200b-3p mimics转染后的miR-200b-3p表达;B:RT-PCR检测OATP3A1表达;C、D:Western blot检测OATP3A1和GAPDH的蛋白水平;1:空白对照组;2:miR-200b-3P阴性对照组;3:miR-200b-3P mimics组;a: P < 0.05, 与空白对照组比较;b: P < 0.05, 与miR-200b-3p阴性对照组比较 图 4 miR-200b-3p mimics转染后检测miR-200b-3p和OATP3A1表达 |
2.5 miR-200b-3p inhibitor转染后检测miR-200b-3p和OATP3A1表达
为进一步证明miR-200b-3p影响OATP3A1表达,将miR-200b-3p inhibitor转染到HepG2及PLC5细胞。结果表明,miR-200b-3p均明显降低(P < 0.05,图 5A);OATP3A1的mRNA水平分别降低44.6%和46.8%(P < 0.05,图 5B);OATP3A1的蛋白水平分别降低47.4%和48.7%(P < 0.05,图 5C、D)。
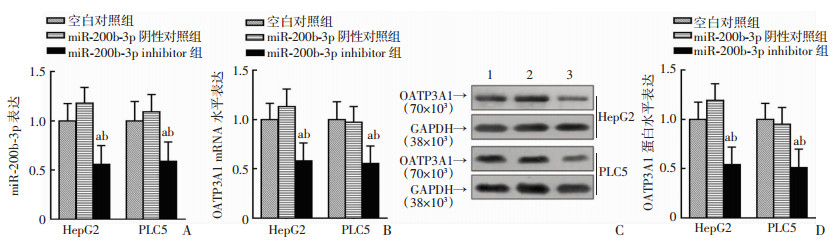
|
| A:RT-PCR检测miR-200b-3p inhibitor转染后miR-200b-3p表达;B:RT-PCR检测OATP3A1表达;C、D:Western blot检测OATP3A1和GAPDH的蛋白水平;1:空白对照组;2:miR-200b-3p阴性对照组;3:miR-200b-3p inhibitor组;a: P < 0.05, 与空白对照组比较;b: P < 0.05, 与miR-200b-3p阴性对照组比较 图 5 miR-200b-3p inhibitor转染后检测miR-200b-3p和OATP3A1表达 |
3 讨论
OATP3A1是一种膜转运蛋白,属于OATP家族,主要介导有机阴离子跨膜转运。近年研究表明,OATP家族在转运多种内源性物质中起到重要作用,比如胆汁酸、胆红素及激素结合物等[5]。研究发现,在人胆汁淤积肝脏中,OATP1B1和OATP1B3显著降低,可以显著减少肝细胞对胆汁酸的摄取,从而保护肝脏[17]。最新研究发现OATP3A1在胆汁淤积中表达升高,可将肝内胆汁酸排出肝细胞,而在OATP3A1基因敲除小鼠中,小鼠肝内的胆汁酸显著升高,这些表明OATP3A1可以通过加速胆汁酸从肝脏流出到血液,从而在胆汁淤积性肝脏中发挥重要的保护作用[5]。XIAO等[13-15]研究发现,miR-200b与肝脏胆汁淤积密切相关,可影响肝纤维化的发生和进展;同时,可以通过PI3K/Akt信号通路促进肝细胞增殖和迁移。miR-200b-3p与膜转运蛋白之间是否存在关系目前尚不清楚,本研究探讨阻塞性胆汁淤积下miR-200b-3p与OATP3A1的表达及两者之间的关系和意义。
本研究收集胆汁淤积患者与对照组患者肝组织对OATP3A1和miR-200b-3p进行检测,发现类似的结果,OATP3A1和miR-200b-3p在胆汁淤积患者中均显著升高。同时,本研究将miR-200b-3p与患者的肝功能进行相关性分析,了解miR-200b-3p对肝功能的影响。结果表明,胆汁淤积患者miR-200b-3p与GGT和ALP呈明显的正相关,与TBA呈明显负相关,与其他肝功能指标无明显相关性。GGT和ALP是诊断胆汁淤积的重要指标,提示胆汁淤积程度越严重,miR-200b-3p的表达量越高;TBA升高是造成胆汁淤积的重要原因,本研究提示miR-200b-3p可能降低肝脏胆汁酸的水平,从而缓解胆汁淤积。同时OATP3A1和miR-200b-3p之间存在正相关关系。因此,我们假设OATP3A1可能受到miR-200b-3p的调控。此外,miR-200b-3p受到何种因子的影响,目前尚不完全清楚。
研究表明,胆汁淤积下FGF19, IL-1β, TNF-α等炎症因子显著升高,在胆汁淤积发生和进展中起到重要作用[4-5, 15, 18]。为探讨上述因子是否引起miR-200b-3p表达的变化,本研究采用50 ng/mL的FGF19, IL-1β, IL-8, IP-10, TNF-α, HGF, TWEAK等因子处理HepG2细胞。结果发现,FGF19可促进miR-200b-3p升高(P < 0.05)。为进一步探讨FGF19调节miR-200b-3p是否具有时间和量效依赖关系,本研究采用不同浓度和不同时间的FGF19处理HepG2细胞。结果发现,FGF19浓度从0~50 ng/mL逐渐增加,miR-200b-3p表达逐渐升高(P < 0.01);此外,培养时间从0~24 h逐渐延长,miR-200b-3p表达逐渐升高(P < 0.05)。上述结果提示:FGF19上调miR-200b-3p呈显著的时间和量效依赖关系,miR-200b-3p可能在其中起到重要的调节作用。
为进一步探讨miR-200b-3p是如何降低胆汁酸水平,本研究采用miR-200b-3p mimic转染后,同时检测了胆汁酸摄取和排泄的一系列基因,研究发现OATP3A1的表达发生了显著的变化。结果发现,OATP3A1的mRNA和蛋白水平显著升高(P < 0.05)。为进一步证明miR-200b-3p影响OATP3A1表达,将miR-200b-3p inhibitor转染入细胞后,OATP3A1的mRNA和蛋白水平显著降低(P < 0.05)。上述结果表明,miR-200b-3p可影响和调控OATP3A1的mRNA和蛋白水平,进而促进胆汁酸的排泄,缓解胆汁淤积,从而起到保护肝脏的作用。上述结果与miR-200b-3p和TBA呈负相关的趋势一致。
本研究发现FGF19可以在胆汁淤积中上调miR-200b-3p的表达,同时miR-200b-3p可进一步促进OATP3A1的增高,该现象可能解释了miR-200b-3p与TBA呈负相关的结果,进而说明其在促进胆汁酸外排、保护肝细胞中可能起到重要作用。本研究对胆汁淤积的发病机制及治疗有重要意义。但miR-200b-3p作用机制是通过与下游靶基因的3’UTR区域结合降解靶基因,从而抑制下游靶基因的表达。而本研究miR-200b-3p升高后导致OATP3A1显著升高,可能原因是miR-200b-3p通过间接调控而影响OATP3A1的表达,其具体机制有待进一步研究。
总之,本研究结果表明,阻塞性胆汁淤积下miR-200b-3p显著升高,可能由FGF19诱导引起,同时miR-200b-3p升高可引起OATP3A1明显升高,通过促进肝脏胆汁酸外排,从而保护肝脏,减轻肝脏损伤,可能为将来临床治疗胆汁淤积提供新的药物靶点。
| [1] | ZHANG A, JIA Y, XU Q, et al. Dioscin protects against ANIT-induced cholestasis via regulating Oatps, Mrp2 and Bsep expression in rats[J]. Toxicol Appl Pharmacol, 2016, 305: 127–135. DOI:10.1016/j.taap.2016.06.019 |
| [2] | JENNISKENS M, LANGOUCHE L, VANWIJNGAERDEN Y M, et al. Cholestatic liver (dys)function during sepsis and other critical illnesses[J]. Intensive Care Med, 2016, 42(1): 16–27. DOI:10.1007/s00134-015-4054-0 |
| [3] | CHAI J, FENG X, ZHANG L, et al. Hepatic expression of detoxification enzymes is decreased in human obstructive cholestasis due to gallstone biliary obstruction[J]. PLoS ONE, 2015, 10(3): e0120055. DOI:10.1371/journal.pone.0120055 |
| [4] | CHAI J, CAI SY, LIU X, et al. Canalicular membrane MRP2/ABCC2 internalization is determined by Ezrin Thr567 phosphorylation in human obstructive cholestasis[J]. J Hepatol, 2015, 63(6): 1440–1448. DOI:10.1016/j.jhep.2015.07.016 |
| [5] | PAN Q, ZHANG X, ZHANG L, et al. Solute carrier organic anion transporter family member 3A1 is a bile acid efflux transporter in cholestasis[J]. Gastroenterology, 2018, 155(5): 1578–1592.e16. DOI:10.1053/j.gastro.2018.07.031 |
| [6] | CASTRO R E, RODRIGUES C M. Cell death and microRNAs in cholestatic liver diseases: Update on potential therapeutic applications[J]. Curr Drug Targets, 2017, 18(8): 921–931. DOI:10.2174/1389450116666151019102358 |
| [7] | KENNEDY L L, MENG F, VENTER J K, et al. Knockout of microRNA-21 reduces biliary hyperplasia and liver fibrosis in cholestatic bile duct ligated mice[J]. Lab Invest, 2016, 96(12): 1256–1267. DOI:10.1038/labinvest.2016.112 |
| [8] | SHEN W J, DONG R, CHEN G, et al. microRNA-222 modulates liver fibrosis in a murine model of biliary atresia[J]. Biochem Biophys Res Commun, 2014, 446(1): 155–159. DOI:10.1016/j.bbrc.2014.02.065 |
| [9] | MARIN J J, BUJANDA L, BANALES J M. MicroRNAs and cholestatic liver diseases[J]. Curr Opin Gastroenterol, 2014, 30(3): 303–309. DOI:10.1097/MOG.0000000000000051 |
| [10] | BERNUZZI F, MARABITA F, LLEO A, et al. Serum microRNAs as novel biomarkers for primary sclerosing cholangitis and cholangiocarcinoma[J]. Clin Exp Immunol, 2016, 185(1): 61–71. DOI:10.1111/cei.12776 |
| [11] | CONRAD T, MARSICO A, GEHRE M, et al. Microprocessor activity controls differential miRNA biogenesis in vivo[J]. Cell Rep, 2014, 9(2): 542–554. DOI:10.1016/j.celrep.2014.09.007 |
| [12] | AUYEUNG V C, ULITSKY I, MCGEARY S E, et al. Beyond secondary structure: primary-sequence determinants license pri-miRNA hairpins for processing[J]. Cell, 2013, 152(4): 844–858. DOI:10.1016/j.cell.2013.01.031 |
| [13] | XIAO Y, ZHOU Y, CHEN Y, et al. The expression of epithelial-mesenchymal transition-related proteins in biliary epithelial cells is associated with liver fibrosis in biliary atresia[J]. Pediatr Res, 2015, 77(2): 310–315. DOI:10.1038/pr.2014.181 |
| [14] | XIAO Y, WANG J, CHEN Y, et al. Up-regulation of miR-200b in biliary atresia patients accelerates proliferation and migration of hepatic stallate cells by activating PI3K/Akt signaling[J]. Cell Signal, 2014, 26(5): 925–932. DOI:10.1016/j.cellsig.2014.01.003 |
| [15] | XIAO Y, WANG J, YAN W, et al. Dysregulated miR-124 and miR-200 expression contribute to cholangiocyte proliferation in the cholestatic liver by targeting IL-6/STAT3 signalling[J]. J Hepatol, 2015, 62(4): 889–896. DOI:10.1016/j.jhep.2014.10.033 |
| [16] |
中华医学会肝病学分会. 胆汁淤积性肝病诊断和治疗共识(2015)[J].
肝脏, 2015, 35(12): 39–51.
Chinese Medical Association Liver Diseases Branch. Consensus on diagnosis and treatment of cholestatic liver disease (2015)[J]. Chin Hepatol, 2015, 35(12): 39–51. |
| [17] | WAGNER M, TRAUNER M. Recent advances in understanding and managing cholestasis[J]. F1000Research, 2016, 5: 705. DOI:10.12688/f1000research.8012.1 |
| [18] | REITER F P, WIMMER R, WOTTKE L, et al. Role of interleukin-1 and its antagonism of hepatic stellate cell proliferation and liver fibrosis in the Abcb4(-/-) mouse model[J]. World J Hepatol, 2016, 8(8): 401–410. DOI:10.4254/wjh.v8.i8.401 |



