肺癌在全球范围内广泛存在,是癌症死亡的主要原因,每年约有160万肺癌患者死亡[1]。非小细胞肺癌(non-small cell lung cancer, NSCLC)约占所有原发肺癌的85%,大多数患者在诊断时已是晚期,预后较差[2-3]。近年来,靶向治疗和免疫治疗在晚期NSCLC治疗中显示出较好的结果,有效地改善了患者的生存[4]。但是,大多数NSCLC患者存在远处转移仍是导致肺癌高死亡率的原因。大约40%的新发NSCLC病例在诊断时出现转移[5],其中大多数患者的5年生存率较低[6]。既往研究报道,NSCLC肝转移患者生存时间显著降低[7-8],且具有多部位转移的NSCLC预后比单一部位转移的患者差[9]。然而,这类研究的主要限制因素是样本量太小,并且现在仍未有相应研究来探讨各转移模式在NSCLC及其主要组织学亚型中的发生率和预后差异。因此,本研究基于SEER(Surveillance, Epidemiology, and End Results)数据库,分析NSCLC的不同转移模式及其对预后的影响。
1 资料与方法 1.1 数据来源SEER数据库精确地收集了美国约34.6%的癌症患者的临床信息。由于SEER数据库在2010年之前没有关于转移部位的具体信息,所以本研究所选患者的诊断时间限于2010-2014年。
为确定NSCLC病例,原发部位选定为“肺和支气管”。通过显微镜确认诊断,并且确定仅有一个原发性肿瘤。根据组织学类型,NSCLC病例分为:腺癌(组织学代码:8140,8230,8250-8255,8260,8310,8333,8470,8480,8481,8490和8550);鳞癌(组织学代码:8052,8070-8073,8083和8084);腺鳞癌(组织学代码:8560);大细胞癌(组织学代码:8012-8014,8082,8123和8310)和其他(组织学代码:8022,8031,8032,8200,8240,8249,8430,8562,8972和8980)。所选病例中,缺乏关于死亡原因和生存时间信息、无远处转移及远处转移部位不涉及骨、脑、肝、肺及转移部位信息未知和美国癌症联合会(American Joint Committee on Cancer, AJCC)分期未知的患者都被排除在外。
1.2 统计学分析采用SPSS 21.0统计软件,利用Kaplan-Meier法和对数秩检验绘制生存曲线和进行生存分析。通过Cox比例风险模型分析改善OS的相关因素,多因素分析得到风险比(hazard ratio,HR)及相应95%置信区间(confidence interval, CI)。双侧P < 0.05被认为具有统计学意义。总生存期(overall survival, OS;定义为从诊断到肿瘤导致死亡的时间)被设定为本研究的主要终点。
2 结果 2.1 基本临床特征从SEER数据库中,最终纳入了38 755例具有骨、肝、脑、肺任一部位转移的NSCLC患者。筛选流程见图 1。
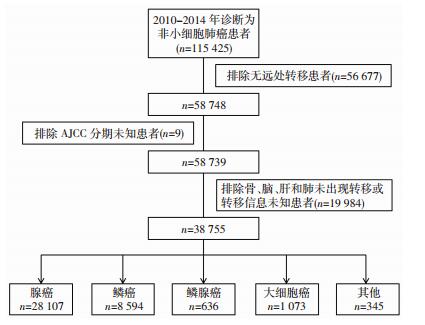
|
| 图 1 基于SEER数据库的患者筛选流程 |
大多数患者在诊断时年龄超过50岁(93.89%),并且以白种人为主(77.38%)。所有入组病例中,肿瘤中度分化(Ⅱ级)患者约占12.50%,肿瘤低分化(Ⅲ级)患者占25.55%,组织学亚型以腺癌为主,约占72.52%。诊断时接受手术治疗的患者比例低,而主要以化疗和/或放疗为主。患者具体临床特征见表 1。
| 变量 | 数量(n) | 比例(%) |
| 年龄/岁 | ||
| <50 | 2 368 | 6.11 |
| ≥50 | 36 387 | 93.89 |
| 性别 | ||
| 男性 | 21 272 | 54.89 |
| 女性 | 17 483 | 45.11 |
| 种族 | ||
| 白人 | 29 990 | 77.38 |
| 黑人 | 5 097 | 13.15 |
| 其他 | 3 668 | 9.46 |
| 分级 | ||
| Ⅰ | 1 071 | 2.76 |
| Ⅱ | 4 846 | 12.50 |
| Ⅲ | 9 900 | 25.55 |
| Ⅳ | 392 | 1.01 |
| 未知 | 22 546 | 58.18 |
| 组织学类型 | ||
| 腺癌 | 28 107 | 72.52 |
| 鳞癌 | 8 594 | 22.18 |
| 腺鳞癌 | 636 | 1.64 |
| 大细胞癌 | 1 073 | 2.77 |
| 未知 | 345 | 0.89 |
| 化疗 | ||
| 有 | 17 618 | 45.46 |
| 无/未知 | 21 137 | 54.54 |
| 放疗 | ||
| 有 | 19 210 | 49.57 |
| 无/未知 | 19 545 | 50.43 |
| 手术 | ||
| 有 | 1 241 | 3.20 |
| 无/未知 | 37 514 | 96.80 |
2.2 NSCLC及其主要组织学亚型的不同转移模式分析
图 2A显示NSCLC不同转移模式的情况,在诊断时分别有8 654(22.43%)、7 699(19.96%)、6 109 (15.84%)和2 264(5.87%)例NSCLC患者证实有孤立性骨、肺、脑和肝转移。对于具有双部位转移的NSCLC,骨和肺是最常见的转移组合,而脑和肝的联合转移最罕见,分别占整个转移病例的7.40%和1.40%。出现三部位联合转移的频率较低。对于NSCLC最常见的三部位转移组合涉及骨、肝和肺,约占所有病例的3.16%。而四部位联合转移相对罕见,仅有652例(1.69%)患者出现四部位转移。
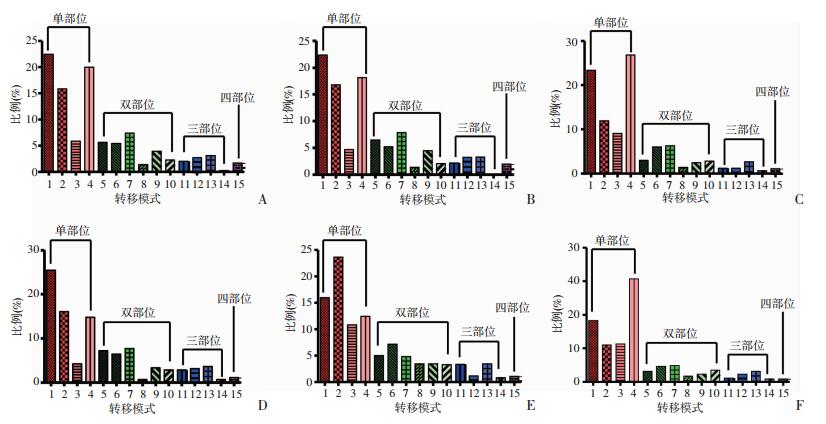
|
| A~F:分别为总体及腺癌、鳞癌、腺鳞癌、大细胞癌及其他亚型的转移情况分布 图 2 NSCLC及其主要组织学亚型的不同转移模式 |
此外,分析了不同NSCLC亚型的转移特征。结果显示,腺癌和腺鳞癌最常见的单转移部位为骨,分别为22.39%和25.47%。鳞癌和其他亚型,单肺转移最常见,分别为26.81%和30.72%。大细胞癌最常见的单转移部位是脑,约占23.64%。腺癌、鳞癌、腺鳞癌及其他亚型最常见的双部位转移是骨和肺,分别占7.87%、6.26%、7.70%和4.93%。而大细胞癌最常见的双部位转移是骨和肝,约占7.18%。对于三部位的联合转移,骨、肝和肺是各NSCLC亚型的最常见组合。见图 2。
2.3 NSCLC不同转移模式的生存分析图 3A显示,与3个或4个部位转移的患者相比,双部位转移患者具有更好的预后,但较单部位转移患者预后更差(P < 0.001)。而三部位与四部位转移患者之间的生存差异无统计学意义(P>0.05)。在单部位转移病例中,孤立性肺转移患者的预后最佳,其次是孤立性脑转移和骨转移(P < 0.001),孤立性肝转移预后最差(P < 0.001,图 3B)。对于双部位转移病例,联合肝脏的双部位转移患者的OS比未联合肝转移的患者更差(P < 0.001,图 3C)。在三部位转移的病例中得到了类似的结果。骨、脑和肺三部位转移患者的OS优于联合肝脏的三部位转移模式(P < 0.001,图 3D)。总之,单独肝转移或多部位联合肝转移的NSCLC患者预后较其他转移模式差。
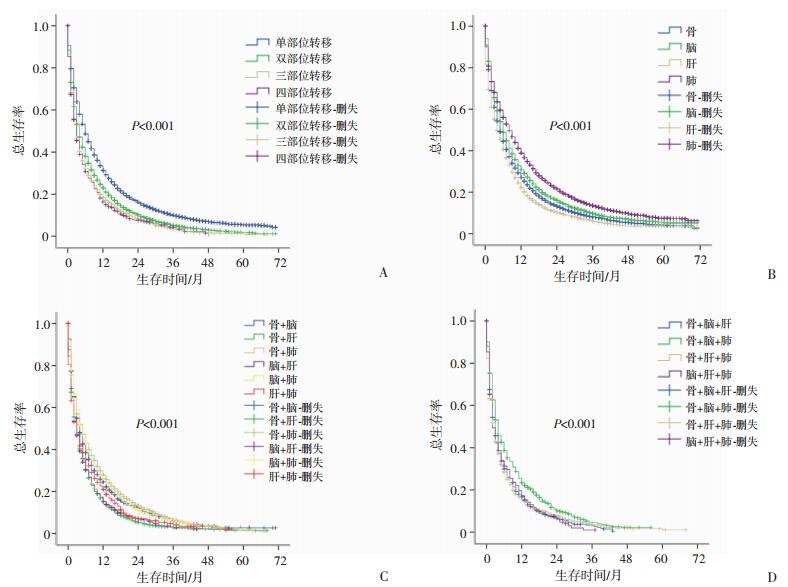
|
| A~D:分别为总体及单部位、双部位、三部位转移的情况 图 3 NSCLC不同转移模式生存分析 |
2.4 基于OS的Cox回归分析
在多因素分析中,较大年龄、男性、肿瘤分化差和转移部位增加与预后不良有关。同时,多因素分析结果还提示,鳞癌、腺鳞癌和大细胞癌死亡风险均较腺癌高,HR分别为1.29、1.13及1.25(表 2)。
| 变量 | HR(95%CI) | P值 |
| 年龄/岁 | ||
| <50 | 1 | |
| ≥50 | 1.45(1.39~1.52) | <0.001 |
| 性别 | ||
| 女性 | 1 | |
| 男性 | 1.18(1.16~1.21) | <0.001 |
| 种族 | ||
| 白人 | 1 | |
| 黑人 | 1.01(0.98~1.04) | 0.682 |
| 其他 | 0.69(0.66-0.72) | <0.001 |
| 肿瘤分级 | ||
| Ⅰ | 1 | |
| Ⅱ | 1.17(1.09~1.27) | <0.001 |
| Ⅲ | 1.43(1.33~1.54) | <0.001 |
| Ⅳ | 1.69(1.49~1.92) | <0.001 |
| 未知 | 1.39(1.30~1.50) | <0.001 |
| 组织学亚型 | ||
| 腺癌 | 1 | |
| 鳞癌 | 1.29(1.26~1.33) | <0.001 |
| 腺鳞癌 | 1.13(1.03~1.23) | 0.006 |
| 大细胞癌 | 1.25(1.17~1.33) | <0.001 |
| 其他 | 0.57(0.50~0.66) | <0.001 |
| 转移类型 | ||
| 单部位转移 | ||
| 肺 | 1 | |
| 脑 | 1.18(1.14~1.23) | <0.001 |
| 骨 | 1.29(1.25~1.34) | <0.001 |
| 肝 | 1.43(1.36~1.51) | <0.001 |
| 双部位转移 | ||
| 骨+肺 | 1 | |
| 脑+肺 | 1.05(0.98~1.12) | 0.177 |
| 骨+脑 | 1.10(1.04~1.17) | 0.002 |
| 肝+肺 | 1.23(1.14~1.34) | <0.001 |
| 脑+肝 | 1.34(1.21~1.47) | <0.001 |
| 骨+肝 | 1.32(1.24~1.40) | <0.001 |
| 三个/四个转移部位 | ||
| 骨+脑+肺 | 1 | |
| 骨+肝+肺 | 1.18(1.08~1.28) | <0.001 |
| 骨+脑+肝 | 1.17(1.06~1.29) | 0.002 |
| 脑+肝+肺 | 1.16(1.01~1.34) | 0.034 |
| 骨+脑+肝+肺 | 1.19(1.07~1.31) | 0.001 |
在单部位转移模式中,孤立性肝转移死亡风险最高(HR=1.53;95%CI=1.36~1.51,P<0.001)。同时,联合肝脏的多部位转移患者与未联合肝转移的患者相比具有显著增高的死亡风险(表 2)。
3 讨论少数研究关注NSCLC不同转移模式的发生率。一项包括729例转移性NSCLC的回顾性研究中,分别有250例(34.3%),234例(32.1%),207例(28.4%),122例(16.7%),98例(13.4%)和69例(9.5%)患者诊断有骨、肺、脑、肾上腺、肝和远处淋巴结转移[10]。另一项基于瑞典家庭癌症数据库的研究表明,所有死亡的肺癌患者中约38%出现单部位转移,19%有两个或更多转移灶[11]。而本研究中,约63.80%的转移性NSCLC为单部位转移。REN等[7]报道,骨和脑是腺癌最常见的双转移部位(11.4%),骨和肝是鳞癌最常见的双转移部位(11.8%)。但在本研究中,腺癌、鳞癌、腺鳞癌和其他亚型最常见的双部位转移均为骨和肺,分别占7.87%、6.26%、7.70%和4.93%。骨和肝是大细胞癌患者最常见的双部位转移组合,约占7.18%。
少数研究报道转移性NSCLC的生存率差异可能与不同的转移模式有关。NSCLC肝转移患者预后较差[10]。另一项研究也显示,诊断为肝转移的腺癌无进展生存期(PFS)和OS较无肝转移的患者更短(分别为2.5个月和6.3个月)[12]。本研究结果也证实肝转移患者在所有转移模式中预后最差。此外,还发现孤立性肝转移的死亡风险比孤立性肺转移高1.51倍。同时,含有肝转移的多部位转移患者的OS也短于无肝转移患者。尽管肝转移在NSCLC转移中所占比例较少,但由于其预后最差,且肝转移患者使用免疫检查点抑制剂单药治疗的疗效不佳[13-15]。因此,该转移类型也引起了特别的关注。
本研究还分析了NSCLC单一部位转移与多部位转移的预后差异。最近一项研究表明,单部位转移患者较多部位转移患者有更好的预后[16]。既往研究结果也显示,NSCLC常见的双部位转移是神经系统和骨骼,骨骼和肝脏,以及神经系统和肝脏,但它们之间的生存差异尚不清楚[11]。然而,本研究发现NSCLC双部位转移最常累及骨和肺。生存分析结果显示,联合肝脏的双部位转移患者的OS比未联合肝转移的患者更差。在三部位转移病例中得到了类似的发现。多部位转移模式中一旦含有肝转移,则提示这类患者具有较差的OS。因此,对涉及肝脏的多部位远处转移患者进行合理分类,对于改善这一特定亚群的预后至关重要。
但是,本研究仍存在一些局限性。①缺乏有关全身治疗的细节信息,包括靶向治疗和免疫治疗等信息。②缺乏并发症、体力状态和基因突变的信息。③仅包括骨、脑、肝和肺4个部位的转移信息,而其他部位例如肾上腺转移也可能影响NSCLC患者的预后。
综上,NSCLC不论是单个或多个器官的转移,骨是最常见的转移靶位。对于NSCLC的不同组织学亚型,大细胞癌具有更为特异的转移特征,其最常见的单部位转移是脑,最常见的双部位转移组合是骨和肝。此外,孤立性肝转移或肝脏联合其他器官的多部位转移是NSCLC患者预后较差的因素,而孤立性肺转移预后最好。
| [1] | TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | CRINÒ L, WEDER W, VAN MEERBEECK J, et al. Early stage and locally advanced(non-metastatic) non-small-cell lung cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2010, 21(Suppl 5): v103–v115. DOI:10.1093/annonc/mdq207 |
| [3] | ZAGO G, MULLER M, VAN DEN HEUVEL M, et al. New targeted treatments for non-small-cell lung cancer—role of nivolumab[J]. Biologics, 2016, 10: 103–117. DOI:10.2147/BTT.S87878 |
| [4] | LORUSSO G, IMBIMBO M, GARASSINO M C. Is the chemotherapy era in advanced non-small cell lung cancer really over? maybe not yet[J]. Tumori, 2016, 102(3): 223–225. DOI:10.5301/tj.5000479 |
| [5] | MORGENSZTERN D, NG S H, GAO F, et al. Trends in stage distribution for patients with non-small cell lung cancer: a national cancer database survey[J]. J Thorac Oncol, 2010, 5(1): 29–33. DOI:10.1097/JTO.0b013e3181c5920c |
| [6] | DETTERBECK F C, BOFFA D J, KIM A W, et al. The eighth edition lung cancer stage classification[J]. Chest, 2017, 151(1): 193–203. DOI:10.1016/j.chest.2016.10.010 |
| [7] | REN Y J, DAI C Y, ZHENG H, et al. Prognostic effect of liver metastasis in lung cancer patients with distant metastasis[J]. Oncotarget, 2016, 7(33): 53245–53253. DOI:10.18632/oncotarget.10644 |
| [8] | CHANG Y P, CHEN Y M, LAI C H, et al. The impact of de novo liver metastasis on clinical outcome in patients with advanced non-small-cell lung cancer[J]. PLoS ONE, 2017, 12(6): e0178676. DOI:10.1371/journal.pone.0178676 |
| [9] | EBERHARDT W E, MITCHELL A, CROWLEY J, et al. The IASLC lung cancer staging project: proposals for the revision of the M descriptors in the forthcoming eighth edition of the TNM classification of lung cancer[J]. J Thorac Oncol, 2015, 10(11): 1515–1522. DOI:10.1097/JTO.0000000000000673 |
| [10] | TAMURA T, KURISHIMA K, NAKAZAWA K, et al. Specific organ metastases and survival in metastatic non-small-cell lung cancer[J]. Mol Clin Oncol, 2015, 3(1): 217–221. DOI:10.3892/mco.2014.410 |
| [11] | RIIHIMÄKI M, HEMMINKI A, FALLAH M, et al. Metastatic sites and survival in lung cancer[J]. Lung Cancer, 2014, 86(1): 78–84. DOI:10.1016/j.lungcan.2014.07.020 |
| [12] | WU K L, TSAI M J, YANG C J, et al. Liver metastasis predicts poorer prognosis in stage Ⅳ lung adenocarcinoma patients receiving first-line gefitinib[J]. Lung Cancer, 2015, 88(2): 187–194. DOI:10.1016/j.lungcan.2015.02.012 |
| [13] | PAZ-ARES L G, SHEN K, HIGGS B W, et al. Association of liver metastases(LM) with survival in NSCLC patients treated with durvalumab(D) in two independent clinical trials[J]. J Clin Oncol, 2017, 35(15_suppl): 3038. DOI:10.1200/jco.2017.35.15_suppl.3038 |
| [14] | PILLAI R N, KAMPHORST A O, OWONIKOKO T K, et al. Liver metastases and sensitivity to checkpoint inhibition in patients with non-small cell lung cancer(NSCLC)[J]. J Clin Oncol, 2016, 34(15_suppl): e20665. DOI:10.1200/jco.2016.34.15_suppl.e20665 |
| [15] | TUMEH P C, HELLMANN M D, HAMID O, et al. Liver metastasis and treatment outcome with anti-PD-1 monoclonal antibody in patients with melanoma and NSCLC[J]. CancerImmunol Res, 2017, 5(5): 417–424. DOI:10.1158/2326-6066.CIR-16-0325 |
| [16] | YANG J, ZHANG Y, SUN X T, et al. The prognostic value of multiorgan metastases in patients with non-small cell lung cancer and its variants: a SEER-based study[J]. J Cancer Res Clin Oncol, 2018, 144(9): 1835–1842. DOI:10.1007/s00432-018-2702-9 |



