Tristetraprolin(TTP)是由锌指蛋白36(zinc finger protein-36,ZFP36)基因编码的一种RNA结合蛋白,该蛋白与多种靶基因mRNA的ARE结合,促进mRNA的降解[1]。目前研究表明,TTP表达异常与恶性肿瘤的发生、发展有着密切的关系,在大部分恶性肿瘤中低表达(如胰腺癌[2]、乳腺癌[3]、前列腺癌[4]、子宫癌[5]等),起着“抑癌基因”[6]的作用。越来越多的研究证明,TTP在不同程度上参与调控多种恶性肿瘤的进展和转移,包括增殖、迁移、侵袭和凋亡[7]。TTP也介导多种癌症中免疫相关转录因子的表达[8]。在肺腺癌的肿瘤驱动基因表达比较研究中发现,ERBB4(Erb-B2 Receptor Tyrosine Kinase 4),KRAS以及STK11 (Serine/threonine kinase 11,编码抑癌分子LKB1)基因突变频率在TTP低表达组织中更低,表明可能仅仅TTP的低表达就是肺腺癌发生的关键驱动力[9],但目前TTP在肺癌中的抑癌作用机制不清,大大限制了TTP的临床应用可能性,因此,揭示其抑癌作用机制对TTP在肺癌治疗的未来临床应用中具有非常重要的意义。
我们前期研究发现,瞬转TTP表达质粒后,细胞生长受到明显抑制,无法探究TTP的具体作用机制。故本研究采用Tet-On诱导表达系统,利用慢病毒载体介导ZFP-36基因转染肺癌细胞H1975、H1299,建立可调控TTP基因表达的稳定细胞株,探究其对肺腺癌细胞增殖、迁移、克隆形成、细胞周期及凋亡的影响,探讨其在肺癌恶性生物学进程中的作用。
1 材料与方法 1.1 材料H1975和H1299细胞购自中科院上海生命科学研究院;TTP过表达质粒由美国圣路易斯医学院刘建国教授赠送;Dox(doxycycline)和嘌呤霉素购自美国SIGMA公司;胎牛血清购自南美PAN公司;细胞培养液1640购自CLONANG公司;CCK-8试剂盒购自日本同仁公司;总RNA提取试剂盒、RNA逆转录试剂盒和Real-time PCR试剂盒购于大连TaKaRa公司;RIPA细胞裂解液和BCA蛋白定量试剂盒购自碧云天生物技术研究所;基因的慢病毒(Tet-On-TTP)由上海诺百生物科技有限公司构建。
兔抗人TTP多克隆抗体购自美国SIGMA公司、鼠抗人Bcelin1单克隆抗体购自武汉Proteintech公司,兔抗人SQSTM1/p62多克隆、兔抗人LC3A/B单克隆、兔抗人Bcl-2单克隆抗体购自美国Cell Signaling Technology公司, 兔抗人caspase3多克隆抗体购自碧云天生物技术有限公司,兔抗人Bax多克隆抗体购自沈阳万类生物科技有限公司,辣根过氧化物酶标记的羊抗兔IgG(二抗)购自北京中杉金桥生物技术有限公司,辣根过氧化物酶标记的羊抗鼠IgG (二抗)购自美国Proteintech公司,ECL试剂购自北京普利莱基因技术有限公司。
实验分为4组:转TTP病毒组:tet-on-TTP-Dox(+)、tet-on-TTP-Dox(-); 空载病毒对照组: tet-on-EV-Dox(+)、tet-on-EV-Dox(-),(+)表示加Dox组而(-)者表示不加Dox组。
1.2 细胞培养人肺腺癌细胞H1975和H1299用含10%胎牛血清RPMI1640培养液,置于37 ℃、CO2体积分数为5%的培养箱中培养,取对数生长期的细胞用于后续实验。
1.3 慢病毒感染H1975和1299及筛选单克隆细胞将处于对数生长期的待感染的H1975和H1975细胞铺于24孔板中,细胞密度30%,24 h后,待细胞贴壁后感染H1975细胞(MOI :60)和H1299细胞(MOI :10),在病毒上清液中,加入凝聚胺(polybrene)(终浓度为4 μg/mL), 6 h后更换培养基,继续培养传代至6 cm培养皿,贴壁后以1.00 μg/mL嘌呤霉素筛选10 h,稳定株(H1975-tet-on-TTP)长出后,采用有限稀释法挑选单克隆细胞,置于荧光显微镜下观察,扩大培养。H1299细胞继续用嘌呤霉素筛选10 d,获得稳定转染慢病毒的细胞系,H1975-tet-on-TTP、H1299-tet-on-TTP及对照H1975-tet-on-EV、H1299-tet-on-EV。
1.4 Dox最适诱导TTP表达浓度和时间的测定及肺腺癌细胞中TTP过表达情况的检测 1.4.1 采用Western blot法检测不同浓度Dox诱导TTP在H1975细胞中的表达结果将处于对数生长期、已感染Tet-On-TTP的H1975细胞接种于75 cm培养瓶中,贴壁培养24 h后弃去上清液,用PBS洗涤细胞3次,加入含有不同质量浓度的Dox(用含10% FBS的1640培养液配制)。实验共分为5组,各实验组Dox终质量浓度分别设定为0、1.00、2.00、4.00和6.00 μg/mL。各组细胞培养48 h后,细胞刮刮取细胞, 离心,加入RIPA,PMSF按RIPA的1/100加入,冰上裂解30 min,每隔10 min涡旋器涡旋30 s,4 ℃ 12 000 r /min离心20 min,取上清液,BCA法蛋白定量。于10% SDS-PAGE行细胞蛋白电泳,转于PVDF膜上,剪取目的条带,快速封闭液封闭15 min,孵TTP一抗(兔抗人多克隆抗体,体积稀释比均为1 :1 000)过夜,第2天孵HRP标记羊抗兔IgG(二抗)1 h,暗室中ECL发光显影,采用Fusion Fx软件对条带进行分析,计算TTP和内参GAPDH的比值。实验重复3次。
1.4.2 采用实时荧光定量PCR检测不同浓度Dox诱导TTP在H1975细胞中的表达结果收集不同浓度Dox(0、1.00、2.00、4.00和6.00 μg/mL)诱导的H1975-tet-on-TTP细胞, TRIzol试剂提取总RNA,并测其浓度。用TaKaRa逆转录试剂盒将RNA转为cDNA,然后进行实时荧光定量PCR反应。PCR反应条件为:95 ℃变性30 s, 60 ℃退火延伸30 s, 循环40次, 每个样本设3个复孔。实验重复3次。目的基因TTP的引物由TaKaRa公司合成。引物序列如下:TTP上游引物:5′-CAACCCTAGCGAAGACCTGG-3′,下游引物: 5′-AGAGGGTGACAGTGGAAGGT-3′。
1.4.3 采用Western blot法检测相同浓度Dox作用不同的时间TTP表达结果将处于对数生长期,已感染Tet-On-TTP的H1975细胞接种于8个75 cm培养瓶中,待细胞贴壁后,加入Dox诱导TTP表达,分别于加入Dox后于第0、1、2、3、4、5、6、7天提取细胞全蛋白。采用蛋白质印迹法检测TTP蛋白的表达情况,实验方法同1.4.1。
1.5 CCK-8法检测细胞增殖分别取对数生长期的H1975-tet-on-TTP、H1975-tet-on-EV细胞制成500个单细胞悬液;将H1299-tet-on-TTP、H1299-tet-on-EV细胞制成100个单细胞悬液,2组细胞实验均分为4组:tet-on-TTP-Dox(+)、tet-on-TTP-Dox(-)、tet-on-EV-Dox(+)、tet-on-EV-Dox(-),将各组细胞接种于96孔板,每孔100 μL,每个组设4个复孔,每个96孔板边缘孔均加入磷酸盐缓冲液(PBS) 100 μL,再将其置于37 ℃、5% CO2的恒温箱中培养,待细胞贴壁(24 h后)后更换培养基Dox(+)或Dox(-)(其中H1975细胞中Dox浓度为2 μg/mL, H1299细胞Dox浓度为1 μg/mL),加入10 μL的CCK-8溶液,将其继续放入恒温箱中培养2 h,置于450 nm波长下测定各孔的光密度值D(450),以后每隔24 h后取出1块板,分别检测1、2、3、4、5、6、7、8 d的D(450)值,比较各组增殖能力的变化。
1.6 Transwell检测细胞的迁移能力分别取对数生长期的H1975和H1299的4组细胞:tet-on-TTP-Dox(+)、tet-on-TTP-Dox(-)、tet-on-EV-Dox(+)、tet-on-EV-Dox(-),Dox(+)(2 μg/mL)或Dox(-)处理4 d,H1975-tet-on和H1299-tet-on细胞分别取2.5×105个/mL的单细胞悬液200 μL接种于含无血清培养基的上室[Dox(+)组中加2 μg/mL的Dox],下室含10%FBS培养基500 μL,将其置于37 ℃,5%CO2的温箱中培养24 h,取出小室,用PBS洗去培养基,再用4%多聚甲醛固定10 min,0.01%结晶紫染色10 min;再洗除小室表面的结晶紫,并用棉签轻轻擦掉上层未迁移的细胞,置于100倍显微镜下随机5个视野观察细胞并拍照,并用Image J软件计数,重复实验3次。
1.7 平板克隆实验检测细胞集落形成能力分别取对数生长期的H1975和H1299的tet-on-TTP、tet-on-EV细胞,计数后分别将H1975-tet-on细胞以500个/孔接种于6孔板中,将H1299-tet-on细胞以250个/孔接种于12孔板中,待细胞贴壁后Dox(+)组加入Dox(H1975浓度:2 μg/mL,H1299浓度:1 μg/mL),再将其置于恒温箱内培养,期间每隔3 d更换培养基,待H1975-tet-on细胞培养12 d,H1299-tet-on细胞培养9 d后使用PBS洗涤细胞集落,再用4%多聚甲醛固定20 min,结晶紫染色20 min。拍照并用Image J软件计数(只计算含有超过50个细胞的集落细胞)。
1.8 细胞周期检测收集H1975的4组细胞:tet-on-TTP-Dox(+)、tet-on-TTP-Dox(-)、tet-on-EV-Dox(+)、tet-on-EV-Dox(-),Dox(+)(2 μg/mL)或Dox(-)处理4 d,离心,经PBS洗涤后重悬,离心,弃上清,加入100 μL的PBS重悬细胞,加入80%冰乙醇400 μL,-20 ℃固定至少2 h,离心,弃上清,加入500 μL的PBS重悬细胞,轻微震荡,离心,弃上清,根据说明书加入DAPI染液,用流式细胞仪检测细胞周期分布。
1.9 流式细胞术检测细胞凋亡收集H1975的4组细胞:tet-on-TTP-Dox(+)、tet-on-TTP-Dox(-)、tet-on-EV-Dox(+)、tet-on-EV-Dox(-),Dox(+)(2 μg/mL)或Dox(-)处理4 d,离心,弃上清,加入500 μL的PBS重悬细胞,轻轻吹散细胞。上机前依照AnnexinV-PE/7-ADD凋亡试剂盒说明书对样本进行处理后,用CytoFIFX流式细胞仪检测。凋亡数据由CytExpert software生成。
1.10 Western blot法检测凋亡相关蛋白表达收集H1975的4组细胞:tet-on-TTP-Dox(+)、tet-on-TTP-Dox(-)、tet-on-EV-Dox(+)、tet-on-EV-Dox(-),Dox(+)组(2 μg/mL)或Dox(-)处理4 d,提取全蛋白,蛋白质印迹法检测凋亡相关蛋白的表达情况, 12% SDS-PAGE行细胞蛋白电泳,余实验方法同1.4.1。
1.11 统计学分析应用SPSS 14.0统计学软件对实验数据进行统计学分析。所有的实验均重复3次,计量资料以x±s表示,多组之间比较采用方差分析及析因设计资料的方差分析。检验水准:α=0.05。
2 结果 2.1 诱导型TTP过表达细胞模型的建立及Dox最适诱导浓度和时间的确定将稳定转染tet-on-TTP的H1975细胞分别置于含不同质量浓度的Dox的培养液中培养,荧光定量PCR和Western blot法检测经不同的Dox浓度诱导后H1975-tet-on-TTP细胞的TTP表达情况。结果显示:不同浓度的Dox均可诱导H1975-tet-on-TTP细胞TTP mRNA和蛋白表达,其中Dox浓度为2 μg/mL诱导时的表达均最高(图 1)。故以Dox(2 μg/mL)为后续实验的工作浓度。以2 μg/mL的Dox诱导H1975-tet-on- TTP细胞,在0~7d不同的时间提取蛋白,诱导第4天后TTP表达明显增高,之后时间点TTP的表达稳定(图 2)。
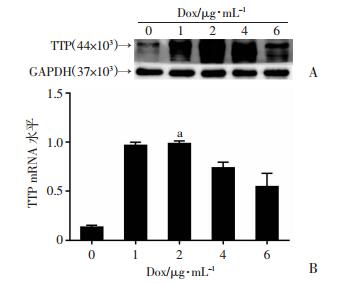
|
| A: Western blot检测不同浓度的Dox诱导TTP表达0~6:分别表示加入Dox的浓度为0、1、2、4、6 μg/mL;B:荧光定量PCR检测不同浓度的Dox诱导TTP表达a:P < 0.05,与对照组(0 μg/mL)比较 图 1 不同Dox诱导浓度TTP mRNA和TTP蛋白的表达情况 |
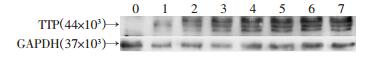
|
| 0~7:分别表示加入Dox后诱导的不同时间(d) 图 2 Western blot检测不同时间的Dox诱导TTP表达 |
2.2 TTP过表达对肺腺癌细胞增殖的影响
利用已感染tet-on-TTP和对照tet-on-EV的肺腺癌H1975和H1299细胞,观察TTP过表达对肺腺癌细胞增殖的影响。CCK-8检测结果显示:第1、2天各组细胞的光密度值未见明显变化,差异无统计学意义(P>0.05)。3 d后随着细胞培养天数的延长,除Dox诱导TTP过表达组外,余各组细胞都呈明显的上升趋势,TTP过表达对H1975细胞及H1299细胞的生长表现为显著抑制作用(图 3)。
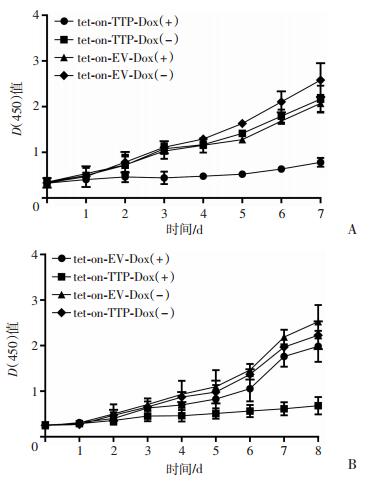
|
| 图 3 Dox诱导TTP过表达对肺腺癌H1975(A)和H1299(B)细胞增殖的影响 |
2.3 TTP过表达对肺腺癌细胞迁移能力的影响
H1975和H1299各组细胞tet-on-TTP-Dox(+)、tet-on-TTP-Dox(-)、tet-on-EV-Dox(+)、tet-on-EV-Dox(-),采用结晶紫染色,在倒置显微镜下观察并计数穿膜细胞数,H1975细胞迁移实验结果如图 4所示,各组细胞穿透小室膜的数量H1975-tet-on-EV-Dox(-)、H1975-tet-on-EV-Dox(+)、H1975-tet-on-TTP-Dox(-)、H1975-tet-on-TTP-Dox (+)分别为:(108.70±10.07)、(98.67±9.02)、(108.00±11.79)、(60.00±9.17)。
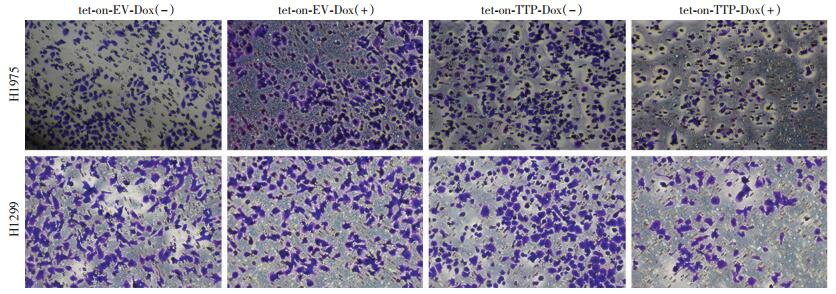
|
| 图 4 Transwell实验检测各组细胞的迁移情况 (结晶紫×100) |
H1299迁移实验结果如图 4所示:穿透小室膜的细胞数量分别H1299-tet-on-EV-Dox(-)、H1299-tet-on-EV-Dox(+)、H1299-tet-on-TTP-Dox(-)、H1299-tet-on-TTP-Dox (+)为:(137.30±11.68)、(136.00±13.53)、(134.70±8.51)、(61.67±11.50)。
2株细胞系的TTP过表达组与TTP低表达组比较,差异均有统计学意义(H1975 : P < 0.01, H1299: P < 0.001, 图 4),表明TTP过表达显著抑制肺腺癌细胞的迁移能力。
2.4 TTP过表达对肺腺癌细胞集落形成的影响2株细胞系(H1975、H1299)平板集落形成实验结果可见,以Dox诱导的H1975-tet-on-TTP-Dox(+)细胞的TTP过表达组集落形成数量明显减少(图 5),其中H1975-tet-on-TTP-Dox (+)组集落形成数量为(57.33±16.62),其余3组的集落形成数量分别为H1975-tet-on-TTP-Dox (-):(158.30±1.53)、H1975-tet-on-EV-Dox (+):(151.00±6.93)、H1975-tet-on-EV-Dox (-): (168.70±12.34)。H1299细胞TTP过表达组集落形成数量明显减少(图 5),H1299-tet-on-TTP-Dox (+)组集落形成数量为(21.00±3.61),其余3组的集落形成数量分别为H1299-tet-on-TTP-Dox (-):(67.67±6.03)、H1299-tet-on-EV-Dox (+):(55.00±50.00)、H1299-tet-on-EV-Dox (-):(72.00±3.61), 2株细胞系中,TTP过表达组与TTP低表达组比较,差异均有统计学意义(P < 0.0001,图 5),表明TTP过表达显著抑制肺腺癌细胞的集落形成能力。
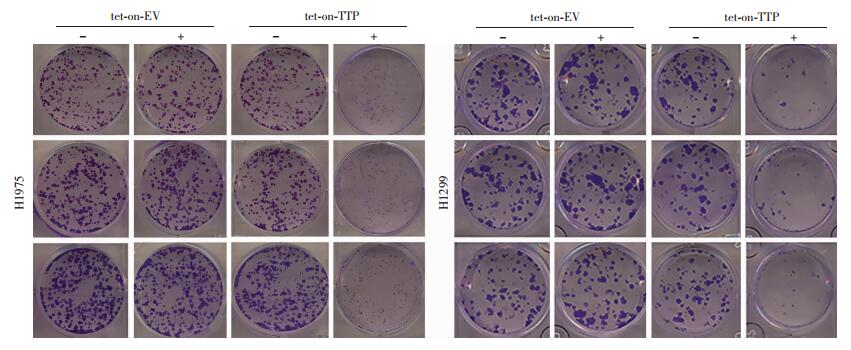
|
| 图 5 Dox诱导TTP过表达对肺腺癌H1975和H1299细胞集落形成的影响 |
2.5 TTP过表达对肺腺癌细胞凋亡和细胞周期的影响
将稳定感染tet-on-TTP和tet-on-EV的H1975细胞,在用Dox(+)或Dox(-)处理4 d后用FCM检测细胞周期。结果显示:Dox诱导的TTP过表达组H1975-tet-on-TTP-Dox(+)处于S期的细胞比例较其他3组提高; 随着细胞S期百分比的增加,G0/G1期细胞百分比较其他3组细胞下降(P < 0.01)。与TTP低表达组比较,TTP过表达后引起H1975细胞周期阻滞在S期,差异有统计学意义(P < 0.01,图 6)。另外用FCM检测细胞凋亡,结果显示:Dox诱导TTP过表达组与其他3组TTP低表达组比较,细胞的凋亡率差异无统计学意义(P>0.05,图 7)。用蛋白质印迹法检测凋亡相关蛋白的表达情况,Dox诱导TTP过表达后,H1975细胞中Bcl-2、Bax、caspase3、cleaved-caspase 3蛋白表达差异均无统计学意义(P>0.05,图 7)。
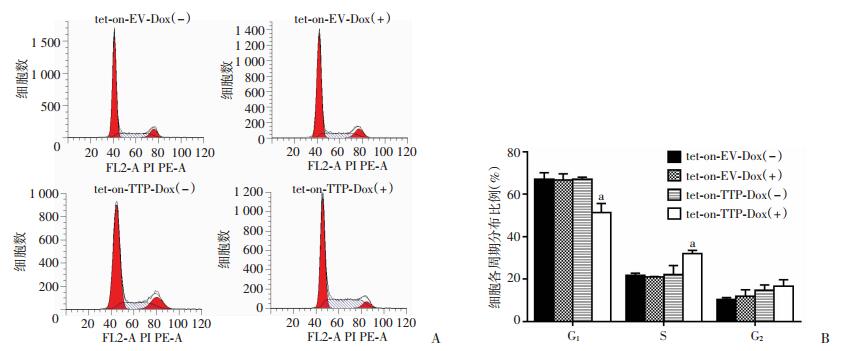
|
| A:FCM检测H1975各组细胞周期变化;B:H1975各组细胞的周期分布结果统计分析 a:P < 0.01,与tet-on-EV-Dox (-)比较 图 6 Dox诱导TTP过表达对肺腺癌H1975细胞周期分布的影响 |
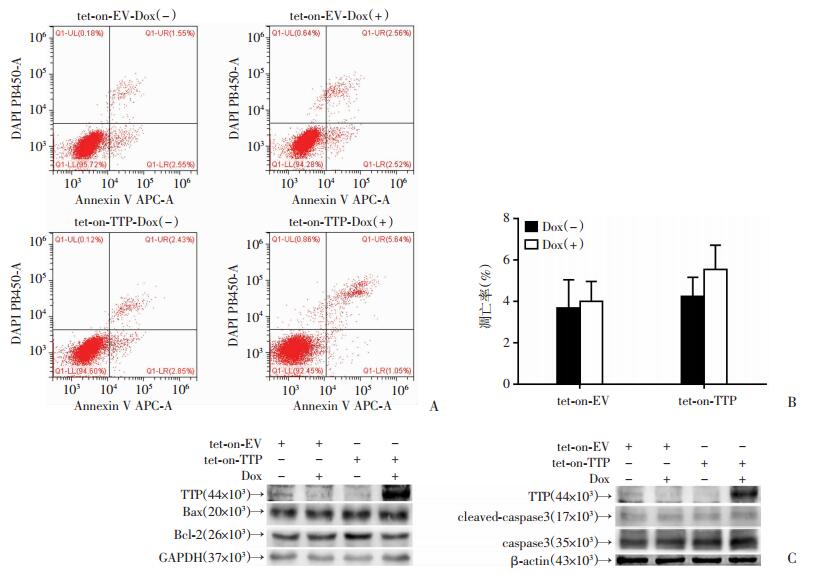
|
| A:FCM检测各组细胞凋亡结果;B:凋亡率统计分析结果;C:Werstern blot检测H1975细胞的凋亡蛋白表达水平 图 7 Dox诱导TTP过表达对肺腺癌H1975细胞凋亡的影响 |
3 讨论
本实验选用Tet-on表达调控系统,通过Dox来控制开启ZFP-36基因的表达,该系统具有高效、特异,且较严密等特点, 而目的基因受其精确且特异性的调控。我们首先建立了带有Tet-On诱导基因表达系统的人肺腺癌细胞H1975-Tet-On、H1299-Tet-On, 构建含有针对TTP的慢病毒表达载体,利用Dox诱导基因表达,建立诱导型TTP过表达细胞模型。
本研究利用Dox调控的Tet-on基因表达系统,研究了TTP过表达对肺腺癌H1975和H1299细胞的生物学效应。本实验结果显示:TTP过表达可显著抑制肺腺癌细胞H1975和H1299增殖、迁移、集落形成,这提示:在H1975和H1299的恶性增殖过程中TTP可能发挥着重要作用。本研究中在H1975细胞系CCK8及平板克隆形成实验中加入Dox(2 μg/mL)对细胞增殖及集落形成无明显影响,但H1299细胞系中Dox (2 μg/mL)对H1299-tet-on-EV-Dox(+)细胞增殖、集落形成影响较大,故H1299细胞系Dox浓度为1 μg/mL。
许多与肿瘤的起始和发展相关的基因都是在mRNA降解的基础上进行调节的,在与许多肿瘤相关的基因中都包含了富含AU的元件,包括那些编码控制增殖、代谢、免疫反应、血管生成和转移的蛋白[4]。TTP是一种RNA结合蛋白,包含ccch锌指结构域,与位于许多mRNA的3′非翻译区的腺苷-尿苷(AU)富集元件结合,促进mRNA的降解[5, 10]。一旦TTP与这些不稳定的mRNA结合,它们就会迁移到P小体,在那里mRNA会被一系列RNA降解酶降解[11]。研究表明,大约16%的人类蛋白质编码基因的3′UTR有ARE结构[12],而这些基因中有许多与免疫反应和肿瘤相关[13-14]。因此TTP能抑制恶性肿瘤的异常增殖,可能是TTP能降解与多种增殖相关基因的mRNA。而与细胞周期相关的基因CCNB1[15]、CCND1[16]、E2F1[17-18]的3′UTR结构中都包含ARE结构,而这些ARE序列可被TTP降解。文献[19]报道能加速细胞周期进程的癌基因pim也能被TTP降解。在小鼠的B淋巴细胞瘤发现,TTP能够引起细胞周期阻滞而抑制癌细胞生长[20]。而本研究中也发现在肺腺癌细胞中TTP过表达引起细胞周期S期阻滞。可见,TTP通过抑制细胞周期进程和细胞增殖基因的表达来防止恶性肿瘤的增殖。
能够逃避细胞的凋亡是肿瘤细胞的一个特点。有研究表明[2, 21-22]过表达TTP可以促进胰腺癌、宫颈癌和胃癌细胞的凋亡。文献[23]报道,MK2抑制剂的治疗可引起肝癌细胞的凋亡,而TTP的敲除使这些细胞在MK2抑制剂的存在下免于凋亡。在本研究中,TTP过表达对肺腺癌细胞的凋亡没有直接影响。目前为止,尚未发现任何促凋亡基因的mRNA作为TTP下游靶标的实验证据,表明TTP可能不直接诱导细胞凋亡,可能通过凋亡相关基因或其他分子机制间接诱导凋亡。值得提出的是,TTP过表达引发细胞非凋亡性细胞死亡的现象尚需进一步研究确定。有研究表明[24]TTP通过抑制细胞自噬而抑制肺癌细胞的生长和增殖。文献[20, 25]报道,PD-L1是胃癌、肺癌和结肠癌细胞中TTP的新靶点,PD-L1的mRNA受到TTP的负调控。总之,TTP可明显抑制肺腺癌细胞的增殖和生长,将TTP作为肺癌治疗靶点,特别是刺激TTP表达可能是治疗低TTP表达肿瘤患者的一种新途径。
| [1] | OGILVIE R L, ABELSON M, HAU H H, et al. Tristetraprolin down-regulates IL-2 gene expression through AU-rich element-mediated mRNA decay[J]. J Immunol, 2005, 174(2): 953–961. DOI:10.4049/jimmunol.174.2.953 |
| [2] | WEI Z R, LIANG C, FENG D, et al. Low tristetraprolin expression promotes cell proliferation and predicts poor patients outcome in pancreatic cancer[J]. Oncotarget, 2016, 7(14): 17737–17750. DOI:10.18632/oncotarget.7397 |
| [3] | GODDIO M V, GATTELLI A, SLOMIANSKY V, et al. Mammary differentiation induces expression of tristetraprolin, a tumor suppressor AU-rich mRNA-binding protein[J]. Breast Cancer Res Treat, 2012, 135(3): 749–758. DOI:10.1007/s10549-012-2216-0 |
| [4] | HALEES A S, EL-BADRAWI R, KHABAR K S. ARED Organism: expansion of ARED reveals AU-rich element cluster variations between human and mouse[J]. Nucleic Acids Res, 2008, 36(Database issue): D137–D140. DOI:10.1093/nar/gkm959 |
| [5] | BLACKSHEAR P J. Tristetraprolin and other CCCH tandem zinc-finger proteins in the regulation of mRNA turnover[J]. Biochem Soc Trans, 2002, 30(Pt 6): 945–952. |
| [6] | BAOU M, JEWELL A, MUTHURANIA A, et al. Involvement of Tis11b, an AU-rich binding protein, in induction of apoptosis by rituximab in B cell chronic lymphocytic leukemia cells[J]. Leukemia, 2009, 23(5): 986–989. DOI:10.1038/leu.2008.340 |
| [7] | GUO J, QU H, CHEN Y, et al. The role of RNA-binding protein tristetraprolin in cancer and immunity[J]. Med Oncol, 2017, 34(12): 196. DOI:10.1007/s12032-017-1055-6 |
| [8] | JELTSCH K M, HEISSMEYER V. Regulation of T cell signaling and autoimmunity by RNA-binding proteins[J]. Curr Opin Immunol, 2016, 39: 127–135. DOI:10.1016/j.coi.2016.01.011 |
| [9] | FALLAHI M, AMELIO A L, CLEVELAND J L, et al. CREB targets define the gene expression signature of malignancies having reduced levels of the tumor suppressor tristetraprolin[J]. PLoS ONE, 2014, 9(12): e115517. DOI:10.1371/journal.pone.0115517 |
| [10] | FU M, BLACKSHEAR P J. RNA-binding proteins in immune regulation: a focus on CCCH zinc finger proteins[J]. Nat Rev Immunol, 2017, 17(2): 130–143. DOI:10.1038/nri.2016.129 |
| [11] | BROOKS S A, BLACKSHEAR P J. Tristetraprolin (TTP): interactions with mRNA and proteins, and current thoughts on mechanisms of action[J]. Biochim Biophys Acta, 2013, 1829(6/7): 666–679. DOI:10.1016/j.bbagrm.2013.02.003 |
| [12] | GRUBER A R, FALLMANN J, KRATOCHVILL F, et al. AREsite: a database for the comprehensive investigation of AU-rich elements[J]. Nucleic Acids Res, 2011, 39(Database issue): D66–D69. DOI:10.1093/nar/gkq990 |
| [13] | KHABAR K S A. Hallmarks of cancer and AU-rich elements[J]. Wiley Interdiscip Rev: RNA, 2016, 8(1): e1368. DOI:10.1002/wrna.1368 |
| [14] | BISOGNO L S, KEENE J D. RNA regulons in cancer and inflammation[J]. Curr Opin Genet Dev, 2018, 48: 97–103. DOI:10.1016/j.gde.2017.11.004 |
| [15] | MUKHERJEE N, JACOBS N C, HAFNER M, et al. Global target mRNA specification and regulation by the RNA-binding protein ZFP36[J]. Genome Biol, 2014, 15(1): R12. DOI:10.1186/gb-2014-15-1-r12 |
| [16] | MUSGROVE E A, CALDON C E, BARRACLOUGH J, et al. Cyclin D as a therapeutic target in cancer[J]. Nat Rev Cancer, 2011, 11(8): 558–572. DOI:10.1038/nrc3090 |
| [17] | LEE H H, LEE S R, LEEM S H. Tristetraprolin regulates prostate cancer cell growth through suppression of E2F1[J]. J Microbiol Biotechnol, 2014, 24(2): 287–294. DOI:10.4014/jmb.1309.09070 |
| [18] | LEE S R, ROH Y G, KIM S K, et al. Activation of EZH2 and SUZ12 regulated by E2F1 predicts the disease progression and aggressive characteristics of bladder cancer[J]. Clin Cancer Res, 2015, 21(23): 5391–5403. DOI:10.1158/1078-0432.CCR-14-2680 |
| [19] | ZHANG Y, WANG Z, MAGNUSON N S. Pim-1 kinase-dependent phosphorylation of p21Cip1/WAF1 regulates its stability and cellular localization in H1299 cells[J]. Mol Cancer Res, 2007, 5(9): 909–922. DOI:10.1158/1541-7786.MCR-06-0388 |
| [20] | ROUNBEHLER R J, FALLAHI M, YANG C, et al. Tristetraprolin impairs myc-induced lymphoma and abolishes the malignant state[J]. Cell, 2012, 150(3): 563–574. DOI:10.1016/j.cell.2012.06.033 |
| [21] | SANDUJA S, KAZA V, DIXON D A. The mRNA decay factor tristetraprolin (TTP) induces senescence in human papillomavirus-transformed cervical cancer cells by targeting E6-AP ubiquitin ligase[J]. Aging (Albany NY), 2009, 1(9): 803–817. DOI:10.18632/aging.100086 |
| [22] | GUO J, QU H, SHAN T, et al. Tristetraprolin overexpression in gastric cancer cells suppresses PD-L1 expression and inhibits tumor progression by enhancing antitumor immunity[J]. Mol Cells, 2018, 41(7): 653–664. DOI:10.14348/molcells.2018.0040 |
| [23] | TRAN D D H, KOCH A, ALLISTER A, et al. Treatment with MAPKAP2 (MK2) inhibitor and DNA methylation inhibitor, 5-aza dC, synergistically triggers apoptosis in hepatocellular carcinoma (HCC) via tristetraprolin (TTP)[J]. Cell Signall, 2016, 28(12): 1872–1880. DOI:10.1016/j.cellsig.2016.09.002 |
| [24] | DONG F, LI C, WANG P, et al. The RNA binding protein tristetraprolin down-regulates autophagy in lung adenocarcinoma cells[J]. Exp Cell Res, 2018, 367(1): 89–96. DOI:10.1016/j.yexcr.2018.03.028 |
| [25] | COELHO M A, DE CARNÉ TRÉCESSON S, RANA S, et al. Oncogenic RAS signaling promotes tumor immunoresistance by stabilizing PD-L1 mRNA[J]. Immunity, 2017, 47(6): 1083–1099. DOI:10.1016/j.immuni.2017.11.016 |



