自SMITH等[1]首次提出前路颈椎植骨融合术(anterior cervical discectomy and fusion, ACDF)以来,ACDF成为治疗颈椎病的标准术式。而椎间融合是ACDF的核心,它可以提供即刻稳定,维持颈椎生理曲度及椎间孔高度,促进植骨融合[2]。最早应用于颈椎前路椎间融合的是三面皮质自体髂骨,具有融合率高的优点(>90%)。但取骨需要另外切口,增加了供骨区疼痛、感染、血肿及神经损伤的风险,不利于患者早期功能康复。椎间融合器具有良好的支撑强度,可以避免取整块自体髂骨或减少取骨数量,成为临床常用的融合器械。尽管文献[2-3]报道临床应用效果良好,但是不同种类的融合器仍然存在自身的缺陷,影响脊柱的稳定。这些融合器均不具有促成骨的生物活性,需要设计较大的植骨窗口来实现椎体间融合,仍需要术中获取自体松质骨,难以避免取骨的创伤及并发症。
同种异体皮质骨椎间融合器不仅为脊柱前柱提供有效的支撑,而且保留良好的成骨能力,有较高的融合率。CLOWARD[4]于1958年首次报道应用冻干同种异体骨行脊柱融合术,疗效显著,融合率高,术后仅3例出现骨吸收。ZDEBLICK等[5]在一项研究中比较三面皮质冻干同种异体骨与自体骨在ACDF中的疗效,术后1年两组融合率差异无统计学意义。BAO等[6]在一项比较异体骨和自体骨用于颈椎融合术的研究中发现:两种植骨材料在随访时融合率没有显著性差异,融合情况良好,没有骨吸收等并发症发生。SUCHOMEL等[7]通过对使用异体腓骨环和自体髂骨行ACDF术的患者进行为期2年的随访,结果显示:异体腓骨环达到骨性融合时间略长于对照组,但两组患者末次随访时融合率及下沉率差异无统计学意义。尽管与自体骨相比,同种异体骨有一些优势,但早期的产品主要是异体股骨环和腓骨环,由于其不规则的外形,椎间植入后不能很好地贴合人体终板,术后容易导致融合器下沉、移位及假关节形成,也不能满足当代脊柱外科手术的要求。
因此,本课题组研发出一种适用于颈椎前路减压、椎间植骨融合术的解剖型同种异体骨颈椎椎间融合器(BioCage®)。该融合器采用冻干的同种异体骨为原料,由上下两片皮质骨拼接而成,上下终板形状按国人的颈椎解剖外形设计,终板骨性接触面积大,有利于载荷均匀分散,不易出现终板切割;上下终板表面设计了齿状突起,可有效地防止融合器的滑移,提供术后即刻稳定性;融合器具有7°的矢状位前凸角,有利于恢复颈椎正常生理前凸;融合器可透X线,便于术后观察融合情况。通过对BioCage®的临床病例进行回顾性分析,观察其临床疗效,与应用最多的PEEK融合器进行对比研究,进一步观察其安全性和有效性。
1 资料与方法 1.1 病例资料所有患者术前均签署知情同意书,该研究通过陆军军医大学第一附属医院伦理委员会批准[伦理审批号:2013年科研第(1)号],并在“中国临床试验注册中心”注册(注册号:ChiCTR-ONRC-13003112)。回顾性分析我院2015年1月至2016年12月采用BioCage®融合器和PEEK融合器行单节段ACDF手术的颈椎病患者80例,其中采用BioCage®融合器的患者43例,采用PEEK的患者37例。脊髓型颈椎病患者24例,神经根型颈椎病患者48例,混合型颈椎病患者8例。BioCage®组:男性29例,女性14例,年龄24~81(50.44±12.32)岁,随访时间12~36(29.60±3.65)个月。PEEK组:男性26例,女性11例,年龄24~78(49.31±11.84)岁,随访时间12~36(29.95±3.46)个月(表 1)。患者均由两位专科医师经过详细询问病史和临床体格检查,以及必要的辅助检查,均诊断明确。排除标准:孕妇、儿童及罹患精神疾病的患者,合并全身或局部感染、结核、肿瘤、椎体骨折等破坏终板的疾病,过敏体质或免疫抑制状态、依从性差、未能按时随访或随访时间不满1年的患者,合并严重心脑血管疾病、肝肾功能障碍或其他系统疾病患者,合并有高血压、糖尿病、重度骨质疏松、类风湿性关节炎或神经系统疾病的患者。
| 组别 | n | 年龄/岁 | 随访时间/月 | 神经根型颈椎病/n(%) | 脊髓型颈椎病/n(%) | 混合型颈椎病/n(%) | 手术时间/min | 出血量/mL | 住院天数/d |
| BioCage®组 | 43 | 50.44 | 29.60 | 26(60.5) | 13(30.2) | 4(9.3) | 119.23±34.21 | 91.16±56.24 | 5.60±1.31 |
| PEEK组 | 37 | 49.31 | 29.95 | 22(59.5) | 11(39.7) | 4(10.8) | 119.00±33.43 | 92.70±43.57 | 5.73±1.26 |
1.2 颈椎BioCage®的制备
在陆军军医大学第一附属医院骨库中取健康成年人-80 ℃条件下冻干3个月以上的股骨、胫骨、肱骨,将其粗加工为2条完整皮质骨条,剩余皮质骨材料加工为骨钉,把两条完整的皮质骨片拼成一个整体,利用钻床在拼接体对角线上从上到下加工出两个合适大小的带内螺纹钉孔,将前述加工好的骨钉旋入钉孔中,用铣床去除骨钉多余部分,在数控机床上对拼接体加工出中央植骨孔、表面弧度及“齿状”凸起,通过后期脱脂、脱蛋白、超声清洗、表面脱矿、冷冻干燥等处理,完成整套加工程序,成品如图 1所示。

|
| 图 1 新型同种异体骨颈椎椎间融合器(BioCage®)外观 |
1.3 观察指标及测量方法
两组患者术前均摄颈椎正侧位片、过伸、过屈位X线片及CT、MRI检查,明确病变部位、性质、脊髓损害程度以及手术节段。比较两组患者术前、术后及末次随访时的VAS和NDI评分,影像学观察比较两组患者术前、术后及随访时的颈椎曲度、椎间高度、融合器位置和融合情况。颈椎曲度的测量采用Cobb法测定;融合器位置通过测量融合器后缘到椎体后缘的距离(D-PCW)判断;椎间高度通过椎体前缘高度+椎体后缘高度/2(FSH)表示;融合器下沉通过术后6个月FSH-术后即刻FSH获得,定义高度下降>2 mm为下沉(图 2)。椎体间的融合情况判断标准:在融合器与骨接触面上无透亮带形成;在颈椎动力位片上,椎体间的活动<5°,棘突间隙改变<1 mm;CT重建扫描图像上,融合器周围或内部有明显的骨长入连续性。
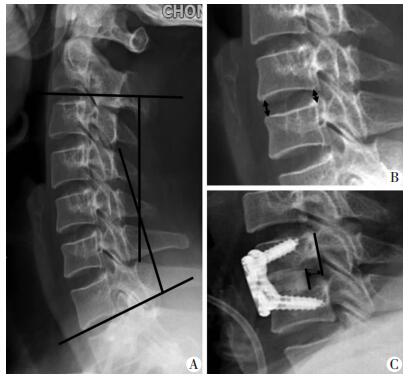
|
| A:颈椎曲度:C2-C7 Cobb角;B:椎间隙高度;C:融合器后缘到椎体后缘的距离 图 2 评价融合器相关指标的测量方法 |
1.4 手术方法
所有患者均采用ACDF术式,常规辅以前路钢板螺钉内固定系统。全麻后,取仰卧位,头稍过伸固定,C臂X线透视下定位手术节段。常规消毒铺巾,取颈部右侧横切口,依次切开皮肤、皮下组织及颈阔肌,电凝止血,沿肩胛舌骨肌内侧与胸骨舌骨肌和甲状胸骨肌之间间隙分离进入,到达椎体前缘。再次在C臂X线透视下,确定责任椎间隙,切开前纵韧带,显露椎间盘,于上位椎体及下位椎体安装撑开器撑开责任椎间隙,用尖刀切开纤维环,刮匙除尽髓核组织和软骨终板,直达后纵韧带,注意避免损伤骨性终板。将椎体前缘增生的骨赘及减压过程中获得的少量自体骨组织,制成米粒大小备用。试模测试椎间隙高度后,选择合适型号融合器,将自体骨颗粒压入融合器上的植骨窗口(PEEK组常需要另作切口获取少量自体髂前上棘的松质骨),随后将融合器植入责任椎间隙中。移除撑开器。选择合适长度前路钢板,植入螺钉固定。C臂X线确认融合器及内固定位置满意,清点器械,冲洗切口,留置硅胶引流管并逐层缝合。术后24 h拔除引流,并在颈托保护下下床活动,4周后去除颈托。
1.5 统计学分析应用SPSS 19.0统计软件进行分析,计量资料采用x±s表示,同一指标多时点重复观测比较采用单因素方差分析,先进行方差齐性检验,方差齐性采用LSD检验,方差不齐采用Dunnett’s T3检验。组间差异采用t检验比较。检验水准:α=0.05。
2 结果患者手术时间、失血量、住院天数如表 1所示,术中、术后无死亡、神经损伤、深部感染、心肺功能下降等发生。术后及末次随访无钢板螺钉断裂,融合器滑出等并发症。所有患者末次随访时均获得骨性融合,无假关节形成。两组病例在年龄、性别、术前诊断、手术时间及住院天数方面差异无统计学意义(P>0.05,表 1)。
2.1 BioCage®治疗单节段颈椎病的临床结果术后与末次随访时VAS和NDI评分明显低于术前(P < 0.05),末次随访时评分最低(P < 0.05),患者临床症状得以持续改善。两组组间比较差异无统计学意义(P>0.05,图 3)。
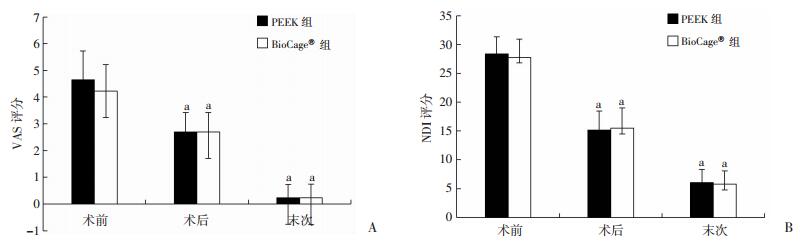
|
| a:P < 0.05,与术前比较;A:VAS评分;B:NDI评分 图 3 两组患者临床功能评分 |
2.2 影像学结果 2.2.1 颈椎曲度
PEEK融合器同样可以很好地恢复并维持局部节段和颈椎整体的生理曲度。组间比较术后颈椎曲度、FSA恢复度数以及末次随访丢失度数,两组差异无统计学意义(P>0.05)。表明新型同种异体骨融合器可以与PEEK融合器一样,在单节段颈椎ACDF手术中很好的维持颈椎的生理曲度(图 4)。
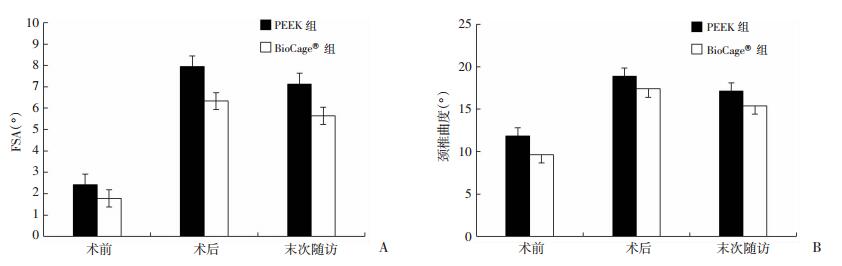
|
| A:FSA;B:颈椎曲度 图 4 患者局部及整体颈椎曲度变化 |
2.2.2 椎间高度
BioCage®组椎间隙高度(FSH)术前为(4.50±0.91)mm,术后为(8.02±0.99)mm,术后椎间高度明显恢复,差异有统计学意义(P < 0.01),末次随访椎间高度为(7.22±0.72)mm,与术后即刻相比,高度丢失差异有统计学意义(P < 0.01),但患者未见相关症状及不良反应。PEEK组FSH术前为(4.29± 0.74)mm,术后为(7.68±0.93)mm,术后椎间高度明显恢复,差异有统计学意义(P < 0.01),末次随访椎间高度为(7.03±0.55)mm,随访中高度丢失差异有统计学意义(P=0.002),但患者同样未见相关症状及不良反应。两组组间比较差异无统计学意义(P>0.05)。结果显示,在单节段ACDF手术中,BioCage®融合器与PEEK融合器均可有效恢复病变节段的椎间高度。
2.2.3 融合器位置由于术后1年椎间融合器实现骨性融合,后缘显示不清,故观察融合器是否移位的测量指标限定在1年内。BioCage®组D-PCW:术后为(5.70±1.93)mm,术后1年为(5.96±1.91)mm,差异无统计学意义(P>0.05)。PEEK组:术后为(4.82±1.61)mm,术后1年为(4.90±1.64)mm,差异无统计学意义(P>0.05)。结果显示:在单节段ACDF手术中该同种异体骨椎间融合器植入后稳定,没有发生明显的移位,具有稳定性。
2.2.4 融合率术后3个月,根据CT判断BioCage®组全部融合,融合率为100%(43/43),PEEK组有1例未融合,融合率为97.3%(36/37)。未融合病例无内固定松动或移位,没有神经或脊髓受压症状,未行二次手术且随访至术后6个月后完全融合(图 5、6)。
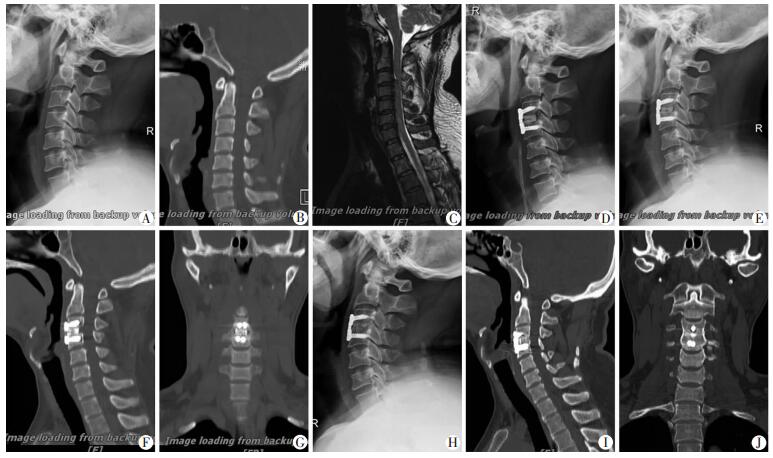
|
| A~C:术前侧位片、CT及MRI;D:术后3 d侧位片;E~G:术后3个月侧位片及CT三维重建,显示已达骨性融合,椎间可见融合器的高密度皮质骨影像;H~J:术后3年侧位片及CT三维重建,侧位片未见融合器影像,CT上椎间未见融合器高密度皮质骨影像,椎间密度与邻近椎体相近,提示已被新骨爬行替代 图 5 BioCage®融合器治疗单节段颈椎病 |

|
| A~B:术前侧位片、MRI;C~E:术后3个月X线片及CT三维重建,显示部分融合;F~H:术后6个月侧位片及CT三维重建,侧位片见融合征象,CT上提示骨融合 图 6 PEEK融合器治疗单节段颈椎病 |
2.2.5 融合器下沉
术后随访观察发现BioCage®组高度丢失为(1.47±0.23)mm,下沉率为20.9%(9/43),PEEK组高度丢失为(1.52±0.57)mm,下沉率为21.6%(8/37),两组之间高度丢失及下沉率差异均无统计学意义(P>0.05)。
本组患者中共有17例患者术后出现融合器下沉,其中BioCage®组9例,PEEK组8例,VAS及NDI评分分别降低3.94(5.09~1.15)、26.87(35.34~8.47),与未下沉患者VAS及NDI评分改善差异无统计学意义(P>0.05)。说明融合器下沉未影响患者术后功能改善(表 2)。
| 功能评分 | 下沉组(S) | 非下沉组(N-S) | P值 | |||||
| 术前 | 末次 | 改善分数 | 术前 | 末次 | 改善分数 | |||
| VAS | 5.09±1.47 | 1.15±0.82 | 3.94±1.23 | 5.67±1.53 | 1.21±0.95 | 4.46±1.07 | 0.61 | |
| NDI | 35.34±6.48 | 8.47±2.98 | 26.87±6.52 | 35.80±5.44 | 7.92±3.17 | 27.88±6.72 | 0.89 | |
2.2.6 并发症
80例患者术后均未发生神经或脊髓损伤、深部感染等并发症,随访中未发现严重融合器下沉(>3 mm)、移位、脱出、内固定松动等。术后6例患者(BioCage®组2例,PEEK组4例)诉轻微吞咽不适,经对症处理后,症状均在6~12个月后消失。BioCage®组1例术后发生脑脊液漏,经保守对症处理后痊愈。
3 讨论尽管目前部分研究表明手术节段是否融合与该术式疗效没有必然联系,但越来越多的证据表明坚强的骨性融合是颈椎活动稳定性的前提,可获得更为理想的疗效。由此可见,选择合适的骨移植材料对术后实现骨融合尤为重要。理想的椎间融合器应满足以下几点:生物相容性和表面化学性质可以使融合器周围细胞与细胞外基质接触时很少产生炎症反应,高孔隙率作用下便于物质交换,弹性模量要与松质骨植骨区相匹配,而且在新生骨和椎间融合器之间的动态应力能够保持材料的支撑作用,生物安全性高[8]。
同种异体骨有较强的骨传导和骨诱导作用,具有天然的三维网状结构,富含成骨所需的多种生长因子。除了具有很好的成骨能力,同种异体骨椎间融合器还能为前柱提供充分的轴向支撑,避免椎间高度丢失。近年来,根据椎间隙解剖学特点设计出的同种异体骨椎间融合器逐渐应用于脊柱融合手术,避免了传统同种异体股骨环、腓骨环无法完美匹配终板的问题,取得可观的疗效。ARNOLD[9]报道了一种用于腰椎后路融合手术的同种异体骨椎间融合器,该融合器由两片皮质骨拼接而成,表面有齿状突起,随后进行了一项多中心前瞻性研究,术后1年融合率达98%。KAO等[10]通过随访73例使用同种异体骨、自体髂骨或融合器行ACDF术患者,发现同种异体骨组融合率高达97.6%。本研究中,43例使用颈椎BioCage®治疗单节段颈椎病患者,术后3个月全部融合,与PEEK相比,融合率更高,表明该同种异体骨椎间融合器有极佳的融合效果。
颈椎矢状位平衡与术后临床疗效相关,是随访中需要关注的另一重要指标。颈椎矢状位平衡对脊柱整体平衡至关重要,生理曲度的丢失会导致疼痛甚至功能障碍,而且可能加速邻近节段的退变[11-14]。KULKARNI[15]对使用PEEK融合器行单节段ACDF术的15例病例进行随访,发现术后颈椎曲度较术前明显增大,随访过程中曲度逐渐丢失,末次随访时颈椎曲度仅比术前增加了0.9°。本研究中,BioCage®组和PEEK组术后颈椎曲度和融合节段曲度较术前均明显增大,末次随访时颈椎曲度和融合节段曲度分别丢失2.0°、0.7°;1.7°、0.9°,与术后相比差异无统计学意义(P>0.05),很好地维持了颈椎的前凸角度,保持颈椎矢状面的平衡。
融合器下沉是融合中需要重点关注的问题。BARSA[11]发现ACDF术后13.2%的患者随访中发生明显的融合器下沉,而BARTEL[12]报道中下沉率更是高达29.2%。PEEK融合器下沉发生率为8%~32%[13-15]。本研究中,BioCage®组下沉率为20.9%,PEEK组下沉率为21.6%,两组之间比较差异无统计学意义(P>0.05)。两种融合器下沉率相似的原因,一种解释可能是两者弹性模量相近;另一解释可能是两者融合大小规格接近,均小于15 mm×13 mm。研究表明,在条件允许情况下,使用更大规格(长×宽)的椎间融合能有效降低下沉率。在腰椎融合术中,术中植入更大的融合器能有效减少融合器相关并发症的发病率[16]。
许多研究观察融合器下沉与椎间高度丢失以及与临床症状改善的相关性。一些学者认为融合器下沉与椎间高度丢失和生理曲度变化相关,术后发生融合器下沉的患者和未发生下沉的患者相比,临床疗效更差,不融合发生率更高[14, 17-18]。在一项5年随访的研究中,观察者发现局部和整体颈椎曲度在非下沉组与下沉组差异无统计学意义。融合器下沉也没有影响术后患者功能的改善。因此得出结论:融合器的下沉与患者的临床效果没有必然联系[19]。早期的研究认为造成这一矛盾的主要原因是测量方法的不同和人们对下沉的定义有差异。近期KAST等[20]的一项回顾性研究证实,不管使用什么测量方法或者如何定义下沉,融合器的下沉对临床疗效都没有影响。本研究中同样证实了这一观点,术后平均椎间隙高度较术前增加了3.44 mm,术后1年平均椎间隙高度丢失1.58 mm,尽管所有患者随访过程中均有不同程度的椎间高度丢失,但未发现严重的融合器下沉(>3 mm)。在下沉组和非下沉组中,术后VAS、NDI评分改善差异无统计学意义(P>0.05)。融合器下沉并没有引发相关的临床症状,且对融合率没有影响。
本研究的不足之处:①本研究为回顾性研究,样本量较少。②病例中随访时间不够长,需要更长时间随访,评估融合器远期疗效。③没有评估该同种异体骨椎间融合器在多节段和不融合高风险人群中的治疗效果。④前路钢板的使用、不同术者对两种融合器掌握程度的差异性也可能对结果造成干扰,引起一定的偏倚。未来,我们将进行大样本、前瞻性对照研究,进一步评估这一同种异体骨融合器的临床应用效果,为今后设计出更符合正常颈椎生理和生物力学环境的融合器提供参考。
颈椎BioCage®融合器在单节段颈椎病的治疗中取得了满意疗效,具有融合时间早、融合率高、无须另外获取自体骨等优点,融合率和融合速度优于PEEK融合器,在体内能够被吸收同时并被新生骨所取代,两组患者在椎间隙高度丢失及融合器下沉发生率差异无统计学意义(P>0.05),且融合器下沉与患者术后症状功能恢复改善无直接明确相关性。
| [1] | SMITH G W, ROBINSON R A. The treatment of certain cervical-spine disorders by anterior removal of the intervertebral disc and interbody fusion[J]. J Bone Joint Surg Am, 1958, 40-A(3): 607–624. |
| [2] | CHEN Y, WANG X W, LU X H, et al. Comparison of titanium and polyetheretherketone (PEEK) cages in the surgical treatment of multilevel cervical spondylotic myelopathy: A prospective, randomized, control study with over 7-year follow-up[J]. Eur Spine J, 2013, 22(7): 1539–1546. DOI:10.1007/s00586-013-2772-y |
| [3] | OFLUOGLU A E, ERDOGAN U, AYDOGAN M, et al. Anterior cervical fusion with interbody cage containing beta-tricalcium phosphate: Clinical and radiological results[J]. Acta Orthop Traumatol Turc, 2017, 51(3): 197–200. DOI:10.1016/j.aott.2017.03.001 |
| [4] | CLOWARD R B. The anterior approach for removal of ruptured cervical disks[J]. J Neurosurg, 1958, 15(6): 602–617. DOI:10.3171/jns.1958.15.6.0602 |
| [5] | ZDEBLICK T A, DUCKER T B. The use of freeze-dried allograft bone for anterior cervical fusions[J]. Spine(Phila Pa 1976), 1991, 16(7): 726–729. DOI:10.1097/00007632-199107000-00006 |
| [6] | BAO D, MA Y Z, CHEN X, et al. Exploratory development of titanium mesh with bone allograft in treatment of cervical spinal tuberculosis[J]. Chin J Surg, 2010, 48(2): 112–115. |
| [7] | SUCHOMEL P, BARSA P, BUCHVALD P, et al. Autologous versus allogenic bone grafts in instrumented anterior cervical discectomy and fusion: a prospective study with respect to bone union pattern[J]. Eur Spine J, 2004, 13(6): 510–515. DOI:10.1007/s00586-003-0667-z |
| [8] | GERCEK E, ARLET V, DELISLE J, et al. Subsidence of stand-alone cervical cages in anterior interbody fusion: warning[J]. Eur Spine J, 2003, 12(5): 513–516. DOI:10.1007/s00586-003-0539-6 |
| [9] | ARNOLD P M, ROBBINS S, PAULLUS W, et al. Clinical outcomes of lumbar degenerative disc disease treated with posterior lumbar interbody fusion allograft spacer: A prospective, multicenter trial with 2-year follow-up[J]. Am J Orthop, 2009, 38(7): E115–E122. |
| [10] | KAO F C, NIU C C, CHEN L H, et al. Maintenance of interbody space in one- and two-level anterior cervical interbody fusion: comparison of the effectiveness of autograft, allograft, and cage[J]. Clin Orthop Relat Res, 2005(430): 108–116. DOI:10.1097/01.blo.0000142626.90278.9e |
| [11] | BARSA P, SUCHOMEL P. Factors affecting sagittalmalalignment due to cage subsidence in standalone cage assisted anterior cervical fusion[J]. Eur Spine J, 2007, 16(9): 1395–1400. DOI:10.1007/s00586-006-0284-8 |
| [12] | BARTELS R H, DONK R D, FEUTH T. Subsidence of stand-alone cervical carbon fiber cages[J]. Neurosurg, 2006, 58(3): 502–508. DOI:10.1227/01.NEU.0000197258.30821.50 |
| [13] | KWON W K, KIM P S, AHN S Y, et al. Analysis of associating factors with C2-7 sagittal vertical axis after two-level anterior cervical fusion: comparison between plate augmentation and stand-alone cages[J]. Spine, 2017, 42(5): 318–325. DOI:10.1097/BRS.0000000000001776 |
| [14] | HYUN S J, KIM K J, JAHNG T A, et al. Relationship between T1 slope and cervical alignment following multilevel posterior cervical fusion surgery: impact of T1 slope minus cervical lordosis[J]. Spine, 2016, 41(7): E396. DOI:10.1097/BRS.0000000000001264 |
| [15] | KULKARNI A G, HEE H T, WONG H K. Solis cage (PEEK) for anterior cervical fusion: preliminary radiological results with emphasis on fusion and subsidence[J]. Spine J, 2007, 7(2): 205–209. DOI:10.1016/j.spinee.2006.03.002 |
| [16] | OH H S, SHIM C S, KIM J S, et al. Clinical and radiological comparison of femur and fibular allografts for the treatment of cervical degenerative disc diseases[J]. J Korean Neurosurg Soc, 2013, 53(1): 6–12. DOI:10.3340/jkns.2013.53.1.6 |
| [17] | RAMNARAIN A, GOVENDER S. Fibular allograft and anterior plating for dislocations/fractures of the cervical spine[J]. Indian J Orthop, 2008, 42(1): 83–86. DOI:10.4103/0019-5413.38587 |
| [18] | YUE W M, BRODNER W, HIGHLAND T R. Long-term results after anterior cervical discectomy and fusion with allograft and plating: A 5- to 11-year radiologic and clinical follow-up study[J]. Spine, 2005, 30(19): 2138–2144. DOI:10.1097/01.brs.0000180479.63092.17 |
| [19] | MARTIN G J Jr, HAID R W Jr, MACMILLAN M, et al. Anterior cervical discectomy with freeze-dried fibula allograft. Overview of 317 cases and literature review[J]. Spine(Phila Pa 1976), 1999, 24(9): 852–858. DOI:10.1097/00007632-199905010-00004 |
| [20] | KAST E, DERAKHSHANI S, BOTHMANN M, et al. Subsidence after anterior cervical inter-body fusion. A randomized prospective clinical trial[J]. Neurosurg Rev, 2009, 32(2): 207–214. DOI:10.1007/s10143-008-0168-y |



