2. 401120 重庆,重庆医科大学附属第三医院皮肤整形美容中心
2. Center of Skin and Plastic Surgery, the Third Affiliated Hospital of Chongqing Medical University, Chongqing, 401120, China
硅胶乳房假体是目前最常用的隆乳假体材料,但术后较高的包膜挛缩率一直被诟病。BUI等[1]研究发现硅胶挛缩包膜的Ⅰ型胶原(CollagenⅠ)含量和肌成纤维细胞的特异性标志物(α-SMA)免疫活性明显高于非挛缩包膜,且挛缩包膜的组织硬度也比非挛缩包膜高。包膜本质上是一种纤维化改变,主要由(肌)成纤维细胞及其合成并沉积的大量胶原成分组成。成纤维细胞在创面愈合及重塑中发挥着关键作用[2],当硅胶假体植入体内后,伤口的愈合及重塑过程始终与硅胶假体表面接触,硅胶表面的机械性能可直接影响成纤维细胞的生物学行为。因此,我们推测硅胶假体硬度在包膜纤维化直至挛缩的发生、发展中发挥了关键作用。
此外,人们已经认识到细胞外基质(extracellular matrix,ECM)硬度可通过影响整合素介导的局部黏着斑形成来调控细胞粘附,进而影响细胞增殖[3]。当细胞与基底或ECM粘附不良时,将启动细胞内的失巢凋亡(anoikis)最终导致细胞死亡[4-5],但同时也激活细胞自噬活性,促使细胞重新粘附,从而促进细胞的存活和增殖[6]。同时,在肾纤维化研究中发现自噬还可抑制胶原的合成[7]。但是目前还没有关于自噬与硅橡胶硬度在影响成纤维细胞增殖和表达α-SMA、CollagenⅠ方面的研究。基于此,我们在该研究中通过对比人真皮成纤维细胞在不同硬度硅橡胶表面增殖和自噬活性的差异,以及不同硬度硅橡胶和不同自噬水平下细胞表达α-SMA和CollagenⅠ的情况,来揭示自噬与硅橡胶硬度如何影响成纤维细胞的生物学行为,为硅橡胶的进一步研究和应用提供参考。
1 材料与方法 1.1 材料 1.1.1 材料与主要仪器A、B双组分医用液态硅胶(成都晨光化工研究院);邵氏A型硬度计(北京卓川电子科技有限公司);470型傅里叶变换红外吸收光谱仪(FTIR,Thermo Ni-colet,美国);SAP 400原子力显微镜(AFM,精工仪器,日本);ESCALAB 250型X射线光电子能谱分析仪(XPS,Thermo Scientific,美国);水接触角测定仪(Kyowa,日本);微孔板分光光度计(Thermo, 美国);激光共聚焦显微镜(Leica,德国);蛋白转印仪(Bio-Rad,美国);ELISA试剂盒(α-SMA, 武汉华美生物工程有限公司; CollagenⅠ, 武汉博士德生物科技有限公司)。
1.1.2 细胞与试剂正常人包皮(取得患者知情同意并通过伦理学专家审查)提取原代真皮成纤维细胞,取第4代以上人真皮成纤维细胞进行实验。DMEM培养基(Gibco);10%胎牛血清(FBS, Gibco);CCK-8(Dojindo, 日本);自噬抑制剂3-MA(3-甲基腺嘌呤;MCE,美国);自噬诱导剂西罗莫司(MCE,美国);鼠抗人P62抗体(Abcam,英国);兔抗人Beclin 1抗体(Abcam,英国);兔抗人LC3抗体(Sigma,美国);内参GAPDH(CST,美国);FITC荧光标记肌动蛋白探针(碧云天, 中国);Hoechst33342(碧云天,中国)。
1.2 方法 1.2.1 不同硬度硅橡胶制备将A、B组分液态硅胶按A :B=9 :1、8 :2、7 :3、6 :4、5 :5、4 :6、3 :7、2 :8、1 :9比例充分混合,然后浇铸到平整光滑的金属模具上,室温硫化,制成100 mm×100 mm×1 mm规格的不同硬度的硅橡胶片。部分硅橡胶被修剪成96孔板、6孔板内孔径大小圆形以及10 mm×10 mm大小方形的小块材料备用。
1.2.2 硅橡胶机械性能检测邵氏硬度测定。将受测样品在75%医用酒精中浸泡3 min,然后用去离子水超声冲洗15 min,在50 ℃环境下干燥。将3块受测样品重叠(确保测试样品的厚度),放置在一个厚度为5 mm的平整光滑金属板上,邵氏A型硬度计测试邵氏硬度。两个测试点之间的间距大于6 mm,测试点距离样本边缘的距离为20 mm。每个样本测定6次,取平均值作为测定值。
其他表面性能检测。综合分析材料各种机械性能和细胞增殖差异后选取硬度和细胞增殖均有显著差异的两组硅橡胶,分别为高硬度stiff组(邵氏硬度11~13HA),低硬度soft组(邵氏硬度7~9HA)。待测硅橡胶片被切成10 mm×10 mm的正方形,用无水酒精进行清洗。酒精挥发后,采用FTIR测定材料表面吸收和反射光谱。原子力显微镜对表面形貌进行检测。XPS检测硅橡胶样品表面是否有吸附杂质。在待测硅橡胶的表面添加去离子水,用接触角测定仪测定样品表面的水接触角,以反映其疏水性。
1.2.3 细胞培养硅橡胶接种细胞前用75%医用酒精浸泡30 min消毒,然后以PBS冲洗3次,与其他实验材料同时置于超净工作台紫外线照射30 min。培养基为DMEM与10%FBS混合的完全培养基,成纤维细胞接种在硅橡胶片上,在37 ℃恒温、5%CO2加湿孵箱中孵育。
1.2.4 成纤维细胞增殖实验将消毒的硅橡胶片按不同硬度分组平铺在96孔板底部,每组设置6个复孔,每孔接种5×103个细胞,在前述条件下培养48 h。然后舍弃原培养基,每孔加入新配制的含5 mg/mL CCK-8试剂的培养液,继续孵育4 h,测定450 nm波长下的光密度值[D(450)]。
1.2.5 Western blot检测自噬标志蛋白细胞处理及分组:将两种消毒好的硅橡胶片平铺在6孔板底部,每组设置3个复孔,每孔加入2 mL的密度为2×105个/mL的成纤维细胞悬液,预培养24 h,然后按以下分组进行后续实验。正常组:soft+PBS, stiff+PBS;3-MA组:soft+3-MA(5 mmol/L), stiff+3-MA(5 mmol/L);西罗莫司组:soft+西罗莫司(100 nmol/L),stiff+西罗莫司(100 nmol/L)。
Western blot:加入3-MA和西罗莫司后继续培养4 h后,用含蛋白酶抑制剂PMSF的RIPA裂解液(碧云天,中国)裂解细胞并收集总蛋白。BCA法测定蛋白含量,并根据样品蛋白浓度,将样品浓度稀释到同一值。蛋白上样量为15 μg,SDS-PAGE电泳完成后,转膜至PVDF膜(Millipore,美国),将膜移至含TBST液的平皿中,5%的TBST脱脂牛奶封闭2 h。一抗p62(1 :4 000)、Beclin 1(1 :2 000)、LC3(1 :1 000)、GAPDH(1 :6 000),4 ℃孵育过夜,二抗(抗兔1 :5 000;抗鼠1 :6 000)室温孵育2 h后,配制显色试剂,在凝胶成像系统成像。
1.2.6 激光共聚焦实验按1.2.5所述分组,将已消毒的10 mm×10 mm方形硅橡胶片平铺于12孔板底部,每组设3个复孔,每孔加入1 mL密度为5×104个/mL的人真皮成纤维细胞悬液,预培养24 h后取出,分别加入3-MA、西罗莫司和PBS溶液,继续培养4 h后取出,弃培养液,4%多聚甲醛溶液0.5 mL固定细胞30 min,0.1% Triton X-100 0.2 mL室温下静置30 min穿孔,10%山羊血清室温封闭30 min,FITC抗体避光孵育1 h,Hoechst33342室温避光孵育1 h,封片后置于激光共聚焦显微镜下观察硅胶片表面成纤维细胞细胞骨架和形态。
1.2.7 ELISA法定量检测α-SMA和CollagenⅠ按1.2.5所述方法培养细胞并收集蛋白后,按ELISA试剂盒说明书操作绘制出标准曲线,再用所得公式计算样品中α-SMA以及CollagenⅠ的含量。
1.3 统计学分析应用SPSS 22.0统计学软件进行分析,两独立样本均数比较采用t检验,两组以上样本均数比较采用单因素方差分析。检验水准:α=0.05。所有统计结果采用GraphPad Prism 7软件作图。
2 结果 2.1 硅橡胶硬度及其他表面性能评价双组分液态硅橡胶A和B组分在按不同比例混合固化后得到不同硬度的硅橡胶,但因A :B=1 :9硬度过低,未能固化。以上硅橡胶的邵氏硬度如图 1A所示,随着B组液态硅胶占比增加,硅橡胶的硬度逐渐下降,所有材料的邵氏硬度介于3.0~13.0 HA之间,A :B=9 :1组硬度最高(11.550±0.887)HA,A :B=2 :8组硬度最低(4.556±0.988)HA。我们同时检测了各组硬度硅橡胶的断裂伸长率,以反映其抗拉伸张力的特性,可见更高硬硅橡胶的抗拉伸能力也更强(图 1B)。stiff组硬度(11.550±0.887)HA与soft组硬度(4.556±0.988)HA硅橡胶表面形貌(图 2A)、XPS检测结果(图 2B)、表面分子结构(图 2C)和水接触角检测结果(图 2D)在两组硅橡胶之间均没有显著区别。因此,在本实验中,硅橡胶硬度是影响细胞增殖的主要因素。

|
| A:系列硅橡胶邵氏硬度;B:系列硅橡胶断裂伸长率;C:CCK-8法检测细胞增殖结果;D:单细胞面积检测结果a:P < 0.05,与A :B=9 :1比较 图 1 硅橡胶硬度和断裂伸长率检测结果及其表面细胞增殖检测结果 |

|
| A、B:AFM检测表面粗糙度;C、D:XPS检测表面元素组成;E:FTIR检测表面杂质;F:水接触角检测结果 图 2 stiff组与soft组两种硅橡胶的几种表面机械性能检测结果 |
2.2 成纤维细胞在高硬度硅橡胶表面增殖能力增强
人真皮成纤维细胞在硅橡胶上培养48 h后,CCK-8实验检测到不同硬度的硅橡胶表面生长的细胞显著不同,随着硅橡胶邵氏硬度的增加,细胞增殖能力随之增强,差异有统计学意义(P < 0.05,图 1C)。使用Image-Pro Plus version 6.0 (Media Cybernetics, 美国)测量细胞面积,可见随着硅橡胶硬度的增加,单个细胞面积也随之变大,差异有统计学意义(P < 0.05,图 1D)。
2.3 成纤维细胞在高硬度硅橡胶上自噬活性增加在stiff和soft组硅橡胶表面,成纤维细胞的增殖能力和细胞形态差异均有统计学意义(P < 0.05)。Western blot检测结果显示两组的Beclin 1、LC3-Ⅱ、p62条带清晰(图 3A),stiff组LC3-Ⅱ/GAPDH比值显著高于soft组,差异有统计学意义(P < 0.01,图 3B)。在加入3-MA后,Western blot检测结果显示两种硅橡胶上Beclin 1及LC3Ⅱ均明显减少,p62增多。CCK-8实验检测分别加入3-MA、西罗莫司后,两组硅橡胶表面上成纤维细胞的增殖活力均随着自噬的抑制和增强出现减弱和增加,差异有统计学意义(P < 0.01,图 3C)。通过细胞骨架染色结果可以看出,在不同自噬水平下,细胞数目、形态、单细胞面积均有明显差别,高硬度或高自噬活性条件下,成纤维细胞数目增多,形态更舒展,单细胞面积增大(图 3D)。
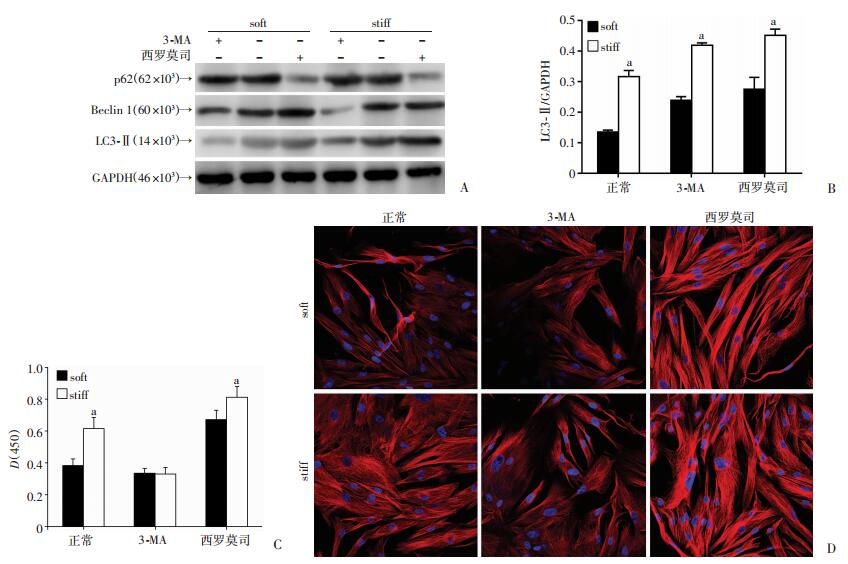
|
| A:Western blot检测soft和stiff两组材料上细胞自噬标志蛋白表达;B:各组LC3-Ⅱ/GAPDH比值变化;C:不同自噬水平下两组硅橡胶上细胞增殖能力a:P < 0.01, 与soft组比较;D:激光共聚焦显微镜观察不同自噬水平下两组硅橡胶上细胞骨架形态及细胞数目(×400) 图 3 不同自噬诱导条件下成纤维细胞在两种硅橡胶表面增殖情况及自噬蛋白检测结果 |
2.4 成纤维细胞在高硬度硅橡胶上表达α-SMA和CollagenⅠ降低
ELISA测定结果显示(图 4),正常情况下soft组表达α-SMA和CollagenⅠ显著高于stiff组。施加3-MA抑制自噬后,soft组和stiff组细胞表达α-SMA、CollagenⅠ均明显增加,其中α-SMA差异无统计学意义(P>0.05),CollagenⅠ差异有统计学意义(P < 0.01)。施加西罗莫司激活自噬后可见两组细胞表达α-SMA、CollagenⅠ均显著下降,两组之间差异无统计学意义(P>0.05)。
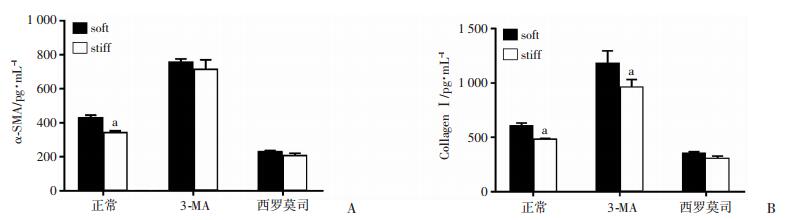
|
| a:P < 0.01,与soft组比较 图 4 ELISA检测不同自噬条件下成纤维细胞表达α-SMA和CollagenⅠ的结果 |
3 讨论
硅胶假体包膜挛缩的根本原因是由于肌成纤维细胞持续合成胶原蛋白并沉积在ECM中,不断加重纤维化,最终发生挛缩。因此,寻求可降低或抑制成纤维细胞合成胶原的新型硅胶假体是解决这一难题的途径之一。
在本研究中,我们首先观察到高硬度硅橡胶有促进成纤维细胞增殖的作用,说明高硬度硅橡胶的细胞相容性更好。这与FUSCO等[3]在不同硬度聚丙烯酰胺和聚二甲基硅氧烷材料上观察到的NIH/3T3细胞的增殖能力、细胞扩散面积、局部黏着斑(FAs)数量和大小均随着基质硬度的增加而增加的现象相符。为明确硅橡胶细胞相容性增加的特性对胶原合成的影响,我们对比了高、低硬度硅橡胶上成纤维细胞表达α-SMA和合成CollagenⅠ的差异,发现两者在高硬度硅橡胶上均下调。肌成纤维细胞持续合成胶原是众多纤维化疾病的共同基础,大量研究已经证实,组织硬度与肌成纤维细胞活力呈正相关,肌成纤维细胞活化合成更多的胶原沉积在ECM中,ECM硬度的增加反过来促进肌成纤维细胞进一步合成胶原,形成恶性循环[8-10]。说明适度增加硅橡胶硬度可以抑制成纤维细胞向肌成纤维细胞转化,并减少其胶原合成量,有利于抑制或减缓包膜的纤维化进程。
在探索硅橡胶硬度影响成纤维细胞向肌成纤维细胞转化和合成CollagenⅠ的机制的研究中,我们发现高硬度硅橡胶上的成纤维细胞的自噬活性明显更高,且人为抑制和激活自噬后细胞表达α-SMA和CollagenⅠ的量分别相应增加和降低,同时细胞增殖能力随自噬活性增加而增强。已有研究表明,自噬作为在饥饿等应激状态下促进细胞存活的一种机制,在促进细胞生长和增殖上也发挥重要作用[11]。自噬还是一种重要的抗凋亡机制,在细胞与基底或ECM粘附不良时被诱导,通过促进局灶性粘附重塑来调控整合素介导的细胞粘附和细胞存活及增殖[6, 12],尤其是在恶性肿瘤中,自噬可以促进失巢肿瘤细胞的存活和增殖,协助肿瘤细胞的远处转移[13-14]。另外,自噬可以通过多种途径参与ECM中胶原成分的代谢,ONG等[15]通过对比人正常角质形成细胞与瘢痕疙瘩细胞,发现mTOR是胶原表达的调节因子,抑制其活性可导致ECM沉积的减少,应用自噬诱导剂西罗莫司抑制mTOR后两种细胞均表现出剂量和时间依赖性地下调胶原蛋白和α-SMA的表达,表明激活自噬对ECM成分可产生负调控作用。KIM等[16]通过基因干扰或特异性siRNA敲除小鼠系膜细胞(MMC)中的Beclin 1,可导致细胞中CollagenⅠ水平升高,并证明诱导自噬能促进细胞内CollagenⅠ的降解,防止在肾脏中过多的胶原沉积,但在给予TGF-β1刺激促进成纤维细胞增殖及胶原合成的实验中却观察到下调的细胞自噬水平。DING等[17]也在敲除Beclin 1基因的MMC中观察到胶原蛋白的表达增加。可见自噬在促进细胞增殖和参与胶原代谢的过程中发挥了重要作用。
关于硬度与成纤维细胞转化和合成胶原的结论与既往的研究结论相反[18-19]。我们分析原因可能是由于创面修复是一个复杂的动态过程,在早期愈合与后期重塑阶段,ECM硬度与细胞间的相互作用也在不断变化。在早期,高硬度ECM促进成纤维细胞增殖,有利于创面修复,当进入重塑期后,成纤维细胞受到高硬度ECM的持续影响,大量增殖使细胞数量增加,合成胶原总量增加,从而加重胶原沉积促进纤维化。我们也将就这一问题以及硅橡胶硬度影响成纤维细胞生物学行为的分子机制继续开展研究,为新型硅橡胶材料的开发提供策略和思路。
| [1] | BUI J M, PERRY T, REN C D, et al. Erratum to: histological characterization of human breast implant capsules[J]. Aesthetic Plast Surg, 2015, 39(3): 316–317. DOI:10.1007/s00266-015-0473-0 |
| [2] | TOMASEK J J, GABBIANI G, HINZ B, et al. Myofibroblasts and mechano-regulation of connective tissue remodelling[J]. Nat Rev Mol Cell Biol, 2002, 3(5): 349–363. DOI:10.1038/nrm809 |
| [3] | FUSCO S, PANZETTA V, EMBRIONE V, et al. Crosstalk between focal adhesions and material mechanical properties governs cell mechanics andfunctions[J]. Acta Biomater, 2015, 23: 63–71. DOI:10.1016/j.actbio.2015.05.008 |
| [4] | GILMORE A P. Anoikis[J]. Cell Death Differ, 2005, 12(Suppl 2): 1473–1477. DOI:10.1038/sj.cdd.4401723 |
| [5] | HAUSMANN M, LEUCHT K, PLONER C, et al. BCL-2 modifying factor (BMF) is a central regulator of anoikis in human intestinal epithelial cells[J]. J Biol Chem, 2011, 286(30): 26533–26540. DOI:10.1074/jbc.M111.265322 |
| [6] | FUNG C, LOCK R, GAO S Z, et al. Induction of autophagy during extracellular matrix detachment promotes cell survival[J]. Mol Biol Cell, 2008, 19(3): 797–806. DOI:10.1091/mbc.e07-10-1092 |
| [7] | LI H Y, PENG X, WANG Y T, et al. Atg5-mediated autophagy deficiency in proximal tubules promotes cell cycle G2/M arrest and renal fibrosis[J]. Autophagy, 2016, 12(9): 1472–1486. DOI:10.1080/15548627.2016.1190071 |
| [8] | SANEYASU T, AKHTAR R, SAKAI T K. Molecular cuesguiding matrix stiffness in liver fibrosis[J]. Biomed Res Int, 2016, 2016: 2646212. DOI:10.1155/2016/2646212 |
| [9] | HERUM K M, LUNDE I G, MCCULLOCH A D, et al. The soft and hard-heartedness of cardiac fibroblasts:mechano-transduction signaling pathways in fibrosis of the heart[J]. J Clin Med, 2017, 6(5): E53. DOI:10.3390/jcm6050053 |
| [10] | HANDORF A M, ZHOU Y X, HALANSKI M A, et al. Tissue stiffness dictates development, homeostasis, and disease progression[J]. Organogenesis, 2015, 11(1): 1–15. DOI:10.1080/15476278.2015.1019687 |
| [11] | MIHAYLOVA MM, SHAW R J. The AMPK signalling pathway coordinates cell growth, autophagy and metabolism[J]. Nat Cell Biol, 2011, 13(9): 1016–1023. DOI:10.1038/ncb2329 |
| [12] | VLAHAKIS A, DEBNATH J. The interconnections between autophagy and integrin-mediated cell adhesion[J]. J Mol Biol, 2017, 429(4): 515–530. DOI:10.1016/j.jmb.2016.11.027 |
| [13] | NEW J, ARNOLD L, ANANTH M, et al. Secretory autophagy in cancer-associated fibroblasts promotes head and neck cancer progression and offers a novel therapeutic target[J]. Cancer Res, 2017, 77(23): 6679–6691. DOI:10.1158/0008-5472.CAN-17-1077 |
| [14] | MOWERS E, SHARIFI N, MACLEOD F. Autophagy in cancer metastasis[J]. Oncogene, 2017, 36(12): 1619–1630. DOI:10.1038/onc.2016.333 |
| [15] | ONG C T, KHOO Y T, MUKHOPADHYAY A, et al. MTOR as a potential therapeutic target for treatment of keloids and excessive scars[J]. Exp Dermatol, 2007, 16(5): 394–404. DOI:10.1111/j.1600-0625.2007.00550.x |
| [16] | KIM S I, NA H J, DING Y, et al. Autophagy promotes intracellular degradation of type I collagen induced by transforming growth factor (TGF)-β1[J]. J Biol Chem, 2012, 287(15): 11677–11688. DOI:10.1074/jbc.M111.308460 |
| [17] | DING Y, KIM S L, LEE S Y, et al. Autophagy regulates TGF-β expression and suppresses kidney fibrosis induced by unilateral ureteral obstruction[J]. J Am Soc Nephrol, 2014, 25(12): 2835–2846. DOI:10.1681/ASN.2013101068 |
| [18] | LIU B Y, KILPATRICK J I, LUKASZ B, et al. Increased substrate stiffness elicits a myofibroblastic phenotype in human lamina cribrosa cells[J]. Invest Ophthalmol Vis Sci, 2018, 59(2): 803–814. DOI:10.1167/iovs.17-22400 |
| [19] | SCHLUNCK G, HAN H, WECKER T, et al. Substrate rigidity modulates cell matrix interactions and protein expression in human trabecular meshwork cells[J]. Invest Ophthalmol Vis Sci, 2008, 49(1): 262–269. DOI:10.1167/iovs.07-0956 |



