2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系军队流行病学教研室;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院:胸外科;
4. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院:全军呼吸内科研究所,全军呼吸病研究重点实验室
2. Department of Epidemiology, Faculty of Military Preventive Medicine, Army Medical University(Third Military Medical University), Chongqing, 400038;
3. Department of Thoracic Surgery, Second Affiliated Hospital, Army Medical University(Third Military Medical University), Chongqing, 400037, China;
4. Institute of Respiratory Diseases, Key Laboratory of Respiratory Diseases, Second Affiliated Hospital, Army Medical University(Third Military Medical University), Chongqing, 400037, China
肺癌是世界上发病率最高的恶性肿瘤[1-2]。肺癌的病因至今仍不完全明确。长链非编码RNA(long non-coding RNAs,lncRNAs)是一种长度大于200 nt,缺乏蛋白质编码能力的RNA分子[3]。研究发现,lncRNAs能够影响多种癌细胞的生长和凋亡以及癌症的进展和转移[4-5]。大量研究也显示lncRNA在多种肿瘤中表达失调,包括胃癌、肝癌、结直肠癌、膀胱癌等[6-9]。NEAT1(核富集转录本1)是一个约3.7 kb的核富集lncRNA,位于染色体11q13.1上[10]。在肺癌研究中发现,NEAT1在肺癌组织和肺癌细胞系中表达上调,可以调控肺癌细胞的增殖和细胞周期以及迁移侵袭,NEAT1被认为是参与肺癌形成及转移的重要致癌基因[11-12]。目前,已有诸多研究显示外周血中存在着稳定表达的lncRNAs,并且这些lncRNAs具有作为肿瘤诊断标志物的巨大潜能[13-14]。然而,关于NEAT1在非小细胞肺癌患者外周血中的表达情况及其诊断价值目前研究较少。
本研究基于前期建立的肺癌患者生物样本库,采用qRT-PCR技术检测NEAT1在非小细胞肺癌患者、肺部良性病变患者及健康对照血浆中的表达水平,比较其在血浆中的差异表达,分析血浆NEAT1水平对肺癌的诊断价值。
1 材料与方法 1.1 材料与试剂 1.1.1 外周血血浆样本研究样本采集2012年12月至2018年5月陆军军医大学第二附属医院胸外科和呼吸内科,术前未进行任何放化疗治疗新近确诊的非小细胞肺癌和肺部良性病变患者外周血,分离血浆置于-80 ℃冰箱保存备用。健康对照来自门诊健康体检者。所有纳入的研究对象都知情同意,本研究通过陆军军医大学伦理委员会审批(20161002)。
1.1.2 试剂血浆RNA提取试剂TRIzol LS购自Life公司,糖原(Glycogen)购自碧云天公司,去基因组DNA反转录试剂盒、qPCR试剂盒购自TaKaRa公司。
1.2 方法 1.2.1 对照组纳入排除标准肺部良性病变患者纳入对象为慢性阻塞性肺病(COPD)患者、肺结核患者、肺炎患者等并排除肺癌和其他癌症。门诊体检的健康者排除任何癌症和其他疾病,所有对照与非小细胞肺癌患者在性别、年龄、吸烟史分布方面匹配。
1.2.2 血浆RNA提取取冻存的血浆样本于4 ℃自然融化,之后12 000×g,4 ℃条件离心10 min以沉淀血浆中杂质。取250 μL血浆加入750 μL TRIzol LS裂解液,旋涡震荡数秒后静置5 min,之后按照试剂说明书提取得到10 μL RNA。
1.2.3 引物合成NEAT1特异性引物设计根据GenBank中NEAT1的IncRNA序列采用Primer5.0进行设计,引物序列上游为5′-CTTCCTCCCTTTAACTTATCCATTCAC-3′,下游为5′-CTCTTCCTCCACCATTACCAACAATAC-3′,产物大小为116 bp。以β-actin作为内参,引物序列上游为5′-CCTGGCACCCAGCACAAT-3′,下游为5′-GGGCCGGACTCGTCATAC-3′,产物大小为144 bp,引物合成由上海生工生物公司完成。
1.2.4 qRT-PCR检测NEAT1表达水平参照试剂盒说明书将RNA逆转录为cDNA,以其为模板进行qPCR聚合酶链式扩增反应。反应体系为1 μL cDNA、12.5 μL 2X SYBR Premix、9.5 μL ddH2O、1 μL上游引物(浓度为10 μmol/L)、1 μL下游引物(浓度为10 μmol/L),体系体积共25 μL。反应程序为95 ℃ 30 s预变性;95 ℃ 5 s变性,60 ℃ 30 s退火延伸,共40个循环。反应结束后确认扩增曲线和溶解曲线,通过2-ΔΔCt法计算lncRNA的相对表达水平。
1.3 统计学分析采用SPSS 19.0软件进行统计学分析,测量数据用M(P25-P75)表示,采用Mann-Whitney U检验及Kruskal Wallis检验对测量数据进行比较,计数资料比较采用卡方检验,ROC曲线分析检验血浆NEAT1水平对非小细胞肺癌的诊断价值。检验水准α=0.05。
2 结果 2.1 肺癌患者及对照组的基本信息纳入研究的所有样本的基本信息见表 1。258例非小细胞肺癌样本中腺癌170例(65.9%),鳞癌88例(34.1%),72例(27.9%)肿瘤大小≤3 cm,发生淋巴结转移有130例(50.4%),117例(45.3%)发生远处转移。TNM分期中Ⅰ期和Ⅱ期共88例(34.1%),185例对照样本中包括健康对照70例(37.8%),慢性阻塞性肺病(COPD)患者56例(30.3%),肺结核36例(19.5%),肺炎15例(8.1%)。
| 项目 | 非小细胞肺癌组(n=258) | 对照组(n=185) |
| 年龄(岁) | ||
| ≤60 | 152(58.9) | 104(56.2) |
| >60 | 106(41.1) | 81(43.8) |
| 性别 | ||
| 男性 | 178(69.0) | 120(64.9) |
| 女性 | 80(31.0) | 65(35.1) |
| 吸烟 | ||
| 是 | 108(41.9) | 86(46.5) |
| 否 | 95(36.8) | 67(36.2) |
| 已戒 | 55(21.3) | 32(17.3) |
| 病理类型 | ||
| 腺癌 | 170(65.9) | - |
| 鳞癌 | 88(34.1) | - |
| 肿瘤大小 | ||
| ≤3 cm | 72(27.9) | - |
| >3 cm | 126(48.8) | - |
| 未知大小 | 60(23.3) | - |
| 淋巴转移 | ||
| 是 | 130(50.4) | - |
| 否 | 90(34.9) | - |
| 不确定 | 38(14.7) | - |
| 远处转移 | ||
| 是 | 117(45.3) | - |
| 否 | 121(46.9) | - |
| 不确定 | 20(7.8) | - |
| TNM分期 | ||
| Ⅰ+Ⅱ | 88(34.1) | - |
| Ⅲ+Ⅵ | 151(58.5) | - |
| 未知分期 | 16(7.4) | - |
| 对照的诊断 | ||
| 健康对照 | - | 70(37.8) |
| COPD | - | 56(30.3) |
| 肺结核 | - | 36(19.5) |
| 肺炎 | - | 15(8.1) |
| 其他 | - | 8(4.3) |
2.2 lncRNA NEAT1在非小细胞肺癌患者外周血血浆样本中高表达
非小细胞肺癌患者血浆中NEAT1(中位数为1.729,四分位数区间为1.171-2.853)较对照组(中位数为0.986,四分位数区间为0.607-1.699)高表达(P < 0.01,图 1)。
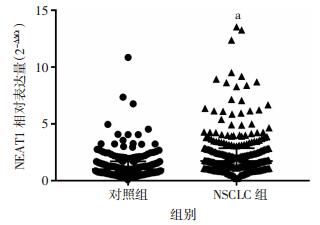
|
| a:P < 0.01,与对照组比较 图 1 血浆NEAT1在非小细胞肺癌与对照间的表达水平 |
| 项目 | 例数 | NEAT1表达水平[M(P25-P75)] | Z值/χ2值 | P值 |
| 年龄 | -2.146 | 0.032 | ||
| ≤60 | 152 | 1.664(1.070-2.634) | ||
| >60 | 106 | 1.945(1.275-3.295) | ||
| 性别 | -0.834 | 0.405 | ||
| 男 | 178 | 1.729(1.181-2.751) | ||
| 女 | 80 | 1.828(1.125-3.249) | ||
| 吸烟史 | 4.115 | 0.128 | ||
| 是 | 108 | 1.688(1.066-2.358) | ||
| 否 | 95 | 1.729(1.189-3.182) | ||
| 已戒 | 55 | 2.014(1.231-3.655) | ||
| 病理类型 | -0.533 | 0.594 | ||
| 腺癌 | 170 | 1.705(1.121-2.853) | ||
| 鳞癌 | 88 | 1.879(1.187-3.085) | ||
| 肿瘤大小 | -2.436 | 0.015 | ||
| ≤3 cm | 72 | 1.385(0.993-2.192) | ||
| >3 cm | 126 | 1.932(1.205-3.340) | ||
| 淋巴转移 | -1.449 | 0.147 | ||
| 是 | 130 | 1.866(1.208-2.770) | ||
| 否 | 90 | 1.542(1.074-3.122) | ||
| 远处转移 | -0.554 | 0.580 | ||
| 是 | 117 | 1.866(1.121-2.742) | ||
| 否 | 121 | 1.613(1.079-3.138) | ||
| TNM分期 | -0.486 | 0.534 | ||
| Ⅰ+Ⅱ | 88 | 1.753(1.151-3.446) | ||
| Ⅲ+Ⅳ | 151 | 1.729(1.101-2.639) | ||
| 肿瘤大小、淋巴结及远处转移、TNM分期的缺失信息未纳入分析 | ||||
2.3 血浆NEAT1水平与肺癌患者临床特征的相关性
分析血浆NEAT1水平与非小细胞肺癌患者临床特征的相关性,结果显示血浆NEAT1水平与患者年龄相关,其在>60岁组的表达水平较≤60岁组高,且具有统计学差异(P < 0.05),与性别、吸烟史均没有相关性。在临床病理特征方面,血浆NEAT1水平与病理类型、淋巴结转移情况和远处转移情况及TNM分期无相关性,而与肿瘤大小相关,其在肿瘤大小>3 cm组的表达水平较肿瘤大小≤3 cm组高,且具有统计学差异(P < 0.05)。
2.4 血浆中NEAT1表达水平对非小细胞肺癌的诊断价值血浆NEAT1水平用于诊断NSCLC、早期NSCLC(Ⅰ期+Ⅱ期)、肿瘤大小≤3 cm NSCLC的灵敏度、特异度、似然比和预测值,见表 3。血浆NEAT1水平用于诊断3组患者均有较高的灵敏度和阴性预测值,而且阴性似然比均较低。尤其是对≤3 cm的非小细胞肺癌具有93%灵敏度和94%阴性预测值。
| 组别 | 截断值 | 灵敏度(95%CI) | 特异度(95%CI) | +LR(95%CI) | -LR(95%CI) | PPV(95%CI) | NPV(95%CI) |
| NSCLC vs对照 | 1.028 | 0.81(0.76-0.85) | 0.54(0.46-0.61) | 1.74(1.48-2.06) | 0.35(0.27-0.46) | 0.71(0.65-0.76) | 0.67(0.59-0.74) |
| Ⅰ+Ⅱ期NSCLC vs对照 | 1.014 | 0.83(0.73-0.90) | 0.52(0.45-0.60) | 1.74(1.46-2.08) | 0.33(0.20-0.52) | 0.45(0.38-0.53) | 0.87(0.79-0.92) |
| 肿瘤大小≤3 cm的NSCLC vs对照 | 0.758 | 0.93(0.84-0.97) | 0.39(0.32-0.46) | 1.52(1.34-1.74) | 0.18(0.08-0.42) | 0.37(0.30-0.45) | 0.94(0.85-0.98) |
| +LR:阳性似然比; -LR:阴性似然比; PPV:阳性预测值; NPV:阴性预测值 | |||||||
受试者工作特征曲线(ROC曲线)显示血浆NEAT1表达水平对于诊断NSCLC、早期NSCLC (Ⅰ期+Ⅱ期)、肿瘤大小≤3 cm NSCLC的AUC值分别为0.72、0.73、0.67(P < 0.01,图 2)。
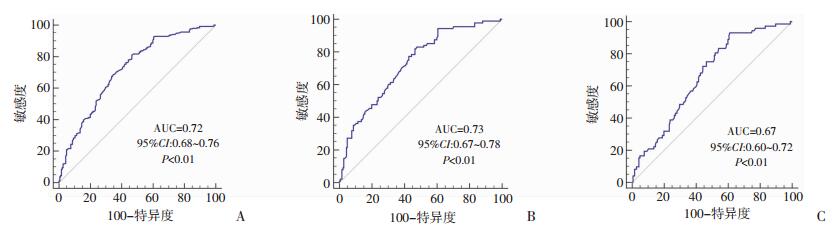
|
| A:NSCLC;B:早期NSCLC(Ⅰ期+Ⅱ期);C:肿瘤大小≤3 cm的NSCLC;AUC:ROC曲线下面积,sensitivity:灵敏度,specificity:特意度;P:与参考线比较 图 2 血浆NEAT1水平对非小细胞肺癌的诊断效能 |
3 讨论
目前对于肺癌的诊断主要依靠病理和影像学手段,检出的病例多已处于晚期阶段,并且对于肺部小结节难以鉴别而易造成误诊或漏诊[15]。寻找新的诊断标志物对于提高肺癌的诊断效能及其准确度具有重要意义。多项研究显示,lncRNAs在肿瘤组织及循环体液中具有差异表达,具有作为肿瘤诊断生物标志物的巨大潜力。例如,lncRNA PCA3是尿液中的一种特殊的生物标志物,已被美国食品药品监督管理局(FDA)批准用于前列腺癌的诊断[16]。MA等[17]发现血浆lncRNA DANCR在区分肝细胞癌患者与各型肝炎及健康对照时,与作为HCC诊断生物标志物的甲胎蛋白相比,具有更显著的区分能力。
NEAT1已被报道在诸多肿瘤中发挥着促癌作用,而其在循环血中的表达情况却少见研究。血浆中NEAT1作为肿瘤标志物的潜力值得深入研究。已有研究显示NEAT1在结直肠癌[18]、乳腺癌[19]等肿瘤中具有肿瘤标志物意义。本研究以临床样本为检测对象,对258例非小细胞肺癌(NSCLC)血浆样本及185例健康对照和肺部良性病变血浆样本进行检测,结果显示NEAT1水平在NSCLC血浆样本中上调。ROC曲线分析显示,血浆NEAT1水平区分非小细胞肺癌与对照样本的曲线下面积AUC=0.72,灵敏度、特异度分别为0.81、0.54,该结果与LUO等[20]在鼻咽癌中的结果较一致。肺癌的早期诊断对改善患者生存及预后有重大意义,本研究结果显示血浆NEAT1水平区分早期非小细胞肺癌(Ⅰ期+Ⅱ期)与对照样本的AUC值为0.73,灵敏度及特异度各为0.83、0.52,阳性似然比及阴性似然比分别为1.74、0.33,阳性预测值及阴性预测值分别为0.45、0.87。另外结果显示血浆NEAT1水平诊断肿瘤≤3 cm的NSCLC的AUC值为0.67,灵敏度、特异度分别为0.93、0.39,阳性似然比及阴性似然比分别为1.52、0.18,阳性预测值及阴性预测值分别为0.37、0.94,提示血浆NEAT1水平检测结果阴性对于小结节肺癌患者具有较高的排除诊断价值。而且根据文献报道,相较于传统研究的蛋白类肿瘤标志物CYFR21-1、CA72-4、NSE(AUC分别为0.519、0.506、0.571)[21],血浆NEAT1水平对于肺癌具有较大诊断价值。
本研究还探讨了血浆NEAT1水平与肺癌患者临床特征的相关性,结果显示血浆NEAT1水平与患者年龄具有相关性(P < 0.05),与性别、吸烟史均没有相关性。在临床病理特征方面,血浆NEAT1水平与病理类型、淋巴结转移情况和远处转移情况及TNM分期无相关性,而与肿瘤大小具有相关性(P < 0.05),表明NEAT1可能对肿瘤生长发挥了重要作用,与肿瘤大小的相关性与HU等[22]的结果一致。而在分化程度、肿瘤TNM分期、淋巴结转移、远处转移方面未发现具有统计学差异的关联。由于本研究的样本量较小,而且部分患者的相关临床信息缺失,因此,血浆NEAT1水平与肺癌患者临床特征的相关性还需要更大样本的研究进行验证。
综上,我们的研究显示血浆中lncRNA NEAT1对于肺癌有一定的诊断价值,在早期肺癌中显示出良好的诊断效能。但是,血浆中lncRNA NEAT1还存在着如特异度较低等问题,今后的研究将继续探讨多个lncRNAs联合检测提高肺癌诊断的效能。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7–30. DOI:10.3322/caac.21442 |
| [2] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | KHANDELWAL A, BACOLLA A, VASQUEZ K M, et al. Long non-coding RNA: A new paradigm for lung cancer[J]. Mol Carcinog, 2015, 54(11): 1235–1251. DOI:10.1002/mc.22362 |
| [4] | SU L, HAN D, WU J, et al. Skp2 regulates non-small cell lung cancer cell growth by Meg3 and miR-3163[J]. Tumour Biol, 2016, 37(3): 3925–3931. DOI:10.1007/s13277-015-4151-2 |
| [5] | MA S, DENG X, YANG Y, et al. The lncRNA LINC00675 regulates cell proliferation, migration, and invasion by affecting Wnt/β-catenin signaling in cervical cancer[J]. Biomed Pharmacother, 2018, 108: 1686–1693. DOI:10.1016/j.biopha.2018.10.011 |
| [6] | WANG J J, YANG Y C, SONG Y X, et al. Long non-coding RNA AB007962 is downregulated in gastric cancer and associated with poor prognosis[J]. Oncol Lett, 2018, 16(4): 4621–4627. DOI:10.3892/ol.2018.9169 |
| [7] | WANG F, XIE C, ZHAO W, et al. Long non-coding RNA CARLo-5 expression is associated with disease progression and predicts outcome in hepatocellular carcinoma patients[J]. Clin Exp Med, 2017, 17(1): 33–43. DOI:10.1007/s10238-015-0395-9 |
| [8] | CHEN Y, YU X, XU Y, et al. Identification of dysregulated lncRNAs profiling and metastasis-associated lncRNAs in colorectal cancer by genome-wide analysis[J]. Cancer Med, 2017, 6(10): 2321–2330. DOI:10.1002/cam4.1168 |
| [9] | LIU A, ZHANG Z, XU W, et al. Overexpression of long non-coding RNA n346372 in bladder cancer tissues is associated with a poor prognosis[J]. Mol Med Rep, 2018, 18(6): 5437–5444. DOI:10.3892/mmr.2018.9597 |
| [10] | YANG C, LI Z, LI Y, et al. Long non-coding RNA NEAT1 overexpression is associated with poor prognosis in cancer patients: a systematic review and meta-analysis[J]. Oncotarget, 2017, 8(2): 2672–2680. DOI:10.18632/oncotarget.13737 |
| [11] | QI L, LIU F, ZHANG F, et al. lncRNA NEAT1 competes against let-7a to contribute to non-small cell lung cancer proliferation and metastasis[J]. Biomed Pharmacother, 2018, 103: 1507–1515. DOI:10.1016/j.biopha.2018.04.053 |
| [12] | LI S, YANG J, XIA Y, et al. Long Noncoding RNA NEAT1 Promotes Proliferation and Invasion via Targeting miR-181a-5p in Non-Small Cell Lung Cancer[J]. Oncol Res, 2018, 26(2): 289–296. DOI:10.3727/096504017X15009404458675 |
| [13] | QUAN J, PAN X, ZHAO L, et al. LncRNA as a diagnostic and prognostic biomarker in bladder cancer: a systematic review and meta-analysis[J]. Onco Targets Ther, 2018, 11: 6415–6424. DOI:10.2147/OTT.S167853 |
| [14] | ZOU Y, ZHONG Y, WU J, et al. Long non-coding PANDAR as a novel biomarker in human cancer: A systematic review[J]. Cell Prolif, 2018, 51(1): e12422. DOI:10.1111/cpr.12422 |
| [15] |
董友玲, 高红梅, 陈文丽, 等. 肺癌早期诊断方法的研究进展[J].
中华灾害救援医学, 2017, 5(1): 55–58.
DONG Y L, GAO H M, CHEN W L, et al. Early diagnosis of lung cancer:a brief review[J]. Chin J Disaster Med, 2017, 5(1): 55–58. DOI:10.13919/j.i-ssn.2095-6274.2017.01.010 |
| [16] | SCHMITT A M, CHANG H Y. Long noncoding RNAs in cancer pathways[J]. Cancer Cell, 2016, 29(4): 452–463. DOI:10.1016/j.ccell.2016.03.010 |
| [17] | MA X, WANG X, YANG C, et al. DANCR acts as a diagnostic biomarker and promotes tumor growth and metastasis in hepatocellular carcinoma[J]. Anticancer Res, 2016, 36(12): 6389–6398. DOI:10.21873/anticanres.11236 |
| [18] | WU Y, YANG L, ZHAO J, et al. Nuclear-enriched abundant transcript 1 as a diagnostic and prognostic biomarker in colorectal cancer[J]. Mol Cancer, 2015, 14: 191. DOI:10.1186/s12943-015-0455-5 |
| [19] | DING X, ZHANG Y, YANG H, et al. Long non-coding RNAs may serve as biomarkers in breast cancer combined with primary lung cancer[J]. Oncotarget, 2017, 8(35): 58210–58221. DOI:10.18632/oncotarget.17356 |
| [20] |
罗泳林, 陆爱英, 蔡永林, 等. 血浆长链非编码RNA NEAT1和H19及MALAT1在鼻咽癌中的表达及临床意义[J].
中国耳鼻咽喉颅底外科杂志, 2018, 24(3): 230–235.
LUO Y L, LU A Y, CAI Y L, et al. Expression and clinical significance of plasma long noncoding RNA NEAT1, H19 and MALAT1 in nasopharyngeal carcinoma[J]. Chin J Otorhinolaryngol-Skull Base Surg, 2018, 24(3): 230–235. DOI:10.11798/j.issn.1007-1520.201803008 |
| [21] | JIANG N, MENG X, MI H, et al. Circulating lncRNA XLOC_009167 serves as a diagnostic biomarker to predict lung cancer[J]. Clin Chim Acta, 2018, 486: 26–33. DOI:10.1016/j.cca.2018.07.026 |
| [22] | HU X, BAO J, WANG Z, et al. The plasma lncRNA acting as fingerprint in non-small-cell lung cancer[J]. Tumour Biol, 2016, 37(3): 3497–3504. DOI:10.1007/s13277-015-4023-9 |



