2. 225000 江苏 扬州,扬州大学附属医院:病理科
2. Department of Pathology, the Affiliated Hospital of Yangzhou University, Yangzhou, Zhejiang Province, 225000, China
来源于食管、胃食管结合部(esophagogastric junction, EGJ)以及胃的上消化道肿瘤发病率逐年提高,是一个重要的世界性卫生问题[1]。SIEWERT等[2]于1987年根据EGJ的解剖特点提出食管胃结合部癌,根据美国癌症联合委员会(American joint committee on cancer,AJCC)癌症分期指南,目前将EGJ肿瘤分为Siewert Ⅰ型(下段食管腺癌)、SiewertⅡ型(贲门癌)和Siewert Ⅲ型(肿瘤中心位于EGJ下2~5 cm处的贲门下癌),其中SiewertⅠ型和Ⅱ型更接近于食管癌,其手术方式多采用胸腹部联合切口[3-4],然而Siewert Ⅲ型手术方式仍有争议,这也对患者术后放化疗方案的选择带来不确定性[5]。此外,随着消化道内镜下治疗肿瘤的进展,Siewert Ⅲ型早期肿瘤是否适合粘膜下切除也缺少循证医学依据[6]。因此,本研究通过回顾性分析162例手术治疗的Siewert Ⅲ型食管胃结合部癌患者的病历资料,探讨淋巴结转移相关因素及其临床意义。
1 资料与方法 1.1 临床资料对2010年1月至2018年6月扬州大学附属医院胃癌手术患者进行筛选,入组标准为:①根据胃镜以及手术后肿瘤位置,确定为Siewert Ⅲ型食管胃结合部癌;②手术前未行新辅助化疗及放疗;③手术中均行D2淋巴结清扫;④患者手术前后临床资料完整(包括手术前后影响资料以及检验结果);⑤术后病理上下切缘均为阴性。排除标准为:①美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分>2分;②淋巴结清扫数量低于15枚;③合并有其他恶性肿瘤。共有162例患者符合条件(图 1),收集患者的临床信息以及病理、影像资料。本研究通过医院伦理委员会审批(YZFH-20170110-016)。
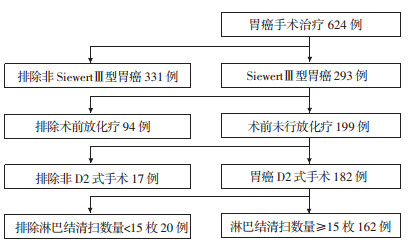
|
| 图 1 研究对象的选择 |
1.2 治疗方法
患者入院后均行常规术前检查。共有四种手术方式:经腹部近端胃切除术、经腹部全胃切除术、经胸腹部联合近端胃切除术、经胸腹部联合全胃切除术;其中腹部手术采用上腹部正中切口,胸部手术采用左胸第6、7肋间后外侧切口。消化道重建方式有:食管残胃吻合、食管空肠Roux-en-Y吻合以及双通路法。淋巴结清扫范围:近端胃切除术包括第1、2、3、4Sa、4Sb、7、8、9、10和11组淋巴结,全胃切除术包括第1、2、3、4、5、6、7、8a、9、10、11和12a组淋巴结,胸腹部手术在上述基础上再清扫第8M、8L、16、17组淋巴结。
1.3 统计学分析计数性指标以x±s表示,采用SPSS 16.0统计软件。两组间定量数据的比较采用t检验,计数资料的比较采用χ2检验或Fisher检验。淋巴结转移与临床病理因素之间的相关性采用Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果 2.1 淋巴结总体清扫情况162例Siewert Ⅲ型食管胃结合部癌患者中,72例发生淋巴结转移,发生淋巴结转移的病人数目比例为44.4%。淋巴结转移阳性患者与淋巴结转移阴性患者相比,年龄、性别、吸烟饮酒史、手术方式选择及淋巴结清扫数量两组间差异无统计学意义(P>0.05,表 1)。
| 临床特征 | 无淋巴结转移组 (n=90) |
有淋巴结转移组 (n=72) |
P值 |
| 性别 | 0.592 | ||
| 男 | 55(61.1) | 41(56.9) | |
| 女 | 35(38.9) | 31(43.1) | |
| 年龄/岁 | 33~81(63.64±7.01) | 37~79(59.21±6.20) | 0.461 |
| 年龄范围 | |||
| 吸烟史 | 0.379 | ||
| 有 | 40(44.4) | 37(51.4) | |
| 无 | 50(55.6) | 35(48.6) | |
| 饮酒史 | 0.141 | ||
| 有 | 31(34.4) | 33(45.8) | |
| 无 | 59(65.6) | 39(54.2) | |
| 病理类型 | 0.001 | ||
| 腺癌 | 74(82.2) | 44(61.1) | |
| 印戒细胞癌 | 16(17.8) | 28(38.9) | |
| 肿瘤大小/cm | 0.001 | ||
| ≤1 | 8(8.9) | 1(1.4) | |
| >1~2 | 21(23.3) | 5(6.9) | |
| >2~3 | 31(34.5) | 25(34.7) | |
| >3 | 30(33.3) | 41(57.0) | |
| 组织形态分型 | 0.001 | ||
| Borrmann(早期) | 5(5.6) | 0(0) | |
| Borrmann Ⅰ(息肉型) | 5(5.6) | 0(0) | |
| Borrmann Ⅱ(局部溃疡型) | 23(25.5) | 9(12.5) | |
| Borrmann Ⅲ(浸润溃疡型) | 44(48.9) | 26(36.1) | |
| Borrmann Ⅵ(弥漫型) | 9(10.0) | 20(27.7) | |
| Borrmann Ⅴ(其他类型) | 4(4.4) | 7(9.7) | |
| 组织学分级 | <0.001 | ||
| G1 | 12(13.3) | 5(6.9) | |
| G2 | 50(55.6) | 15(20.8) | |
| G3 | 21(23.3) | 31(43.1) | |
| G4 | 5(5.6) | 17(23.6) | |
| Gx | 2(2.2) | 4(5.6) | |
| 肿瘤浸润深度 | <0.001 | ||
| T1 | 5(5.6%) | 0(0%) | |
| T2 | 25(27.8%) | 6(8.4%) | |
| T3 | 54(60.0%) | 33(45.8%) | |
| T4 | 6(6.6%) | 33(45.8%) | |
| 脉管癌栓 | <0.001 | ||
| 有 | 27(30.0) | 49(68.1) | |
| 无 | 63(70.0) | 23(31.9) | |
| 手术方式 | 0.464 | ||
| 近端胃切除术(经腹部) | 51(56.7) | 40(55.5) | |
| 近端胃切除术(经胸腹部) | 4(4.4) | 6(8.4) | |
| 全胃切除术(经腹部) | 30(33.3) | 19(26.4) | |
| 全胃切除术(经胸腹部) | 5(5.6) | 7(9.7) | |
| 清扫淋巴结数量(枚) | 17.41±3.30 | 18.12±4.32 | 0.264 |
2.2 肿瘤临床病理特征与淋巴结转移的关系
肿瘤病理类型中印戒细胞癌淋巴结转移率最高(63.6%),而腺癌淋巴结转移率最低(37.3%)。肿瘤病理形态分型中,按照淋巴结转移率高低,依次为Borrmann Ⅵ(弥漫型)(69.0%)、Borrmann Ⅴ(其他类型)(63.6%)、Borrmann Ⅲ(浸润溃疡型)(37.1%)、BorrmannⅡ(局部溃疡型)(28.1%)、Borrmann Ⅰ(息肉型)和Borrmann(早期)(0)。此外,淋巴结转移率随肿瘤长度、肿瘤浸润深度以及肿瘤组织学分级的进展而逐渐增加。在脉管有癌栓的患者中淋巴结转移率为64.5%,而在脉管癌栓阴性的患者中淋巴结转移率为26.7%。具体临床基本资料见表 1。
2.3 食管癌淋巴结转移的logistic回归分析单因素分析结果显示:Siewert Ⅲ型食管胃结合部癌淋巴结转移与肿瘤病理类型、组织形态、分化程度、肿瘤大小、浸润深度、有无脉管癌栓有关(P<0.05)。多因素回归分析显示:肿瘤病理类型、组织学分化程度、浸润深度以及有无脉管癌栓是影响胸段食管鳞癌淋巴结转移的独立危险因素(P<0.05)。
3 讨论食管胃结合部癌是临床较为常见的恶性肿瘤,其发病率逐年上升并且呈现年轻化趋势[7]。随着个人生活习惯的改变,我国也已成为食管胃结合部癌的高发国家,给个人和家庭带来沉重的负担[8]。由于EGJ处于胸腹交接的解剖区域,其具有较为特殊的病理特征及生物学行为。目前研究发现食管胃结合部癌多与贲门肠化生有关,其中Siewert Ⅰ患者预后最好,Siewert Ⅲ型患者预后最差,考虑与Siewert Ⅲ型患者临床症状隐匿,发病时已经是中晚期有关[9]。但是一些学者认为手术方式也是Siewert Ⅲ患者预后不佳的原因之一[10-11],Siewert Ⅰ型和Ⅱ型均参照食管癌行胸腹部联合手术,而Siewert Ⅲ型患者多采用经腹部手术,这主要是因为Siewert Ⅲ型肿瘤中心位于贲门下方,经腹部手术能够保证足够切缘,同时能够减少患者术后并发症及降低死亡风险。然而Siewert Ⅲ型患者也有发生食管下段旁淋巴结转移的风险,而淋巴结转移是影响食管胃结合部癌预后的重要因素之一[8, 12]。虽然超声内镜和PET-CT扫描均有助于术前辨别有无淋巴结转移,但是仍有相当比例的假阳性及假阴性[13],且PET-CT费用高昂,部分患者经济上无法承担,也限制了其临床使用。因此,本研究通过分析食管胃结合部癌淋巴结转移的分布特点,探讨其相关影响因素,为手术治疗的范围选择以及术后序贯治疗提供理论依据。
本研究通过对162例Siewert Ⅲ型食管胃结合部癌患者淋巴结转移率进行统计,发现影响淋巴结转移的因素较多,其中脉管内癌栓与淋巴结转移的相关性最为密切,这与Siewert Ⅰ型和Ⅱ型的结果相一致,均证实其是独立影响因素[14-15],多因素回归提示脉管癌栓患者淋巴结转移的发生率是无癌栓患者的7.34倍。由于EGJ的淋巴管网可通往纵隔区、腹腔区及腹膜后区三大方向,因此对于具有脉管癌栓患者不仅应扩大手术切除范围(建议胸腹部联合入路手术),而且术后治疗应更加积极,多学科会诊(multidisciplinary treatment,MDT)有助于患者术后的恢复。此外,目前已有研究证实HER2在食管胃结合部癌中表达率较高,且HER2阳性患者中淋巴结转移率增加[16-17],是否脉管癌栓与HER2的表达具有相关性还需要进一步研究。
Siewert Ⅲ型食管胃结合部癌淋巴结转移与肿瘤组织学分化程度、肿瘤病理类型以及肿瘤侵犯深度也存在一定的相关性。本研究结果提示:随着肿瘤恶性程度增加,其淋巴结转移的发生率也显著增加。而印戒细胞癌肿瘤组织学分化程度低于腺癌,进一步证实了上述结果。多因素分析显示肿瘤中低分化患者淋巴结转移发生率是肿瘤中高分化患者的3.65倍, 而印戒细胞癌患者是腺癌患者的2.95倍。此外,肿瘤侵犯全层时(T3、T4),淋巴结转移发生率是未及全层(T1、T2)的1.62倍。然而,关于肿瘤长度与淋巴结转移的关系目前仍有争议,本研究中虽然随着肿瘤长度的增加,淋巴结转移率也随之增长,但是多因素分析却提示肿瘤长度与淋巴结转移无相关性。这可能与肿瘤生物学行为有关,部分肿瘤组织延消化道黏膜生长而浸润深度较浅。已有研究表明机体不同的解剖位置、免疫状态以及饮食习惯可能会造成肿瘤生物学行为的不同[18],而EGJ的独特位置以及国内生活水平提高(高脂高糖饮食增加)可能是引起上述结果的原因。同时,无论是胃癌还是食管癌,其AJCC分期中均没有把肿瘤长度作为分期标准[19-20],因此,可以认为肿瘤长度与Siewert Ⅲ型食管胃结合部癌淋巴结转移无关。
有关肿瘤病理形态对于食管胃结合部癌淋巴结转移的影响报道较少,本组资料显示Borrmann Ⅵ型最高而BorrmannⅠ和Borrmann型最低。分析原因考虑与Borrmann Ⅵ型病变范围较广有关。而Borrmann Ⅰ型病变大多生长凸向管腔,较早出现梗阻,使得患者能够早期发现、早期治疗,且肿瘤基底部浸润浅,所以形成淋巴结转移的病例较少。此外Borrmann型属于肿瘤早期(非进展期),也未发现淋巴结转移。然而令人意外的是,虽然单因素分析提示肿瘤组织形态与淋巴结转移相关,但是多因素分析并未发现相关性。可能是因为肿瘤组织形态与其恶性程度及浸润深度密切相关所致(Borrmann Ⅵ型恶性程度最高,肿瘤进展最快;与之相反,Borrmann Ⅰ型恶性程度低,肿瘤进展慢),尚需进一步研究。
本研究样本量比较少,为单中心研究,没有进行生存分析,缺少术前放疗或(和)新辅助化疗患者的数据资料。而淋巴结转移特点是否在完善上述缺血后仍有差异,还需要进一步证实。总之,在现有技术条件下,我们认为当Siewert Ⅲ型食管胃结合部癌病理类型为印戒细胞癌、组织学中低度分化、肿瘤侵犯胃壁全层以及脉管癌栓时,更易发生淋巴结转移,建议扩大淋巴结清扫范围,术后放疗化疗时需综合考虑相关因素进行个体化治疗。
| [1] | GUPTA V, COBURN N, KIDANE B, et al. Survival prediction tools for esophageal and gastroesophageal junction cancer: A systematic review[J]. J Thorac Cardiov Surg, 2018, 156(2): 847–856. DOI:10.1016/j.jtcvs.2018.03.146 |
| [2] | SIEWERT J R, HÖLSCHER A H, BECKER K, et al. Cardia cancer: attempt at a therapeutically relevant classification[J]. Chirurg, 1987, 58(1): 25–32. |
| [3] |
朱纯超, 赵刚, 徐佳, 等. Siewert Ⅰ型食管胃结合部腺癌的手术径路及预后分析[J].
中华消化外科杂志, 2012, 11(3): 207–210.
ZHU C C, ZHAO G, XU J, et al. Surgical approaches and prognostic analysis of Siewert type Ⅰ adenocarcinoma of the esophagogastric junction[J]. Chin J Dig Surg, 2012, 11(3): 207–210. DOI:10.3760/cma.j.issn.1673-9752.2012.03.005 |
| [4] | SUGITA S, KINOSHITA T, KAITO A, et al. Short-term outcomes after laparoscopic versus open transhiatal resection of Siewert type Ⅱ adenocarcinoma of the esophagogastric junction[J]. Surg Endosc, 2018, 32(1): 383–390. DOI:10.1007/s00464-017-5687-6 |
| [5] | ZHANG P, ZHANG X, XUE H. Long-term results of hand-assisted laparoscopic gastrectomy for advanced Siewert type Ⅱ and type Ⅲ esophagogastric junction adenocarcinoma[J]. Int J Surg, 2018, 53: 201–205. DOI:10.1016/j.ijsu.2018.03.004 |
| [6] | KAKUSHIMA N, YAHAGI N, FUJISHIRO M, et al. Efficacy and safety of endoscopic submucosal dissection for tumors of the esophagogastric junction[J]. Endoscopy, 2006, 38(2): 170–174. DOI:10.1055/s-2005-921039 |
| [7] | AJANI JA, D'AMICO TA, ALMHANNA K, et al. Esophageal and esophagogastric junction cancers, version 1.2015[J]. J Natl Compr Canc Netw, 2015, 13(2): 194–227. DOI:10.6004/jnccn.2015.0028 |
| [8] |
曹晖, 赵恩昊. 食管胃结合部腺癌外科治疗现状与争议[J].
中国实用外科杂志, 2016, 36(1): 62–66.
CAO H, ZHAO E H. Current satus and controversy of surgical treatment for adenocarcinoma of esophagogasric junction[J]. Chin J Pract Surg, 2016, 36(1): 62–66. DOI:10.7504/CJPS.ISSN1005-2208.2016.01.19 |
| [9] | SIEWERT J R, FEITH M, STEIN H J. Biologic and clinical variations of adenocarcinoma at the esophago-gastric junction: relevance of a topographic-anatomic subclassification[J]. J Surg Oncol, 2005, 90(3): 139–146. DOI:10.1002/jso.20218 |
| [10] |
张晓雨, 杨金云, 平洪, 等. Siewert Ⅱ型和Ⅲ型食管胃结合部腺癌手术入路的选择[J].
中华胃肠外科杂志, 2014(9): 924–926.
ZHANG X Y, YANG J Y, PING H, et al. Choice of surgical approach for Siewert Ⅱ and Ⅲ adenocarcinomas of the esophagogastric junction[J]. Chin J Gastrointest Surg, 2014(9): 924–926. DOI:10.3760/cma.j.issn.1671-0274.2014.09.019 |
| [11] | HOSODA K, YAMASHITA K, MORIYA H, et al. Optimal treatment for Siewert type Ⅱ and Ⅲ adenocarcinoma of the esophagogastric junction: A retrospective cohort study with long-term follow-up[J]. World J Gastroenterol, 2017, 23(15): 2723–2730. DOI:10.3748/wjg.v23.i15.2723 |
| [12] | HOSOKAWA Y, KINOSHITA T, KONISHI M, et al. Clinicopathological features and prognostic factors of adenocarcinoma of the esophagogastric junction according to Siewert classification: experiences at a single institution in Japan[J]. Ann Surg Oncol, 2012, 19(2): 677–683. DOI:10.1245/s10434-011-1983-x |
| [13] | STAGG J, FARUKHI I, LAZAGA F, et al. Significance of 18F-fluorodeoxyglucose uptake at the gastroesophageal junction: comparison of PET to esophagogastroduodenoscopy[J]. Dig Dis Sci, 2015, 60(5): 1335–1342. DOI:10.1007/s10620-014-3456-0 |
| [14] |
亓磊, 田辉, 岳韦名, 等. Siewert Ⅰ型食管胃结合部腺癌淋巴结转移特点及预后分析[J].
中华消化外科杂志, 2016, 15(11): 1075–1080.
QI L, TIAN H, YUE W M, et al. Characteristics of lymph node metastasis and prognostic analysis of Siewert type Ⅰ adenocarcinoma of esophagogastric junction[J]. Chin J Dig Surg, 2016, 15(11): 1075–1080. DOI:10.3760/cma.j.issn.1673-9752.2016.11.008 |
| [15] | YAMASHITA H, KATAI H, MORITA S, et al. Optimal extent of lymph node dissection for Siewert type Ⅱ esophagogastric junction carcinoma[J]. Ann Surg, 2011, 254(2): 274–280. DOI:10.1097/SLA.0b013e3182263911 |
| [16] | KATAI H, ISHIDA M, YAMASHITA H, et al. HER2 expression in carcinomas of the true cardia (Siewert type Ⅱ esophagogastric junction carcinoma)[J]. World J Surg, 2014, 38(2): 426–430. DOI:10.1007/s00268-013-2256-6 |
| [17] |
刘中元, 张黎. Siewert Ⅱ、Ⅲ型胃食管结合部癌的临床特点及HER2、SKP2表达[J].
山东医药, 2016, 56(33): 25–27.
LIU Z Y, ZHANG L. Clinical characteristics and expression of HER2 and SKP2 in Siewert Ⅱand Ⅲ adencarcinoma of gastric esophageal junction[J]. Shangdong Med J, 2016, 56(33): 25–27. DOI:10.3969/j.issn.1002-266X.2016.33.008 |
| [18] | ZHANG Q, PENG C. Cancer-associated fibroblasts regulate the biological behavior of cancer cells and stroma in gastric cancer[J]. Oncol Lett, 2018, 15(1): 691–698. DOI:10.3892/ol.2017.7385 |
| [19] | LU J, ZHENG C H, CAO L L, et al. The effectiveness of the 8th American Joint Committee on Cancer TNM classification in the prognosis evaluation of gastric cancer patients: A comparative study between the 7th and 8th editions[J]. Eur J Surg Oncol, 2017, 43(12): 2349–2356. DOI:10.1016/j.ejso.2017.09.001 |
| [20] | TALSMA K, VAN HAGEN P, GROTENHUIS B A, et al. Comparison of the 6th and 7th Editions of the UICC-AJCC TNM Classification for Esophageal Cancer[J]. Ann Surg Oncol, 2012, 19(7): 2142–2148. DOI:10.1245/s10434-012-2218-5 |



