结肠癌是我国常见的消化道恶性肿瘤[1],其发生率和死亡率呈上升趋势[2]。尽管手术、化疗和生物制剂等治疗手段让结肠癌患者的生存率有所提高,但大多数结肠癌患者仍然预后不良。因此,寻找结肠癌起始和进展的关键分子标志物和机制显得尤为重要[3]。
代谢重编程是肿瘤细胞区别于正常细胞的重要特征。在肿瘤细胞中,即使在氧气存在的情况下,丙酮酸也优先转化为乳酸,这被称为有氧糖酵解(Warburg效应)[4]。到目前为止,Warburg效应的分子机制仍不清楚。果糖-1, 6-二磷酸酶1(fructose-1, 6-bisphosphatase 1,FBP1)是一种关键的糖异生调节酶,催化果糖-1, 6-二磷酸水解为6-磷酸果糖和无机磷酸盐[5]。FBP1是哺乳动物细胞中FBP的两种同工酶之一,在不同组织中普遍表达,而另一种旁系同源物FBP2仅表达于肌肉组织[6]。越来越多的证据揭示了FBP1在多种肿瘤的发生和发展中发挥着肿瘤抑制因子的作用,如肾癌、乳腺癌、胃癌、肺癌和胰腺癌[7-11],然而,FBP1在结肠癌侵袭中的功能研究仍有待探索。因此,本研究拟在结肠癌临床标本中验证FBP1的表达情况,并进一步在结肠癌SW480细胞实验中探讨FBP1对结肠癌细胞增殖、侵袭和有氧糖酵解的影响,期望从肿瘤代谢的角度为结肠癌治疗提供新思路。
1 材料与方法 1.1 主要材料与试剂Polymer双染检测试剂盒(DS-0001)和中性树胶(ZLI-9555)均购自中杉金桥公司,FBP1敲低(shFBP1)、FBP1过表达(FBP1)和对照(shControl、Vector)的结肠癌SW480细胞由本实验室冻存,RPMI1640培养基、0.25%胰蛋白酶购自HyClone公司,胎牛血清(10100FBS)购自Gibco公司,RIPA裂解液(P0013B)、青霉素-链霉素溶液(C0222)和Bradford蛋白浓度测定试剂盒(P0006)均购自碧云天;兔抗人FBP1抗体(orb37871)购自Biorbyt公司;羊抗兔二抗(SA0001-2)购自武汉三鹰公司。
1.2 临床标本和免疫组化染色 1.2.1 组织芯片制作收集本院2016-2017年手术切除结肠癌标本和对应癌旁组织标本各80例。4%多聚甲醛固定标本,石蜡包埋制成3 μm切片后HE染色,由2名病理学医师进行病理诊断和评分。采用组织芯片制作仪(上海芯超生物科技有限公司)制作组织芯片(取样针直径1 mm)。每例标本在癌细胞或黏膜腺体丰富区取2~3个区,结肠癌样本及对应癌旁组织样本制作2个蜡块。
1.2.2 免疫组化染色采用S-P法,组织芯片置于60 ℃烤箱2 h、二甲苯脱蜡、梯度酒精水化。依据免疫组化试剂盒说明书染色,抗体浓度:FBP1(1 :500)。显色完成后风干,中性树胶封片。
1.2.3 结果判定参照相关免疫组化评判标准对免疫组化染色结果进行判定,依据细胞出现棕黄色颗粒为阳性结果。采用半定量法对染色结果进行判定。染色强度计分方法:无阳性染色、浅黄色、棕黄色、棕褐色分别计0、1、2、3分;阳性染色细胞构成比计分方法:阳性染色细胞数百分比0%、≤10%、>10%~50%、>50%~75%、≥75%分别计分0、1、2、3、4分。最后将染色强度分数与阳性细胞百分比分数相乘,低于7分为蛋白低表达,7分及以上为蛋白高表达。
1.3 Western blot检测蛋白表达敲低实验分shControl(对照)组和shFBP1组,过表达实验分Vector(对照)组和FBP1组,分别取对数生长期shControl、shFBP1、Vector、FBP1结肠癌SW480细胞提取蛋白,按Bradford试剂盒说明测定浓度。SDS-PAGE电泳仪120 V恒压2 h分离蛋白,250 mA恒流2 h转膜,5% BSA(牛血清白蛋白)室温封闭1 h,4 ℃摇床孵育FBP1一抗12 h,PBST(磷酸盐吐温缓冲液)洗3次,每次5 min,羊抗兔二抗室温孵育1 h,PBST洗3次,每次5 min,滴加显影液后采集图片。
1.4 Transwell法检测细胞侵袭能力Matrigel基质胶均匀平铺于Transwell小室微膜,将8×103个SW480细胞接种至Transwell上室,下室加入无血清1640培养基。48 h后多聚甲醛固定细胞,洗净多聚甲醛后结晶紫染色10 min,显微镜观察拍照,重复3次计数并取平均值。
1.5 细胞增殖实验取对数生长期SW480细胞接种至96孔细胞培养板,每孔加入1640完全培养基100 μL,调整细胞浓度至1×104/mL(于6、12、24、48 h测定细胞增殖能力,对照组、干扰组每个时间点各设3个复孔,另设空白对照孔)。待细胞贴壁后,在对应检测时间点分别测定细胞增殖能力:每孔加入100 μL RPMI1640完全培养基和10 μL CCK-8试剂,放入37 ℃,5%CO2无菌恒温培养箱中1 h后使用酶标仪检测450 nm处各孔光密度值[D(450)],实验重复3次,绘制细胞增殖曲线。
1.6 乳酸产量和ECAR检测通过乳酸测定试剂盒(比色法)(BioVision)检测乳酸产生。将FBP1过表达或敲低的SW480细胞在含有酶和乳酸探针的乳酸测定缓冲液中温育。测量光密度的波长为570 nm。使用Seahorse XF24分析仪(Seahorse Biosciences)测量细胞外酸化率(ECAR)。首先,将细胞在不含葡萄糖或丙酮酸的糖酵解应激测试培养基中温育。第一步加入饱和葡萄糖,第二步注射寡霉素,最终注射剂是2-dexoy-glucose。将细胞以每孔8×103个细胞种植在96孔细胞培养物XF微孔板(Seahorse Bioscience)中并孵育过夜。然后,用37 ℃测定培养基(补充有2 mmol/L L-谷氨酰胺,pH 7.4的1640培养基)洗涤细胞,然后将细胞培养微孔板置于37 ℃无CO2培养箱中1 h后进行测定。药筒端口A、B、C分别装载有25 μL葡萄糖(80 mmol/L),寡霉素(9 μmol/L)和2-脱氧-葡萄糖(1 mol/L)。使用结晶紫测定,将所有测量标准化为细胞数。葡萄糖处理后的胞外酸化率表明糖酵解率。寡霉素处理后的胞外酸化率表明糖酵解能力。
1.7 统计学分析采用SPSS 17.0统计软件,数据以x±s表示,采用t检验分析两组之间数据差异性。检验水准:α=0.05。
2 结果 2.1 结肠癌组织及癌旁组织中FBP1蛋白的表达免疫组化染色结果显示,FBP1蛋白主要在细胞质表达(图 1)。在80例结肠癌组织标本中有17例FBP1蛋白为高表达,占总例数的21.25%,80例癌旁肠黏膜组织标本中有69例FBP1蛋白为高表达,占总例数的86.25%。癌旁肠黏膜组织FBP1表达明显高于结肠癌组织,差异有统计学意义(P < 0.01),即FBP1在癌旁肠黏膜组织标本中高表达,而在结肠癌组织标本中低表达。
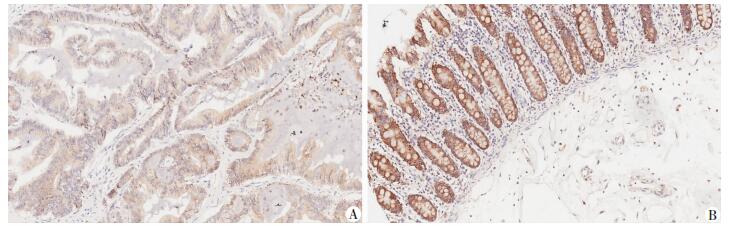
|
| A:结肠癌组织;B:癌旁组织 图 1 FBP1蛋白在结肠癌及癌旁组织中的表达 (S-P ×100) |
2.2 敲低FBP1增强体外SW480细胞的集落形成、增殖和侵袭
Western blot检测敲低效率,与shControl组(对照)比较,shFBP1组FBP1表达显著下调(P < 0.01,图 2A)。敲低结肠癌SW480细胞FBP1表达后,SW480细胞的增殖较shControl组显著增加(P < 0.01,图 2B)。与shControl组比较,FBP1表达的降低显著增强了SW480细胞的侵袭能力(P < 0.01,图 2C)。证明FBP1在结肠癌SW480细胞的增殖和侵袭中起到重要作用。
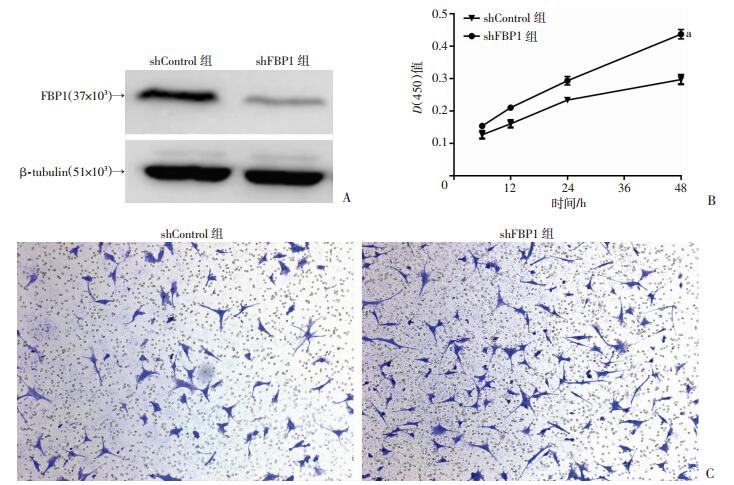
|
| A:Western blot检测SW480细胞FBP1敲低效率;B:敲低FBP1对细胞增殖速度的影响 a:P < 0.01,与shControl组比较;C:敲低FBP1对细胞侵袭能力的影响(结晶紫×200) 图 2 敲低FBP1促进了体外SW480细胞的增殖和侵袭 |
2.3 过表达FBP1抑制结肠癌细胞的集落形成、增殖和侵袭
为了进一步证实FBP1对结肠癌SW480细胞增殖和侵袭的影响,用FBP1过表达慢病毒(FBP1)转染SW480细胞,Western blot检测其过表达的效率。结果显示,与Vector组(对照)比较,FBP1组FBP1表达显著上调(P < 0.01,图 3A)。在结肠癌SW480细胞中过表达FBP1(FBP1组)后,SW480细胞增殖能力被显著抑制(P < 0.01,图 3B)。与Vector组比较,过表达FBP1后结肠癌细胞的侵袭能力明显减弱(图 3C)。
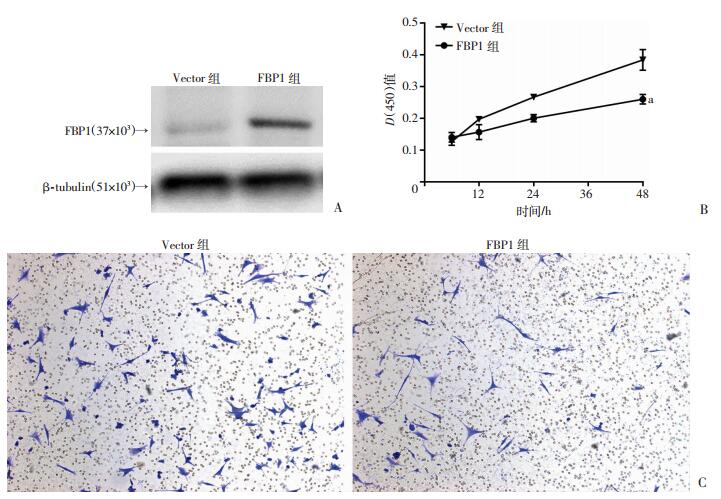
|
| A:Western blot检测SW480细胞FBP1过表达效率;B:过表达FBP1对细胞增殖速度的影响 a:P < 0.01,与Vector组比较;C:过表达FBP1对细胞侵袭能力的影响(结晶紫×200) 图 3 过表达FBP1抑制体外SW480细胞的增殖和侵袭 |
2.4 FBP1对结肠癌细胞有氧糖酵解的影响
为了探究FBP1是否影响结肠癌细胞的有氧糖酵解,检测结肠癌SW480细胞的糖酵解速率。用XF24细胞外通量分析仪检测胞外酸化率。结果显示,FBP1过表达显著降低了SW480细胞的糖酵解速率和糖酵解能力(图 4A),而FBP1敲低明显提升SW480细胞的糖酵解速率和糖酵解能力(图 4B)。提示FBP1在结肠癌细胞代谢中发挥重要作用。
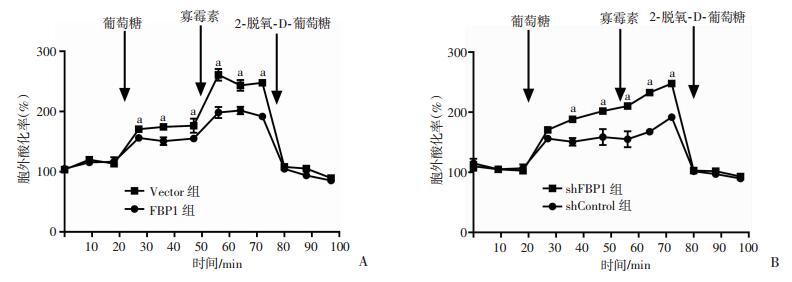
|
| A:FBP1过表达后检测SW480细胞的细胞外酸化率糖酵解速率表示葡萄糖处理后的细胞外酸化率,糖酵解能力表示寡霉素处理后的细胞外酸化率;B:敲低FBP1后检测SW480细胞的细胞外酸化率 a:P < 0.01,与对应对照组比较 图 4 FBP1抑制SW480细胞的有氧糖酵解 |
3 讨论
尽管现在结肠癌诊断和治疗方面取得了显著进步,但预后差的情况并未发生实质性改变[1-2]。因此,确定结肠癌进展的分子机制和寻找有效改善结肠癌不良预后的预测因素是非常重要的[12]。我们对结肠癌组织的免疫组织化学染色结果进行分析发现,结肠癌患者肿瘤组织中FBP1降低,表明FBP1表达下调可能参与了结肠癌的进展。据报道,FBP1在肺癌组织和细胞中表达下调。FBP1表达的恢复抑制了肺癌细胞的生长、侵袭和糖酵解[13]。FBP1在胃癌细胞中也显示表达下调。在胃癌细胞中恢复FBP1表达可以拮抗糖酵解并抑制胃癌细胞的生长[10-11]。在乳腺癌中,缺失FBP1介导的代谢重编程通过增强β-连环蛋白与T细胞因子的相互作用导致癌症干细胞样特性和致肿瘤性增加[7]。然而,关于FBP1在结肠癌进展中的作用及相关的研究证据较少。在FBP1低表达的情况下,肿瘤细胞通过改变葡萄糖代谢促进肿瘤生长和细胞内葡萄糖摄取[14]。作为糖酵解拮抗剂,FBP1缺乏反过来会导致有氧糖酵解增加,Warburg效应的关键结果是乳酸生成和分泌增加,这将导致肿瘤微环境的酸化[15],许多致癌基因和肿瘤抑制因子参与从氧化磷酸化向肿瘤细胞的有氧糖酵解的代谢转换[16]。缺氧和酸性肿瘤微环境有利于激活与细胞外基质降解,血管生成和迁移相关的一系列蛋白酶[17],从而导致肿瘤生长加快,发生侵袭、转移。我们通过体外实验研究发现,FBP1的过表达显著降低了结肠癌细胞的增殖和侵袭,结肠癌细胞的乳酸分泌减少,有氧糖酵解显著减弱,抑制肿瘤的生长和侵袭。相反,降低FBP1的表达可以促进结肠癌细胞从氧化磷酸化向有氧糖酵解的代谢转换,在体外促进SW480细胞生长和侵袭。
综上所述,本实验以临床标本和结肠癌细胞系为模型,通过免疫组化和干扰FBP1表达的方法,初步证实了FBP1表达在结肠癌中下调,FBP1抑制结肠癌SW480细胞的侵袭以及有氧糖酵解。结果提示FBP1可能在结肠癌的生长、侵袭中起重要作用,为结肠癌治疗提供了新的思路。FBP1参与调控结肠癌生长和侵袭的具体机制仍有待进一步的研究。
| [1] | BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.21492 |
| [2] | MARTINEZ-OUTSCHOORN U E, PEIRIS-PAGÉS M, PESTELL R G, et al. Cancer metabolism: a therapeutic perspective[J]. Nat Rev Clin Oncol, 2017, 14(1): 11–13. DOI:10.1038/nrclinonc.2016.60 |
| [3] | LEVINE A J, PUZIO-KUTER A M. The control of the metabolic switch in cancers by oncogenes and tumor suppressor genes[J]. Science, 2010, 330(6009): 1340–1344. DOI:10.1126/science.1193494 |
| [4] | WARBURG O. On the origin of cancer cells[J]. Science, 1956, 123(3191): 309–314. DOI:10.1126/science.123.3191.309 |
| [5] | SINGH S, HARMALKAR D S, CHOI Y, et al. Fructose-1, 6-bisphosphatase inhibitors: a review of recent (2000-2017) advances and structure-activity relationship studies[J]. Curr Med Chem, 2018, 25. DOI:10.2174/0929867325666180831133734 |
| [6] | MOU J J, PENG J, SHI Y Y, et al. Mitochondrial DNA content reduction induces aerobic glycolysis and reversible resistance to drug-induced apoptosis in SW480 colorectal cancer cells[J]. Biomed Pharmacother, 2018, 103: 729–737. DOI:10.1016/j.biopha.2018.04.099 |
| [7] | DONG C, YUAN T, WU Y, et al. Loss of FBP1 by Snail-mediated repression provides metabolic advantages in basal-like breast cancer[J]. Cancer Cell, 2013, 23(3): 316–331. DOI:10.1016/j.ccr.2013.01.022 |
| [8] | HIRATA H, SUGIMACHI K, KOMATSU H, et al. Decreased expression of fructose-1, 6-bisphosphatase associates with glucose metabolism and tumor progression in hepatocellular carcinoma[J]. Cancer Res, 2016, 76(11): 3265–3276. DOI:10.1158/0008-5472.Can-15-2601 |
| [9] | LI B, QIU B, LEE D S, et al. Fructose-1, 6-bisphosphatase opposes renal carcinoma progression[J]. Nature, 2014, 513(7517): 251–255. DOI:10.1038/nature13557 |
| [10] | LI J, WANG Y, LI Q G, et al. Downregulation of FBP1 promotes tumor metastasis and indicates poor prognosis in gastric cancer via regulating epithelial-mesenchymaltransition[J]. PLoS ONE, 2016, 11(12): e0167857. DOI:10.1371/journal.pone.0167857 |
| [11] | LIU G M, LI Q, ZHANG P F, et al. Restoration of FBP1 suppressed Snail-induced epithelial to mesenchymal transition in hepatocellular carcinoma[J]. Cell Death Dis, 2018, 9(11): 1132. DOI:10.1038/s41419-018-1165-x |
| [12] |
林树海, 蔡宗苇. 同位素示踪技术定量分析肿瘤细胞中的代谢重编[J].
色谱, 2015, 33(2): 112–115.
LIN S H, CAI Z W. Isotopic tracing technique in quantitative analysis of metabolic reprogramming in tumor cells[J]. Se Pu, 2015, 33(2): 112–115. DOI:10.3724/SP.J.1123.2014.11011 |
| [13] | ZHANG J, WANG J, XING H, et al. Down-regulation of FBP1 by ZEB1-mediated repression confers to growth and invasion in lung cancer cells[J]. Mol Cell Biochem, 2016, 411(1/2): 331–340. DOI:10.1007/s11010-015-2595-8 |
| [14] | CHEN M, ZHANG J, LI N, et al. Promoterhypermethylation mediated downregulation of FBP1 in human hepatocellular carcinoma and colon cancer[J]. PLoS ONE, 2011, 6(10): e25564. DOI:10.1371/journal.pone.0025564 |
| [15] | YANG J, JIN X, YAN Y, et al. Inhibiting histonedeacetylases suppresses glucose metabolism and hepatocellular carcinoma growth by restoring FBP1 expression[J]. Sci Rep, 2017, 7: 43864. DOI:10.1038/srep43864 |
| [16] | KONDAVEETI Y, GUTTILLA REED I K, WHITE B A. Epithelial-mesenchymal transition induces similar metabolic alterations in two independent breast cancer cell lines[J]. Cancer Lett, 2015, 364(1): 44–58. DOI:10.1016/j.canlet.2015.04.025 |
| [17] | HAM J, COSTA C, SANO R, et al. Exploitation of theapoptosis-primed state of MYCN-amplified neuroblastoma to develop a potent and specific targeted therapy combination[J]. Cancer Cell, 2016, 29(2): 159–172. DOI:10.1016/j.ccell.2016.01.002 |



