铜绿假单胞菌(Pseudomonas aeruginosa, PA)普遍存在于潮湿环境中,是一种常见的条件致病菌,主要致病物质是内毒素。PA是引起医院感染的重要病原菌,其感染多见于皮肤黏膜受损部位,常引起烧伤、创伤或手术切口感染及长期化疗或使用免疫抑制剂患者的局部化脓性炎症等[1-2]。随着抗生素的大量使用甚至滥用,多重耐药的铜绿假单胞菌在临床中越来越常见[3]。2017年世界卫生组织将铜绿假单胞菌作为高危致病菌列入12种急需新型抗生素的超级细菌名单中[2, 4],全国细菌耐药监测网统计显示铜绿假单胞菌的耐药性在G-菌中位居首位[5]。因此,寻找新的抗菌手段已成为目前重要的研究课题和研究热点。系列新抗菌药物研发方法既昂贵又费时,应用时又不断地诱导出对新药的耐药性[6];临床趋向于寻找能替代抗生素的抗菌生物制剂,其中噬菌体备受关注[7]。噬菌体是专门感染细菌的一类病毒,具有严格的宿主特异性和独特的作用机制,自我增殖快、研发时间短,可作为一种安全的治疗细菌感染的生物制剂[6, 8]。目前,越来越多的实验证明了铜绿假单胞菌噬菌体治疗的可行性[2, 6, 9-10],开发高效广谱的铜绿假单胞菌噬菌体制剂已成为临床控制多重耐药铜绿假单胞菌感染性疾病研究的新思路[11]。近年来,一些能够裂解多重耐药临床菌株的裂解性噬菌体被分离并得到进一步研究。本研究以铜绿假单胞菌为宿主菌,拟从医院污水中分离到铜绿假单胞菌裂解性噬菌体,检测其裂解谱,并观察其形态及生物学特性,为储备噬菌体和研发治疗铜绿假单胞菌感染的噬菌体制剂奠定基础。
1 材料与方法 1.1 主要试剂和仪器本研究涉及的主要试剂(酵母提取物、蛋白胨、氯化钠、琼脂粉等)、培养基及配方(LB、LA、半固体等)、仪器(离心机、摇床、培养箱、透射电镜等)均参考文献[3, 12]。
1.2 菌株铜绿假单胞菌标准菌株ATCC 27853和临床分离菌株均为陆军军医大学第一附属医院检验科微生物室保存并提供,临床分离菌株均由微生物室分离并利用VITEK 2 Compact全自动微生物分析系统进行菌种鉴定和药敏试验。
1.3 噬菌体的筛选、分离及纯化采集西南医院污水处理站未消毒处理的污水,无菌纱布滤去明显杂质,12 000 r/min离心10 min后,用0.22 μm滤膜过滤得到污水上清液。活化铜绿假单胞菌标准菌株ATCC 27853,并用LB培养成对数生长期的菌悬液(OD600约为0.6)。取菌悬液3 mL、污水上清液17 mL和3×浓缩的LB培养基10 mL于100 mL无菌三角瓶中,混匀后于37 ℃、160 r/min恒温摇床培养过夜,离心并滤膜过滤得到扩增上清液。参考药敏试验K-B法[13],用无菌棉签将菌悬液均匀涂布LA平板,滴加10 μL污水上清液或扩增上清液,37 ℃恒温培养16~20 h后,观察是否形成噬菌斑。挑取噬菌斑或取100 μL能形成噬菌斑的污水上清液(或扩增上清液)至2 mL菌悬液中,摇床培养4~6 h以扩增噬菌体,离心过滤得到噬菌体原液。用LB培养基对噬菌体原液进行10-1~10-8连续梯度稀释,分别取10 μL各梯度稀释液与190 μL菌悬液于1.5 mL离心管中混匀,静置15 min后加入5 mL预冷的半固体培养基中混匀,倾注至LA平板上制成双层琼脂平板,倒置培养过夜并观察噬菌斑,以分离噬菌体。挑取边缘光滑、透明的较大噬菌单斑扩增噬菌体,用双层琼脂平板法重复分离噬菌体数次,即可得到纯化的噬菌体。
1.4 噬菌体裂解谱试验调取微生物室临床分离并保存的铜绿假单胞菌菌株药敏试验信息,选择不同耐药性(耐药R,中介I,敏感S)的菌株作为裂解宿主菌,选择部分菌株进行菌落PCR扩增16s DNA,测序并用软件进行进化树分析。活化各临床菌株并培养成菌悬液,在5 mL菌悬液中加入200 μL各纯化的噬菌体,于摇床中培养2~4 h,并每隔30 min观察菌液是否变澄清,或测定菌悬液D(600)是否有较大变化(设置对照);或参考K-B法将菌悬液涂布LA平板后,滴加10 μL各纯化的噬菌体并培养过夜,观察是否形成噬菌斑;均用双层琼脂平板法验证是否形成噬菌体单斑。并以大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、金黄色葡萄球菌等临床分离菌株为裂解宿主菌,采用相同的方法扩大噬菌体宿主谱分析。
1.5 噬菌体PA-27-1形态电镜观察参考文献[5, 12]方法,采用磷钨酸负染法处理噬菌体PA-27-1,干燥后用透射电镜观察其形态结构。
1.6 噬菌体PA-27-1生物学特性研究 1.6.1 感染复数感染复数(multiplicity of infection,MOI)是指噬菌体初始感染宿主菌时噬菌体总数与宿主菌总数的比值,也称感染倍数。分别取80 μL各噬菌体梯度稀释液与100 μL菌悬液于10 mL无菌空试管中,用LB培养基调节至体积相同,配制的不同MOI混合液经摇床培养3.5 h后,用双层琼脂平板法测定噬菌体的效价[plaque forming units,pfu,计算公式为:噬菌体效价(pfu/mL)=平均噬菌斑数×稀释倍数×100],同时测定起始噬菌体效价及菌悬液浓度。以产生最高噬菌体效价的MOI为最佳感染复数。
1.6.2 吸附率试验参考文献[11, 14]方法,以MOI=0.1加入噬菌体和菌悬液并摇床培养,分别于不同培养时间取50 μL混合液测定效价,重复试验3次。计算公式为:噬菌体吸附率=(1-未吸附噬菌体效价/起始噬菌体效价)×100%。
1.6.3 一步生长曲线参考文献[3, 11]方法,并加以改进,以MOI=10加入噬菌体和菌悬液并摇床孵育5 min,离心并用1 mL的LB迅速洗涤沉淀2次,用3 mL的LB重悬沉淀并摇床培养,分别于不同培养时间取50 μL重悬液测定效价,重复试验3次,并以最佳感染复数作对照。绘制一步生长曲线,获得潜伏期、暴发期和平台期,并计算裂解量(暴发量),计算公式为:裂解量=裂解末期噬菌体效价/感染初期宿主菌浓度。
1.6.4 稳定性试验将等量分装的噬菌体分别置于室温(25 ℃)和先后设定40 ℃、50 ℃、60 ℃、70 ℃、80 ℃的水浴锅中,孵育30 min后测定效价。按10%接种量将噬菌体分别加入不同pH值的LB培养基中,混匀并摇床培养1 h后测定效价。以不同体积比(1%、10%、20%、50%)的氯仿加入不同噬菌体梯度稀释液中,混匀并摇床培养过夜后测定效价。
1.6.5 核酸提取及酶切分析采用Abigen公司的λ噬菌体基因组DNA提取试剂盒(离心柱型)提取噬菌体基因组;Invitrogen公司的Genomic DNA Mini Kit提取试剂盒提取铜绿假单胞菌ATCC 27853的基因组。用试剂盒配套的DNaseⅠ和RNase A同时酶切提取的噬菌体和细菌的基因组,并用TaKaRa公司的限制性内切酶(如NheⅠ和XhoⅠ等)酶切噬菌体和细菌的基因组。经琼脂糖凝胶电泳后用成像系统观察结果。
2 结果 2.1 噬菌斑及裂解谱以铜绿假单胞菌标准菌株ATCC 27853和临床菌株为宿主菌,从西南医院污水中先后分离纯化到6株噬菌体。以162株不同药敏试验结果的临床菌株(包括多重耐药菌63株)进行裂解谱试验,其中1株裂解效率最高可达79.63%(129/162),命名为噬菌体PA-27-1,能裂解80.95%(51/63)的耐药菌株,表明其裂解谱较宽,是一株相对广谱的噬菌体;其余5株的裂解效率分别为73.95%(88/119)、60.50%(72/119)、58.82%(70/119)、57.98%(69/119)、54.62%(65/119)。选择部分裂解谱试验用临床菌株的16s DNA建立进化树(图 1),初步表明被检测宿主菌为不同毒株。噬菌体PA-27-1经双层琼脂平板法纯化5次后,平板上可观察到直径2~3 mm的圆形透明且边界清晰噬菌斑,表现出裂解性噬菌体的噬菌斑特征(图 2A),在扩增培养时可将对数生长期的宿主菌悬液裂解澄清,可初步判定PA-27-1为裂解性噬菌体。通过对20株大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、金黄色葡萄球菌等临床分离菌株进行裂解谱试验,发现PA-27-1不能裂解被测菌株,表明PA-27-1为专一裂解病原性铜绿假单胞菌的宽谱噬菌体。
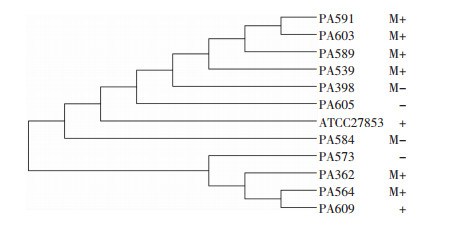
|
| M:多重耐药菌株;+:能被PA-27-1裂解;-:不能被PA-27-1裂解 图 1 部分临床菌株的16s DNA进化树 |
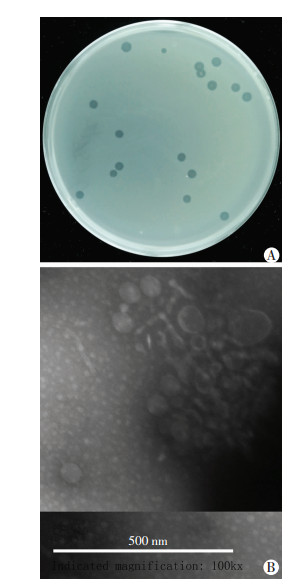
|
| 图 2 噬菌体PA-27-1噬菌斑(A)和透射电镜观察(B) |
2.2 形态特征及分类
纯化后的噬菌体PA-27-1经透射电镜观察(图 2B),可见头部呈多面立体对称结构,直径约为55 nm,尾长约30 nm,尾宽约7 nm,无囊膜。根据其尾丝的特点,噬菌体PA-27-1应属于有尾病毒目、短尾病毒科(Podoviridae)。
2.3 生物学特性 2.3.1 感染复数噬菌体PA-27-1的感染复数如图 3A,当以MOI=0.0001混合感染并培养3.5 h后,噬菌体效价最高,表明其对铜绿假单胞菌ATCC 27853的最佳感染复数为0.0001。
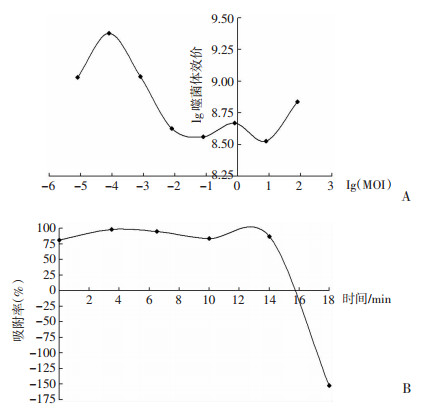
|
| 图 3 噬菌体PA-27-1感染复数(A)、吸附率曲线(B) |
2.3.2 吸附率曲线
噬菌体PA-27-1的吸附率曲线如图 3B。当噬菌体与宿主菌悬液混合后即有80%的噬菌体吸附,孵育4 min后有98%的噬菌体吸附;前14 min吸附率均在80%以上,表明噬菌体对宿主菌有较高的吸附率;孵育18 min后吸附率急剧下降,表明有子代噬菌体的产生。
2.3.3 一步生长曲线噬菌体PA-27-1的一步生长曲线如图 4,结果显示其对ATCC 27853的潜伏期为0~20 min,以MOI=10试验时,裂解期为20~60 min,60 min后为平台期,根据裂解量计算公式可得其裂解量约为248;以最佳感染复数0.0001试验时,裂解期为20~120 min,培养60~80 min可能是第二代噬菌体潜伏期,120~140 min效价变化不明显,进入平台期,裂解量约为164。
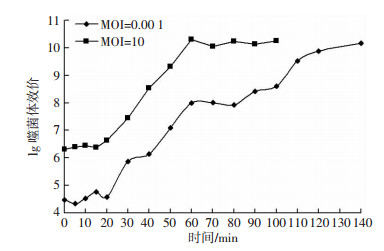
|
| 图 4 噬菌体PA-27-1一步生长曲线 |
2.3.4 稳定性试验
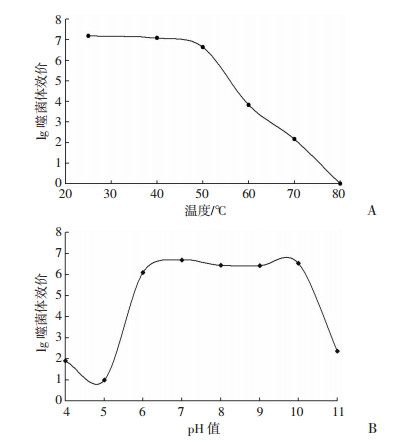
噬菌体PA-27-1温度稳定性和酸碱稳定性如图 5A和5B。PA-27-1在室温、40 ℃和50 ℃中孵育30 min后,均能保持较高的效价,当温度在60 ℃和70 ℃时,效价依次迅速下降,80 ℃时效价为0,噬菌体基本被灭活。PA-27-1在pH 6~10的培养液中孵育1 h后,均能保持较高的效价,在pH为4、5和11时,噬菌体效价迅速下降。PA-27-1与1%和10%的氯仿培养过夜后,效价变化不明显,即使是低效价(104 pfu/mL)的起始噬菌体;当氯仿终浓度提高到20%和50%后,不同效价(109、106、104 pfu/mL)的噬菌体的存活率分别为57.80%、49.11%、34.87%和37.48%、14.21%、18.73%。
|
| 图 5 噬菌体PA-27-1温度(A)和pH(B)稳定性 |
2.3.5 核酸及其酶切分析
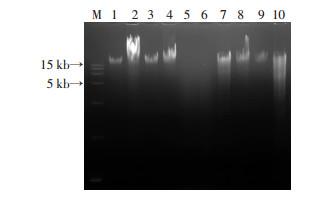
噬菌体PA-27-1和宿主菌ATCC 27853基因组及其酶切产物电泳结果如图 6,噬菌体PA-27-1的基因组为1个节段,大小>15 kb;基因组能被DNaseⅠ、NheⅠ、HindⅢ、SphⅠ等酶切,不能被RNase A、XhoⅠ、NdeⅠ等降解,表明PA-27-1的核酸类型为dsDNA,并有NheⅠ、BamHⅠ、HindⅢ、SphⅠ酶切位点。
|
| M:DNA标准;1~2:噬菌体PA-27-1和宿主菌ATCC 27853基因组;3~10:噬菌体PA-27-1和宿主菌ATCC 27853基因组分别被RNaseA、DNaseⅠ、NheⅠ、XhoⅠ酶切 图 6 噬菌体PA-27-1基因组及其酶切图谱 |
3 讨论
铜绿假单胞菌(俗称绿脓杆菌)主要通过污染的医疗器具及带菌医务人员引起医院感染,是引起医院感染的重要病原菌(10%左右),在某些特殊病房(如烧伤和肿瘤病房)中可高达30%[1]。张然等[15]分析了某院近年来临床分离病原菌的变迁及耐药趋势,指出铜绿假单胞菌总体上对临床常用抗菌药物的耐药性普遍较高,且对多数抗菌药物的耐药性逐年增强,对β-内酰胺类、一/二代头孢类药物的耐药率为50.0%~100.0%,对亚胺培南、氨曲南、美罗培南的耐药率近年来维持在较高水平。随着多耐药铜绿假单胞菌的不断出现,临床治疗该菌引起的感染变得更加困难且面临巨大挑战[8],探索其有效的治疗方法已至关重要[4-5]。研究人员试图研发全新作用机制的抗菌药物,如寻找与开发新型抗菌药物、研制能抑制新靶位的抗菌药物、破坏耐药菌的目标耐药基因以恢复其对抗菌药物的敏感性等,但这些办法既昂贵又费时,新抗菌药物应用的同时又不断地诱导出对新抗菌药物的耐药性,形成恶性循环[4, 6]。噬菌体作为一类裂解细菌的病毒,只感染并杀灭细菌,对人和动物无害,可作为一种安全的生物抗菌剂[5],被认为是对抗人类致病菌(包括耐药菌株)最有希望的疗法之一[16]。铜绿假单胞菌噬菌体治疗在动物实验中显示出了惊人的效果,少数临床病例报道也证实了其可行性和安全性[2]。
本研究先以铜绿假单胞菌标准菌株ATCC 27853为宿主菌,从医院污水中分离出1株裂解性噬菌体,以此噬菌体对临床菌株进行噬菌体裂解谱试验,选择不能裂解的临床菌株作为宿主再次筛选噬菌体,尽可能避免筛选到相同的噬菌体。为提高筛选效率,可以将过滤除菌的污水与宿主菌悬液共培养,目标噬菌体得以富集;培养液直接参考药敏试验K-B法,检测是否有目标噬菌体。裂解谱试验中,根据临床菌株药敏试验结果,选择不同耐药性的菌株作为裂解宿主菌,尽可能避免因检测相同的宿主菌而扩大裂解谱;后期只是对部分宿主菌进行16s DNA扩增、测序及进化树分析,未用RAPD-PCR基因指纹法[14]、Rep-PCR法[17]等对选择的所有宿主菌进行基因同源性分析,从基因水平上确认宽嗜性裂解谱。噬菌体PA-27-1对检测的162株临床菌株裂解效率可达79.63%(129/162),高于文献报道[75.86%(44/58)[14]、75%(6/8)[18]、66%(33/50)[5]、56.7%(17/30)[11]、40.1%(45/112)[3] ],对其中的耐药菌株能裂解80.95%(51/63),略低于文献[19]报道的81.5%(22/27);不能裂解大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、金黄色葡萄球菌等临床菌株,与宽谱噬菌体PL39[5]类似,表明PA-27-1为1株专一裂解铜绿假单胞菌的相对广谱噬菌体。电镜观察PA-27-1形态时,未将标尺调整为100 nm[3, 12],视野中噬菌体形态偏小;且未将标尺放置到目标视野附近,图 2B是按比例预估拼接而成。噬菌体PA-27-1的最佳感染复数(0.0001)<0.001[7]和0.1[3],>0.000 001[18]。吸附率试验显示噬菌体PA-27-1与ATCC 27853在4 min内即可完成98%的吸附,高于文献报道的5 min内约为90%[14]和10 min有85%以上、50 min有95%以上[11]的吸附率;18 min后吸附率急剧下降,表明有子代噬菌体的产生,提示裂解期开始。氯仿稳定性试验结果显示PA-27-1对氯仿具有较高的耐受性,低效价的噬菌体对高浓度的氯仿有较高的敏感性,不同于孙策[20](<1%的氯仿15 ℃作用1 h效价降至65%)、马兴铭[19](0.5%氯仿37 ℃处理13 h后无活性)、崔尹赡[21](25%的氯仿室温处理10 min完全丧失活性)和郭棵棵[3](等体积氯仿振荡1 min后完全失去感染活性)等的报道,表明噬菌体含脂类物质(脂质包膜、脂质囊膜等)较少。以上均提示噬菌体PA-27-1具有较强的裂解性、感染性和吸附性。
一步生长曲线可以反应出噬菌体繁殖经历的3个时期(①潜伏期,指噬菌体吸附于宿主菌之后至宿主菌开始释放子代噬菌体的一段时间;②裂解期,指被感染宿主菌开始裂解释放子代噬菌体至全部宿主菌被裂解的一段时间;③平台期,指宿主菌裂解完全后,噬菌体效价保持稳定的时期)和裂解量(指每个受染宿主菌产生子代噬菌体的平均数目)[3, 19]。潜伏期内噬菌体的吸附率应≤100%,当噬菌体开始裂解释放后,吸附率应急剧变化;潜伏期在吸附率曲线和一步生长曲线中应具有相关性,本研究绘制的两个曲线对应的潜伏期(18 min和20 min)差异不明显。这种裂解量计算方式忽略了多个噬菌体同时吸附同一宿主菌、潜伏期培养体系中游离噬菌体数、培养体系体积变化等影响因素,等同于用裂解末期噬菌体总数/感染初期宿主菌总数计算。结合感染复数定义,可以推算出感染初期噬菌体效价,且应大于潜伏期培养体系中噬菌体效价。不同的文献和专利中一步生长曲线检测方法不同,主要是起始感染复数(10[3]、0.1[14, 22]、0.05[11]和0.01[5])差异很大:当MOI≥1时,起始噬菌体总数≥宿主菌总数,混匀后可保证每个宿主菌细胞均能被噬菌体吸附,当宿主菌被完全裂解后将不再产生子代噬菌体,只有第一代噬菌体;当MOI<1时,起始噬菌体总数<宿主菌总数,如MOI=0.1,培养体系中噬菌体与宿主菌符合Poisson分布,仅有10%的宿主菌被感染,但在被感染的宿主菌中有90%是被单个噬菌体感染[14, 22],裂解释放出的第一代噬菌体继续侵染未被吸附的宿主菌(90%),并释放出第二代噬菌体,依次侵染直至宿主菌被完全裂解,因此其裂解期较长,释放有多代噬菌体,且MOI值越小裂解期越长。检测步骤多以“混匀-吸附-离心-洗涤-重悬-计时-取样-测效价”进行,有研究以高倍稀释(如稀释至1/10 000[14])或以抗噬菌体血清处理[19]孵育吸附后的噬菌体-宿主菌混悬液等方式使吸附停止。本研究分别用不同的MOI(10和最佳感染复数0.000 1)进行了试验,显示裂解期分别为20~60 min和20~120 min,计算出裂解量分别为248和164,高于文献(10[3]、20[5]、160[11]、174[19]等)报道,表明其裂解量大、侵染性强。
噬菌体疗法作为一种有效的生物治疗手段已引起人们的重视,但要将其真正应用于临床仍有大量问题需解决,如噬菌体自身(宿主谱较窄、宿主特异性和数量较少等)、细菌进化后快速耐受、机体免疫反应后快速中和、制剂安全等问题[2]。因此,需要分离筛选更多的不同裂解谱的宽谱噬菌体、人工进化突变株、噬菌体改造等,构建容量巨大的噬菌体库,通过含多种噬菌体的鸡尾酒混合制剂提高裂菌谱的覆盖率[3, 5];或对噬菌体裂解细菌机制(自内裂解和自外裂解)、裂解酶(葡糖苷酶、酰胺酶、内肽酶和转糖基酶)、“穿孔素-裂解酶”二元裂解系统、尾端吸附机制、噬菌体-宿主互作(菌毛,转录组学和代谢组学分析)等进行研究[5, 12, 23-25]。本研究分离筛选到的噬菌体PA-27-1,具有较宽的裂解谱和较强的生物学特性,为铜绿假单胞菌噬菌体的文库(生物多样性、基因多样性)构建、分子生物学研究、动物实验、临床治疗等后续研究奠定了重要基础。
| [1] |
李明远, 宝福凯. 医学微生物学[M]. 北京: 科学出版社, 2016.
LI M Y, BAO F K. Medical Microbiology[M]. Beijing: Science Press, 2016. |
| [2] |
杨雨卉, 乐率. 铜绿假单胞菌噬菌体治疗的研究进展[J].
中国抗生素杂志, 2017, 42(10): 814–820.
YANG Y H, LE S. Progress on Pseudomonas aeruginosa bacteriophage therapy[J]. Chin J Antibiot, 2017, 42(10): 814–820. DOI:10.3969/j.issn.1001-8689.2017.10.002 |
| [3] |
郭棵棵, 杨雨卉, 沈伟, 等. 一株感染铜绿假单胞菌的双链RNA噬菌体PaP6的分离和鉴定[J].
微生物学通报, 2016, 43(5): 948–954.
GUO K K, YANG Y H, SHEN W, et al. Isolation and characterization of PaP6, a newly isolated Pseudomonas aeruginosa bacteriophage containing three dsRNA genomic segments[J]. Microbiol China, 2016, 43(5): 948–954. |
| [4] | BURROWS L L. The Therapeutic Pipeline for Pseudomonas aeruginosa Infections[J]. ACS Infect Dis, 2018, 4(7): 1041–1047. DOI:10.1021/acsinfecdis.8b00112 |
| [5] |
李亚辉, 王小亭, 靳静, 等. 铜绿假单胞菌宽谱噬菌体PL39生物学特性研究[J].
中国病原生物学杂志, 2016(2): 144–146.
LI Y H, WANG X T, JIN J, et al. Characterization of a bacteriophage, PL39, that infects a broad range of Pseudomonas aeruginosa[J]. J Pathogen Biol, 2016(2): 144–146. |
| [6] |
付丽娜, 王丽丽, 李晓宇, 等. 噬菌体对三大耐药菌的防控作用研究进展[J].
中国抗生素杂志, 2017, 42(10): 836–841.
FU L N, WANG L L, LI X Y, et al. Advances in phage control of three drug-resistant strains[J]. Chin J Antibiot, 2017, 42(10): 836–841. DOI:10.3969/j.issn.1001-8689.2017.10.005 |
| [7] |
王文杰. 宽嗜性铜绿假单胞菌噬菌体的生物学特性及对临床菌株的嗜性覆盖研究[J].
医学临床研究, 2014, 31(7): 1259–1262.
WANG W J. Study on biological characteristics and coverage on clinical strains of wide tropism pseudomonas aeruginosa phages[J]. J Clin Res, 2014, 31(7): 1259–1262. DOI:10.3969/j.issn.1671-7171.2014.07.004 |
| [8] |
杨梅, 杜崇涛, 顾敬敏, 等. 铜绿假单胞菌噬菌体裂解酶LysYH6的表达与活性[J].
吉林农业大学学报, 2015, 37(3): 357–362.
YANG M, DU C T, GU J M, et al. Expression and antibacterial activity of endolysin lysYH6 derived from a novel Pseudomonas aeruginosa phage YH6[J]. J Jilin Agricult Univ, 2015, 37(3): 357–362. |
| [9] |
曹振辉, 张建城, 金礼吉, 等. 噬菌体控制绿脓杆菌感染的研究进展[J].
黑龙江畜牧兽医, 2014(11): 58–61.
CAO Z H, ZHANG J C, JIN L J, et al. Research process on the use of bacteriophages to control the infection of Pseudomonas aeruginosa[J]. Heilongjiang Animal Sci Veterin Med, 2014(11): 58–61. |
| [10] | AL-WRAFY F, BRZOZOWSKA E, GÓRSKA S, et al. Pathogenic factors of Pseudomonas aeruginosa — the role of biofilm in pathogenicity and as a target for phage therapy[J]. Postepy Hig Med Dosw (Online), 2017, 71(0): 78–91. DOI:10.5604/01.3001.0010.3792 |
| [11] |
徐彬, 高晶, 郭晓奎, 等. 铜绿假单胞菌噬菌体D204的生物学特性和基因组学研究[J].
上海交通大学学报(医学版), 2016, 36(1): 1–5.
XU B, GAO J, GUO X K, et al. Study on the biological and genomic characteristics of Pseudomonas aeruginosa phage D204[J]. J Shanghai Jiaotong Univ(Med Sci), 2016, 36(1): 1–5. DOI:10.3969/j.issn.1674-8115.2016.01.001 |
| [12] |
罗娟, 张然, 吴柳, 等. 鲍曼不动杆菌噬菌体SWH-Ab-1分离鉴定及其重要功能基因的生物信息学分析[J].
第三军医大学学报, 2018, 40(1): 23–30.
LUO J, ZHANG R, WU L, et al. Isolation and identification of phage SWH-Ab-1 against Acinetobacter baumannii and bioinformatic analysis of its major functional genes[J]. J Third Mil Med Univ, 2018, 40(1): 23–30. DOI:10.16016/j.1000-5404.201708010 |
| [13] |
陈龙, 胡佳萍, 徐文刚, 等. 噬菌体治疗铜绿假单胞菌感染的初步应用研究[J].
中国卫生检验杂志, 2016, 26(10): 1409–1411.
CHEN L, HU J P, XU W G, et al. Preliminary application of bacteriophages against Pseudomonas aeruginosa infection[J]. Chin J Health Lab Tec, 2016, 26(10): 1409–1411. |
| [14] |
李宁.宽嗜性铜绿假单胞菌噬菌体YAPa及其用途: 中国, 201410120067.9[P]. 2014-03-02.
LI N. Application of wide tropism pseudomonas aeruginosa phages YAPa: China, 201410120067.9[P]. 2014-03-02. |
| [15] |
张然, 刘智勇, 吴柳, 等. 2012-2017年某综合教学医院临床分离病原菌的变迁及耐药趋势分析[J].
中华医院感染学杂志, 2018, 28(16): 2463–2469.
ZHANG R, LIU Z Y, WU L, et al. Distribution and variation of antimicrobial resistance of pathogenic bacteria isolated from clinical specimens in a teaching hospital in 2012-2017[J]. Chin J Nosocomiol, 2018, 28(16): 2463–2469. DOI:10.11816/cn.ni.2018-181279 |
| [16] | ROHWER F, SEGALL A M. In retrospect: A century of phage lessons[J]. Nature, 2015, 528(7580): 46–48. DOI:10.1038/528046a |
| [17] |
代芳芳, 赵秀英, 于艳华, 等. 医院内宽嗜性铜绿假单胞菌噬菌体的分离筛选[J].
首都医科大学学报, 2013, 34(5): 727–732.
DAI F F, ZHAO X Y, YU Y H, et al. Isolation and identification of pseudomonas aeruginosa phages with broad host range in hospital[J]. J Capit Med Univ, 2013, 34(5): 727–732. DOI:10.3969/j.issn.1006-7795.2013.05.019 |
| [18] |
张凡, 陈昊, 柳鹏程, 等. 6株铜绿假单胞菌噬菌体的分离及其生物学特性[J].
兰州大学学报(医学版), 2017, 43(6): 28–34.
ZHANG F, CHEN H, LIU P C, et al. Identification and biological characteristics of six Pseudomonas aeruginosa phage strains[J]. J Lanzhou Univ (Med Sci), 2017, 43(6): 28–34. DOI:10.13885/j.issn.1000-2812.2017.06.007 |
| [19] |
马兴铭.一株可裂解多重耐药铜绿假单胞菌的噬菌体及其治疗感染的应用: 201310164780.9[P]. 2014-11-12.
MA X M. Phage capable of lysing multi-drug resistant Pseudomonas aeruginosa and application thereof for treating infection: 201310164780.9[P]. 2014-11-12. |
| [20] |
孙策, 赵龙, 魏云林, 等. 一株裂解性低温假单胞菌噬菌体的分离及特性研究[J].
生命科学研究, 2014, 18(3): 222–226.
SUN C, ZHAO L, WEI Y L, et al. Isolation and characterization of a lytic cold-active bacteriophage of pseudomonas fluorescens[J]. Life Sci Res, 2014, 18(3): 222–226. |
| [21] |
崔尹赡, 易萍, 许忠福, 等. 一株假单胞菌属低温噬菌体的分离及其特性研究[J].
中国微生态学杂志, 2013, 25(3): 249–253.
CUI Y S, YI P, XU Z F, et al. Isolation and characterization of a Pseudomonas-specific cold-active bacteriophage[J]. Chin J Microecol, 2013, 25(3): 249–253. |
| [22] |
范华昊.耐药性嗜麦芽窄食单胞菌和绿脓杆菌噬菌体初步应用研究[D].长沙: 中南大学, 2013.
FAN H H, et al. Preliminary application of bacteriophages against antibiotics-resistant Stenotrophomonas maltophilia and Pseudomonas aeruginosa[D]. Changsha: Central South University, 2013. |
| [23] |
朱丹, 祝思路, 付玉荣, 等. 噬菌体裂解酶作用机制及用于细菌感染治疗的研究进展[J].
基础医学与临床, 2018(2): 241–245.
ZHU D, ZHU S L, FU Y R, et al. Mechanism and progress of the research on the treatment of bacterial infection with bacteriophage lysin[J]. Basic Clin Med, 2018(2): 241–245. DOI:10.3969/j.issn.1001-6325.2018.02.020 |
| [24] | KIM E S, BAE H W, CHO Y H. A pilin region affecting host range of the Pseudomonas aeruginosa RNA phage, PP7[J]. Front Microbiol, 2018, 9: 247. DOI:10.3389/fmicb.2018.00247 |
| [25] | ZHAO X, SHEN M, JIANG X, et al. Transcriptomic and metabolomics profiling of phage-host interactions between phage PaP1 and Pseudomonas aeruginosa[J]. Front Microbiol, 2017, 8: 548. DOI:10.3389/fmicb.2017.00548 |



