2. 400016 重庆,重庆医科大学附属第一医院:胃肠外科
2. Department of Gastrointestinal Surgery, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
肺癌是当今世界最常见的肿瘤,很多肺癌患者在确诊时候已经是中晚期,失去了手术的机会,因而化疗成为肺癌常用的治疗方法,其中最常用的为铂类化疗方案。但随着化疗药物的长期和不规范使用,很多肺癌患者对顺铂产生获得性耐药,治疗效果大大降低。因此,研究导致肺癌发生化疗耐药的基因以及可能作用的机制具有重要的理论价值和意义。
microRNA是一类高度保守非编码小分子RNA,其长度为18~24核苷酸,参与人体的多种生物学过程,能够与靶基因mRNA3’UTR结合,影响其蛋白的表达,进而影响多种生物学功能[1]。据报道microRNA可以通过调控上皮间质转化相关过程,进而影响肿瘤细胞的各种生物学过程[2],例如:microRNA不仅能够影响靶细胞增殖、迁移、侵袭能力,还能影响其对化疗药物的敏感性[3-4]。上皮间质转化(epithelial-mesenchymal transition, EMT)是指排列整齐、具有细胞极性的上皮细胞在特定的生理病理情况下转变成排列松散,失去细胞极性的间充质细胞,使细胞黏附能力减弱并具有运动能力,从而增强肿瘤细胞的侵袭与转移能力[5]。研究报道上皮间质转换与化疗耐药密切相关,可能与EMT相关转录因子TWIST、SLUG、ZEB等相关[6-7]。mir-151a-5p能在多种肿瘤中进行表达,例如:肝癌、乳腺癌、胃癌、鼻咽癌、前列腺癌中都有过度表达,提示在肿瘤中可能作为一种致癌基因[8]。而mir-151a-5p是否与EMT相关,是否通过调控EMT的发生从而影响肺癌A549细胞对顺铂的敏感性等目前尚不清楚。因此,本实验探讨在肺癌中mir-151a-5p与EMT之间的关系,拟通过下调其在肺癌细胞中的表达,抑制EMT发生,从而抑制肺癌细胞侵袭转移,增加对顺铂的敏感性。
1 材料与方法 1.1 材料 1.1.1 组织标本16例肺腺癌肿瘤组织(1例中含肺腺癌组织和距离切缘约5 cm癌旁组织)来自本院胸心外科2017年9-12月和2018年12月的手术患者,均经病理证实为原发性肺腺癌,并且术前未行放化疗治疗,已取得患者及家属知情同意。本研究经本院伦理委员会审批通过(2018-124号)。
1.1.2 细胞和主要试剂H1975、H2228、HBE细胞株均由重庆医科大学基础医学院馈赠,H1299、A549由重庆医科大学分子肿瘤及表观遗传学重庆市重点实验室保存。胎牛血清购自BI公司,RPMI1640培养基购自HyClone公司,胰蛋白酶购自碧云天公司,TRIzol购自TaKaRa公司。All-in-one miRNA qRT-PCR检测试剂盒(20RT+200qPCR)以及验证引物mir-151a-5p、U6均购自GeneCopoeia公司,hsa-mir-151a-5p上游引物:5′-ACGCGTCGAGGAGCTCACAG-3′,下游引物:5′-ATCCAGTGCAGGGTCCGAGG-3′;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCT- TCACGAATTTGCGT-3′。microRNA inhibitor NC(negative control)、hsa-mir-151a-5p inhibitor购自上海吉玛基因公司。LipofectamineTM2000购自Invitrogen公司。CCK-8细胞活力检测试剂盒购自恩晶生物公司。Transwell小室购自美国Corning公司。Matrigel基质胶购自BD公司。RIPA裂解液、PMSF、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(5×)、SDS-PAGE凝胶配制试剂盒、Protein ladder、超敏ECL化学发光试剂盒均购自碧云天公司。TBS粉、封闭蛋白干粉购自博士德公司,Tween购自赛米克公司。兔抗人E-cadherin、N-cadherin、Vimentin、Notch1多克隆抗体均购自万类生物公司。兔抗人GAPDH单克隆抗体购自CST公司。辣根过氧化物酶标记的山羊抗兔IgG二抗购自博奥森公司。顺铂购自麦克林公司。
1.2 方法 1.2.1 肺腺癌组织的收集与RNA提取先将从手术室收集的新鲜离体肺癌组织(含癌旁组织)直接放入-80 ℃冰箱储存。然后将总共收集的16对肺腺癌组织(含癌旁组织)加入适量液氮进行研磨,再用匀浆器进一步研磨,做好标记,把研磨好的肺癌和对应的癌旁组织放入相应的EP管中。用TRIzol提取组织中总RNA,将提取好的RNA放入-80 ℃冰箱保存。最后用提取好的16对组织RNA应用All-in-one miRNA qRT-PCR检测试剂盒(20RT+200qPCR)逆转录成cDNA,参照说明书进行qPCR扩增检测, 并采用2-△△ct相对定量方法进行计算。
1.2.2 细胞培养、细胞株的筛选用含10%胎牛血清的RPMI1640培养基培养H1975、H1299、H2228、A549、HBE细胞,再放入37 ℃,5%CO2孵箱中培养。每天进行细胞换液,当细胞处于生长对数期,细胞融合度达到80%左右进行传代、冻存。传代时用0.25%胰酶(含EDTA)消化细胞。冻存用含10%DMSO胎牛血清冻存液,采用梯度冻存法冻存细胞,然后放置-80 ℃保存。待H1975、H1299、H2228、A549、HBE细胞生长状态良好、处于对数期时用TRIzol法提取RNA,接着应用All-in-one miRNA qRT-PCR检测试剂盒(20RT+200qPCR)逆转录成cDNA,再进行qPCR扩增检测,结果采用2-△△ct相对定量方法进行计算,最后筛选出表达最高的一组细胞。
1.2.3 细胞转染及qPCR验证将筛选出的A549细胞以50×104个/孔接种于六孔板,分别设置NC对照组和hsa-mir-151a-5p inhibitor转染组(inhibitor组),每组设3个复孔。当细胞融合度至70%~90%时,开始接种。首先将100 pmol microRNA-151a-5p inhibitor、microRNA inhibitor NC和5 μL LipofectamineTM2000分别加入125 μL RPMI1640无血清培养基中,将稀释好的上述液体室温静止5 min,再把两者混合,用枪头轻轻吹打后,室温下静止20 min。然后将上述混合液加入每个孔中,再加入含10%胎牛血清的RPMI1640完全培养基补充至2 mL,最后放入37 ℃,5%CO2孵箱中培养,4~6 h后更换为新鲜的完全培养基。转染24~48 h后用TRIzol提取细胞总RNA,方法同上。
1.2.4 CCK-8检测转染后A549细胞增殖将转染后的且处于生长对数期的A549细胞以5×103个/孔接种于96孔板中,每组设置3个复孔,再分别于细胞接种0、24、48、72 h时加入10 μL/孔CCK-8试剂(避光)后,放入37 ℃,5%CO2孵箱中培养2 h,应用酶标仪检测波长为450 nm时的光密度值[D(450)]。
1.2.5 Transwell实验检测A549细胞迁移和侵袭能力 1.2.5.1 迁移实验将已分组转染后的A549细胞放入37 ℃,5%CO2孵箱中培养48 h,细胞融合度达80%时,先用胰酶消化收集,再用无血清的RPMI1640重悬细胞后,取上述200 μL的重悬液(约含有5×104细胞)加入到24孔板的上室中。下室加入700 μL含10%胎牛血清的RPMI1640培养基,每组设有3个复孔,放入孵箱中培养24 h;再拿出小室,用PBS清洗,用棉签轻轻擦掉上室细胞,晾干,然后加入700 μL 4%多聚甲醛固定30 min,固定完后自然晾干,再用结晶紫染色15 min,PBS清洗3遍,晾干后置于光学显微镜下观察、拍照并计数穿膜细胞。
1.2.5.2 侵袭实验将已分装好保存于-20 ℃的Matrigel基质胶放置4 ℃解冻,用无血清的RPMI1640稀释,稀释比例为1 :7;把稀释好的100 μL基质胶加入上室,放入孵箱3~4 h使其凝固,然后将已分好组转染后的A549细胞用胰酶消化收集,无血清培养基重悬,小室上室加入约含8×104个细胞的重悬液,其余步骤同迁移实验。
1.2.6 细胞克隆形成实验将转染后A549细胞放入孵箱内培养,等待细胞融合度为80%~90%时,用胰酶消化离心,接着用含10%胎牛血清的RPMI1640完全培养基重悬并计数,以每孔800个细胞接种于六孔板中,每组设置3个复孔, 再放入37 ℃,5%CO2孵箱中培养7 d, 观察至长出肉眼可见细胞集落,终止培养,弃掉培养液,用PBS清洗1遍,每孔加入1 mL 4%多聚甲醛固定30 min, 然后加入1 mL结晶紫染色15 min, PBS清洗3遍,自然干燥后拍照。
1.2.7 细胞蛋白提取及Western blot验证蛋白表达将转染48 h后的A549细胞用PBS清洗3遍,每个皿中加入100 μL裂解液(RIPA :PMSF=100 :1), 放置4 ℃摇床上裂解30 min, 用细胞刮将细胞刮下,超声裂解1 min,4 ℃离心机12 000 r/min离心10 min, 用枪头吸取上清液至干净的1.5 mL EP管中, 用BCA蛋白浓度测定试剂盒测蛋白浓度,加入1/4总体积的SDS-PAGE蛋白上样缓冲液(5×),然后在100 ℃中煮沸裂解后的蛋白5 min。用SDS-PAGE凝胶配制试剂盒配制10%分离胶和5%浓缩胶,20 μg进行上样,SDS-PAGE凝胶电泳,切取相应大小的PVDF膜,0 ℃、250 mA电转。再用50 g/L脱脂奶粉室温封闭2 h,TBST洗膜,加入兔抗人E-cadherin(1 :300)、N-cadherin(1 :500)、Vimentin (1 :500)、Notch1(1 :500)、GAPDH(1 :300)的一抗,放在4 ℃冻库摇床孵育过夜,之后用TBST清洗PVDF膜3次,10 min/次。清洗后室温孵育二抗HRP山羊抗兔IgG(1 :3 000)2 h,再用TBST洗3次,每次10 min。最后用ECL化学发光试剂(A液:B液=1 :1)进行显影,Fusion软件进行曝光。Image J进行蛋白条带灰度值分析和细胞计数。
1.2.8 转染后A549细胞对顺铂增敏作用将已转染后A549细胞以每孔5 000个细胞接种于96孔板,放入孵箱中培养24 h, 再设置顺铂药物浓度梯度为:0、2、4、8、16、32、64、128 μg/mL,同时每组浓度设置3个复孔,然后将稀释好的不同浓度顺铂药物依次加入96孔板中,继续放入孵箱中培养24 h后, 每孔加入10 μL CCK-8试剂,37 ℃,5%CO2孵育2 h(避光),用酶标仪测量波长450 nm处的光密度值[D(450)]。最后用Graphpad Prism5计算IC50值。
1.2.9 流式细胞术检测细胞凋亡将已转染后的A549细胞,加入2 μg/mL顺铂处理24 h后,开始收集细胞,先用PBS清洗1遍,然后用0.25%胰酶消化离心,弃上清,每管加入已预冷5 mL冷PBS,轻轻吹打重悬细胞,再离心,弃上清,每管加入100 μL Binding Buffer轻轻吹匀,然后加入5 μL Annexin V-FITC和5 μL PI,室温避光孵育15 min,然后流式细胞仪进行检测。
1.3 统计学分析采用SPSS 22.0统计软件,Graphpad Prism5绘制图形,计量资料以x±s表示,两组间计量资料采用student t检验,多组间数据采用单因素方差分析,检验水准α=0.05。
2 结果 2.1 mir-151a-5p在肺癌和癌旁组织中的表达在收集的16对肺腺癌组织与癌旁组织中,RT-qPCR结果显示mir-151a-5p在癌组织中的相对表达量(4.22±3.06)明显高于癌旁组织(1.02±1.04, P < 0.01)。
2.2 mir-151a-5p在H1975、H1299、H2228、A549、HBE细胞株中的表达mir-151a-5p在各肺腺癌细胞株中的表达情况以U6作为内参,用RT-qPCR检测mir-151a-5p在H1975、H1299、H2228、A549、HBE细胞株中的表达,结果显示,mir-151a-5p在各种肺腺癌细胞中表达均高于人支气管上皮细胞HBE(P < 0.01,图 1)。选择表达最高肺腺癌A549细胞做后续实验。
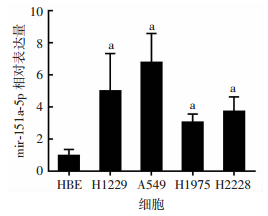
|
| a:P < 0.01,与HBE细胞比较 图 1 mir-151a-5p在肺癌细胞株和人正常支气管上皮细胞中的表达 |
2.3 构建mir-151a-5p-inhibitor转染的A549细胞
RT-qPCR检测结果显示,mir-151a-5p在inhibitor组中的相对表达量明显低于NC对照组(P < 0.01,图 2),成功构建了mir-151a-5p-inhibitor转染的A549细胞。
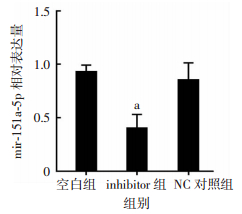
|
| a: P < 0.01,与NC对照组比较 图 2 RT-qPCR检测inhibitor转染后mir-151a-5p在A549细胞中的表达 |
2.4 Inhibitor转染后A549细胞增殖能力检测
CCK-8检测mir-151a-5p inhibitor转染后A549细胞的增殖能力,结果表明inhibitor组细胞增殖能力明显低于NC组对照(P < 0.05,图 3)。说明下调mir-151a-5p表达能明显抑制细胞的增殖。
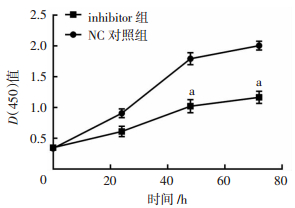
|
| a: P < 0.05,与NC对照组比较 图 3 CCK-8检测mir-151a-5p转染后A549细胞增殖能力 |
2.5 Transwell迁移、侵袭实验
以每组计数5个非重复视野,计算出各组穿膜细胞数的平均值。Transwell迁移实验结果显示,inhibitor组A549细胞穿膜数明显少于NC对照组(P < 0.01,图 4)。侵袭实验结果显示,inhibitor组A549细胞穿膜数明显少于NC对照组(P < 0.01,图 4)。说明下调mir-151a-5p表达显著抑制A549细胞的迁移和侵袭能力。

|
| A:迁移和侵袭结果;B:穿膜细胞数a:P < 0.01,与NC对照组比较 图 4 Transwell检测A549细胞的迁移和侵袭能力 (结晶紫×200) |
2.6 克隆形成实验
细胞克隆形成实验结果显示,inhibitor组细胞克隆形成数为(58±14),明显低于NC对照组(162±17,P < 0.01, 图 5)。故下调mir-151a-5p表达能显著抑制细胞克隆形成能力。
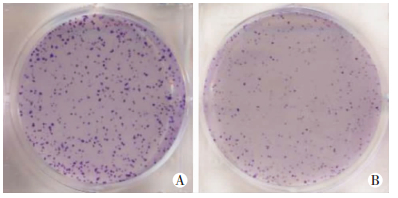
|
| A:NC对照组;B:inhibitor组 图 5 克隆形成实验观察两组细胞克隆数 |
2.7 EMT相关蛋白的表达
Western blot检测蛋白表达,通过Image J软件定量分析各蛋白条带的灰度值,计算相对蛋白表达量:目的/内参蛋白灰度值。结果显示inhibitor组E-cadherin表达较NC对照组显著升高(P < 0.01),而N-cadherin、Vimentin、Notch1表达较NC对照组显著降低(P<0.01,图 6)。
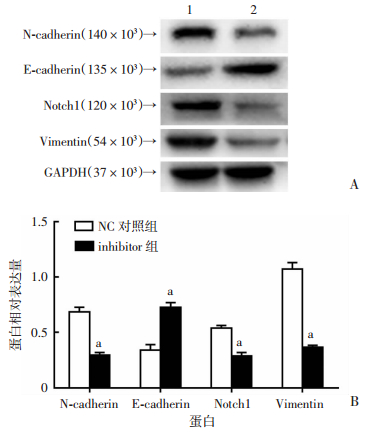
|
| A:Western blot检测结果1:NC对照组;2:inhibitor组;B:蛋白相对表达量a: P < 0.01,与NC对照组比较 图 6 Western blot检测各组N-cadherin、E-cadherin、Notch1、Vimentin蛋白的表达 |
2.8 mir-151a-5p inhibitor转染肺癌A549细胞后对顺铂增敏作用
CCK-8检测结果显示,inhibitor组IC50值为(5.14± 1.20)μg/mL,显著低于NC对照组[(10.75±1.57)μg/mL,P < 0.01]。证明下调mir-151a-5p表达能增加肺癌A549细胞对顺铂化疗药物的敏感性。
2.9 mir-151a-5p inhibitor转染A549细胞后对凋亡的影响用2 μg/mL顺铂处理转染后的A549细胞,用流式细胞仪检测细胞凋亡情况(图 7)。结果显示,inhibitor组的凋亡率为(11.2±0.6)%,显著高于NC对照组[(5.3±0.1)%,P < 0.01]。故下调mir-151a-5p可以促使A549细胞对顺铂更敏感,增加其凋亡率。
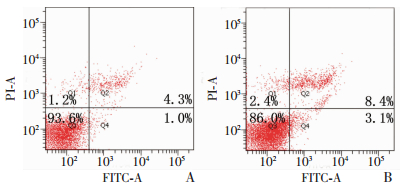
|
| A:NC对照组;B:inhibitor组 图 7 流式细胞术检测顺铂作用的A549细胞凋亡情况 |
3 讨论
肺癌已经成为威胁现代社会人类健康和生命的无形杀手。据2018年美国最新癌症数据统计,其发病率在男性和女性中分别占14%和13%,位列第二位,死亡率更是占到男性和女性的首位,分别为26%和25%[9]。在我国肺癌的发病率也逐年增加,每年确诊的肺癌患者高达73万人,无论是男性、还是女性死亡率均排在第一位,显然肺癌已经成为癌症死亡的首要原因[10]。尽管目前在肺癌的早期诊断、治疗方法(如:手术治疗、靶向药物、免疫治疗、放化疗等综合治疗措施)都取得了一些进展,但是肺癌患者的预后并没有明显的改善,5年生存期依然没有提高[11]。
近年研究发现,EMT与化疗耐药密切相关,当肿瘤细胞发生EMT时,肿瘤细胞由上皮细胞进而转变成失去细胞极性的间质细胞,增加了运动、侵袭能力,同时也让肿瘤细胞对凋亡有更高的抵抗力,降低其对化疗药物的敏感性,使患者对化疗药物产生耐药,从而导致治疗的失败[12-13]。E-cadherin作为上皮表型的关键分子,当肿瘤细胞被诱导发生EMT时,其表达会降低,而间质表型标志物Vimentin的表达升高[14-15]。然而EMT又是通过什么机制导致肺癌患者对化疗药物产生耐药呢?研究发现,EMT会增强肿瘤细胞的增殖能力,抑制肿瘤细胞的凋亡,同时细胞膜的糖蛋白变化也会使化疗药物的吸收减少,增加药物的外排,从而抑制对肿瘤细胞的杀伤作用,进而导致患者对化疗药的耐药。由此可见EMT可能是导致肺癌患者对化疗药不敏感的关键步骤,抑制EMT发生能够逆转肿瘤细胞对化疗药的耐药。ZHUO等[16]发现通过干扰EMT相关转录因子Twist,下调其在肺癌A549细胞中的表达,可以增加A549细胞对顺铂药物的敏感性。ZHENG等[13]报道了发生EMT的胰腺癌细胞不仅会增加其转移能力,还能诱导对化疗药物产生耐药。
而microRNA作为一种调控基因,能够调节人体的多种生物学过程,包括EMT的发生[17-19]。其中mir-151a-5p在各种肿瘤中都表达升高。因此,本实验首先验证其在肺腺癌组织中的表达高于正常肺组织,提示作为一种致癌基因,参与肿瘤的发生与发展。研究发现mir-151在胶质瘤中高表达,促进胶质瘤的迁移侵袭能力和EMT[20]。本实验为了验证mir-151a-5p与EMT之间的关系,通过下调mir-151a-5p在肺癌A549中的表达,证实了A549的增殖、迁移、侵袭能力均下降,而Western blot结果发现EMT相关蛋白的表达:上皮标志物E-cadherin表达升高,而N-cadherin、Notch1、Vimentin蛋白的表达明显降低。因此,可以得出通过下调mir-151a-5p在A549细胞表达,能够抑制其发生EMT。然后CCK-8实验检测IC50也证实了下调mir-151a-5p的表达能够抑制EMT,从而增强A549对顺铂的敏感性。最后通过流式细胞术检测用顺铂处理转染后的A549细胞,结果表明mir-151a-5p inhibitor转染组的凋亡率明显高于NC对照组。说明下调mir-151a-5p在A549细胞中的表达能够促进肺癌细胞发生凋亡,增加A549细胞对顺铂的敏感性。
然而本研究只验证了mir-151a-5p与EMT及化疗耐药之间的直接关系,具体mir-151a-5p通过调控哪一个靶基因、哪一条通路影响着A549对顺铂的敏感性还有待进一步研究。EMT相关的经典通路有Wnt/β-catenin通路、TGF-β通路、EGFR生长因子通路、hedgehog通路、Notch通路等[21]。Western blot结果显示Notch蛋白表达的变化,提示mir-151a-5p在肺癌中可能是通过Notch通路来调控EMT的发生。相关研究发现,Notch通路的激活是由配体与受体的结合所激发的,并诱导Snail与E-cadherin的E-box部位结合,从而调控E-cadherin的表达,进而调节EMT的发生[22-23]。通过mirRNA靶基因预测软件Target Scan Human7.2和miRBase的预测,发现mir-151a-5p能够与snail2(slug)结合,进而调控EMT的发生。因此,mir-151a-5p是否通过Notch通路影响肺癌细胞对顺铂的敏感性,有待后续进一步实验验证。
综上,本实验证实了下调mir-151a-5p在A549细胞株中的表达能够抑制其增殖、迁移、侵袭能力,增加对顺铂化疗药物的敏感性,为临床上肺癌的治疗提供新的理论依据。
| [1] | DI LEVA G, CROCE C M. miRNA profiling of cancer[J]. Curr Opin Genet Dev, 2013, 23(1): 3–11. DOI:10.1016/j.gde.2013.01.004 |
| [2] |
何姝槿, 陈厚文, 熊丽霞. MicroRNA对EMT的调节作用及其与肿瘤侵袭的关系[J].
中国生物化学与分子生物学报, 2016, 32(11): 1197–1205.
HE S J, CHEN H W, XIONG L X. Regulation of EMT by microRNA and its relation with tumor invasion[J]. Chin J Biochem Mol Biol, 2016, 32(11): 1197–1205. DOI:10.13865/j.cnki.cjbmb.2016.11.04 |
| [3] | HUR K, TOIYAMA Y, TAKAHASHI M, et al. MicroRNA-200c modulates epithelial-to-mesenchymal transition (EMT) in human colorectal cancer metastasis[J]. Gut, 2013, 62(9): 1315–1326. DOI:10.1136/gutjnl-2011-301846 |
| [4] | SINGH A, SETTLEMAN J. EMT, cancer stem cells and drug resistance: an emerging axis of evil in the war on cancer[J]. Oncogene, 2010, 29(34): 4741–4751. DOI:10.1038/onc.2010.215 |
| [5] |
张弛, 谈景旺, 施国明, 等. 上皮间质转化与肿瘤侵袭转移[J].
中国临床医学, 2012, 19(2): 187–189.
ZHANG C, TAN J W, SHI G M, et al. Epithelial-mesenchymal transformation and invasion and metastasis of tumors[J]. Chin Clin Med, 2012, 19(2): 187–189. DOI:10.3969/j.issn.1008-6358.2012.02.036 |
| [6] | BULLOCK M D, SAYAN A E, PACKHAM G K, et al. MicroRNAs: critical regulators of epithelial to mesenchymal (EMT) and mesenchymal to epithelial transition (MET) in cancer progression[J]. Biol Cell, 2012, 104(1): 3–12. DOI:10.1111/boc.201100115 |
| [7] | SHINTANI Y, OKIMURA A, SATO K, et al. Epithelial to mesenchymal transition is a determinant of sensitivity to chemo- radiotherapy in non-small cell lung cancer[J]. Ann Thorac Surg, 2011, 92(5): 1794–1804. DOI:10.1016/j.athoracsur.2011.07.032 |
| [8] | CHIYOMARU T, YAMAMURA S, ZAMAN M S, et al. Genistein suppresses prostate cancer growth through inhibition of oncogenic microRNA-151[J]. PLoS ONE, 2012, 7(8): e43812. DOI:10.1371/journal.pone.0043812 |
| [9] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7–30. DOI:10.3322/caac.21442 |
| [10] | CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [11] |
徐国栋. MicroRNA-9/eIF5A2通路在非小细胞肺癌侵袭转移和顺铂耐药中的作用及机制研究[D].杭州: 浙江大学, 2017.
XU G D. Role and mechanism of microRNA-9/eIF5A2 pathway in invasion and metastasis of non-small cell lung cancer and cisplatin resistance[D]. Hangzhou: Zhejiang University, 2017. |
| [12] | FISCHER K R, DURRANS A, LEE S, et al. Epithelial-to-mesenchymal transition is not required for lung metastasis but contributes to chemoresistance[J]. Nature, 2015, 527(7579): 472–476. DOI:10.1038/nature15748 |
| [13] | ZHENG X, CARSTENS J L, KIM J, et al. Epithelial-to-mesenchymal transition is dispensable for metastasis but induces chemoresistance in pancreatic cancer[J]. Nature, 2015, 527(7579): 525–530. DOI:10.1038/nature16064 |
| [14] | OLIVERAS-FERRAROS C, COROMINAS-FAJA B, CUFÍ S, et al. Epithelial-to-mesenchymal transition(EMT) confers primary resistance to trastuzumab (Herceptin)[J]. Cell Cycle, 2012, 11(21): 4020–4032. DOI:10.4161/cc.22225 |
| [15] | NURWIDYA F, TAKAHASHI F, MURAKAMI A, et al. Epithelial mesenchymal transition in drug resistance and metastasis of lung cancer[J]. Cancer Res Treat, 2012, 44(3): 151–156. DOI:10.4143/crt.2012.44.3.151 |
| [16] | ZHUO W L, WANG Y, ZHUO X L, et al. Short interfering RNA directed against TWIST, a novel zinc finger transcription factor, increases A549 cell sensitivity to cisplatin via MAPK/mitochondrial pathway[J]. Biochem Biophys Res Commun, 2008, 369(4): 1098–1102. DOI:10.1016/j.bbrc.2008.02.143 |
| [17] | JIAO A, SUI M, ZHANG L, et al. MicroRNA-200c inhibits the metastasis of non-small cell lung cancer cells by targeting ZEB2, an epithelial-mesenchymal transition regulator[J]. Mol Med Rep, 2016, 13(4): 3349–3355. DOI:10.3892/mmr.2016.4901 |
| [18] | JIN Z, GUAN L, SONG Y, et al. MicroRNA-138 regulates chemoresistance in human non-small cell lung cancer via epithelialmesenchymaltransition[J]. Eur Rev Med Pharmacol Sci, 2016, 20(6): 1080–1086. |
| [19] | HE Z, YU L, LUO S, et al. miR-296 inhibits the metastasis and epithelial-mesenchymal transition of colorectal cancer by targeting S100A4[J]. BMC Cancer, 2017, 17(1): 140. DOI:10.1186/s12885-017-3121-z |
| [20] | LIN X, YANG B, LIU W, et al. Interplay between PCBP2 and miRNA modulates ARHGDIA expression and function in glioma migration and invasion[J]. Oncotarget, 2016, 7(15): 19483–19498. DOI:10.18632/oncotarget.6869 |
| [21] |
徐思云, 李静, 耿美玉. 上皮间质转化的信号转导调控及药物开发[J].
中国药理学通报, 2008, 24(9): 1131–1134.
XU S Y, LI J, GENG M Y. Regulation of signal transduction in epithelial-mesenchymal transition and drug development[J]. Chin Pharmacol Bull, 2008, 24(9): 1131–1134. DOI:10.3321/j.issn:1001-1978.2008.09.004 |
| [22] | HSU K W, FANG W L, HUANG K H, et al. Notch1 pathway-mediated microRNA-151-5p promotes gastric cancer progression[J]. Oncotarget, 2016, 7(25): 38036–38051. DOI:10.18632/oncotarget.9342 |
| [23] | YUAN X, WU H, HAN N, et al. Notch signaling and EMT in non-small cell lung cancer: biological significance and therapeutic application[J]. J Hematol Oncol, 2014, 7: 87. DOI:10.1186/s13045-014-0087-z |



