2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:病理科
2. Department of Pathology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
近年来,随着甲状腺体检及高分辨率超声的普及,甲状腺结节的检出率越来越高[1-3]。甲状腺良恶性结节的临床治疗方案和预后完全不同,二者在常规超声图像上存在着一定的重叠,这为甲状腺良恶性结节的鉴别诊断带来了困难。随着超声造影剂的普及,超声造影(contrast-enhanced ultrasonography,CEUS)技术已经逐步应用于肝脏、乳腺等各种良恶性肿瘤的鉴别诊断中。相关文献显示,虽然CEUS能实时动态地显示甲状腺良恶性结节的微循环灌注特点,但由于甲状腺良恶性结节血供的特殊性,如甲状腺良性结节常表现为血供丰富,而恶性结节多表现为少血供[4-5],因此甲状腺良恶性结节的CEUS图像特征尚存在一定的分歧,还需要进一步深入研究和探讨。基于此,本研究回顾性分析患者良恶性甲状腺结节的CEUS增强模式及其CEUS时间-强度曲线(time-intensity curve,TIC),研究良恶性结节CEUS的图像特征和定量参数,并与其病理结果进行对照研究,探讨CEUS鉴别诊断甲状腺良恶性结节的临床价值。
1 资料与方法 1.1 一般资料回顾性分析2016年8月至2017年9月在陆军军医大学第一附属医院就诊,并在超声科行CEUS检查发现甲状腺结节的114例患者,排除大于5 cm的结节,入选共计175个结节,其中男性41例,女性73例,年龄15~78(41.7±7.6)岁。甲状腺结节常规超声图像表现为低回声、囊实混合回声或稍高回声结节,直径0.5~4.7(1.8±0.8)cm。所有患者在CEUS前签署CEUS知情同意书。入选病例均住院行手术切除甲状腺结节,经病理证实,其中良性结节98个(29个甲状腺腺瘤和69个结节性甲状腺肿),甲状腺乳头状癌77个。
1.2 仪器及试剂使用迈瑞Resona7彩色多普勒超声诊断仪,CEUS采用实时造影匹配成像技术,机械指数为0.04~0.06,探头频率为5~9 MHz。造影剂采用声诺维(SonoVue,注射用六氟化硫微泡,意大利Bracco公司生产)。
1.3 方法患者采取仰卧位,常规超声先观察甲状腺结节及颈部淋巴结的情况,然后通过肘部静脉建立起静脉通道,进行CEUS检查,选取感兴趣结节,并尽可能显示结节全貌及周围正常甲状腺实质,保持探头不动,嘱咐患者避免吞咽动作。打开声诺维包装,加入5 mL生理盐水后,震荡摇匀,经肘静脉团注1.5~2.0 mL配制好的造影剂混悬液,然后立即用3~5 mL生理盐水冲管,同时实时存储动态造影全过程图像供后续图像处理分析。对于多发性结节,第1次注射造影剂后,间隔10~15 min后待CEUS剂完全消退,再进行第2次注射。CEUS检查结束后,分析甲状腺良恶性结节CEUS增强模式,以不均匀低增强为甲状腺乳头状癌诊断标准,同时分析良恶性结节的时间-强度曲线,并与周围组织比较,从中提取造影剂开始增强时间(arrival time,AT)、峰值时间(time to peak, TTP)、峰值强度(peak intensity, PI)、曲线下面积(area under the curve, AUC) 4个指标进行比较,以慢进慢退模式为甲状腺乳头状癌诊断标准。所有病例均通过手术病理检查,由陆军军医大学第一附属医院病理科医师进行病理诊断。
1.4 观察指标及定量分析回放造影动态录像,观察造影剂进入结节的方式、速度、造影剂分布的均匀度与灌注区增强强度及造影剂在结节内的消退情况。采用超声仪器自带的CEUS分析软件对CEUS图像进行TIC分析,选择甲状腺内结节为感兴趣区(region of interest,ROI),避开粗大钙化及囊性回声,ROI包绕病灶区域,并在周边相邻的正常甲状腺实质内复制ROI(其中4个>3.0 cm的较大结节,选取病灶中心适当大小绘制)。获得结节和周围正常组织的2条TIC曲线,选取造影剂开始增强时间至增强后1 min的CEUS图像进行定量分析,获得定量参数,包括AT、TTP、AUC、PI。整个分析过程是由2名从事甲状腺超声检查工作5年以上,且具有丰富诊断经验的超声医师独立分析,各自给出甲状腺结节的诊断意见,对于有争议的病例则双方讨论分析,最后得到相同结论。
1.5 统计学分析使用SPSS 22.0统计软件,计量资料以x±s表示,组间定量参数的比较采用独立样本t检验,计数资料用χ2进行检验。检验水准:α=0.05。
2 结果 2.1 CEUS鉴别诊断甲状腺良恶性结节的价值本研究结果显示,良性结节CEUS表现为:周边环状增强、内部均匀增强及无增强,边界清晰;恶性结节CEUS表现为:不均匀增强、低增强,边界不清晰。CEUS检测结果中显示良性结节为93个,恶性结节为82个。所有病例均进行手术,并经病理证实。病理结果显示良性结节为98个(其中腺瘤29个,结节性甲状腺肿69个),恶性结节(乳头状癌)为77个,常规超声结合CEUS诊断甲状腺恶性结节的准确率为84.5%,特异性为83.6%,敏感性为85.7%,阳性预测值为82.7%,阴性预测值为92.4%(表 1)。
2.2 甲状腺良恶性结节CEUS增强模式及造影图像特点
本组甲状腺恶性结节中,71.4%(55/77)甲状腺乳头状癌CEUS在增强早期和晚期呈不均匀低增强,CEUS后边界不清晰,形态不规则,大部分结节呈现不均匀低增强,结节显影时间晚于周围正常甲状腺组织,消退时间晚(图 1A、B)。本组甲状腺良性结节中,58.1%(57/98)甲状腺腺瘤和结节性甲状腺肿CEUS呈均匀整体高增强、等增强或周边环状增强,部分结节内呈现无增强区,其中20个甲状腺腺瘤增强早期较周围甲状腺组织早,且快速达到高峰,且PI多较周围组织强,消退时间也较周围组织晚,呈现出“进入快、消退慢、高增强”的增强形式(图 1C、D)。37个结节性甲状腺肿的增强早期显影时间与周围的正常甲状腺组织基本同步或稍慢,PI不等,消退时间与周围的甲状腺组织基本同步或稍晚。

|
| A:甲状腺乳头状癌超声造影呈不均匀低增强(←);B:甲状腺乳头状癌组织学病理变化(HE×400);C:甲状腺腺瘤超声造影呈均匀高增强(↓);D:甲状腺腺瘤组织学病理变化(HE×400) 图 1 甲状腺乳头状癌及腺瘤超声造影图像与病理观察 |
2.3 定量分析时间-强度曲线
甲状腺乳头状癌与良性结节的定量参数比较,PI低于良性结节,差异有统计学意义(P < 0.05),而AT、TTP差异无统计学意义(表 2)。
| 病理结果 | 样本量/个 | AT/s | TTP/s | PI/dB | AUC/dB·s |
| 良性(结节性甲状腺肿+腺瘤) | 98 | 2.15±1.75 | 15.67±5.40 | 18.89±4.09 | 779.16±257.83 |
| 恶性(乳头状癌) | 77 | 1.97±1.01 | 16.35±8.63 | 13.82±5.97 | 624.85±275.93 |
| P值 | 0.764 | 0.792 | 0.01 | 0.135 |
与病灶周围正常的甲状腺组织相比,多数(57/77)甲状腺乳头状癌的TIC曲线呈慢进慢退模式,即上升段缓慢,下降段平缓,曲线低平,峰值后移,PI和AUC较周围组织低,PI、AUC差异有统计学意义(P < 0.05,图 2A,表 3);多数(20/29)甲状腺腺瘤样结节TIC表现出造影剂迅速进入的特点,且上升支稍高,PI稍高,PI、AUC差异有统计学意义(P < 0.05,图 2B,表 4);多数(61/69)结节性甲状腺肿TIC也表现出迅速进入的特点,且上升支稍高,PI与甲状腺周围组织无明显差别,但与周围甲状腺腺体相比,前者的TTP稍晚于后者,二者差异有统计学意义(P < 0.05,表 5)。
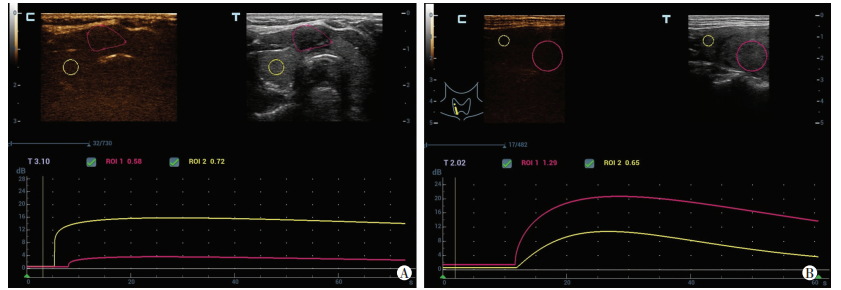
|
| A:甲状腺乳头状癌TIC拟合曲线,上升段缓慢,下降段平缓,曲线低平,峰值后移,峰值强度低;B:甲状腺腺瘤TIC拟合曲线,造影剂快速进入,且上升支高,峰值强度高 图 2 甲状腺乳头状癌及腺瘤TIC曲线分析 |
| 病理结果 | 样本量/个 | AT/s | TTP/s | PI/dB | AUC/dB·s |
| 乳头状癌 | 77 | 1.97±1.01 | 16.35±8.63 | 13.82±5.97 | 624.85±275.93 |
| 正常组织 | 77 | 1.95±0.99 | 17.48±5.22 | 21.06±5.65 | 1025.43±260.37 |
| P值 | 0.950 | 0.715 | 0.008 | 0.003 |
| 病理结果 | 样本量/个 | AT/s | TTP/s | PI/dB | AUC/dB·s |
| 腺瘤 | 29 | 2.05±0.97 | 17.79±6.59 | 19.90±4.50 | 926.68±224.60 |
| 正常组织 | 29 | 2.01±0.99 | 15.41±5.27 | 13.67±5.70 | 622.87±269.23 |
| P值 | 0.915 | 0.410 | 0.021 | 0.019 |
| 病理结果 | 样本量/个 | AT/s | TTP/s | PI/dB | AUC/dB·s |
| 结节性甲状腺肿 | 69 | 2.23±2.29 | 13.77±3.33 | 17.98±3.67 | 646.39±216.27 |
| 正常组织 | 69 | 2.22±2.30 | 10.48±3.35 | 19.73±4.29 | 715.65±265.45 |
| P值 | 0.992 | 0.041 | 0.341 | 0.530 |
3 讨论
目前,常规超声已经成为诊断和鉴别诊断甲状腺良恶性结节的有效手段,但是由于一些甲状腺良、恶性结节在常规彩色多普勒超声图像特征上存在着不同程度的重叠,这为准确鉴别诊断甲状腺结节的良恶性带来困难[6-8]。而CEUS能更清晰、更完整地显示甲状腺良恶性结节的血管分布和微循环灌注,为甲状腺良恶性结节的鉴别诊断提供了全新的诊断信息[9]。已有的临床研究表明,甲状腺良、恶性结节在造影剂进入方式、快慢、造影剂分布、增强强度等方面表现不一[10-11]。但是,由于甲状腺良恶性结节的血供特点存在一定的混淆,特别是甲状腺常见良性结节如甲状腺腺瘤和结节性甲状腺肿各自的CEUS灌注特征尚不清楚,且甲状腺良恶性结节CEUS的图像特征和相关定量参数尚需要进一步研究和完善[12-13]。因此,为了进一步明确CEUS在鉴别诊断甲状腺良恶性结节中的应用价值,本研究对比分析了乳头状癌、甲状腺腺瘤和结节性甲状腺肿三种甲状腺最常见良恶性结节的CEUS图像特征、增强模式,并定量分析了三者造影后TIC的规律,从而为甲状腺良恶性结节的鉴别诊断提供一种有效手段和方法。
本组研究中,甲状腺良恶性结节的CEUS图像特征主要表现为:良性结节多表现为增强早期同步增强,或早于周边组织增强,增强晚期消退时间与周围组织同步或较晚,多呈现出均匀等增强或高增强,高增强时结节边界清晰。由于甲状腺良性结节中最常见的是腺瘤和结节性甲状腺肿,为了进一步深入分析甲状腺良性结节的CEUS特征,本研究回顾性分析了腺瘤和结节性甲状腺肿的CEUS的TIC规律, 结果显示,其中20个甲状腺腺瘤造影剂增强时间和达峰时间较周围甲状腺组织早,且PI多较周围组织强,消退时间也较周围组织晚,呈现出“进入快、消退慢、高增强”的增强形式;37个结节性甲状腺肿的显影时间与周围的正常甲状腺组织基本同步或稍慢,PI不等,消退时间与周围的甲状腺组织基本同步或稍晚。甲状腺乳头状癌CEUS在增强早期和晚期呈现不均匀低增强,造影后边界不清晰,形态不规则。与甲状腺周围组织相比较,甲状腺乳头状癌的CEUS图像特征多以进入慢或同步进入为主,超过71.4%的恶性结节呈不均匀低增强,且边界不清晰。甲状腺乳头状癌的PI低于腺瘤及结节性甲状腺肿,二者差异有统计学意义。本研究的结果进一步表明甲状腺良恶性结节具有不同的CEUS图像特征和TIC参数。
已有学者在此基础上进一步分析,甲状腺良恶性结节具有不同的CEUS特征,与甲状腺结节的病理学基础有关。甲状腺癌主要以乳头状癌为主,结节内可能会存在有微小癌栓,导致了微血管腔狭窄或者出现闭塞,同时由于正常甲状腺组织中有丰富的血管,甲状腺癌在恶性浸润生长的过程中会大量破坏正常血管结构,导致结节内血管少于周围正常甲状腺组织血管,因此乳头状癌CEUS图像特征为内部低增强,边缘不均匀增强,造影剂缓慢进入,PI低,该特征与文献[14-16]报道一致。甲状腺良性结节大多数是甲状腺腺瘤和结节性甲状腺肿[17]。由于甲状腺腺瘤来源于滤泡上皮细胞,多呈膨胀性生长,在生长过程中周边形成丰富的环绕状血管,因此其CEUS特征多表现为均匀高增强或周边环状增强,造影剂在增强早期进入迅速,且上升支稍高,PI稍高。结节性甲状腺肿的病理改变主要是滤泡上皮增生性病变,且由于组织的反复增生及不断修复而形成结节,故结节性甲状腺肿可处于增生的不同时期,从而超声图像特征和造影增强特点表现为多样性,容易与甲状腺癌发生混淆,发生误诊和漏诊[18]。本组研究的2个结节性甲状腺肿患者被误诊为甲状腺癌,其中的1个结节在CEUS中呈现出不均匀低增强,分析其原因是结节内形成囊性变和粗大钙化灶,导致了造影剂的分布不均匀,另1个结节在CEUS中其内部基本无造影剂进入,边缘呈不均匀增强,分析其原因可能由于结节内部充满了浓缩胶质,无明显血供所致。
由于CEUS与常规超声不同,它能实时动态地显示出甲状腺结节的血流灌注特点,为甲状腺良恶性结节的鉴别诊断提供一种新的诊断方法。相关临床研究结果证实,常规超声结合CEUS对甲状腺癌的诊断准确性明显高于常规超声[19]。本研究表明,CEUS对甲状腺结节诊断的准确率为84.5%,进一步表明在常规超声检查的基础上,联合CEUS和定量分析TIC技术能为甲状腺良恶性结节的鉴别诊断提供有价值的诊断信息[20],且具有准确性高,安全性强的特点。但甲状腺的CEUS检查也有一定的局限性,其不能离开常规超声而独立存在,必须要以常规超声为基础;对于<0.5 cm的结节造影剂灌注有可能显示不清,易导致漏诊,本组研究有2个乳头状癌结节因<0.5 cm,造影剂灌注不典型,表现为与周围甲状腺组织同步增强;同时对于伴有粗大钙化的结节,结节内部及后方组织因为钙化声影影响,造影剂灌注会显示不清。另外,由于不同的医师在图像存储过程中习惯及手法不同,也会造成后期图像分析处理的差别。本研究回顾性分析的恶性病例都是甲状腺乳头状癌,良性病例是甲状腺腺瘤及结节性甲状腺肿,今后有待于加大样本量,对所有病理类型进行研究。
综上所述,CEUS能显示甲状腺乳头状癌、甲状腺腺瘤、结节性甲状腺肿3种最常见甲状腺良恶性结节的微血流灌注及分布特点,在常规超声的基础上,CEUS联合定量分析技术,可为甲状腺良恶性结节的准确诊断提供一种有效手段和方法,值得临床上推广应用。
| [1] |
马文琦, 周茹, 姜珏, 等. 甲状腺结节三维能量多普勒定量分析与病理微血管密度的相关性研究[J].
中国超声医学杂志, 2018, 34(5): 385–388.
MA W Q, ZHOU R, JIANG J, et al. Correlation between Three-dimensional color power angiography quantification and pathological microvessel density in thyroid nodules[J]. Chin J Ultrasound Med, 2018, 34(5): 385–388. DOI:10.3969/j.issn.1002-0101.2018.05.001 |
| [2] |
赵瑞娜, 张波, 杨筱, 等. 超声造影对桥本甲状腺炎合并甲状腺结节的诊断价值[J].
中国医学科学院学报, 2015, 37(1): 66–70.
ZHAO R N, ZHANG B, YANG X, et al. Diagnostic value of contrast-enhanced ultrasound of thyroid nodules coexisting with Hashimoto's thyroiditis[J]. ACTA Academiae Medicinae Sinicae, 2015, 37(1): 66–70. DOI:10.3881/j.issn.1000-503X.2015.01.012 |
| [3] | ZHANG Y Z, XU T, GONG H Y, et al. Application of high-resolution ultrasound, real-time elastography, and contrast-enhanced ultrasound in differentiating solid thyroid nodules[J]. Medicine(Baltimore), 2016, 95(45): e5329. DOI:10.1097/MD.0000000000005329 |
| [4] | YUAN Z, QUAN J, YUNXIAO Z, et al. Contrast-enhanced ultrasound in the diagnosis of solitary thyroid nodules[J]. J Cancer Res Ther, 2015, 11(1): 41–45. DOI:10.4103/0973-1482.147382 |
| [5] | LIU Y, ZHOU H, YANG P, et al. Contrast-enhanced ultrasonography features of papillary thyroid carcinoma for predicting cervical lymph node metastasis[J]. Exp Ther Med, 2017, 14(5): 4321–4327. DOI:10.3892/etm.2017.5087 |
| [6] | JIANG J, SHANG X, WANG H, et al. Diagnostic value of contrast-enhanced ultrasound in thyroid nodules with calcification[J]. Kaohsiung J Med Sci, 2015, 31(3): 138–144. DOI:10.1016/j.kjms.2014.12.001 |
| [7] |
杨萌, 苏娜, 王亮, 等. 甲状腺乳头状癌微血管灌注模式的量化评估及其病理学基础[J].
中华医学超声杂志(电子版), 2017, 14(4): 269–273.
YANG M, SU N, WANG L, et al. The contrast enhanced perfusion pattern and pathological changes of papillary thyroid cancer[J]. Chin J Med Ultrasound(Electr Ed), 2017, 14(4): 269–273. DOI:10.3877/cma.j.issn.1672-6448.2017.04.007 |
| [8] | SCHLEDER S, JANKE M, AGHA A, et al. Preoperative differentiation of thyroid adenomas and thyroid carcinomas using high resolution contrast-enhanced ultrasound (CEUS)[J]. Clin Hemorheol Microcirc, 2015, 61(1): 13–22. DOI:10.3233/CH-141848 |
| [9] | LI F, WANG Y, BAI B, et al. Advantages of routine ultrasound combined with contrast-enhanced ultrasound in diagnosing papillary thyroid carcinoma[J]. Ultrasound Q, 2017, 33(3): 213–218. DOI:10.1097/RUQ.0000000000000309 |
| [10] | WIESINGER I, KROISS E, ZAUSIG N, et al. Analysis of arterial dynamic micro-vascularization with contrast-enhanced ultrasound (CEUS) in thyroid lesions using external perfusion software: First results[J]. Clin Hemorheol Microcirc, 2016, 64(4): 747–755. DOI:10.3233/CH-168044 |
| [11] | ZHOU Q, JIANG J, SHANG X, et al. Correlation of contrast-enhanced ultrasonographic features with microvessel density in papillary thyroid carcinomas[J]. Asian Pac J Cancer Prev, 2014, 15(17): 7449–7452. DOI:10.7314/apjcp.2014.15.17.7449 |
| [12] | WEI X, LI Y, ZHANG S, et al. Evaluation of thyroid cancer in Chinese females with breast cancer by vascular endothelial growth factor (VEGF), microvessel density, and contrast-enhanced ultrasound (CEUS)[J]. Tumour Biol, 2014, 35(7): 6521–6529. DOI:10.1007/s13277-014-1868-2 |
| [13] | WEI X, LI Y, ZHANG S, et al. Evaluation of primary thyroid lymphoma by ultrasonography combined with contrast-enhanced ultrasonography: A pilot study[J]. Indian J Cancer, 2015, 52(4): 546–550. DOI:10.4103/0019-509X.178419 |
| [14] | PANG T, HUANG L, DENG Y, et al. Logistic regression analysis of conventional ultrasonography, strain elastosonography, and contrast-enhanced ultrasound characteristics for the differentiation of benign and malignant thyroid nodules[J]. PLoS ONE, 2017, 12(12): e0188987. DOI:10.1371/journal.pone.0188987 |
| [15] | CHALHOUB M, HARRIS K. The use of endobronchial ultrasonography with transbronchial needle aspiration to sample a solitary substernal thyroid nodule[J]. Chest, 2010, 137(6): 1435–1436. DOI:10.1378/chest.09-2840 |
| [16] |
马步云, 金亚, SUNDARP S, 等. 甲状腺乳头状癌的超声造影表现及其病理基础[J].
四川大学学报(医学版), 2014, 45(6): 997–1000.
MA B Y, JIN Y, SUNDAR P S, et al. Contrast-enhanced ultrasonography findings for papillary thyroid carcinoma and its pathological base[J]. J Sichuan Univ(Med Sci Edi), 2014, 45(6): 997–1000. |
| [17] | MOLINARI F, MANTOVANI A, DEANDREA M, et al. Characterization of single thyroid nodules by contrast-enhanced 3-D ultrasound[J]. Ultrasound Med Biol, 2010, 36(10): 1616–1625. DOI:10.1016/j.ultrasmedbio.2010.07.011 |
| [18] | MA X, ZHANG B, LING W, et al. Contrast-enhanced sonography for the identification of benign and malignant thyroid nodules: systematic review and meta-analysis[J]. J Clin Ultrasound, 2016, 44(4): 199–209. DOI:10.1002/jcu.22311 |
| [19] | JIA Z, HONG D. Application of contrast-enhanced ultrasound for evaluation of thyroid nodules[J]. Ultrasonography, 2018, 37(4): 288–297. DOI:10.14366/usg.18019 |
| [20] | GU F, HAN L, YANG X, et al. Value of time-intensity curve analysis of contrast-enhanced ultrasound in the differential diagnosis of thyroid nodules[J]. Eur J Radiol, 2018, 105: 182–187. DOI:10.1016/j.ejrad.2018.05.013 |



