2. 409099 重庆,重庆市黔江中心医院:输血科
2. Department of Blood Transfusion, Qianjiang Central Hospital, Chongqing, 409099, China
目前几乎所有市售HIV血清抗体初筛试剂盒检测HIV疫苗受试者血清时,均会出现HIV抗体阳性结果,称之为疫苗诱导的血清反应性(vaccine-inducedsero-reactivity,VISR)或疫苗诱导的血清阳性(vaccine-induced sero-positivity,VISP)[1-2]。市售HIV抗体初筛诊断试剂盒一般采用HIV-1膜蛋白gp41和HIV-2膜蛋白gp36作为检测靶点对HIV感染进行诊断,其中gp41包被试剂用于对HIV-1自然感染的初筛诊断,gp36包被试剂用于HIV-2自然感染的初筛诊断。艾滋病疫苗受试者或志愿者接种包含有这些检测靶点的HIV疫苗后会产生针对艾滋病毒的广泛、持久的抗体,研究证明这些抗体在一定程度上具有保护作用,但同时这些抗体成分也是HIV初筛试剂的检测靶点,因而出现假阳性检测结果[3]。该阳性检测结果会让艾滋病疫苗接种者产生严重的心理负担,并在求职、学习、参军以及献血等过程中遇到各种困难和阻碍; 同时这一检测结果也不能快速有效地判断疫苗受试者是否感染了HIV病毒,从而阻碍HIV疫苗研究及临床评价进程[4]。因此,研制一种能有效区分HIV自然感染和疫苗诱导产生抗体的鉴别诊断试剂盒就十分必要。KHURANA课题组在美国国立卫生研究院(National Institutes of Health,NIH)基金资助下,利用噬菌体文库技术筛选到能鉴别HIV自然感染和疫苗诱导产生抗体的HIV-1鉴别肽[5],分别命名为SK1、SK2及SK3。这3个肽段1个位于HIV-1 Gag p6,另2个位于HIV-1 Env gp41。本研究利用前期原核表达方式获取的HIV-1抗原肽SK1-SK2-SK3及HIV-1膜蛋白gp41研制HIV-1鉴别诊断快速检测试纸条,探讨其能否有效区分HIV-1自然感染与疫苗诱导产生的抗体,用于HIV-1疫苗受试者的感染检测评价,以期作为疫苗广泛接种后HIV-1检测的技术储备。
1 材料与方法 1.1 生物原材料课题组前期利用原核表达的方式成功获取了HIV-1融合蛋白gp41和HIV-1三肽融合抗原SK1-SK2-SK3,并通过Western blot、ELISA证实重组蛋白具有良好的生物学活性[6-8]。本研究中gp41融合抗原经镍Ni柱纯化后纯度大于95%,经透析浓缩至5.0 mg/mL; HIV-1抗原鉴别肽SK1、SK2、SK3通过甘氨酸linker连接,利用原核表达获得SK1-SK2-SK3串联肽,SK1-SK2-SK3纯度大于95%,经透析浓缩至2.0 mg/mL。SK1、SK2、SK3三肽段氨基酸序列[5]见表 1。
| HIV-1肽段名称 | 氨基酸序列 |
| SK1(Env gp41) | LIAARIVELLGHSSLKGLRRGWEALKYLWNLLQY- WGQELKNSAISL |
| SK2(Env gp41) | AVAEGTDRVIEVVQRVCRAILNIPRRIRQGFERALL |
| SK3(Gag p6) | SRPEPTAPPAESFRFGEEITPTPSQKQEPKDKELYP-PLASLRSLFGNDPSSQ |
1.2 血清样本及血清盘
500份HIV阴性对照血清收集于重庆市黔江中心医院检验科,所有血清经美国Abbott第4代HIV试剂盒(ARCHITECT HIV Ag/Ab Combo)检测为阴性结果,并且排除HAV、HBV、HCV、Syphilis、tuberculosis感染; 305份HIV阳性血清(包括HIV-1 276份和HIV-2 29份)由四川省疾病预防控制中心和中国疾病预防控制中心提供,部分血清收集于重庆市黔江中心医院,所有阳性血清经HIV确诊试剂盒检测为阳性; 30份HIV天坛疫苗临床试验血清由中国疾病预防控制中心艾滋病研究所提供; HIV交叉反应血清样本来源于重庆市黔江中心医院,包括HBV阳性血清125份,HCV抗体阳性血清32份,TB抗体阳性血清55份,TP阳性血清66份。所有样本详细信息见表 2。该研究中血清盘购于SeraCare Life Sciences公司,血清盘信息如下:AccuTrakTM HIV 1/2/O/p24 Qualification Panel,Material Number:2400-0158,血清盘共6份血清样本,详细信息见表 3。
| 样本种类 | n | 初筛实验a | 确诊试验b | |||
| 阳性例数 | 阴性例数 | 阳性例数 | 阴性例数 | |||
| HIV-1阳性 | 276 | 276 | 0 | 276 | 0 | |
| HIV-2阳性 | 29 | 29 | 0 | 29 | 0 | |
| HIV疫苗血清c | 30 | 27 | 3 | 27 | 3 | |
| HIV阴性血清 | 500 | 0 | 500 | |||
| HBV阳性 | 125 | 0 | 125 | |||
| HCV阳性 | 32 | 0 | 32 | |||
| TB阳性 | 55 | 0 | 55 | |||
| TP阳性 | 66 | 0 | 66 | |||
| a:HIV初筛试验采用雅培第4代ARCHITECT HIV Ag/Ab Combo试剂盒; b:HIV确诊试验采用免疫印迹法确认; c:HIV疫苗血清来源于中国疾病预防控制中心,为中国天坛疫苗临床试验志愿者血清,30份样本,其中16份样本为anti-evn IgG阳性,25份为anti-gag IgG阳性。HBV阳性:乙型肝炎病毒表面抗原阳性血清; HCV阳性:丙型肝炎病毒抗体阳性血清; TB阳性:结核抗体阳性血清; TP阳性:梅毒抗体阳性血清 | ||||||
| 血清盘ID | 反应性 |
| 2400-0158-01 | HIV-1低反应性 |
| 2400-0158-02 | 无反应性 |
| 2400-0158-03 | HIV-2低反应性 |
| 2400-0158-04 | HIV-1 O亚型低反应性 |
| 2400-0158-05 | HIV-1 p24抗原低反应性 |
| 2400-0158-06 | HIV-1中高反应性 |
1.3 其他材料及试剂
蛋白A(Protein A)偶联胶体金试剂、羊抗人单克隆抗体IgG、辣根过氧化物酶标记的羊抗人IgG均由加拿大Artron Bioresearch公司提供; 试纸条研制所需卡式模具及其他辅助材料均由加拿大Artron Bioresearch公司提供; 硝酸纤维素膜(nitrocellulose membrane)购于GE Healthcare’s Life Sciences公司; 酶标仪型号为Thermo Labsystem MK3。
1.4 ELISA评价重组gp41及SK1-SK2-SK3SK1-SK2-SK3融合蛋白用PBST稀释,按照500 ng/孔包被96孔板,gp41重组蛋白用PBST稀释,按照300 ng/孔包被96孔板; 用0.5% BSA的PBST封闭96孔板,置于37 ℃孵育2 h后用PBST洗板; 包被完成的板置于4 ℃冰箱备用。300份正常血清(来源于500份HIV阴性血清)分别用PBS 1 :10稀释后用gp41和SK1-SK2-SK3 ELISA包被板检测,ELISA板显色,450 nm波长酶标仪检测光密度值[D(450)],并计算300份血清平均D(450)值和标准差,以平均D(450)值加5倍标准差作为cutoff值; 实际检测血清样本时,当D(450)值/cutoff≥1时为阳性结果,D(450)值/cutoff < 1时为阴性结果。确定cutoff值的ELISA包被板检测表 2中的血清样本,样本用PBS 1 :10稀释,每孔加入100 μL稀释后血清,37 ℃孵育30 min,PBST洗板后加入辣根过氧化物酶标记的羊抗人IgG(1 :10 000稀释),孵育30 min,加入四甲基联苯胺(TMB)显色,450 nm波长酶标仪检测光密度值[D(450)]。
1.5 新型HIV-1胶体金免疫层析试纸研制重组HIV-1包膜蛋白gp41包被NC膜,磷酸盐缓冲液稀释至1.0 mg/mL,包被于T1位置,作为检测线T1;HIV-1鉴别肽SK1-SK2-SK3,磷酸盐稀释液稀释至0.5 mg/mL,包被于T2位置,作为检测线T2;羊抗人单克隆抗体IgG用磷酸盐缓冲液稀释至2.0 mg/mL包被于NC膜C线位置,作为质控线。将Protein A偶联胶体金试剂按照0.15 mg/mL浓度均匀涂抹于5 g无纺布,并烘干后作为金垫。按照图 1组装试纸条,并将条置于卡式模具中,室温密封干燥保存。
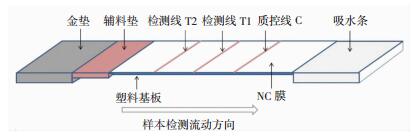
|
| 图 1 HIV-1鉴别诊断试纸条结构模式图 |
1.6 试纸条灵敏度、特异性评价
试纸条检测端浸入血清10~15 s,待血清爬至NC膜表面后取出,放置于平整干燥的桌面,并记录检测时间,15 min后肉眼判读结果,30 min后结果判读无效。试纸条C线若无显示则判读结果无效,重新检测; 若T1和T2均显示有条带,提示为HIV-1自然感染; 若T1显示有条带,而T2无条带,则提示为疫苗注射后产生抗体; 若T1无条带,而T2显示有条带,则需重新检测。所有检测结果由专人统一判读,排除人员间的差异。该新型HIV-1试纸条检测血清样本及血清盘,评价其灵敏度和特异性。血清检测前均恢复至室温,并随机编号,由专业检验技术人员完成检测并记录检测结果。血清盘检测按照说明书要求进行检测,并记录结果。
1.7 统计学分析采用GraphPad Prism 7.0软件进行分析。不同方法检测结果比较采用χ2检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 ELISA检测结果包被gp41和SK1-SK2-SK3的ELISA试剂检测表 2中的血清样本,结果见表 4。ELISA gp41检测HIV-1的灵敏度为100.0%,检测特异性为97.8%。对于30份HIV天坛疫苗血清,gp41检测结果有16份显示阳性结果,特异性仅为46.7%。ELISA SK1-SK2-SK3检测HIV-1的灵敏度为92.8%,特异性为100.0%,30份HIV天坛疫苗血清均为阴性结果,特异性为100.0%。ELISA gp41联合SK1-SK2-SK3检测灵敏度和特异性均为100.0%。
| 样本 | n | gp41阳性 | SK1-SK2-SK3阳性 | |||
| ELISA | Rapid(T1) | ELISA | Rapid(T2) | |||
| HIV-1阳性 | 276 | 276 | 276 | 256 | 258 | |
| HIV-2阳性 | 29 | 0 | 0 | 0 | 0 | |
| HIV疫苗血清 | 30 | 16 | 16 | 0 | 0 | |
| 正常血清 | 500 | 2 | 1 | 0 | 0 | |
| HBV阳性 | 125 | 0 | 0 | 0 | 0 | |
| HCV阳性 | 32 | 0 | 0 | 0 | 0 | |
| TB阳性 | 55 | 0 | 0 | 0 | 0 | |
| TP阳性 | 66 | 0 | 0 | 0 | 0 | |
| 灵敏度(%) | 100.0 | 100.0 | 92.8 | 93.5 | ||
| 特异性(%) | 97.8(46.7a) | 98.0(46.7a) | 100.0 | 100.0 | ||
| ELISA:酶联免疫吸附法检测,Rapid:试纸条快速检测,T1、T2:试纸条检测线; 灵敏度计算方法:(实际HIV-1阳性血清例数/276)×100%;特异性计算方法:(实际非HIV-1阳性血清例数/837)×100%;a:疫苗血清样本的特异性,因16份疫苗血清样本中含有抗HIV-1 Env IgG抗体 | ||||||
2.2 快速试纸检测结果
研制的试纸条评价血清样本,检测线T1(gp41)检测HIV-1阳性血清灵敏度达到100.0%,特异性为98.0%,针对HIV 30份天坛疫苗血清出现了16份阳性反应(46.7%特异性),这16份均为anti-evn IgG阳性样本,针对其他非HIV-1阳性血清均为阴性结果,特异性为100.0%;检测线T2 (SK1-SK2-SK3)检测HIV-1阳性血清灵敏度达93.5%,特异性达100.0%。T1和T2联合检出HIV-1的灵敏度可以达到100.0%,检测HIV-1的特异性达100.0%。ELISA检测结果与试纸条检测结果比较,SK1-SK2-SK3检测灵敏度方面ELISA为92.8%,试纸条为93.5%,稍高于ELISA,二者比较差异无统计学意义(P>0.05);在gp41检测特异性方面比较,ELISA为97.8%,试纸条为98.0%,二者比较差异无统计学意义(P>0.05)。
2.3 血清盘评价试纸条评价HIV血清盘,结果显示该试纸条能够有效检出HIV-1低反应性血清和HIV-1中高反应血清,01号和06号样本均可见明显T1和T2条带; 对于HIV-1 O亚型低反应血清04号样本,可见较弱的T1和T2条带; 但对于HIV-2低反应性血清、HIV无反应性血清及HIV-1 p24抗原低反应性血清,试纸条均无T1和T2条带显示,即02、03、05号血清检测结果。血清盘详细信息见表 3,试纸条检测血清盘结果见图 2。
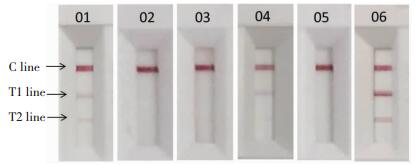
|
| C:质控线; T1:gp41包被检测线; T2:SK1-SK2-SK3包被检测线; 01~06:血清盘2400-0158的01~06号血清 图 2 试纸条检测血清盘结果 |
3 讨论
自从1987年艾滋病疫苗研制以来,已经有3万多名志愿者参加了HIV疫苗的临床试验研究。不管是HIV基因疫苗、HIV蛋白疫苗,还是改变疫苗注入方式,最终目的是通过类似于HIV的病毒基因产物刺激机体产生保护性抗体。因此,参加疫苗临床试验的志愿者体内都能产生与自然感染一致的抗体,用FDA认证的血清学检测试剂盒检测呈阳性[9-11]。这种假阳性结果不仅给志愿者带来意想不到的经济上的损失和社会利益的伤害,使得血清转换成为感染并不可靠的标志,疫苗的免疫效果难以评价,同时也难以继续招募志愿者参与以后的疫苗研究[12-15]。即使是用于HIV诊断的确诊试验也是以抗体检测为基础的免疫学诊断,不能区分疫苗产生的抗体和自然感染产生的抗体。尽管PCR可以区分疫苗和HIV的自然感染,但由于PCR需要特殊的仪器和专业的操作人员,且成本高、费时长,故不宜作为HIV诊断的初筛方法; 而且一些HIV感染患者由于疫苗的注射,病毒载量的降低,可能会导致PCR检测出现假阴性结果,因此HIV核酸检测方法不能完全代替血清学检测作为HIV筛查的一线检测方法。因此,尝试研制用于HIV疫苗抗体检测试剂意义重大。
从疫苗进入临床研究以来,一直有许多课题组致力于疫苗产生抗体检测的研究。DAVID等[16]用商业化的试剂盒对第一代重组胞膜蛋白gp120疫苗受试者进行跟踪随访研究,发现这些针对gp120抗原的检测试剂盒对疫苗注射者均呈现很高的假阳性率。ACKERS等[17]受美国NIH资助,对美国1993-1999年HIV疫苗Ⅰ、Ⅱ期临床研究涉及HIV env、gag、pol及nef等基因产物受试志愿者490份血清样本同时进行6种血清学检测试验,发现假阳性率高达20.4%,用作HIV确诊的Western blot试验也有高达13%的假阳性率。KHURANA课题组利用HIV阳性患者的血清与HIV噬菌体展示文库反应,通过反复的生物淘洗,筛选到三段肽段,其中两段来源于HIV膜蛋白gp41(SK1、SK2),一段来源于核心蛋白p6(SK3)[3-5]。前两者可以识别急慢性HIV感染后产生的抗体,但由于不能刺激机体产生中和性抗体或细胞毒性体淋巴细胞反应,因而这两段肽段的基因序列或肽段本身并不包含在大多数疫苗中[5];后者尽管在早期的HIV疫苗中含有该肽段,但由于该肽段几乎不能被HLA限制性细胞毒性T细胞识别,不能激发机体的细胞免疫。同时这三段肽段非常保守,不易产生变异,是作为区分HIV疫苗产生抗体和自然感染产生抗体的最佳候选肽段。本研究基于KHURANA课题组筛选的三个肽段,用原核表达技术获取高纯度的三肽联合抗原,利用免疫层析技术和胶体金标记技术,成功研制了HIV-1抗体鉴别的快速诊断试纸条。
目前我国进行的比较全面的HIV疫苗临床试验主要有三组,包括中国疾病预防控制中心的天坛痘苗复合疫苗、百克药业的预防性疫苗以及奥克生物研发的治疗性基因疫苗。本研究中评价的HIV疫苗血清来自于中国疾病预防控制中心邵一鸣教授团队研制的DNA-天坛痘苗复合疫苗,该疫苗的免疫原选自中国流行最广的HIV毒株CRF-07,包括gag、pol、env和nef四个基因,并针对我国人群的免疫反应和遗传背景作了技术改进,目前该试验已经完成了二期临床评价,并取得了良好的效果[18-19]。本研究选取的30份天坛疫苗血清,其中16份样本为anti-evn IgG阳性,25份为anti-gag IgG阳性,用目前HIV初筛方法和确证试验检测有高达90%(27/30)的阳性率。这些阳性结果的血清并非是真正感染了HIV病毒,而是疫苗免疫过后产生抗体而出现的假阳性检测结果。本研究基于原核表达的HIV-1抗原SK1-SK2-SK3研制HIV-1抗体检测试纸条,希望该试纸条能够区分这些疫苗血清中的HIV抗体,而避免出现假阳性。最终结果显示:SK1-SK2-SK3(T2检测线)三肽抗原能够有效区分疫苗血清抗体,30份天坛疫苗血清检测结果均为阴性,而对于HIV-1阳性血清的检出灵敏度达93.5%,联合gp41抗原(T1检测线),HIV-1阳性血清检测率可达100.0%。由于疫苗血清十分珍贵,本研究只获取了有限的疫苗血清标本来评价试纸条,这让试纸条的性能评价不够全面。因此,课题组后期尝试获取更多的天坛疫苗接种血清、百克药业预防性疫苗血清以及奥克生物的治疗性基因疫苗血清来进行更详细的评价,以获取更全面的性能评价指标。
该研究采用三线包被组合的方式研制了新型HIV-1抗体快速鉴别诊断试纸条,gp41抗原包被T1检测线,用于HIV-1感染的检测,提升试纸条检测的灵敏度,避免HIV-1感染的漏检; SK1-SK2-SK3抗原肽包被T2检测线,提升试纸条检测的特异性,避免对疫苗血清的误诊。该新型试纸条以快速、准确、成本低廉的优点,可用于目前我国HIV疫苗临床试验血清评价的各个环节,特别对于接种疫苗的高危人群,可定期检测,及早发现HIV的感染状况,避免误诊、漏诊,及时评价疫苗接种效果; 该新型试纸条还可作为技术储备,用于疫苗研制成功后大范围人群接种疫苗后的HIV-1初筛诊断,避免应用常规HIV初筛检测出现的假阳性给疫苗受试者带来的各种负面影响。
本研究研制的HIV-1抗体检测试纸条,在灵敏度和特异性方面与ELISA方法比较无明显差异(P>0.05),提示基于膜包被的试纸条快速检测方法在检测性能上与ELISA方法是一致的。在评价HIV血清盘时,对于HIV-1 p24抗原低反应性血清,试纸条检测结果为阴性,主要原因是此血清为HIV窗口期样本,血清p24抗原含量较低,而HIV-1抗体尚未产生或滴度太低,所以不能检出; 对于其他HIV-1抗体滴度较低的血清,本试纸条检测显色条带颜色也不够强,还应进一步提高检测灵敏度,可尝试采用生物素亲和素信号放大系统来实现。
本研究基于原核表达的HIV-1 gp41抗原和SK1-SK2-SK3三肽抗原,成功研制了HIV-1自然感染与疫苗诱导产生抗体的鉴别诊断试纸条。经过系统评价,该试纸条检测HIV-1的灵敏度可达93.5%,联合gp41可以达100.0%,二者联合检测特异性可达100.0%。该新型试纸条的研制为HIV-1疫苗诱导产生抗体与自然感染产生抗体的鉴别诊断,以及HIV疫苗接种后效果评价的跟踪随访,提供了一种简单、灵敏、经济的检测方法。
| [1] | VORONIN Y, ZINSZNER H, KARG C, et al. HIV vaccine-induced sero-reactivity: a challenge for trial participants, researchers, and physicians[J]. Vaccine, 2015, 33(10): 1243–1249. DOI:10.1016/j.vaccine.2014.10.040 |
| [2] | ACKERMAN M E, BAROUCH D H, ALTER G. Systems serology for evaluation of HIV vaccine trials[J]. Immunol Rev, 2017, 275(1): 262–270. DOI:10.1111/imr.12503 |
| [3] | KHURANA S, NORRIS P J, BUSCH M P, et al. HIV-selectest enzyme immunoassay and rapid test: ability to detect seroconversion following HIV-1 infection[J]. J Clin Microbiol, 2010, 48(1): 281–285. DOI:10.1128/JCM.01573-09 |
| [4] | KHURANA S, NEEDHAM J, PARK S, et al. Novel approach for differential diagnosis of HIV infections in the face of vaccine-generated antibodies: utility for detection of diverse HIV-1 subtypes[J]. J Acquir Immune Defic Syndr, 2006, 43(3): 304–312. DOI:10.1097/01.qai.0000242465.50947.5f |
| [5] | KHURANA S, NEEDHAM J, MATHIESON B, et al. Human immunodeficiency virus (HIV) vaccine trials: a novel assay for differential diagnosis of HIV infections in the face of vaccine-generated antibodies[J]. J Virol, 2006, 80(5): 2092–2099. DOI:10.1128/JVI.80.5.2092-2099.2006 |
| [6] |
袁作为, 帅光泽, 张君, 等. HIV跨膜蛋白gp41和gp36原核表达及抗原性研究[J].
第三军医大学学报, 2010, 32(21): 2281–2285.
YUAN Z W, SHUAI G Z, ZHANG J, et al. Expression of HIV trans-membrane protein gp41 and pronucleus gp36 and their antigenicity[J]. J Third Mil Med Univ, 2010, 32(21): 2281–2285. |
| [7] | YUAN Z W, CHEN W X, ZHANG J, et al. Development of an immunoassay for differentiating human immunodeficiency virus infections: from vaccine-induced immune response in Tiantan vaccine trials in China[J]. Clin Biochem, 2012, 45(15): 1219–1224. DOI:10.1016/j.clinbiochem.2012.05.013 |
| [8] |
袁作为, 张君, 胡接力, 等. HIV自然感染与疫苗诱导产生抗体鉴别肽的原核表达及纯化[J].
中国生物制品学杂志, 2011, 24(11): 1254–1258, 1263.
YUAN Z W, ZHANG J, HU J L, et al. Prokaryotic expression and purification of HIV differential peptides for natural infection-elicited and vaccine-induced antibodies[J]. Chin J Biologicals, 2011, 24(11): 1254–1258, 1263. DOI:10.13200/j.cjb.2011.11.11.yuanzw.019 |
| [9] | GINN S L, AMAYA A K, ALEXANDER I E, et al. Gene therapy clinical trials worldwide to 2017: An update[J]. J Gene Med, 2018, 20(5): e3015. DOI:10.1002/jgm.3015 |
| [10] | ACKERS M L, PAREKH B, EVANS T G, et al. Human immunodeficiency virus (HIV) seropositivity among uninfected HIV vaccine recipients[J]. J Infect Dis, 2003, 187(6): 879–886. DOI:10.1086/368169 |
| [11] | PITISUTTITHUM P, NITAYAPHAN S, THONGCHAROEN P, et al. Safety and immunogenicity of combinations of recombinant subtype E and B human immunodeficiency virus type 1 envelope glycoprotein 120 vaccines in healthy Thai adults[J]. J Infect Dis, 2003, 188(2): 219–227. DOI:10.1086/376506 |
| [12] | ALLEN M, ISRAEL H, RYBCZYK K, et al. Trial-related discrimination in HIV vaccine clinical trials[J]. AIDS Res Hum Retroviruses, 2001, 17(8): 667–674. DOI:10.1089/088922201750236942 |
| [13] | ANDRABI R, BHIMAN J N, BURTON D R. Strategies for a multi-stage neutralizing antibody-based HIV vaccine[J]. Curr Opin Immunol, 2018, 53: 143–151. DOI:10.1016/j.coi.2018.04.025 |
| [14] | KONG R, XU K, ZHOU T Q, et al. Fusion peptide of HIV-1 as a site of vulnerability to neutralizing antibody[J]. Science, 2016, 352(6287): 828–833. DOI:10.1126/science.aae0474 |
| [15] | LIAO H X, LYNCH R, ZHOU T Q, et al. Co-evolution of a broadly neutralizing HIV-1 antibody and founder virus[J]. Nature, 2013, 496(7446): 469–476. DOI:10.1038/nature12053 |
| [16] | DAVID D, GOOSSENS D, DESGRANGES C, et al. Molecular characterization of human monoclonal antibodies specific for several HIV proteins: analysis of the VH3 family expression[J]. Immunol Lett, 1995, 47(1/2): 107–112. |
| [17] | ACKERS M L, PAREKH B, EVANS T G, et al. Human immunodeficiency virus (HIV) seropositivity among uninfected HIV vaccine recipients[J]. J Infect Dis, 2003, 187(6): 879–886. DOI:10.1086/368169 |
| [18] | ZHANG Q C, LIU Z, HOU J, et al. Improved safety of a replication-competent poxvirus-based HIV vaccine with the introduction of the HSV-TK/GCV suicide gene system[J]. Vaccine, 2016, 34(30): 3447–3453. DOI:10.1016/j.vaccine.2016.05.012 |
| [19] | ZHANG Q C, TIAN M J, FENG Y, et al. Genomic sequence and virulence of clonal isolates of vaccinia virus Tiantan, the Chinese smallpox vaccine strain[J]. PLoS ONE, 2013, 8(4): e60557. DOI:10.1371/journal.pone.0060557 |



