肺癌是全球最常见、死亡率最高的恶性肿瘤[1],肺癌细胞的转移及侵袭是患者致死的主要因素之一,参与肿瘤细胞定向迁移的生物学和分子机制尚未完全明确。有研究发现生物电场会增强细胞的运动能力,与肿瘤侵袭过程密切相关[2-3],肺癌细胞的运动及定向迁移也受到生物电场的调控[4-5]。因此,生物电场可能是影响肺癌转移的重要因素之一。近年研究发现上皮-间质转化(epithelial-mesenchymal transition, EMT)在上皮源性肿瘤的侵袭和转移中起关键作用[6],并且在肿瘤化疗耐药、诱导干细胞特性及免疫抑制中发挥重要作用[7]。因此,进一步研究EMT和生物电场诱导肺癌细胞定向迁移的分子机制、探讨其逆转策略具有重要的科学意义和临床应用前景。二甲双胍是一种经济、有效的经典降糖药物,同时也可能具有重要的抗肿瘤效应,能够逆转EMT,杀伤肿瘤干细胞,减弱肿瘤细胞侵袭转移[8-10],但二甲双胍抗肿瘤的机制尚不清楚。本研究根据既往研究结果[5]应用生理强度直流电作用于体外培养的肺癌H1975细胞,观察经电场刺激及二甲双胍处理后细胞运动、增殖能力及EMT的变化,检测AKT、ERK、STAT3等关键分子的蛋白表达变化情况,以探索二甲双胍能否通过抑制生物电场减弱肺癌H1975细胞的侵袭、转移能力。
1 材料与方法 1.1 材料与试剂人肺癌细胞株H1975购自美国国立细胞库(ATCC),二甲双胍购自Sigma公司,RPMI1640培养基购自HyClone公司,胎牛血清购自Gibco公司,DAPI试剂购自碧云天公司,BCA蛋白定量试剂盒购自密理博公司,Ki67购自博士德公司,Vimentin、GAPDH、AKT、p-AKT、ERK、p-ERK、STAT3、p-STAT3等抗体购自美国CST公司,山羊抗兔IgG抗体购自美国Abcam公司。
1.2 方法 1.2.1 细胞培养人肺癌细胞株H1975培养于含10%胎牛血清,100 μg/mL青、链霉素的RPMI1640培养基,培养于37 ℃、90%湿度、5% CO2的培养箱中。
1.2.2 实验分组空白对照组、二甲双胍处理组(5 mmol/L二甲双胍预处理48 h)、电场处理组(外加直流电100 mV/mm处理1 h)、二甲双胍联合电场处理组(5 mmol/L二甲双胍预处理48 h后,100 mV/mm外加直流电加电处理1 h)。根据本课题组既往研究结果[11],二甲双胍加药剂量为5 mmol/L。
1.2.3 外加电场制备及药物处理参照文献[12]方法,录制运动细胞运动轨迹时,用高真空硅脂胶将2片厚0.2 mm、长24 mm、间距10 mm的有机玻璃片平行固定于六孔板底部,接种3×104个H1975细胞,培养24 h后于上方覆盖盖玻片并用高真空硅脂胶密封,即形成一两端开放的24 mm×10 mm×0.2 mm的趋电小室。使用CO2非依赖培养基(Gibco)+10% FBS维持pH值稳定。细胞培养小室两端放置小烧杯,置入Steinberg溶液,用2根盐桥管将培养液与烧杯相连。在指定时间内予以相应处理后,施加恒定直流电作用于趋电小室内的肺癌H1975细胞。使用ImageXpress细胞成像微孔板检测仪获得延时图像。行Ki67检测、EMT、蛋白免疫印迹法等实验时,按上述制备方法于培养皿内制作50 mm×20 mm×0.2 mm趋电小室,接种3×105个H1975细胞后按照相应步骤继续实验。
1.2.4 细胞运动图像采集在各处理因素作用下使用ImageXpress细胞成像微孔板检测仪于加电后每隔5 min采集细胞图像,连续观察4 h后进行图像分析。细胞定向性及细胞运动性分析使用Image J软件。实验重复3次。
1.2.5 蛋白免疫印迹法(Western blot)检测收取各组细胞并提取蛋白,使用BCA浓度测定试剂盒测定蛋白浓度并配平,配平后各组蛋白上样于相应浓度SDS-聚丙烯酰胺凝胶电泳(PAGE),电转后经半干转膜仪转至聚偏氩乙烯(PVDF)膜上,5%脱脂奶粉常温封闭1 h,一抗(1 :1 000) 4 ℃孵育过夜,次日用TBST洗膜3次后加入二抗(1 :5 000)常温孵育2 h,再次TBST洗膜后ECL发光显影液显影,Bio-Rad成像系统采集图像。实验重复3次。
1.2.6 Ki67检测取培养皿按电场制备方法制作50 mm×20 mm×0.2 mm趋电小室,小室中接种3×105个细胞,培养24 h后加入二甲双胍,继续培养48 h。取出培养皿,更换电场专用培养基,加电处理1 h,使用4%甲醛固定30 min,10%普通山羊血清封闭30 min,用Ki67抗体1 :100稀释后置于4 ℃孵育过夜,荧光二抗避光孵育1 h,DAPI避光孵育15 min,荧光显微镜拍照。实验重复3次。
1.2.7 EMT检测取培养皿按电场制备方法制作50 mm×20 mm×0.2 mm趋电小室,小室中接种3×105个细胞,培养24 h后加入二甲双胍,继续培养48 h。取出培养皿,更换电场专用培养基,加电处理1 h,使用4%甲醛固定30 min,10%普通山羊血清封闭30 min,用Vimentin抗体1 :100稀释后置于4 ℃孵育过夜,荧光二抗避光孵育1 h,DAPI避光孵育15 min,荧光显微镜拍照。实验重复3次。
1.3 统计学处理采用SPSS 13.0统计软件进行分析,计量资料以x±s表示,组间比较采用LSD-t检验。检验水准α=0.05。
2 结果 2.1 不加电及加电50、100 mV/mm后H1975细胞运动能力及运动定向性检测分别在不加电,加电50、100 mV/mm 3种电压梯度下记录H1975细胞的迁移情况(图 1A~C)。结果显示在无外加电场处理时,细胞有一定运动性,但运动定向性差,在不同梯度电场刺激下,细胞的运动速度随电场强度升高而逐渐增加(P < 0.05,图 1D),呈现由阳极朝向阴极的定向运动,运动定向性也随电压梯度增加而明显增强(P < 0.05,图 1E)。
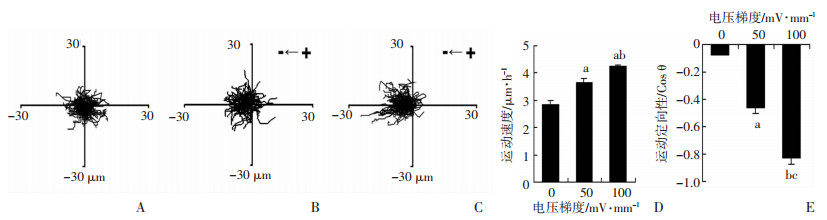
|
| A~C:分别为不加电及加电50、100 mV/mm后细胞轨迹移动记录;D:细胞运动速度(n=3,x±s) a:P < 0.05,与不加电组比较;b:P < 0.05,与50 mV/mm电场组比较;E:细胞运动定向性(n=3,x±s) a:P < 0.05,b:P < 0.01,与不加电组比较;c:P < 0.05,与50 mV/mm电场组比较 图 1 不加电及加电50、100 mV/mm后H1975细胞运动能力及运动定向性检测 |
2.2 二甲双胍及电场处理后H1975细胞运动能力及运动定向性检测
按照实验分组的4种实验条件处理后记录H1975细胞的迁移情况。结果显示二甲双胍处理组中细胞运动速度及定向性较空白对照组减弱(P < 0.05)。电场处理组细胞运动能力及运动定向性较空白对照组明显增强(P < 0.01)。二甲双胍联合电场处理组中,细胞运动速度较电场处理组下降(P < 0.05),趋电性减弱(P < 0.01),提示二甲双胍可抑制电场诱导的细胞定向运动。见图 2。
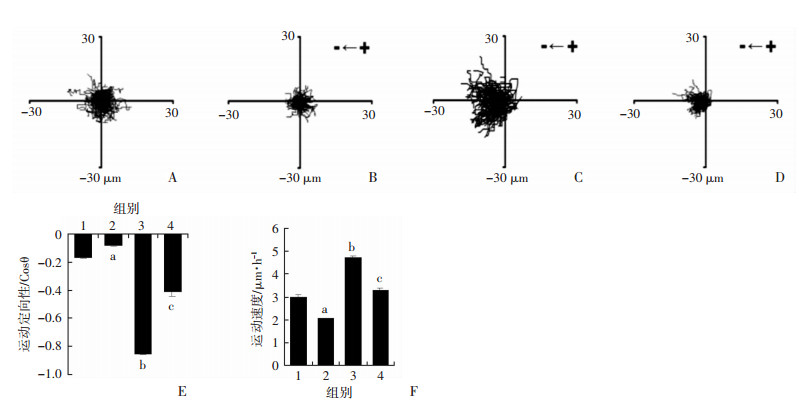
|
| A~D:分别为空白对照组、二甲双胍处理组、电场处理组、二甲双胍联合电场处理组细胞轨迹移动记录;E:各组细胞运动定向性(n=3,x±s);F:各组细胞运动速度(n=3,x±s);1:空白对照组; 2:二甲双胍处理组; 3:电场处理组;4:二甲双胍联合电场处理组; a:P < 0.05,b:P < 0.01,与空白对照组比较;c:P < 0.01,与电场处理组比较 图 2 二甲双胍及电场处理后H1975细胞运动能力及运动定向性检测 |
2.3 外加直流电及二甲双胍对H1975细胞增殖能力的影响
通过免疫荧光方法及Western blot检测细胞增殖能力,结果提示:电场处理组中增殖标志Ki67阳性细胞数量及细胞Ki67蛋白表达量较空白对照组升高(P < 0.05),二甲双胍联合电场处理组中Ki67阳性细胞数量及细胞Ki67蛋白表达量较电场处理组下降(P < 0.05)。见图 3。
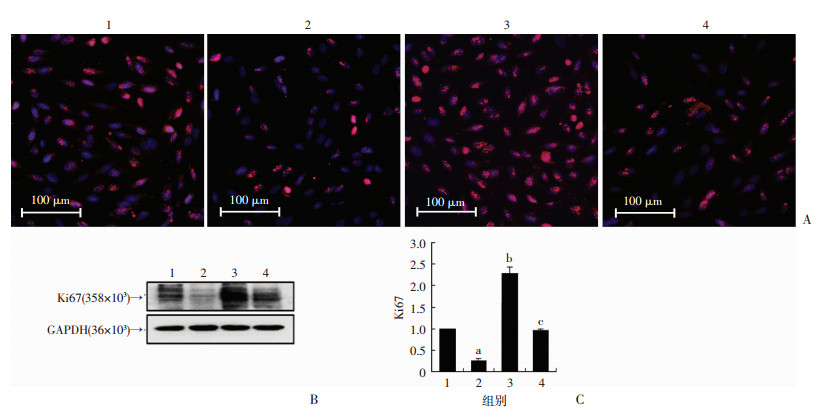
|
| 1:空白对照组; 2:二甲双胍处理组; 3:电场处理组;4:二甲双胍联合电场处理组; a:P < 0.01,b:P < 0.05,与空白对照组比较;c:P < 0.05,与电场处理组比较A:Ki67法检测各组细胞的增殖能力;B:Western blot检测各组细胞Ki67蛋白表达;C:蛋白相对表达量(n=3,x±s) 图 3 各组H1975细胞增殖能力比较 |
2.4 外加直流电及二甲双胍对H1975细胞EMT标志分子表达的影响
通过免疫荧光方法及Western blot检测EMT标志分子表达,结果提示:电场处理组细胞间质标志物Vimentin表达量较空白对照组升高(P < 0.01),上皮标志物E-cadherin蛋白表达量减少(P < 0.01)。二甲双胍联合电场处理组细胞E-cadherin蛋白表达量较电场处理组升高(P < 0.01),Vimentin表达量下降(P < 0.05)。见图 4。
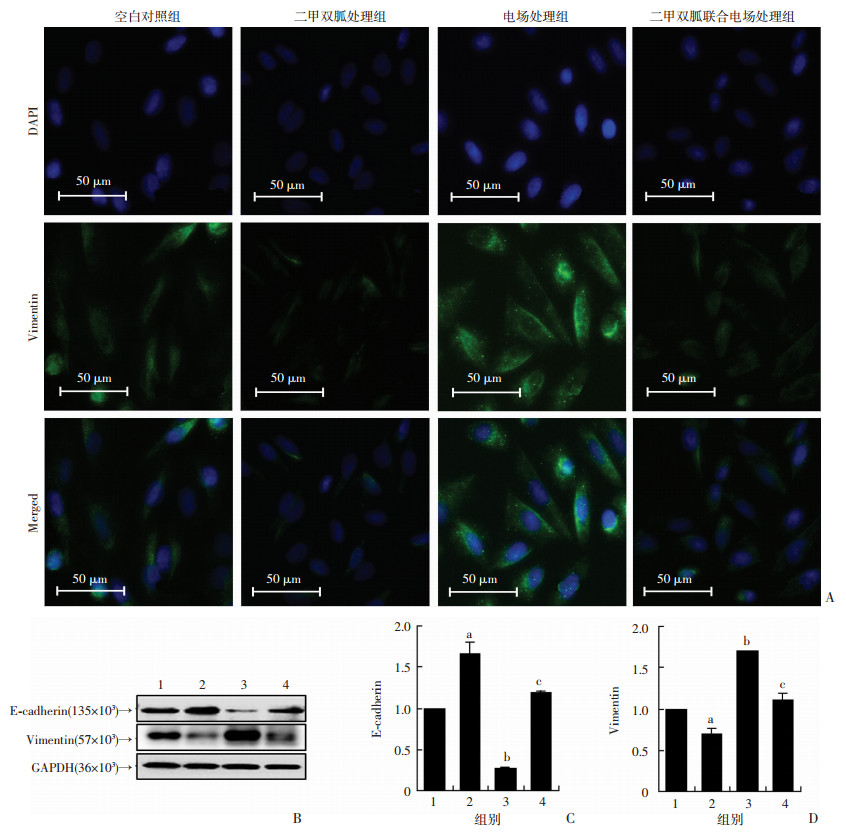
|
| A:免疫荧光染色法检测电场及二甲双胍处理后细胞E-cadherin、Vimentin表达;B:Western blot检测各处理组细胞E-cadherin、Vimentin蛋白表达;C、D:E-cadherin、Vimentin蛋白相对表达量(n=3,x±s);1:空白对照组; 2:二甲双胍处理组; 3:电场处理组;4:二甲双胍联合电场处理组; a:P < 0.05,b:P < 0.01,与空白对照组比较;c:P < 0.01,与电场处理组比较 图 4 二甲双胍可抑制电场刺激诱导的H1975细胞发生EMT改变 |
2.5 二甲双胍减弱生物电场对H1975细胞作用的机制
通过Western blot法检测p-AKT、AKT、p-EKR、ERK、p-STAT3、STAT3等增殖,EMT关键分子的蛋白表达量,结果显示:电场处理组中细胞的p-AKT、p-EKR、p-STAT3蛋白表达量较空白对照组升高(P < 0.05),AKT、ERK、STAT3蛋白量未见明显变化,二甲双胍联合电场处理组细胞的p-AKT、p-EKR、p-STAT3蛋白表达量较电场处理组降低(P < 0.05)。见图 5,表 1。
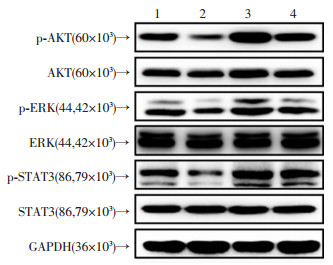
|
| 1:空白对照组; 2:二甲双胍处理组; 3:电场处理组;4:二甲双胍联合电场组 图 5 Western blot检测各处理因素作用于H1975细胞后增殖相关分子及EMT相关分子蛋白水平的变化 |
| 组别 | p-AKT | AKT | p-ERK | ERK | p-STAT3 | STAT3 |
| 空白对照组 | 1 | 1 | 1 | 1 | 1 | 1 |
| 二甲双胍处理组 | 0.488±0.027a | 0.944±0.027 | 0.701±0.003a | 0.938±0.016 | 0.622±0.081b | 0.958±0.014 |
| 电场处理组 | 1.667±0.042a | 1.011±0.088 | 1.309±0.020a | 1.045±0.109 | 1.635±0.079b | 1.048±0.026 |
| 二甲双胍联合电场处理组 | 1.167±0.059c | 0.922±0.021 | 0.901±0.018d | 0.968±0.065 | 1.262±0.017c | 0.966±0.056 |
| a: P < 0.01, b: P < 0.05, 与空白对照组比较;c: P < 0.05,d: P < 0.01,与电场处理组比较 | ||||||
3 讨论
本研究根据既往研究结果[5]选用与内源性电场强度相当的外加直流电,构建了生物电场诱导肺癌H1975细胞定向迁移的实验模型,并发现降糖药二甲双胍可通过抑制AKT/ERK信号通路、逆转EMT减弱电场诱导的H1975细胞增殖及定向运动。肿瘤侵袭和转移是一个多步骤、连续的主动过程,其中关键环节是肿瘤细胞在多种因素调控下发生定向迁移[13]。人体内正常上皮组织中存在跨上皮电势[14],上皮细胞屏障受损后会产生内源性生物电场,内源性生物电场是组织发育、创伤修复、肿瘤侵袭过程中重要的微环境信号之一[15-16],肿瘤细胞突破上皮组织后便会受到生物电场的调控。我们前期研究发现肺癌细胞移植瘤周围存在生物电场,可诱导肺癌细胞的定向运动[5],本研究进一步发现生物电场不仅诱导肺癌H1975细胞的定向运动,同时能够增强其增殖能力并诱导EMT发生,从而调控肿瘤细胞的转移及侵袭能力。
如何有效抑制肺癌转移是一个亟待解决的重要科学问题。既往研究报道经典降糖药物二甲双胍可能具有潜在的抗肿瘤新效应,能够一定程度降低肺癌及乳腺癌、肝癌、胰腺癌等疾病的发病风险[17-20]。本课题组前期回顾性研究发现,二甲双胍可增强表皮生长因子受体酪氨酸酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EFGR-TKI)在非小细胞肺癌合并糖尿病患者中的疗效[21],相关基础研究进一步证实二甲双胍可通过抑制IL-6/STAT3信号通路、逆转EMT克服非小细胞肺癌EGFR-TKI耐药[11]。除此之外,有研究报道二甲双胍不仅可以抑制卵巢癌干细胞体外增殖能力,减弱其体内致瘤性[22],同时对多种类型的肺癌细胞系均可发挥抗增殖效应[23]。二甲双胍是否能通过减弱生物电场的促肿瘤细胞增殖、侵袭作用而起到抑制肺癌转移作用,目前尚不清楚。本研究发现二甲双胍可减弱电场作用下肺癌H1975细胞的定向运动,同时抑制电场诱导的细胞增殖并逆转EMT发生,因此二甲双胍可能具有抑制肺癌细胞转移的作用。
二甲双胍抑制生物电场作用的分子机制有待探索。EGFR下游的AKT、ERK及STAT3是调控肺癌发生发展的重要分子,既往研究发现抑制AKT/ERK信号通路可减弱肺癌细胞增殖能力[24-25],而肿瘤细胞的增殖能力与其转移、侵袭能力关系密切[26]。STAT3则是调控EMT的关键分子,发生EMT的肿瘤细胞由于上皮组织屏障的损伤更容易发生转移[27]。ROKAVEC等[28]研究发现IL-6/STAT3信号通路的活化会诱导结肠直肠癌发生EMT,而IL-6/JAK/STAT3信号通路在肺癌细胞中也能诱导EMT发生,从而增强细胞的侵袭能力[29-30]。本研究结果显示,在电场刺激作用下肺癌H1975细胞p-AKT、p-ERK、p-STAT3蛋白表达升高,E-cadherin表达水平降低、Vimentin表达水平升高,提示电场刺激可活化STAT3及AKT/ERK信号通路,从而增强细胞增殖能力并诱导EMT。而加入二甲双胍和电场刺激联合处理后,细胞p-AKT、p-ERK、p-STAT3蛋白表达较电场处理组降低,E-cadherin表达水平升高,Vimentin表达水平降低,提示二甲双胍可以通过抑制AKT/ERK通路减弱细胞增殖能力,抑制STAT3活化逆转EMT,从而抑制电场刺激诱导的肺癌H1975细胞增殖及定向迁移。
目前关于内源性生物电场对恶性肿瘤细胞侵袭及转移能力的影响还有待进一步探究,深入研究生物电场对肺癌细胞的影响有助于更深层次的认识肺癌细胞的生物学特性。本研究发现二甲双胍可通过减弱细胞的增殖能力并逆转EMT来抑制生物电场对肺癌H1975细胞的影响,为今后进一步研究如何有效抑制肿瘤转移提供了理论基础。
| [1] | HERBST R S, HEYMACH J V, LIPPMAN S M. Lung cancer[J]. New Engl J Med, 2008, 359(13): 1367–1380. DOI:10.1056/NEJMra0802714 |
| [2] | LAUFFENBURGER D A, HORWITZ A F. Cell migration:a physically integrated molecular process[J]. Cell, 1996, 84(3): 359–369. DOI:10.1016/S0092-8674(00)81280-5 |
| [3] | TAI G, REID B, LIN C, et al. Electrotaxis and wound healing:experimental methods to study electric fields as a directional signal for cell migration[J]. Methods Mol Biol, 2009, 571: 77–97. DOI:10.1007/978-1-60761-198-1_5 |
| [4] | YAN X, HAN J, ZHANG Z, et al. Lung cancer A549 cells migrate directionally in DC electric fields with polarized and activated EGFRs[J]. Bioelectromagnetics, 2009, 30(1): 29–35. DOI:10.1002/bem.20436 |
| [5] | LI L, ZHANG K, LU C, et al. Caveolin-1-mediated STAT3 activation determines electrotaxis of human lung cancer cells[J]. Onetarget, 2017, 8(56): 95741–95754. DOI:10.18632/oncotarget.21306 |
| [6] | THIERY J P, ACLOQUE H, HUANG R Y J, et al. Epithelial-mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5): 871. DOI:10.1016/j.cell.2009.11.007 |
| [7] | ARUMUGAM T, RAMACHANDRAN V, FOURNIER K F, et al. Epithelial to mesenchymal transition contributes to drug resistance in pancreatic cancer[J]. Cancer Res, 2009, 69(14): 5820–5828. DOI:10.1158/0008-5472.CAN-08-2819 |
| [8] | BAO B, AZMI A S, ALI S, et al. Metformin may function as anti-cancer agent via targeting cancer stem cells:the potential biological significance of tumor-associated miRNAs in breast and pancreatic cancers[J]. Ann Trans Med, 2014, 2(6): 59. DOI:10.3978/j.issn.2305-5839.2014.06.05 |
| [9] | HART T, DIDER S, HAN W, et al. Toward repurposing metformin as a precision anti-cancer therapy using structural systems pharmacology[J]. Sci Rep, 2016, 6: 20441. DOI:10.1038/srep20441 |
| [10] | RATTAN R, FEHMI R A, MUNKARAH A. Metformin:an emerging new therapeutic option for targeting cancer stem cells and metastasis[J]. J Oncol, 2012, 2012(3): 928127. DOI:10.1155/2012/928127 |
| [11] | LI L, HAN R, XIAO H, et al. Metformin sensitizes EGFR-TKI-resistant human lung cancer cells in vitro and in vivo through inhibition of IL-6 signaling and EMT reversal[J]. Clin Cancer Res, 2014, 20(10): 2714. DOI:10.1158/1078-0432.CCR-13-2613 |
| [12] | ZHAO M, AGIUSFERNANDEZ A, FORRESTER J V, et al. Orientation and directed migration of cultured corneal epithelial cells in small electric fields are serum dependent[J]. J Cell Sci, 1996, 109(Pt 6): 1405–1414. DOI:10.1083/jcb.133.6.1403 |
| [13] | GEORGE S P, CHEN H, CONRAD J C, et al. Regulation of directional cell migration by membrane-induced actin bundling[J]. J Cell Sci, 2013, 126(1): 312–326. DOI:10.1242/jcs.116244 |
| [14] | NUCCITELLI R. A role for endogenous electric fields in wound healing[J]. Curr Top Dev Biol, 2003, 58(2): 1–26. DOI:10.1016/S0070-2153(03)58001-2 |
| [15] | LAUFFENBURGER D A, HORWITZ A F. Cell migration:a physically integrated molecular process[J]. Cell, 1996, 84(3): 359–369. DOI:10.1016/S0092-8674(00)81280-5 |
| [16] | RAFTOPOULOU M, HALL A. Cell migration:Rho GTPases lead the way[J]. Dev Biol, 2004, 265(1): 23–32. DOI:10.1016/j.ydbio.2003.06.003 |
| [17] | COL N F, OCHS L, SPRINGMANN V, et al. Metformin and breast cancer risk:a meta-analysis and critical literature review[J]. Breast Cancer Res Treat, 2012, 135(3): 639–646. DOI:10.1007/s10549-012-2170-x |
| [18] | SORANNA D, SCOTTI L, ZAMBON A, et al. Cancer risk associated with use of metformin and sulfonylurea in type 2 diabetes:a meta-analysis[J]. Oncologist, 2012, 17(6): 813–822. DOI:10.1634/theoncologist.2011-0462 |
| [19] | ZHANG Z J, ZHENG Z J, SHI R, et al. Metformin for liver cancer prevention in patients with type 2 diabetes:a systematic review and meta-analysis[J]. J Clin Endocr Metab, 2012, 97(7): 2347. DOI:10.1210/jc.2012-1267 |
| [20] | TSAI M J, YANG C J, KUNG Y T, et al. Metformin, lung cancer[J]. Lung Cancer, 2014, 86(2): 137–143. DOI:10.1016/j.lungcan.2014.09.012 |
| [21] | CHEN H, YAO W, CHU Q, et al. Synergistic effects of metformin in combination with EGFR-TKI in the treatment of patients with advanced non-small cell lung cancer and type 2 diabetes[J]. Cancer Lett, 2015, 369(1): 97–102. DOI:10.1016/j.canlet.2015.08.024 |
| [22] | SHANK J J, YANG K, GHANNAM J, et al. Metformin targets ovarian cancer stem cells in vitro and in vivo[J]. Gynecol Oncol, 2012, 127(2): 390–397. DOI:10.1016/j.ygyno.2012.07.115 |
| [23] | ASHINUMA H, TAKIGUCHI Y, KITAZONO S, et al. Antiproliferative action of metformin in human lung cancer cell lines[J]. Oncol Rep, 2012, 28(28): 8–14. DOI:10.3892/or.2012.1763 |
| [24] | LU Z J, ZHOU Y, SONG Q, et al. Periplocin inhibits growth of lung cancer in vitro and in vivo by blocking AKT/ERK signaling pathways[J]. Cell Physiol Biochem, 2010, 26(4/5): 609–618. DOI:10.1159/000322328 |
| [25] | ZHOU F, NIE L, FENG D, et al. MicroRNA-379 acts as a tumor suppressor in non-small cell lung cancer by targeting the IGF-1R-mediated AKT and ERK pathways[J]. Oncol Rep, 2017, 38(3): 1857–1866. DOI:10.3892/or.2017.5835 |
| [26] | AL-MEHDI A B, TOZAWA K, FISHER A B, et al. Intravascular origin of metastasis from the proliferation of endothelium-attached tumor cells:a new model for metastasis[J]. Nat Med, 2000, 6(1): 100–102. DOI:10.1038/71429 |
| [27] | KUDOSAITO C, SHIRAKO H, TAKEUCHI T, et al. Cancer metastasis is accelerated through immunosuppression during Snail-induced EMT of cancer cells[J]. Cancer Cell, 2009, 15(3): 195–206. DOI:10.1016/j.ccr.2009.01.023 |
| [28] | ROKAVEC M, ÖNER M G, LI H, et al. IL-6R/STAT3/miR-34a feedback loop promotes EMT-mediated colorectal cancer invasion and metastasis[J]. J Clin Invest, 2014, 124(4): 1853. DOI:10.1172/JCI73531 |
| [29] | LIU R Y, ZENG Y, LEI Z, et al. JAK/STAT3 signaling is required for TGF-β-induced epithelial-mesenchymal transition in lung cancer cells[J]. Int J Oncol, 2014, 44(5): 1643–1651. DOI:10.3892/ijo.2014.2310 |
| [30] | YAO Z, FENOGLIO S, GAO D C, et al. TGF-beta IL-6 axis mediates selective and adaptive mechanisms of resistance to molecular targeted therapy in lung cancer[J]. P Natl Acad Sci USA, 2010, 107(35): 15535–15540. DOI:10.1073/pnas.1009472107 |



