据美国癌症中心2018年公布的全球癌症统计数据,胃癌占全球癌症死亡率第二位及发病率第六位[1]。而东亚地区胃癌发病率最高,其中我国胃癌新发病例约占全球所有胃癌新发病例的40%[2]。尿苷三磷酸(uridine triphosphate,UTP)是一种嘧啶核苷酸,长期被认为多在细胞内参与生物化学反应,例如能量交换和核酸合成。然而,最近研究显示,核苷酸从受损伤或应激的细胞和组织中释放后可通过激活细胞膜表面的P2受体活化细胞应答。例如,高转移性乳腺癌细胞释放的UTP可激活血管内皮细胞膜上的P2Y2受体而增加肿瘤的生长和侵袭[3]。UTP主要与P2Y2和P2Y4受体结合,而P2Y2受体在大多数肿瘤细胞中高表达,并介导肿瘤细胞的增殖[4]。我们前期研究发现,UTP通过PTEN/Vimentin抑制胃癌细胞的迁移和侵袭[5],而UTP在胃癌增殖方面的研究鲜有报道。
细胞内游离的Ca2+参与了许多重要的生理病理过程,如肌肉的收缩、神经递质的释放、基因的转录调控、细胞的增殖和凋亡等。近年研究表明,细胞内Ca2+平衡的紊乱是导致肿瘤发生、发展及其恶性转化的重要原因[6-7]。同时,胞内Ca2+信号也是细胞自噬重要的调节剂之一。既往研究发现,Gypenoside L通过内质网应激介导的Ca2+释放,抑制自噬通量并诱导人食管癌细胞死亡[8]。细胞外ATP可通过激活P2X7受体,诱导人肠上皮细胞的自噬和凋亡[9]。而UTP是否可以通过影响细胞内Ca2+信号来影响胃癌细胞的自噬从而调节胃癌细胞的增殖,目前尚不清楚。因此,本研究初步探讨UTP对胃癌细胞增殖的影响及其可能的分子机制。
1 材料与方法 1.1 主要材料人胃癌细胞SGC-7901、AGS为本实验室保存。
UTP购自Sigma公司,抗体LC3、β-tubulin购自Cell Signaling Technology公司,高糖DMEM、RPMI培养基及胎牛血清购自HyClone公司(美国),蛋白提取试剂盒购自碧云天公司,BAPTA-AM、CCK-8试剂盒购自MCE公司(美国),coverslip购自Millicell公司(美国),Fura-2AM购自Invitrogen公司(美国纽约),6孔板、12孔板、96孔板购自Corning公司(美国),结晶紫染色液购自上海生工。
1.2 细胞培养人胃癌细胞SGC-7901和AGS分别于含10%胎牛血清的高糖DMEM培养基、RPMI培养基,37 ℃、5% CO2的培养箱中培养。
1.3 CCK-8细胞增殖实验将SGC-7901和AGS细胞培养至对数生长期,胰酶消化、离心、重悬后,细胞计数,以细胞数2 000个/100 μL接种至96孔板中,周围加PBS,置于37 ℃、5% CO2的培养箱中培养24 h,将UTP用培养基稀释并按照0(对照)、5、50、100 μmol/L的浓度分别加入相应接种细胞的96孔中,分别于第1、3、5天后换液,每孔加入含有10%的CCK-8试剂的新鲜培养基100 μL,置于37 ℃、5% CO2的培养箱中约1 h,用酶联免疫检测仪测定450 nm波长处的光密度值[D(450)]。回复实验时将SGC-7901和AGS细胞接种至96孔板中,培养24 h后,按对照、UTP、UTP+BAPTA-AM、BAPTA-AM的分组加入对应UTP(50 μmol/L)、BAPTA-AM(2 μmol/L),于第3天换液后加入CCK-8试剂,1 h后用酶标仪检测波长450 nm处光密度值[D(450)]。
1.4 集落形成实验通过形成集落的能力评估胃癌细胞的增殖能力。将SGC-7901和AGS细胞分别消化、离心、重悬,细胞计数,以800个细胞/孔接种至6孔板中。24 h后加入UTP(对照、50 μmol/L、100 μL),置于37 ℃、5% CO2的培养箱中培养14 d,用75%乙醇固定后,用结晶紫染色液染色,并对形成的集落进行计数。
1.5 Western blot检测将SGC-7901和AGS细胞分别接种至6孔板内,置于37 ℃、5% CO2的培养箱中培养24 h后,加入UTP(50 μmol/L),按照0、6、12、18、24 h的时间顺序采用SDS蛋白裂解液提取细胞总蛋白; 回复实验时将SGC-7901和AGS细胞分别接种至6孔板内,培养24 h后,按对照、UTP、UTP+BAPTA- AM、BAPTA-AM的分组加入对应UTP(50 μmol/L)、BAPTA-AM(2 μmol/L), BAPTA-AM需预处理至少2 h,加入UTP 18 h后提取细胞总蛋白。100 ℃,煮8 min,使蛋白变性,BCA法测定蛋白浓度,配置5%的浓缩胶12%的分离胶SDS-PAGE电泳,每孔上样量为30~40 μg蛋白,进行SDS-PAGE电泳。常规湿转法转膜(恒压100 V,70 min),5%的脱脂奶粉室温封闭2 h,一抗4 ℃过夜(LC3 1 :1 000,β-tubulin 1 :1 000),二抗室温孵育1 h,(山羊抗鼠1 :5 000,山羊抗兔1 :10 000),ECL化学发光,凝胶成像系统显影。
1.6 钙显像测定实验将SGC-7901和AGS细胞接种于12孔板中的盖玻片上,置于37 ℃、5% CO2的培养箱中培养24 h,将在盖玻片上培养的SGC-7901和AGS细胞在生理盐溶液(PSS)中加载5 μmol/L Fura-2AM置于37 ℃、5% CO2的培养箱中60 min,用PSS洗涤30 min。然后,将盖玻片上的细胞置于倒置荧光显微镜台上的标准灌注室中。在PSS中加入UTP 50 μmol/L,随着时间的推移跟踪Fura-2荧光与340或380 nm激发(F340/F380)的比率,并用增强的CCD相机捕获。使用MetaFluor软件获得图像。PSS包含(mmol/L):140 Na+、5 K+、2 Ca2+、147 Cl-、10 HEPES和10葡萄糖,pH=7.4。
1.7 统计学分析数据以x±s表示,采用GraphPad Prism 7.0软件进行分析。多组间比较采用单因素方差分析。检验水准:α=0.05。
2 结果 2.1 UTP通过增加细胞内钙抑制胃癌细胞的增殖能力与对照组比较,UTP 5 μmol/L对胃癌细胞SGC-7901和AGS的增殖无明显作用,但UTP 50 μmol/L对胃癌细胞SGC-7901和AGS的增殖却有明显抑制作用(P < 0.05,n=3),并且随着UTP浓度的增大和时间的延长,抑制作用逐渐增加。在第3天时,UTP 50~100 μmol/L对胃癌细胞SGC-7901和AGS的增殖抑制作用更加明显(P < 0.01,n=3,图 1)。而加入细胞内钙螯合剂BAPTA-AM 2 μmol/L后,可逆转UTP对胃癌细胞增殖的抑制作用(图 1)。因此,UTP能够抑制胃癌细胞的增殖,并呈浓度和时间依赖性,其可能通过增加细胞内钙信号来实现。
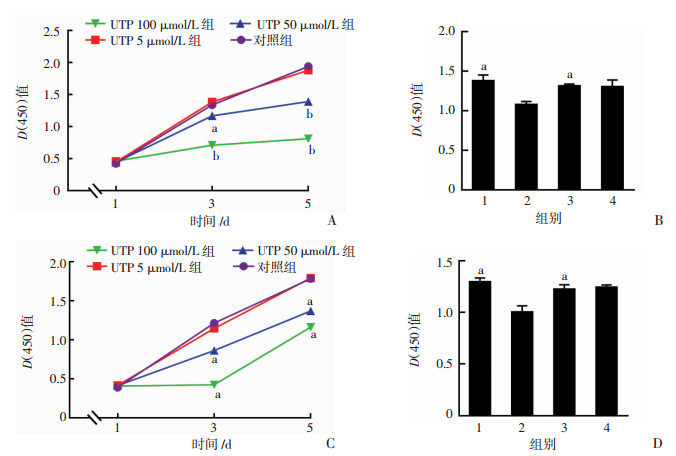
|
| A: SGC-7901细胞不同时间增殖能力 a:P < 0.05, b:P < 0.01, 与对照组及UTP 5 μmol/L组比较;B: SGC-7901细胞不同处理组增殖能力 1:对照组;2:UTP 50 μmol/L组;3:UTP+BAPTA-AM组;4:BAPTA-AM 2 μmol/L组; a:P < 0.01, 与UTP 50 μmol/L组比较;C: AGS细胞不同时间增殖能力a: P < 0.01, 与对照组及UTP 5 μmol/L组比较;D: AGS细胞不同处理组增殖能力 1:对照组;2:UTP 50 μmol/L组;3:UTP+BAPTA-AM组;4:BAPTA-AM 2 μmol/L组; a: P < 0.01, 与UTP 50 μmol/L组比较 图 1 CCK-8实验检测UTP对胃癌细胞SGC-7901和AGS增殖能力的影响 |
2.2 UTP抑制胃癌细胞的集落形成能力
与对照组比较,UTP 50 μmol/L可明显抑制胃癌细胞SGC-7901和AGS集落形成的能力,并且随着UTP浓度的增大,抑制效应逐渐增强(P < 0.01, n=3, 图 2)。UTP 100 μmol/L抑制胃癌细胞SGC-7901和AGS集落形成的能力更加明显。因此,UTP能够浓度依赖性地抑制胃癌细胞的集落形成,从而抑制胃癌细胞的增殖。
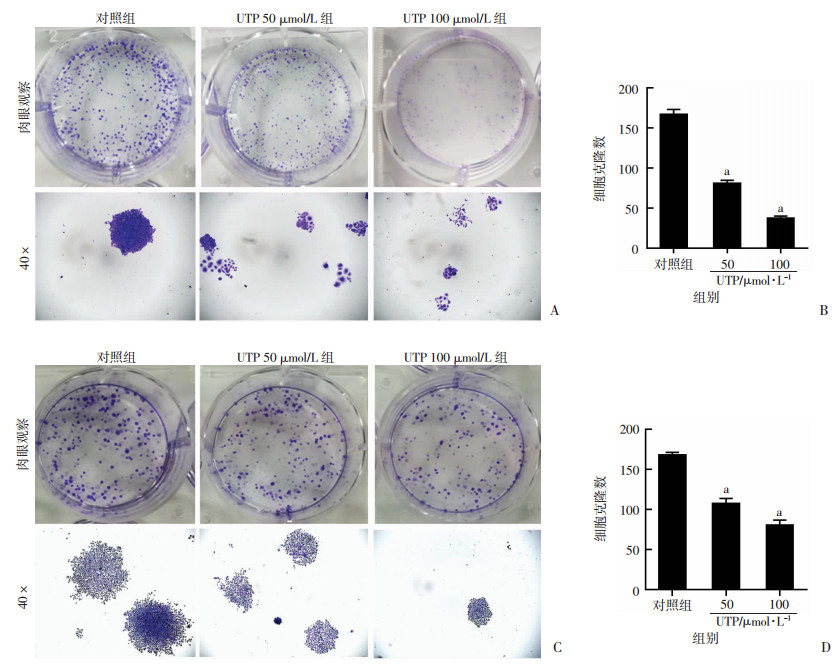
|
| A: SGC-7901细胞集落形成实验结果(结晶紫染色);B: SGC-7901细胞各组细胞克隆数比较a:P < 0.01, 与对照组比较; C: AGS细胞集落形成实验结果(结晶紫染色);D: AGS细胞各组细胞克隆数比较a: P < 0.01, 与对照组比较 图 2 集落形成实验检测UTP对胃癌细胞SGC-7901和AGS集落形成能力的影响 |
2.3 UTP增加细胞内Ca2+信号
单细胞内钙测定实验结果显示,在生理盐溶液PSS中加入UTP 50 μmol/L后,胃癌细胞SGC-7901和AGS的细胞内Ca2+信号(F340/F380比值)明显上升(n=20,图 3)。表明UTP可触发SGC-7901和AGS胃癌细胞内的Ca2+信号。
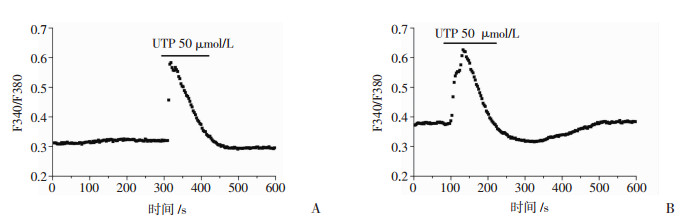
|
| A:SGC-7901细胞;B:AGS细胞 图 3 UTP对胃癌细胞SGC-7901和AGS胞内Ca2+信号的影响 |
2.4 UTP通过增加细胞内钙促进胃癌细胞的自噬
与0 h相比,UTP(50 μmol/L)作用18 h,胃癌细胞SGC-7901 LC3Ⅱ/LC3Ⅰ蛋白的表达水平明显升高(P < 0.01),24 h下降(图 4)。UTP对AGS细胞有相同作用,LC3Ⅱ/LC3Ⅰ蛋白的表达水平在18 h明显高于0 h(P < 0.05),24 h下降(图 4)。而加入BAPTA-AM后降低了LC3Ⅱ/LC3Ⅰ蛋白的表达水平,阻断了UTP促进的细胞自噬(P < 0.05, 图 4)。提示UTP可上调LC3Ⅱ/LC3Ⅰ蛋白的表达水平,从而促进了胃癌细胞的自噬,其可能与增加细胞内钙信号有关。
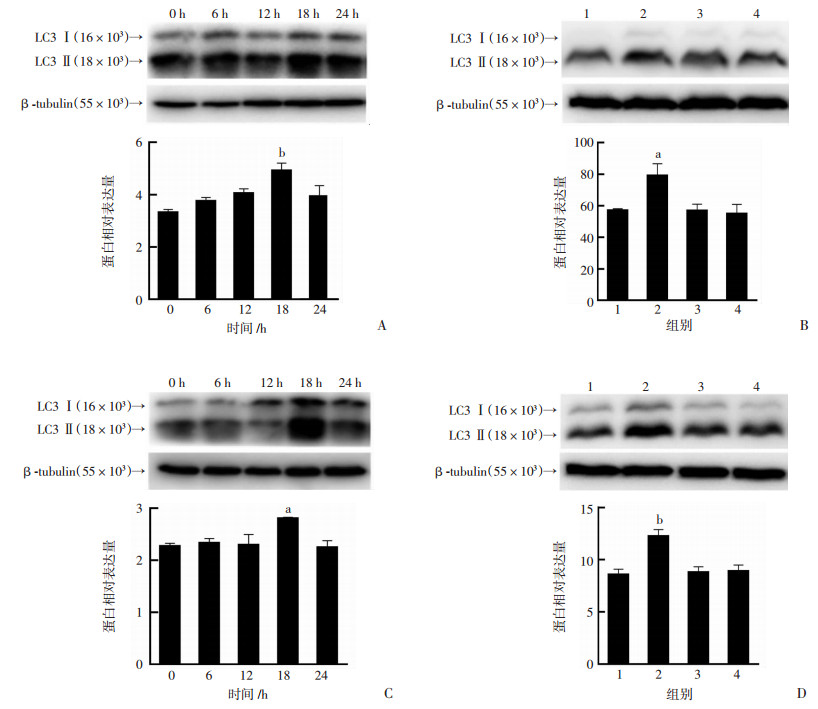
|
| A: UTP(50 μmol/L)作用SGC-7901细胞不同时间蛋白的表达 b: P < 0.01,与0 h比较;B: SGC-7901细胞各处理组蛋白表达 1:对照组;2:UTP组;3:UTP+BAPTA-AM组;4:BAPTA-AM组; a: P < 0.05,与对照组和UTP+BAPTA-AM组比较;C: UTP(50 μmol/L)作用AGS细胞不同时间蛋白的表达 a: P < 0.05, 与0 h比较;D: AGS细胞各处理组蛋白表达 1:对照组;2:UTP组;3:UTP+BAPTA-AM组;4:BAPTA-AM组; b: P < 0.01,与对照组和UTP+BAPTA-AM组比较 图 4 UTP对胃癌细胞SGC-7901和AGS LC3Ⅱ/LC3Ⅰ蛋白表达水平的影响 |
3 讨论
近年来,我国胃癌的发病率不断上升,已成为“胃癌大国”,死亡率也排在所有恶性肿瘤前列。而胃癌的病因复杂,发病机制仍不清楚。既往研究发现,UTP通过激活P2Y2受体增加人癌性胰管上皮细胞的增殖[10]。本研究探讨UTP对胃癌细胞增殖的影响。首先,CCK-8实验表明UTP可以抑制胃癌细胞的增殖;其次,集落形成实验也显示UTP可以抑制胃癌细胞克隆形成,进一步证实UTP对胃癌细胞的增殖有抑制作而用;后加入细胞内钙螯合剂BAPTA-AM后,逆转了UTP对胃癌细胞增殖的抑制作用。因此,UTP可能通过增加细胞内钙信号,从而抑制胃癌细胞的增殖和集落形成能力。
已知细胞内Ca2+信号,在自噬过程中发挥重要的调节作用。细胞在正常生理状态下,IP3R介导的Ca2+释放和L型钙通道引起少量的钙内流,可抑制细胞的基础自噬[11]。细胞应激时,例如饥饿或使用毒胡萝卜素、离子霉素等,细胞内Ca2+信号升高,通过各种途径诱导自噬,例如激活钙调蛋白CAMKK/AMPK,抑制mTOR活性,最终促进自噬[12]。而细胞内钙螯合剂BAPTA-AM可阻止自噬的产生[13],表明胞内Ca2+信号对自噬发生过程的重要调控作用。RAH等[14]研究发现,NAADP介导的Ca2+信号促进自噬并防止LPS诱导的肝损伤。而胞内Ca2+信号在消化道肿瘤自噬方面的研究少有报道。已有研究表明,UTP可激活P2Y受体,通过cAMP/PLC/IP3通路,促进细胞内储存的Ca2+释放来介导细胞效应[15]。本研究结果也证实,UTP可以触发胃癌细胞SGC-7901和AGS内的Ca2+信号。因此,UTP可能通过细胞内Ca2+信号,激活胃癌细胞的自噬从而抑制其增殖。接下来我们对UTP促进胃癌细胞自噬的机制,进行了初步探讨。
自噬是一种依赖溶酶体途径对胞质蛋白和细胞器进行降解的一种过程, 也是一种防御和应激调控机制。饥饿状态下可降解部分蛋白质和细胞器用于供能和生物合成,也可以清除变性或错误折叠的蛋白质、衰老或损伤的细胞器等,以维持细胞内稳态[16]。研究发现,自噬通过影响增殖、凋亡和抗癌治疗敏感性在癌症的发生和发展中起重要作用[17]。自噬在癌症发生的早期阶段,可以通过清除线粒体蛋白质,其折叠物通过活性氧(ROS)破坏基因组充当肿瘤抑制剂,但在进展期肿瘤中,缺氧、代谢或治疗等应激条件下细胞自噬水平的升高可能是促进肿瘤存活的机制[18]。虽然研究表明,自噬可以抑制胃癌细胞的增殖及促进凋亡[19-20],但UTP对胃癌细胞自噬的影响还未有报道。本研究发现UTP可以促使胃癌细胞内LC3Ⅱ/LC3Ⅰ蛋白的表达,促进胃癌细胞的自噬,抑制了胃癌细胞的增殖。而细胞内钙螯合剂BAPTA-AM能够降低LC3Ⅱ/LC3Ⅰ蛋白的表达水平,阻断UTP所致胃癌细胞的自噬。充分验证了我们关于UTP通过触发细胞内钙信号促进细胞自噬,最终抑制胃癌细胞的增殖和集落形成的假说。但目前UTP增加胞内Ca2+,激活胃癌细胞自噬的分子途径有待进一步的深入研究。
综上所述,本研究发现UTP能够增加细胞内Ca2+信号以激活自噬,最终抑制了胃癌细胞的增殖和集落形成能力(图 5)。因此,UTP通过细胞内Ca2+依赖的自噬机制,可能具有潜在的防治胃癌作用。
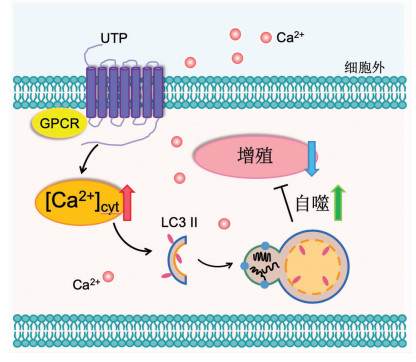
|
| 图 5 尿苷三磷酸增加细胞内Ca2+信号诱导自噬抑制胃癌细胞的增殖 |
| [1] | BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.21492 |
| [2] | YANG L, ZHENG R S, WANG N, et al. Incidence and mortality of stomach cancer in China, 2014[J]. Chin J Cancer Res, 2018, 30(3): 291–298. DOI:10.21147/j.issn.1000-9604.2018.03.01 |
| [3] | JIN H N, EUN S Y, LEE J S, et al. P2Y2 receptor acti-vation by nucleotides released from highly metastatic breast cancer cells increases tumor growth and invasion via crosstalk with endothelial cells[J]. Breast Cancer Res, 2014, 16(5): R77. DOI:10.1186/bcr3694 |
| [4] | WHITE N, BURNSTOCK G. P2 receptors and cancer[J]. Trends Pharmacol Sci, 2006, 27(4): 211–217. DOI:10.1016/j.tips.2006.02.004 |
| [5] |
万晗星, 谢睿, 刘菁菁, 等. 尿苷三磷酸通过PTEN/Vimentin抑制胃癌细胞的侵袭[J].
第三军医大学学报, 2016, 38(6): 550–553.
WAN H X, XIE R, LIU J J, et al. UTP attenuates migration of gastric cancer cells via PTEN/vimentin[J]. J Third Mil Med Univ, 2016, 38(6): 550–553. DOI:10.16016/j.1000-5404.201510120 |
| [6] | SHAPOVALOV G, RITAINE A, SKRYMA R, et al. Role of TRP ion channels in cancer and tumorigenesis[J]. Semin Immunopathol, 2016, 38(3): 357–369. DOI:10.1007/s00281-015-0525-1 |
| [7] | LIU X Y, WAN X, KAN H, et al. Hypoxia-induced upregulation of Orai1 drives colon cancer invasiveness and angiogenesis[J]. Eur J Pharmacol, 2018, 832: 1–10. DOI:10.1016/j.ejphar.2018.05.008 |
| [8] | LIAO C H, ZHENG K, LI Y, et al. Gypenoside L inhibits autophagic flux and induces cell death in human esophageal cancer cells through endoplasm reticulum stress-mediated Ca2+ release[J]. Oncotarget, 2016, 7(30): 47387–47402. DOI:10.18632/oncotarget.10159 |
| [9] | SOUZA C O, SANTORO G F, FIGLIUOLO V R, et al. Extracellular ATP induces cell death in human intestinal epithelial cells[J]. Biochim Biophys Acta, 2012, 1820(12): 1867–1878. DOI:10.1016/j.bbagen.2012.08.013 |
| [10] | CHOI J H, JI Y G, LEE D H. Uridine triphosphate increases proliferation of human cancerous pancreatic duct epithelial cells by activating P2Y2 receptor[J]. Pancreas, 2013, 42(4): 680–686. DOI:10.1097/MPA.0b013e318271bb4b |
| [11] | CÁRDENAS C, MILLER R A, SMITH I, et al. Essential regulation of cell bioenergetics by constitutive InsP3 receptor Ca2+ transfer to mitochondria[J]. Cell, 2010, 142(2): 270–283. DOI:10.1016/j.cell.2010.06.007 |
| [12] | GROTEMEIER A, ALERS S, PFISTERER S G, et al. AMPK-independent induction of autophagy by cytosolic Ca2+ increase[J]. Cell Signal, 2010, 22(6): 914–925. DOI:10.1016/j.cellsig.2010.01.015 |
| [13] | JI T R, ZHANG C W, MA L L, et al. TRPC6-mediated Ca2+ signaling is required for hypoxia-induced autophagy in human podocytes[J]. Cell Physiol Biochem, 2018, 48(4): 1782–1792. DOI:10.1159/000492351 |
| [14] | RAH S Y, LEE Y H, KIM U H. NAADP-mediated Ca2+ signaling promotes autophagy and protects against LPS-induced liver injury[J]. FASEB J, 2017, 31(7): 3126–3137. DOI:10.1096/fj.201601290R |
| [15] | CHOI R C, CHU G K, SIOW N L, et al. Activation of UTP-sensitive P2Y2 receptor induces the expression of cholinergic genes in cultured cortical neurons: A signaling cascade triggered by Ca2+ mobilization and extracellular regulated kinase phosphorylation[J]. Mol Pharmacol, 2013, 84(1): 50–61. DOI:10.1124/mol.112.084160 |
| [16] | RABINOWITZ J D, WHITE E. Autophagy and metabolism[J]. Science, 2010, 330(6009): 1344–1348. DOI:10.1126/science.1193497 |
| [17] | GEWIRTZ D A. The four faces of autophagy: implications for cancer therapy[J]. Cancer Res, 2014, 74(3): 647–651. DOI:10.1158/0008-5472.CAN-13-2966 |
| [18] | WHITE E, DIPAOLA R S. The double-edged sword of autophagy modulation in cancer[J]. Clin Cancer Res, 2009, 15(17): 5308–5316. DOI:10.1158/1078-0432.CCR-07-5023 |
| [19] | GAO Y, QI W W, SUN L B, et al. FOXO3 inhibits human gastric adenocarcinoma (AGS) cell growth by promoting autophagy in an acidic microenvironment[J]. Cell Physiol Biochem, 2018, 49(1): 335–348. DOI:10.1159/000492884 |
| [20] | CHEN P P, MA X Y, LIN Q, et al. Kangfuxin promotes apoptosis of gastric cancer cells through activating ER-stress and autophagy[J]. Mol Med Rep, 2017, 16(6): 9043–9050. DOI:10.3892/mmr.2017.7716 |



