凝血功能障碍所导致的脑出血病死率高,且并发症复杂,临床预后差[1]。但目前的临床研究多聚焦在华法林、阿司匹林等抗凝或抗血小板药物所致脑出血的临床特点及预后研究,缺乏对凝血功能障碍所致脑出血的全面认识,而且目前尚无明确推荐的治疗方案[2]。而各种凝血功能障碍所致脑出血其发病机制、病死率及预后目前都未得到深入的研究,更无法探究针对性治疗方案[3-5]。基于此,本研究回顾性纳入2000年1月至2016年8月陆军军医大学第一附属医院神经外科收治的134例凝血功能障碍所致脑出血患者,分析其临床特点,对于不同凝血功能障碍进行亚组分析,以期寻求有效的治疗方法。
1 资料与方法 1.1 临床资料收集收集2000年1月至2016年8月本科收治的凝血功能障碍所致脑出血患者。纳入标准:①年龄18~85岁,性别不限; ②入院影像学与临床诊断为脑实质出血; ③血小板或凝血功能检验有明显异常,且有明确导致凝血功能障碍的诱因; ④发病至入院时间<96 h; ⑤患者有全面的凝血功能检验结果,包括国际标准化比值(prothrombin time-international normalized ratio,PT-INR)、血小板数目、凝血六项:血浆凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)、纤维蛋白原降解产物(FDP)、D-二聚体。排除标准:①合并晚期脑疝(双侧瞳孔散大,中枢性呼吸循环衰竭); ②有明确的高血压病史; ③严重的肝肾功能不全者; ④发病前存在残障[改良兰金量表评分(modified rankin scale,mRS)>1]; ⑤患者有无法控制的精神症状; ⑥免疫抑制状态或感染无法控制者。
本研究属回顾性分析,研究方案于2017年获陆军军医大学第一附属医院伦理委员会审查通过(KY201775)。
1.2 影像学资料入院后,患者均行急诊头颅CT或头颅CT血管成像检查,诊断为脑实质出血。出血部位为脑叶36例,基底节区86例,小脑12例。出血量采用多田氏公式计算。入院后首次检查出血量为3~120 mL,平均35.2 mL; 其中63例为3~30 mL,68例为>30~80 mL,3例患者出血量大于80 mL。45例患者出血破入脑室。
1.3 实验室检查入院时常规查血常规、肝肾功能、PT-INR、凝血6项; 凝血功能障碍定义为INR比值>2.5、血小板计数<100×109/L或PT延长5 s以上。
1.4 治疗方法服用华法林、阿司匹林或氯吡格雷等抗凝血或抗血小板药物的患者入院后立即停止口服相关药物,同时给予服用华法林的患者静脉注射维生素K(10 mg)治疗,随后治疗根据PT-INR值调整; 67例患者静脉输注新鲜冰冻血浆200~1 000 mL、12例给予冷沉淀10单位以快速纠正凝血功能。10例患者静脉输注浓缩血小板每次10~20个单位直至复查血小板升至50×109/L后根据情况决定是否继续输注。本组患者中16例行开颅血肿清除,10例行神经内镜下血肿清除,13例行脑室外引流,手术均在凝血功能异常基本纠正后开展。95例患者行保守治疗。为避免因停用抗凝药物所致血栓性疾病的发生,患者在术后7 d病情稳定后开始恢复使用小剂量抗凝或抗血小板药物:华法林(2.5~3.0 mg/d)、阿司匹林(25.0~100.0 mg/d)或氯吡格雷(75.0 mg/d),定期监测凝血功能和血常规。根据血小板计数、PT及PT-INR值调整用药。
1.5 统计学分析采用SPSS 13.0统计学软件,计量资料以x±s表示,根据是否为正态分布,采用t检验或非参数检验比较组间差异; 计数资料采用χ2检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 一般资料本组134例患者中,男性86例,女性48例; 年龄23~85岁,平均61.3岁。年龄小于45岁17例,45~60岁51例,>60~75岁45例,>75岁21例。凝血功能障碍病因包括:27例有口服华法林(3~5 mg/g)病史,服药距发病时间为3~41个月,其中4例为心脏瓣膜置换术后,23例为心房颤动患者; 71例抗血小板聚集药物(阿司匹林100 mg/d和/或氯吡格雷75 mg/d),其中心脑血管支架术后15例,缺血性脑血管病56例; 5例溶栓,其中2例为尿激酶溶栓,3例rt-PA溶栓; 12例血液系统疾病,其中10例为特发性血小板减少性紫癜,1例为急性髓细胞白血病,1例为慢性粒细胞白细胞; 13例肝硬化肝功能失代偿期; 血友病1例,2例鼠药中毒,3例患系统性红斑狼疮。
入院时患者意识状态采用格拉斯哥昏迷评分(Glasgow coma scale,GCS),13~15分65例,6~12分60例,3~5分9例。出院时按mRS评分评估患者的预后。死亡(mRS:6分)54例,严重残疾(mRS:3~5分)47例,预后良好(mRS:1~2分)33例。死亡患者中华法林所致14例,占服用华法林者的51.8%,抗血小板药物所致21例,占服用抗血小板药物者的29.6%,肝硬化所致7例,占患肝硬化者的53.8%;血液系统疾病所致7例,占患血液系统疾病者的58.3%;系统性红斑狼疮所致2例,占患系统性红斑狼疮者的66.6%;血友病所致1例,占患血友病者的100.0%;溶栓所致2例,占溶栓者的40.0%。鼠药中毒患者未产生死亡病例。
2.2 凝血功能患者凝血功能均有不同程度异常。27例服用华法林的患者入院时PT-INR为1.2~6.4(3.2±1.8),其中10例患者PT-INR值大于3.0。10例患者血小板计数水平为(7~50)×109/L,平均为16×109/L。13例肝硬化肝功能失代偿期,凝血酶原时间较正常值延长5 s,血小板计数小于50×109/L。
2.3 并发症及病死率患者出院时评估本组病例各项并发症:76例(56.7%)患者发生肺部感染,27例(20.1%)患者发生血肿扩大,19例(13.9%)患者发生脑积水; 11例(8.2%)患者发生上消化道出血; 5例(3.7%)患者发生继发脑梗死; 4例(3.0%)患者发生深静脉血栓形成。
亚组分析:68例出血量为>30~80 mL的脑出血患者中,32例采取保守治疗,其中23例患者死亡,病死率为71.9%;36例采取手术治疗,其中16例患者死亡,病死率为44.4%。手术组病死率显著低于保守治疗组(χ2=5.212,P=0.022)。另外,本研究对两组患者平均住院时间进行了比较:手术组病例住院时间为(17.02±5.90)d,显著短于保守治疗组[(20.09±5.35)d,t=0.314,P=0.038]。脑出血术前、术后典型影像学图像见图 1。
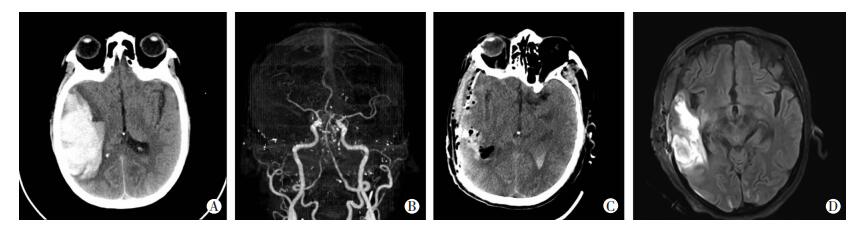
|
| A:术前头颅CT示右额颞叶大量颅内血肿,血肿密度不均匀; B:术前CTA未见明显动脉瘤及血管畸形; C:颅内血肿清除+去骨瓣减压术后6 h,可见血肿基本清除; D:术后20 d头颅MRI-Flair成像可见右侧颞叶脑软化灶,未见血肿复发 图 1 长期服用华法林导致脑出血患者手术前后影像学表现 |
3 讨论
本研究纳入近16年来本中心收治的134例凝血功能障碍所致的脑出血病例,其发病率远低于高血压脑出血,但病死率高达40.2%,远高于高血压脑出血。其中除血友病只有1例病例,不具有代表性之外,血液系统疾病与系统性红斑狼疮所导致的脑出血患者病死率最高,分别达到58.3%与66.6%。而服用抗血小板药物所致的脑出血患者病死率最低,只有29.6%。病因分析发现抗凝与抗血小板药物所致的脑出血病例占比最高,达到73.1%,是导致凝血功能障碍相关脑出血的主要病因,其他病因主要包括肝硬化失代偿期和血液系统疾病。根据对PT-INR比值、血小板计数及PT等指标的评估,患者入院时凝血功能均有不同程度异常,我们采取综合手段首先纠正凝血功能障碍。对于本组病例的并发症分析发现:肺部感染与血肿扩大都是凝血功能障碍所致脑出血的高发并发症。同时,亚组分析发现早期采取积极的手术治疗可以有效降低患者病死率,同时缩短患者住院时间。
FLIBOTTE等[6]报道住院7 d内,抗凝药使用患者的血肿扩大发生率为54%,未服抗凝药的自发性脑出血患者中血肿量扩大发生率仅为16%,两者差异明显,预示血肿早期的扩大可能是抗凝药所导致的脑出血预后不良的主要原因。口服抗凝药的抗凝血机制主要是干扰维生素K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的羧化,使其仅停留在前体阶段,使这些凝血因子无法活化,从而达到拮抗自发性凝血系统激活的目的[7]。抗血小板药物则主要包括血栓素A2 (TXA2)抑制剂(阿司匹林)、P2Y12受体拮抗剂(氯吡格雷)和非噻吩吡啶类(替格瑞洛)、糖蛋白Ⅱb/Ⅲa受体抑制剂(阿西单抗和替罗非班)以及磷酸二酯酶抑制剂(如双嘧达莫和西洛他唑)。虽然各类抗血小板药物作用的上游机制各不相同,但下游作用效应都是干扰血小板的聚集效应[8]。对于非依赖维生素K途径的抗凝药物,输注凝血酶原复合物与rFVⅡa被报道是行之有效的治疗手段[9]。目前国际上通用PT-INR作为最主要的临床指标来观察并纠正抗凝状态,口服抗凝药治疗通常应使PT-INR值保持在2.0~3.0。研究发现PT-INR值异常升高能够增加脑出血的风险,但PT-INR值异常和脑出血患者预后的联系尚未明确[10]。KURAMATSU等[11]报道:脑出血4 h内维持INR于1.3以下,同时控制收缩压160 mmHg以下,可有效降低血肿再扩大率。凝血因子Ⅶ、Ⅹ、凝血酶原复合物活性是PT-INR值变化的主要影响因素,而其对凝血因子Ⅸ减少的敏感性较差,故PT-INR在正常范围的患者也可能发生颅内再出血的情况,因此对凝血功能紊乱的患者不应只监测PT-INR,还需整体检测各项凝血因子的实时水平及变化[12]。除抗血栓药物对于凝血功能的影响外,研究表明患者发生脑出血后凝血功能较健康人明显下降,而随着脑出血病情的好转,患者凝血功能障碍逐渐恢复,这暗示着颅内血肿可能反作用于全身凝血系统[13]。
凝血功能障碍所致脑出血具有更高的血肿扩大率,其病情变化更加迅猛[14]。凝血异常的快速反转与卒中绿色通道、靶向介入和手术治疗、强制降压被联合推荐为脑出血早期最重要的处理原则之一[15]。临床实践中,我们特别针对这一特点采取以下措施:患者入院后立即停止口服华法林、阿司匹林或氯吡格雷等抗凝或抗血小板药物,同时针对有抗凝作用药物史的患者予以静脉注射维生素K(10 mg)治疗,随后根据PT-INR值进行治疗方案调整,快速改善患者的凝血功能。新鲜冰冻血浆包含了所有的凝血因子,大剂量使用能有效起到止血效果。因此,本组病例处理中对67例患者进行静脉输注新鲜冰冻血浆200~1 000 mL,同时给予12例患者冷沉淀10单位以快速纠正凝血功能。另外激活的血小板可以填充毛细血管内皮细胞之间的空隙,保持毛细血管的完整性,并减弱毛细血管的通透性,利于维持血脑屏障的稳态[16]。因此,对10例患者进行静脉输注浓缩血小板每次10~20个单位直至复查血小板升至50×109/L。对16例进行开颅血肿清除,10例神经内镜下血肿清除,3例脑室外引流以及95例保守治疗等治疗方案相结合。通过清除或减少血肿量,减轻血肿对周围血管的压迫效应,有利于降低再出血与血肿扩大的风险,改善预后。本研究区别性分析各型凝血功能障碍所致脑出血的疾病特点,以探究其个体化治疗方案。本组134例患者总病死率为40.3%,低于国外相关报道的病死率。在68例出血量为>30~80 mL的脑出血患者亚组分析中,32例采取保守治疗,其中23例患者死亡,病死率为71.8%; 36例采取手术治疗,其中16例患者死亡,病死率为44.4%。手术治疗组患者的病死率显著低于保守治疗组(P < 0.05),且平均住院时间也显著缩短(P < 0.05)。因此对于血肿量符合手术指征的患者,在纠正凝血功能的前提下,早期积极手术治疗同样能够有效降低凝血功能障碍所致的脑出血患者的病死率。
本研究为单中心回顾性研究,存在一定局限性:病例数不足,部分病种甚至只有几例,其数据不具有统计学意义; 单中心研究只代表某一区域的发表特点,其治疗方案有效性证据力度较弱。未来研究中,我们期望开展前瞻性扩区域多中心临床试验,进一步探讨凝血功能障碍所致脑出血的临床特点及有效治疗手段。
综上所述,针对凝血功能障碍性脑出血的患者,应在早期迅速纠正凝血功能,同时严密观察其凝血功能变化,根据患者颅内血肿大小进行早期积极的手术治疗,达到减少病死率,提高预后的目的。
| [1] | KAWANO-CASTILLO J, WARD E, ELLIOTT A, et al. Thrombelastography detects possible coagulation disturbance in patients with intracerebral hemorrhage with hematoma enlargement[J]. Stroke, 2014, 45(3): 683–688. DOI:10.1161/STROKEAHA.113.003826 |
| [2] | MA M M, MERETOJA A, CHURILOV L, et al. Warfarin-associated intracerebral hemorrhage: volume, anticoagulation intensity and location[J]. J Neurol Sci, 2013, 332(1/2): 75–79. DOI:10.1016/j.jns.2013.06.020 |
| [3] | ROSAND J, ECKMAN M H, KNUDSEN K A, et al. The effect of warfarin and intensity of anticoagulation on outcome of intracerebral hemorrhage[J]. Arch Intern Med, 2004, 164(8): 880–884. DOI:10.1001/archinte.164.8.880 |
| [4] | SJ BLOM L, H RDEMARK H G, LINDGREN A, et al. Management and prognostic features of intracerebral hemorrhage during anticoagulant therapy: a Swedish multicenter study[J]. Stroke, 2001, 32(11): 2567–2574. DOI:10.1161/hs1101.098523 |
| [5] | MAYER S A, BRUN N C, BEGTRUP K, et al. Efficacy and safety of recombinant activated factor Ⅶ for acute intracerebral hemorrhage[J]. N Engl J Med, 2008, 358(20): 2127–2137. DOI:10.1056/NEJMoa0707534 |
| [6] | FLIBOTTE J J, HAGAN N, O'DONNELL J, et al. Warfarin, hematoma expansion, and outcome of intracerebral hemorrhage[J]. Neurology, 2004, 63(6): 1059–1064. DOI:10.1212/01.WNL.0000138428.40673.83 |
| [7] |
鲁大双, 王启华, 崔杰, 等. 凝血功能障碍性脑出血的治疗[J].
海南医学院学报, 2012, 18(1): 74–76.
LU D S, WANG Q H, CUI J, et al. Treatment for cerebral hemorrhage due to coagulation disorders[J]. J Hainan Med Univ, 2012, 18(1): 74–76. |
| [8] | ROMERO N, LUPI K, CARTER D, et al. The role of double and triple therapy with direct oral anticoagulants in coronary artery disease, peripheral artery disease, and stroke[J]. Clin Ther, 2018, 40(11): 1907–1917. DOI:10.1016/j.clinthera.2018.09.014 |
| [9] | YASAKA M. New insights into nonvitamin K antagonist oral anticoagulants' reversal of intracerebral hemorrhage[J]. Front Neurol Neurosci, 2015, 37: 93–106. DOI:10.1159/000437116 |
| [10] | GREENBLATT D J, VON MOLTKE L L. Interaction of warfarin with drugs, natural substances, and foods[J]. J Clin Pharmacol, 2005, 45(2): 127–132. DOI:10.1177/0091270004271404 |
| [11] | KURAMATSU J B, GERNER S T, SCHELLINGER P D, et al. Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulation-related intracerebral hemorrhage[J]. JAMA, 2015, 313(8): 824–836. DOI:10.1001/jama.2015.0846 |
| [12] | TAKARADA K, SATO M, GOTO M, et al. Long-term PT-INR levels and the clinical events in the patients with non-valvular atrial fibrillation: a special reference to low-intensity warfarin therapy[J]. J Cardiol, 2014, 64(2): 127–132. DOI:10.1016/j.jjcc.2013.11.015 |
| [13] | YU Y, WU J, ZHAO W, et al. Calibrated automated thrombography for monitoring coagulation function in patients with intracerebral haemorrhage[J]. J Int Med Res, 2015, 43(3): 316–325. DOI:10.1177/0300060514565801 |
| [14] | BURCHELL S R, TANG J P, ZHANG J H. Hematoma expansion following intracerebral hemorrhage: mechanisms targeting the coagulation cascade and platelet activation[J]. Curr Drug Targets, 2017, 18(12): 1329–1344. DOI:10.2174/1389450118666170329152305 |
| [15] | CORDONNIER C, DEMCHUK A, ZIAI W, et al. Intracerebral haemorrhage: current approaches to acute management[J]. Lancet, 2018, 392(10154): 1257–1268. DOI:10.1016/s0140-6736(18)31878-6 |
| [16] | BRAILOIU E, BARLOW C L, RAMIREZ S H, et al. Effects of platelet-activating factor on brain microvascular endothelial cells[J]. Neuroscience, 2018, 377: 105–113. DOI:10.1016/j.neuroscience.2018.02.039 |



