冠状动脉为维持心脏正常生理功能有着重要作用,而冠脉血管平滑肌在调节冠脉血流及结构支持上起着至关重要的作用,因此了解冠脉血管平滑肌细胞的来源和分化过程的机制具有重大意义。EpiCs由前体心外膜细胞发育而来,是覆盖在脊椎动物心脏最外面的上皮细胞层,在心脏发育过程中起着重要作用,抑制心外膜生长后可导致异常的心肌与冠状动脉发育[1],EpiCs在发育过程中经历上皮细胞向间充质细胞转化(epithelial-to-mesenchymal transition,EMT),并在心外膜下形成心外膜来源的衍生细胞(epicardially derived cells,EPDCs),可在多种因素作用下向冠脉平滑肌细胞分化[2-4]。有研究证实部分冠状动脉发育始于内皮细胞在心外膜下区域形成的原始管道,原始管道通过内皮细胞出芽作用自心外膜下延伸至心内膜,最终连接到主动脉获得血流,之后内皮细胞促进其周围的间质细胞向血管平滑肌细胞分化,并最终形成成熟的冠状动脉[5-7]。最近的研究提示心外膜细胞可作为心肌梗死后进行心脏细胞移植的候选细胞,因为它们具有多种特殊的特性,包括在心脏发育过程中作为祖细胞的作用[8]。但迄今为止,很少有研究探讨心外膜细胞及其衍生物作为细胞移植的候选材料。这在一定程度上是由于对心外膜细胞体内分化机制的不了解和其特异性的分离培养技术所造成的[9]。本研究旨在使用Transwell共培养法,探讨冠脉发育过程中,血管内皮细胞是否可以影响EpiCs的分化从而调节冠状动脉的发育,为心脏疾病的治疗提供新的思路。
1 材料与方法 1.1 材料与试剂细胞培养12孔细胞培养板、0.4 μm 12孔Transwell小室购自Corning公司;高糖DMEM培养基、胎牛血清(FBS)购自Gibco公司;兔α-SMA抗体、兔Myh11抗体、兔Tbx18抗体、兔WT1抗体购自Abcam公司;Cy3标记山羊抗兔IgG购自北京康为世纪生物科技有限公司;Trizol试剂、反转录试剂盒购自TaKaRa公司;人bFGF ELISA试剂盒购自深圳欣博盛生物科技有限公司;胰蛋白酶、多聚甲醛、Triton X-100等试剂购自Beyotime公司;鼠尾胶原蛋白Ⅰ型购自北京索莱宝科技有限公司。
1.2 实验动物7~8周龄成年C57BL/6小鼠60只,雌雄各半,体质量25~30 g,饲养于重庆医科大学IVC级环境动物房,饲养室内温度保持于22~26 ℃,相对湿度维持在40%~60%。将C57BL/6小鼠以1雄2雌于22:00合笼,次日8:00观察,若见阴栓记为胚龄E0.5。所有实验严格执行国家卫计委关于实验动物的饲养原则。
1.3 原代心外膜祖细胞的提取与培养根据以前研究报道的方法,我们对原代心外膜祖细胞进行提取与培养。在孕鼠E12.5时提取心外膜祖细胞,将子宫分离入4 ℃无菌PBS(0.01 mol/L,pH=7.2),再用无菌眼科镊从子宫中分离出完整胚胎,在倒置光学显微镜下自胚胎中分离出心脏,并用无菌眼科镊剔除掉心房、流出道及肺静脉组织,保留完整心室组织。将心室组织放入预先用(高压灭菌后)1%明胶覆盖过的12孔细胞培养板里,用含10%FBS的DMEM高糖培养基、100 U/mL青霉素与100 ng/mL链霉素进行培养。24 h后,EpiCs自心脏组织边缘爬出,将心脏组织移除,继续培养EpiCs 48 h。细胞每2天换液1次。用相差显微镜观察心外膜祖细胞的生长状态。
1.4 Transwell共培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购自北京北纳创联生物技术研究院。用含10%FBS的DMEM高糖培养基、100 U/mL青霉素与100 ng/mL链霉素进行培养,每2天换液1次。
在Transwell共培养中使用膜孔径0.4 μm的12孔细胞培养板进行实验。实验分为对照组和共培养组,共培养组将HUVECs培养至第7~8代后按1×105/mL接种入Transwell共培养系统上室,将EpiCs按2×104/mL接种入下室。对照组上室不接种HUVECs,下室按2×104/mL接种EpiCs。上下室均用无血清高糖DMEM培养基进行培养,每2天换液1次。
1.5 免疫荧光染色将EpiCs用PBS漂洗5 min 3次,用4%多聚甲醛室温固定15 min,0.25%TritonX-100破膜5 min,然后10%山羊血清室温封闭1 h,一抗WT1(1 :50,Abcam)、Tbx18(1 :100,Abcam)、α-SMA(1 :200,Abcam)、Myh11(1 :100,Abcam)4 ℃孵育过夜。次日将EpiCs用PBS漂洗5 min3次,二抗在37 ℃避光孵育45 min,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)室温避光孵育5 min。在激光共聚焦显微镜下采集图像,并对每组1000个细胞中α-SMA+/Myh11+细胞进行计数。
1.6 qRT-PCR检测使用TRIzol法提取心外膜祖细胞的总RNA,用PrimeScript Reverse Transcriptase试剂盒将1 μg RNA反转录为cDNA,之后在C1000 thermal cycler用以下步骤执行qPCR:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 30 s;72 ℃ 30 s,重复39个循环。每次反应中都使用SYBR premix Ex Taq,以GAPDH为对照。引物序列如下:Tbx18:正义链5′-TCGATACAGCACATCCTTGG-3′,反义链5′-GCTGCTCACACTCACGTAGG-3′;WT1:正义链5′-ATCCGCAACCAAGGATACAG-3′, 反义链5′-CCTC-GTGTTTGAAGGAATGG-3′;α-SMA:正义链5′-GGGA-GTAATGGTTGGAATGG-3′, 反义链5′-GGTGATGATG-CCGTGTTCTA-3′;Myh11:正义链5′-CAGTGACAAGGT-CCACAAGC-3′, 反义链5′-CAAGGGAAGCCACATCT-TTG-3′。通过2-ΔΔCT计算方法将基因表达水平标准化至GAPDH水平得到相对目的基因表达水平。
1.7 ELISA实验收集HUVECs与EpiCs在Transwell共培养下的培养基,离心300×g 5 min,于-80 ℃保存。将收集的培养基(100 μL/孔)加入bFGFs抗体预包被酶标板中37 ℃孵育90 min,使用洗涤液洗5次,生物素化抗体工作液(100 μL/孔)37 ℃孵育60 min,酶结合物工作液(100 μL/孔)避光37 ℃孵育30 min,显色底物(TMB,100 μL/孔)避光37 ℃孵育15 min,加入终止液(100 μL/孔)在Bio Tek-SYNERGY/HT多功能酶标仪上读取结果。
1.8 胶原凝胶收缩实验使用0.01 mol/L NaOH、PBS(×10,pH7.0)与鼠尾胶原蛋白Ⅰ型溶液配制胶原凝胶溶液,之后加入预先用DMEM重悬的EpiCs,使胶原蛋白Ⅰ型的终浓度达到1 mg/mL,细胞终浓度达到1×105/mL。将细胞胶原混合液加入12孔细胞培养板,并在室温下静置30 min待胶凝固。之后每孔加入1 mL无血清DMEM,并在37 ℃下培养6 h。吸出DMEM并每孔加入1 mmol/L收缩激动剂卡巴胆碱,在37 ℃下培养12 h后观察胶原蛋白凝胶面积的变化,用数码相机采集图像并用Image Pro Plus 6.0计算胶原凝胶面积变化。
1.9 统计学处理所有计量资料用x±s形式表示,应用SPSS 23.0统计软件进行分析,两组间的计量资料比较用独立样本t检验。检验水准α=0.05。
2 结果 2.1 心外膜祖细胞的培养及鉴定自组织提取EpiCs后培养24 h,可见EpiCs从心脏组织边缘爬出,以铺路石样向外生长。在移除心脏组织后,EpiCs继续生长并填补移除组织后的空隙,在高倍镜下观察可见细胞呈上皮样细胞形态(图 1)。继续培养48 h后,对细胞进行免疫荧光染色可见其阳性表达EpiCs标志物WT1、Tbx18(图 2),用qRT-PCR证实标志物mRNA水平的表达(P < 0.01,图 3),结果提示EpiCs成功提取并培养。
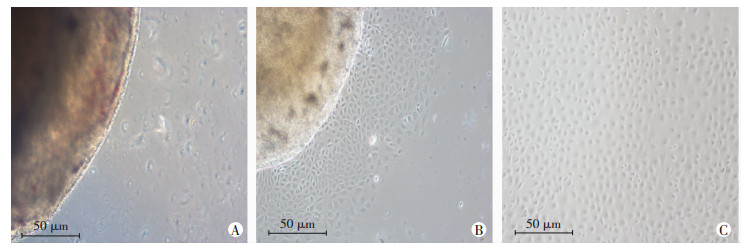
|
| A:1 h;B:12 h;C:24 h 图 1 E12.5原代EpiCs提取与培养 |

|
| 图 2 细胞免疫荧光染色观察EpiCs标志物WT1和Tbx18的阳性表达 |
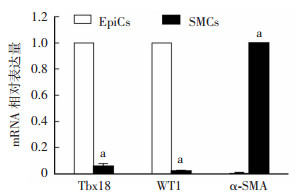
|
| a:P < 0.01,与EpiCs比较 图 3 荧光定量PCR检测培养细胞与血管平滑肌细胞中心外膜标记物(Tbx18和WT1)和血管平滑肌细胞标记物(α-SMA)mRNA的表达 (n=3,x±s) |
2.2 共培养后诱导心外膜祖细胞向冠脉血管平滑肌细胞的分化
细胞免疫荧光染色结果见图 4、5。在Transwell共培养后,Myh11阳性的EpiCs细胞为(45.63±4.85)%,显著高于对照组[(3.70±1.49)%,P < 0.01,n=3];α-SMA阳性EpiCs细胞为(34.20±3.38)%, 显著高于对照组[(1.73±0.85)%,P < 0.01,n=3]。同时qRT-PCR也验证了此结果[Myh11(1.64±0.63);α-SMA(1.38±0.59),P < 0.01,n=3]。提示HUVECs在与EpiCs共培养后可促进EpiCs向血管平滑肌细胞的分化。
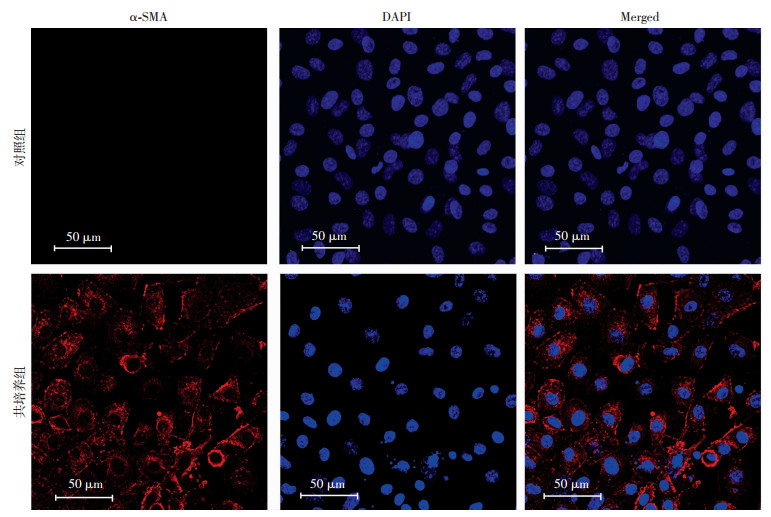
|
| 图 4 细胞免疫荧光染色观察HUVECs与EpiCs共培养诱导α-SMA的表达 |
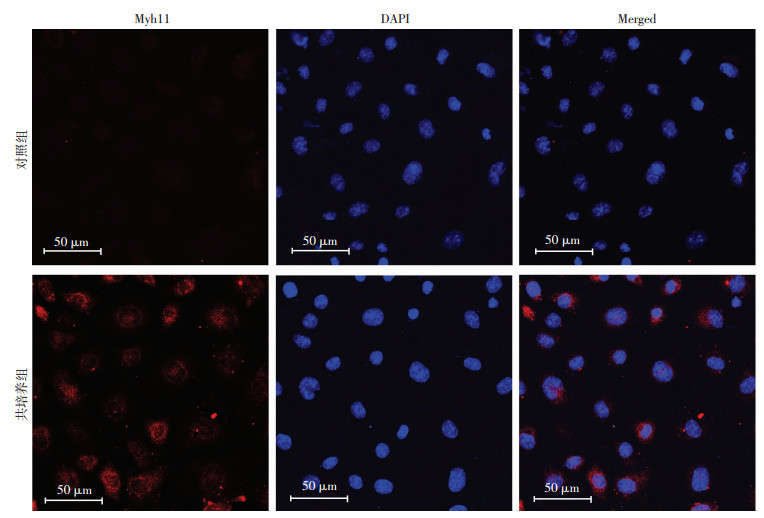
|
| 图 5 细胞免疫荧光染色观察HUVECs与EpiCs共培养诱导Myh11的表达 |
2.3 共培养后心外膜祖细胞收缩能力增强
为进一步确定是否共培养促进了EpiCs向血管平滑肌细胞分化,通过胶原凝胶收缩实验检测共培养后EpiCs的收缩能力,在加入收缩激动剂卡巴胆碱后比较加药前后胶原凝胶面积的变化,可见共培养组胶原凝胶面积减小(图 6),说明在与HUVECs共培养后可增强EpiCs收缩能力,进一步提示了共培养可促进EpiCs向血管平滑肌细胞分化。
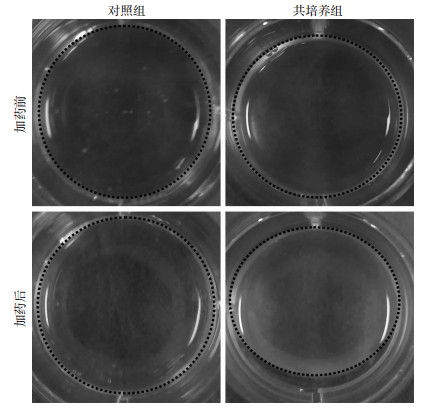
|
| 图 6 HUVECs与EpiCs共培养EpiCs收缩能力增强的观察 |
2.4 共培养后诱导bFGF的分泌
ELISA实验结果显示,Transwell共培养后的条件培养基中bFGFs因子[(304.96±52.91)pg/mL]含量较对照组[(87.64±8.78)pg/mL]显著增高(P < 0.01),提示共培养后促进了bFGFs的分泌。
3 讨论EpiCs是具有多向分化潜能的多能间充质细胞,在多种因素作用下,可向起搏细胞、血管内皮细胞及血管平滑肌细胞分化[10-13]。在冠脉发育中,心外膜是冠脉血管平滑肌细胞的重要来源[14];在成年小鼠心梗后24 h,可见EPDCs表达成纤维细胞与血管平滑肌细胞的表型Fsp1、α-SMA、FN1等,并可促进心脏损伤后血管的生长与存活[15];与正常小鼠相比,在Tbx18-/-小鼠可见与血管发育有关的79个基因的表达改变,包括Vegfa、Lama4、Angptl2等,并且出现冠状动脉发育的异常[16]。本研究提示血管内皮细胞可通过分泌bFGFs影响心外膜细胞向血管平滑肌细胞的分化。
内皮细胞可以分泌多种生长因子调节周围间质细胞的招募、迁移、分化、增殖等,包括PDGF、FGFs、TGF-β等,在分化、迁移、接合及成熟等血管发育过程中都起着重要作用[17-18]。FGFs可以调节人体内多个发育过程,包括大脑、血管、肢体的发育[19],bFGFs可促进肾小管上皮细胞EMT进程[20];在EpiCs中RXRα基因突变小鼠出现bFGFs的下调从而导致冠脉发育异常及α-SMA表达的减少[21];在抑制了FGFR信号通路后可导致前心外膜细胞EMT过程受阻且α-SMA表达减少,而加入bFGFs后可促进前心外膜细胞EMT从而影响心外膜细胞向冠脉的分化[3]。因此bFGFs对EpiCs的EMT进程和冠脉的发育有着重要作用,但血管内皮细胞是否通过这一方式影响EpiCs的分化现在仍不清楚。
Transwell共培养是用特殊的共培养工具进行细胞共培养研究,在Transwell小室底层有一张通透性聚碳酸酯膜,可允许细胞分泌的生长因子透过此膜作用于另一细胞,从而探讨两种细胞的相互作用情况。为探求EpiCs向冠脉平滑肌细胞分化的机制,我们使用E12.5d的C57BL/6小鼠成功培养出高纯度的EpiCs,并将HUVECs种入Transwell上室,将EpiCs种入下室,探究两种细胞的相互作用,研究结果提示HUVECs可促进EpiCs中平滑肌细胞特有表型α-SMA、Myh11的表达。同时提取Transwell共培养后的条件培养基,测试培养基中bFGFs的含量,发现相较于普通的EpiCs培养基,共培养后的条件培养基bFGFs含量增高,提示bFGFs在EpiCs向冠脉平滑肌细胞的分化过程中起重要作用。
综上所述,本实验成功培养了EpiCs,通过Transwell共培养技术得出了内皮细胞可通过分泌bFGFs影响EpiCs向冠脉平滑肌细胞分化的结论。该结论为进一步探索EpiCs向冠状动脉平滑肌细胞分化的机制奠定了一定基础,但EpiCs向冠状动脉平滑肌细胞分化是一个相当复杂的生理过程,涉及众多信号通路,此过程的具体机制仍需进一步研究。
| [1] | GITTENBERGER-DE GROOT A C, VRANCKEN PEETERS M P, BERGWERFF M, et al. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation[J]. Circ Res, 2000, 87(11): 969–971. DOI:10.1161/01.RES.87.11.969 |
| [2] | JING X, GAO Y, XIAO S, et al. Hypoxia induced the differentiation of Tbx18-positive epicardial cells to CoSMCs[J]. Sci Rep, 2016, 6: 30468. DOI:10.1038/srep30468 |
| [3] | PENNISI D J, MIKAWA T. FGFR-1 is required by epicardium-derived cells for myocardial invasion and correct coronary vascular lineage differentiation[J]. Dev Biol, 2009, 328(1): 148–159. DOI:10.1016/j.ydbio.2009.01.023 |
| [4] | QIN Q, WANG J, YAN Y, et al. Angiotensin Ⅱinduces the differentiation of mouse epicardial progenitor cells into vascular smooth muscle-like cells[J]. Biochem Biophys Res Commun, 2016, 480(4): 696–701. DOI:10.1016/j.bbrc.2016.10.122 |
| [5] | RATAJSKA A, CZARNOWSKA E, CISZEK B, et al. Embryonic development of the proepicardium and coronary vessels[J]. Int J Dev Biol, 2008, 52(2/3): 229–236. DOI:10.1387/ijdb.072340ar |
| [6] | HERBERT S P, STAINIER D Y. Molecular control of endothelial cell behaviour during blood vessel morphogenesis[J]. Nat Rev Mol Cell Biol, 2011, 12(9): 551–564. DOI:10.1038/nrm3176 |
| [7] | GAENGEL K, GENOVE G, ARMULIK A, et al. Endothelial-mural cell signaling in vascular development and angiogenesis[J]. Arterioscler Thromb Vasc Biol, 2009, 29(5): 630–638. DOI:10.1161/ATVBAHA.107.161521 |
| [8] | RAMJEE V, LI D, MANDERFIELD L J, et al. Epicardial YAP/TAZ orchestrate an immunosuppressive response following myocardial infarction[J]. J Clin Invest, 2017, 127(3): 899–911. DOI:10.1172/JCI88759 |
| [9] | RAO K S, SPEES J L. Harnessing epicardial progenitor cells and their derivatives for rescue and repair of cardiac tissue after myocardial infarction[J]. Curr Mol Biol Rep, 2017, 3(3): 149–158. DOI:10.1007/s40610-017-0066-6 |
| [10] | AZAMBUJA A P, PORTILLO-SANCHEZ V, RODRIGUES M V, et al. Retinoic acid and VEGF delay smooth muscle relative to endothelial differentiation to coordinate inner and outer coronary vessel wall morphogenesis[J]. Circ Res, 2010, 107(2): 204–216. DOI:10.1161/CIRCRESAHA.109.214650 |
| [11] | SMITH C L, BAEK S T, SUNG C Y, et al. Epicardial-derived cell epithelial-to-mesenchymal transition and fate specification require PDGF receptor signaling[J]. Circ Res, 2011, 108(12): e15–26. DOI:10.1161/CIRCRESAHA.110.235531 |
| [12] | WIESE C, GRIEKKAMP T, AIRIK R, et al. Formation of the sinus node head and differentiation of sinus node myocardium are independently regulated by Tbx18 and Tbx3[J]. Circ Res, 2009, 104(3): 388–397. DOI:10.1161/CIRCRESAHA.108.187062 |
| [13] | LI J, LI S H, WU J, et al. Young bone marrow Sca-1 cells rejuvenate the aged heart by promoting epithelial-to-mesenchymal transition[J]. Theranostics, 2018, 8(7): 1766–1781. DOI:10.7150/thno.22788 |
| [14] | MAJESKY M W. Development of coronary vessels[J]. Curr Top Dev Biol, 2004, 62: 225–259. DOI:10.1016/S0070-2153(04)62008-4 |
| [15] | ZHOU B, HONOR L B, HE H, et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors[J]. J Clin Invest, 2011, 121(5): 1894–1904. DOI:10.1172/JCI45529 |
| [16] | WU S P, DONG X R, REGAN J N, et al. Tbx18 regulates development of the epicardium and coronary vessels[J]. Dev Biol, 2013, 383(2): 307–320. DOI:10.1016/j.ydbio.2013.08.019 |
| [17] | HIRSCHI K K, ROHOVSKY S A, D'AMORE P A, et al. PDGF, TGF-beta, and heterotypic cell-cell interactions mediate endothelial cell-induced recruitment of 10T1/2 cells and their differentiation to a smooth muscle fate[J]. J Cell Biol, 1998, 141(3): 805–814. DOI:10.1083/jcb.141.3.805 |
| [18] | MERFELD-CLAUSS S, LUPOV I P, LU H, et al. Adipose stromal cells differentiate along a smooth muscle lineage pathway upon endothelial cell contact via induction of activin A[J]. Circ Res, 2014, 115(9): 800–809. DOI:10.1161/CIRCRESAHA.115.304026 |
| [19] | BEENKEN A, MOHAMMADI M. The FGF family: biology, pathophysiology and therapy[J]. Nat Rev Drug Discov, 2009, 8(3): 235–253. DOI:10.1038/nrd2792 |
| [20] | STRUTZ F, ZEISBERG M, ZIYADEH F N, et al. Role of basic fibroblast growth factor-2 in epithelial-mesenchymal transformation[J]. Kidney Int, 2002, 61(5): 1714–1728. DOI:10.1046/j.1523-1755.2002.00333.x |
| [21] | MERKI E, ZAMORA M, RAYA A, et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation[J]. Proc Natl Acad Sci U S A, 2005, 102(51): 18455–18460. DOI:10.1073/pnas.0504343102 |



