淋巴瘤系原发于淋巴结或结外淋巴组织的恶性肿瘤,分为非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)和霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)两类。NHL依据疾病侵袭性不同分为惰性淋巴瘤(iNHL)、侵袭性淋巴瘤及高度侵袭性淋巴瘤。iNHL以惰性B细胞淋巴瘤(indolent B-cell nontlodgkin’s lymphoma, B-iNHL)多见,约占NHL的1/3[1]。主要包括滤泡性淋巴瘤(follicular lymphoma,FL)Ⅰ~Ⅱ级、慢性淋巴细胞性白血病(chronic lymphocytic leukemia,CLL)、结内边缘区淋巴瘤(nodal marginal zone lymphoma,NMZL)、脾边缘区淋巴瘤(splenic marginal zone lymphoma,SMZL)、黏膜相关淋巴组织结外边缘区淋巴瘤(mucosa associated lymphoid tissue,MALT)、毛细胞白血病(hairy cell leukemia,HCL)、淋巴浆细胞性淋巴瘤/华氏巨球蛋白血症(lympho plasmacytic lymphoma/waldenstro mmacroglobulinemia,LPL/WM)等[2]。18F-FDG PET/CT(positron emission tomography/computed tomography)是一种新型的分子影像技术,特异性高、敏感性强,其在淋巴瘤的分期、疗效评价中的价值已被肯定,但治疗前18F-FDG PET/CT能否预测B-iNHL患者的预后尚不明确[3-4]。最大标准摄取值(maximum standardized uptake value, SUVmax)是PET/CT最常用的代谢参数,是一种基于肿瘤代谢程度的半定量参数,有关SUVmax对B-iNHL预后的价值目前尚不明确。本研究将对本院收治的98例B-iNHL患者的临床资料进行分析,探讨治疗前SUVmax等临床因素对B-iNHL预后的判定价值。
1 资料与方法 1.1 病例资料收集2012-2017年本院收治的293例B-iNHL患者临床资料,治疗前行18F-FDG PET/CT检查98例,占33.4%。入组标准:①年龄≥18岁;②病理确诊的初诊B-iNHL;③PET/CT检查前未接受任何肿瘤相关治疗;④有完整的病历资料及随访结果;⑤既往无其他恶性肿瘤病史。排除标准:①伴有严重的心脑血管疾病,如难治性心功能不全等;②伴有活动性感染或不可控制的慢性感染。
1.2 病理类型、分期、治疗98例B-iNHL患者的病理诊断参照2008、2016年版WHO造血和淋巴组织肿瘤分类标准。CLL/SLL患者临床分期采用Rai及Binet分期系统,FL、NMZL、LPL、SMZL、MALT患者临床分期采用Ann Arbor分期系统。危险分层参照国际预后指数(international prognostic index,IPI)评分。74例CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)/CHOP样±R(美罗华)方案治疗,3例单纯放疗,21例观察等待。
1.3 随访随访终点时间为2018年9月1日,中位随访26个月。无进展生存期(progression free survival,PFS)为疾病确诊至首次出现疾病进展、复发、任何原因导致的死亡或随访截止的时间。总生存期(overall survival,OS)为疾病确诊至任何原因导致的死亡或随访截止的时间。
1.4 统计学分析采用SPSS 19.0统计软件,计数资料以频数和百分比表示,进行χ2检验;非正态分布的计量资料采用Mann-Whitney U秩和检验;病灶SUVmax与Ki67表达之间的相关性采用Spearman相关分析;采用受试者工作特征(ROC)曲线获得SUVmax最佳界值点,并计算曲线下面积(AUC);生存分析采用Kaplan-Meier法,组间比较采用Log-Rank检验;多因素分析采用COX比例风险模型。检验水准:α=0.05。
2 结果 2.1 一般资料98例行18F-FDG PET/CT检查B-iNHL患者中,男性52例,女性46例,比例为男:女=1.13 :1。各种病理类型的中位发病年龄均在50岁以上,发病高峰在50~70岁,差异无统计学意义(P > 0.05,表 1)。
| 病理类型 | 例数(%) | 年龄(M)/岁 | 男:女 |
| FL | 43(43.9) | 51 (28~69) | 1.15:1(23:20) |
| MZL | 41(41.8) | 57 (33~74) | 1:1.05(20:21) |
| MALT | 29(29.6) | 58 (33~74) | 1:1.23(13:16) |
| NMZL | 11 (11.2) | 53 (37~67) | 1.2:1(6:5) |
| SMZL | 1(1.0) | 62(62) | 1:0 |
| CLL/SLL | 11(11.2) | 59 (32~74) | 1.75:1(7:4) |
| LPL/WM | 3(3.1) | 64 (59~66) | 2:1 |
2.2 B-iNHL患者SUVmax与Ki67相关分析
结果显示,B-iNHL患者SUVmax与Ki67表达程度呈正相关(r=0.217,P=0.035)。
2.3 不同病理类型B-iNHL患者SUVmax比较98例B-iNHL患者中位SUVmax 6.8(1.8~25.4),其中FL 43例,中位SUVmax 7.8(3.6~20.3),非FL(MZL、CLL/SLL、LPL) 55例,中位SUVmax 5.3(1.8~25.4)。FL患者中位SUVmax较非FL患者显著升高(P=0.001,表 2)。
| 病理类型 | 例数(%) | 中位SUVmax | P值 |
| FL | 43(43.9) | 7.8(3.6~20.3) | |
| 非FL | 55(56.1) | 5.3(1.8~25.4) | 0.001 |
| MZL | 41(41.8) | 5.5(1.8~25.4) | |
| CLL/SLL | 11(11.2) | 3.3(1.8~21.2) | |
| LPL | 3 (3.1) | 6.1(3.3~9.21) |
2.4 SUVmax判断预后的界值点
以PFS作为阳性事件,采用受试者工作特征(ROC)曲线获得SUVmax最佳界值点。98例B-iNHL患者SUVmax界值点为7.25;43例FL患者SUVmax界值点为7.55;55例非FL患者SUVmax界值点为5.15,差异均有统计学意义(P < 0.05,表 3)。
| 患者 | n | SUVmax界值点 | AUC | 95% CI | P值 |
| B-iNHL | 98 | 7.25 | 0.764 | 0.669~0.858 | 0.001 |
| FL | 43 | 7.55 | 0.751 | 0.600~0.902 | 0.007 |
| 非FL | 55 | 5.15 | 0.783 | 0.661~0.905 | 0.004 |
2.5 预后影响因素的单因素分析
单因素分析结果显示:临床分期Ⅲ~Ⅳ期、SUVmax > 7.25、结外侵犯病灶≥2个、骨髓侵犯是B-iNHL患者PFS的预后危险因素;LDH > 226 U/L、SUVmax > 7.25、IPI评分 > 3分、肿瘤直径≥6cm是患者OS的预后危险因素,差异有统计学意义(P < 0.05,表 4)。
| 因素 | 例数 | 3年PFS(%) | P值 | 3年OS(%) | P值 |
| 性别 | |||||
| 男 | 52 | 64.3 | 0.322 | 87.2 | 0.109 |
| 女 | 46 | 74.1 | 94.5 | ||
| 年龄/岁 | |||||
| ≤60 | 70 | 68.4 | 0.748 | 90.9 | 0.784 |
| > 60 | 28 | 70.2 | 89.3 | ||
| 临床分期 | |||||
| Ⅰ~Ⅱ | 38 | 84.8 | 0.032 | 97.4 | 0.068 |
| Ⅲ~Ⅳ | 60 | 61 | 86.6 | ||
| LDH | |||||
| 正常 | 77 | 70.8 | 0.127 | 96.1 | 0.009 |
| 升高 | 21 | 66.7 | 69.1 | ||
| β2微球蛋白 | |||||
| 正常 | 14 | 38.9 | 0.783 | 100.0 | 0.235 |
| 升高 | 84 | 71.6 | 84.0 | ||
| 结外侵犯病灶 | |||||
| 0~1个 | 68 | 73.6 | 0.013 | 93.0 | 0.551 |
| ≥2个 | 30 | 58.8 | 85.3 | ||
| 肿瘤直径/cm | |||||
| <6 | 82 | 71.3 | 0.153 | 94.2 | 0.001 |
| ≥6 | 16 | 55.6 | 73.1 | ||
| 骨髓侵犯 | |||||
| 无 | 63 | 74.7 | 0.021 | 96.8 | 0.141 |
| 有 | 35 | 60.1 | 80.9 | ||
| IPI评分 | |||||
| 0~2 | 71 | 73.7 | 0.053 | 97.2 | 0.001 |
| 3~5 | 27 | 57.3 | 72.5 | ||
| SUVmax | |||||
| ≤7.25 | 59 | 85.9 | 0.001 | 98.3 | 0.002 |
| > 7.25 | 39 | 43.8 | 79.0 | ||
| Ki67 | |||||
| <30 | 54 | 63.3 | 0.471 | 92.6 | 0.798 |
| ≥30 | 44 | 76.5 | 87.7 |
2.6 预后影响因素的多因素分析
COX多因素分析结果显示SUVmax > 7.25是影响PFS及OS的独立预后危险因素(P < 0.05,表 5、6)。
| 因素 | B | SE | Wald | 95% CI | P值 |
| 临床分期Ⅲ~Ⅳ期 | 0.164 | 0.590 | 0.077 | 0.370~3.747 | 0.781 |
| SUVmax > 7.25 | 1.711 | 0.471 | 13.167 | 2.196~13.937 | 0.001 |
| 结外侵犯病灶数≥2个 | 0.146 | 0.474 | 0.095 | 0.457~2.933 | 0.758 |
| 骨髓侵犯 | 0.966 | 0.510 | 3.584 | 0.966~7.140 | 0.058 |
| 因素 | B | SE | Wald | 95% CI | P值 |
| LDH > 226 U/L | 0.96 | 0.851 | 1.271 | 0.492~13.846 | 0.260 |
| SUVmax > 7.25 | 2.263 | 1.082 | 4.371 | 1.152~80.129 | 0.037 |
| IPI评分 > 3分 | 1.409 | 1.004 | 1.968 | 0.571~29.299 | 0.161 |
| 肿瘤直径≥6 cm | 0.787 | 0.742 | 1.124 | 0.513~9.410 | 0.289 |
2.7 治疗前SUVmax与PFS、OS关系
高SUVmax组(SUVmax > 7.25)39例,低SUVmax组(SUVmax ≤7.25)59例。3年PFS:高SUVmax组43.8%,低SUVmax组85.9%,差异有统计学意义(P=0.001,图 1);3年OS率:高SUVmax组79.0%,低SUVmax组98.3%,差异有统计学意义(P=0.002,图 2)。
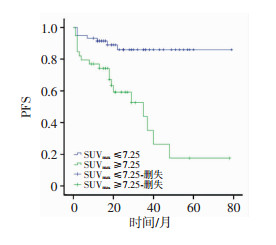
|
| 图 1 低SUVmax与高SUVmax两组患者的PFS生存曲线 |
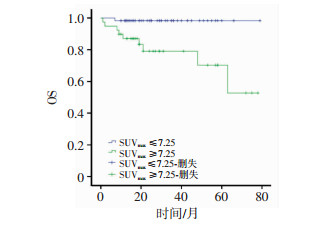
|
| 图 2 低SUVmax与高SUVmax两组患者的OS生存曲线 |
2.8 治疗前SUVmax与死亡的关系
与疾病相关死亡10例,低SUVmax组1例,病死率1.7%(1/59),高SUVmax组9例,病死率23.1%(9/39),差异有统计学意义(P=0.001)。
3 讨论B-iNHL是一组恶性程度低、进展缓慢、预后较好的淋巴瘤,约占非霍奇金淋巴瘤的1/3[1]。本研究纳入98例B-iNHL患者,男女比例为1.13 :1,中位发病年龄均在50岁以上,发病高峰均在50~70岁,年龄及性别分布差异无统计学意义。病理类型以FL(43.9%)多见,其次是MZL(41.8%)、CLL/SLL(11.2%)、LPL/WM(3.1%),以上特点与文献[5]报道一致。
PET/CT全身显像目前以18F标记的氟代脱氧葡萄糖(18F-FDG)应用最为广泛,SUVmax是衡量18F-FDG摄取量的常用指标。Ki67作为一种与细胞周期密切相关的核抗原,是评价淋巴瘤细胞增殖活性的指标,能够有效区分惰性与侵袭性淋巴瘤。HASHMI等[6]研究发现,多数MZL、FL Ⅰ~Ⅱ级患者Ki67 < 30%。张建华等[7]研究发现,Ki-67表达水平与SUVmax呈正相关。本研究发现98例B-iNHL患者的SUVmax与Ki67呈正相关,说明SUVmax也能反映病灶增殖性,SUVmax越大,侵袭性越高,与文献[8]报道一致。
研究表明,不同病理类型的淋巴瘤SUVmax不同,惰性淋巴瘤在18F-FDG PET/CT上常表现为病灶对18F-FDG低摄取、SUVmax < 10[9-11]。本研究中不同B-iNHL病理类型的淋巴瘤SUVmax不同。与总体98例B-iNHL患者SUVmax比较,FL患者SUVmax中位值、预后界值高于总体,非FL中位SUVmax与预后界值显著低于总体。因此,临床上应依据SUVmax界值分别判定B-iNHL的预后。
目前,国内外对治疗前SUVmax在淋巴瘤预后判断中的价值存在争议,戴云秀等[12]回顾性分析48例FL患者治疗前18F-FDG PET/CT资料,结果表明SUVmax与患者的不良预后相关。而TYCHYJ-PINEL等[13]、丁重阳等[14]分别回顾性分析59、30例治疗前行PET/CT检查的FL患者的临床资料,结果表明治疗前SUVmax与PFS、OS无相关性(P > 0.05)。具体原因可能与患者的纳入与排除标准、样本量小或相关指标阈值不同有关。本研究单因素分析显示临床分期Ⅲ~Ⅳ期、SUVmax > 7.25、结外侵犯病灶≥2个、骨髓侵犯是患者PFS预后因素;LDH > 226 U/L、SUVmax > 7.25、IPI评分 > 3分、肿瘤直径≥6 cm是患者OS预后因素,差异有统计学意义(P < 0.05)。多因素分析显示,只有SUVmax > 7.25是影响B-iNHL PFS及OS的独立预后危险因素。表明SUVmax对B-iNHL患者预后的判断具有一定的参考价值,且优于临床分期、LDH、肿瘤大小及结外受累情况。
本研究发现,与低SUVmax组相比,高SUVmax组患者PFS、OS缩短,死亡率升高,预后差。这与惰性淋巴瘤恶性程度低、进展缓慢、预后较好的临床特点不符,而是符合侵袭性淋巴瘤的临床特点,与临床转化相关,提示SUVmax具有预测惰性淋巴瘤向侵袭性淋巴瘤转化的作用,临床上应高度重视。
B-iNHL具有异质性,病理类型不同,预后不同。5%~10% B-iNHL可发生组织类型向侵袭性淋巴瘤转化,其恶性程度高,进展快,预后较差[15]。目前,临床上多通过浅表淋巴结等易于获取的病灶部位行病理检查,确诊淋巴瘤后行18F-FDG PET/CT明确分期,但可能会使已经或正在发生向侵袭性转化的B-iNHL漏诊,因此,对于多发淋巴结肿大的高度怀疑淋巴瘤或恶性肿瘤的患者,可以先行18F-FDG PET/CT检查,针对全身病灶SUVmax摄取情况选择靶病灶行病理检查,提高诊断的准确率,减少漏诊率,指导临床个体化治疗,改善预后,延长生存期。而对于治疗效果差,疾病进展迅速的患者,可以行18F-FDG PET/CT辅助诊断其是否向侵袭性转化,必要时进行再次活检明确,及时调整治疗方案。
综上所述,SUVmax是B-iNHL患者PFS及OS的独立预后危险因素,高SUVmax的患者PFS、OS明显缩短,病死率升高,预后差。临床上可通过检测SUVmax来监测B-iNHL向侵袭性淋巴瘤转化,从而指导临床个体化治疗。SUVmax有望成为惰性B细胞淋巴瘤预后评估系统的重要因素。近年来,有学者通过计算病灶的总体代谢体积(MTV)来预测淋巴瘤患者的预后,本研究因条件有限,未能计算MTV,后续将进一步研究以证实治疗前MTV与B-iNHL预后的关系。
| [1] | MONTGOMERY N D, MATHEWS S P. Transformation in low-grade B-cell neoplasms[J]. Surg Pathol Clin, 2016, 9(1): 79–92. DOI:10.1016/j.path.2015.09.004 |
| [2] | WIRTH A. Indolentlymphomasoccurring in bone[J]. LeukLymphoma, 2014, 55(8): 1701–1702. DOI:10.3109/10428194.2013.876635 |
| [3] | METSER U, DUDEBOUT J, BAETZ T, et al. 18F-FDG PET/CT in the staging and management of indolent lymphoma: A prospective multicenter PET registry study: PET/CT in indolent lymphoma[J]. Cancer, 2017, 123(15): 2860–2866. DOI:10.1002/cncr.30672 |
| [4] | CHO S F, CHANG C C, LIU Y C, et al. Utilization of 18F-FDG PET/CT as a staging tool in patients with newly diagnosed lymphoma[J]. Kaohsiung J Med Sci, 2015, 31(3): 130–137. DOI:10.1016/j.kjms.2014.11.012 |
| [5] |
薛久巍, 于生龙, 马德爽, 等. 惰性B细胞淋巴瘤的临床特点与生存状况研究[J].
中国医药科学, 2017, 7(5): 158–160.
XUE J W, YU S L, MA D S, et al. Clinical characteristics and survival status of patients with indolent B-cell non-Hodgkin lymphoma[J]. China Med Pharmacy, 2017, 7(5): 158–160. DOI:10.3969/j.issn.2095-0616.2017.05.046 |
| [6] | HASHMI A A, HUSSAIN Z F, FARIDI N, et al. Distribution of Ki67 proliferative indices among WHO subtypes of non-Hodgkin's lymphoma: association with other clinical parameters[J]. Asia Pac J Cancer Prev, 2014, 15(20): 8759–8763. DOI:10.7314/APJCP.2014.15.20.8759 |
| [7] |
张建华, 王荣福, 范岩, 等. 18F-FDG PET/CT评价初诊非霍奇金淋巴瘤代谢活性及其与免疫表型的相关性[J].
中华医学杂志, 2014, 94(33): 2576–2579.
ZHANG J H, WANG R F, FAN Y, et al. Metabolic activity measured by 18F-FDG PET/CT in newly diagnosed patients with non-Hodgkin lymphoma: correlation with immunophenotype[J]. Natl Med J China, 2014, 94(33): 2576–2579. DOI:10.3760/cma.j.issn.0376-2491.2014.33.006 |
| [8] |
刘艳, 沈丽达, 杨小芸, 等. PET/CT应用于恶性淋巴瘤诊治中的临床价值[J].
现代医药卫生, 2016, 32(19): 2982–2986.
LIU Y, SHEN L D, YANG X Y, et al. Clinical value of PET/CT applied in diagnosis and treatment of malignant lymphoma[J]. J Mod Med Health, 2016, 32(19): 2982–2986. DOI:10.3969/j.issn.1009-5519.2016.19.016 |
| [9] | ALOBTHANI G, ROMANOV V, ISOHASHI K, et al. Value of 18F-FDG PET/CT in discrimination between indolent and aggressive non-Hodgkin's lymphoma: A study of 328 patients[J]. Hell J Nucl Med, 2018, 21(1): 7–14. DOI:10.1967/s002449910701 |
| [10] | NGEOW J Y, QUEK R H, NG D C, et al. High SUV uptake on FDG-PET/CT predicts for an aggressive B-cell lymphoma in a prospective study of primary FDG-PET/CT staging in lymphoma[J]. Ann Oncol, 2009, 20(9): 1543–1547. DOI:10.1093/annonc/mdp030 |
| [11] |
程志祥, 魏征, 邹善华, 等. 不同病理类型非霍奇金淋巴瘤18F-氟代脱氧葡萄糖PET/CT标准摄取值的比较[J].
中国临床医学, 2015, 22(5): 586–588.
CHENG Z X, WEI Z, ZOU S H, et al. Comparison of the standarized uptake value of fluorine-18Flurodeoxyglucose PET/CT among different type of non-hodgkin lymphoma[J]. Chin J Clin Med, 2015, 22(5): 586–588. |
| [12] |
戴云秀, 杨光杰, 王振光, 等. 18F-FDG PET/CT基线SUVmax在滤泡性淋巴瘤侵袭性、分期评价中的价值及其与中期疗效的相关性研究[J].
国际放射医学核医学杂志, 2018, 42(2): 104–110.
DAI Y X, YANG G J, WANG Z G, et al. Evaluation of invasiveness staging and correlation with interim therapeutic response based on baseline 18F-FDG PET/CT SUVmax in patients with follicular lymphoma[J]. Int J Radiat Med Nucl Med, 2018, 42(2): 104–110. DOI:10.3760/cma.j.issn.1673-4114.2018.02.002 |
| [13] | TYCHYJ-PINEL C, RICARD F, FULHAM M, et al. PET/CT assessment in follicular lymphoma using standardized criteria: central review in the PRIMA study[J]. Eur J Nucl Med Mol Imaging, 2014, 41(3): 408–415. DOI:10.1007/s00259-013-2441-8 |
| [14] |
丁重阳, 孙晋, 李天女, 等. 治疗前18F-FDG PET/CT最大标准摄取值在滤泡性淋巴瘤的预后价值[J].
中国实验血液学杂志, 2015, 23(5): 1331–1335.
DING C Y, SUN J, LI T N, et al. Prognostic value of maximum standard uptake on pretreatment 18F-FDG PET/CT scan in newly diagnosed follicular lymphoma[J]. J Exp Hematol, 2015, 23(5): 1331–1335. DOI:10.7534/j.issn.1009-2137.2015.05.020 |
| [15] | SUZUKI R. Indolent B-cell lymphoma: the current standard in 2014[J]. J Clin Exp Hematop, 2014, 54(1): 1–2. DOI:10.3960/jslrt.54.1 |



