2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院消化内科
2. Department of Gastroenterology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
急性胰腺炎(acute pancreatitis,AP)是多种病因导致胰腺内胰酶不适当的激活,进而引发胰腺组织自身消化、水肿、出血甚至坏死等一系列炎症反应性疾病。近年来急性胰腺炎发病率逐渐增高,是临床常见的急腹症。由于它发病急,而且对人体重要脏器损害明显,故死亡率接近30%,甚至有时可引起骤然死亡。由于急性胰腺炎发病机制目前尚不十分清楚,因此缺乏有效及特异的治疗方案。
胰腺腺泡细胞约占外分泌胰腺组织的90%[1]。大量研究表明,凋亡作为胰腺腺泡细胞的一种保护机制,在急性胰腺炎中扮演重要角色,而诱导凋亡可改善急性胰腺炎的严重程度[2]。关于凋亡的发生机制目前已经较为明确,而钙超载和自噬引发急性胰腺炎的机制是近年来研究的热点。自噬又名Ⅱ型程序性细胞死亡,被证明与炎症性疾病的发生存在密切联系,并与炎症反应相互作用参与急性胰腺炎的病理生理过程[3-4]。随着对多种炎症模型研究的深入,发现钙超载可以通过激活某些核转录因子参与下游一系列炎症因子的调控和凋亡反应的发生。
近年来,大量研究报道核转录因子Sp1是Sp蛋白家族中转录激活功能最强的因子,在炎症和肿瘤发生发展中发挥重要作用,且可协助临床预后评估。Sp1可启动和调控富含GC序列的细胞基因转录,发挥多种生物学效应,包括细胞增殖、凋亡、代谢、分化和迁移等过程[5-7]。近期研究报道Sp1在脑缺血预处理中能通过增加钠钙交换体NCX1启动子活性,上调NCX1 mRNA和蛋白的表达[8]。而我们的前期研究发现NCX1可通过介导钙超载从而促进急性胰腺炎发展[9]。雨蛙素是一种功能和组成类似于胆囊收缩素的胃调节分子,能刺激胃、胆管和胰腺分泌,已用于动物急性胰腺炎模型的建立。因此,本研究拟在胰腺腺泡细胞模型中,探讨雨蛙素诱导急性胰腺炎的分子机制及其Sp1和NCX1在急性胰腺炎中的调控作用。
1 材料与方法 1.1 主要材料大鼠胰腺腺泡细胞系AR42J于2016年从中国科学院购买,且所有细胞系均冷冻在液氮中,在本实验中复苏细胞3个月内传代次数小于20次。4~5周龄健康成年雄性Sprague-Dawley大鼠(体质量180~220 g)由陆军军医大学第二附属医院实验动物中心提供。实验前均采用昼夜对照,以适应实验环境1周。用于处理大鼠的雨蛙素购自Sigma公司,雨蛙素和CCK-8试剂购自MCE公司,Sp1抑制剂(Mithramycin A)购自MCEApexbio公司,Western blot检测所用NCX1抗体购自Abcam公司,Sp1抗体和LC3抗体购自Cell Signaling Technology公司,辣根过氧化物酶(HRP)标记山羊抗兔IgG、辣根过氧化物酶(HRP)标记山羊抗小鼠IgG和GAPDH单克隆抗体均购自Molecular probes公司,1640细胞培养液及胎牛血清购自HyClone公司,逆转录和定量qPCR试剂盒购自日本TaKaRa公司,PVDF膜购自Millipore Corporate公司,化学发光ECL显影剂购自Thermo公司。
1.2 细胞培养AR42J细胞培养于含10%胎牛血清的DMEM-改良型1640培养基中,于37 ℃、5%CO2恒温培养箱中孵育。雨蛙素、Mithramycin A处理浓度均为100 nmol/L。
1.3 免疫组织化学染色处死雨蛙素50 μg/(kg·h)诱导6 h构建的胰腺炎模型(雨蛙素组)和阴性对照组大鼠,立即取出胰腺并用4%多聚甲醛固定后石蜡包埋,制作成4 μm的切片标本,与抗Sp1(1 :100稀释,CST)一起温育。用生物素化的山羊抗小鼠IgG(Vector Laboratories)二抗检测一抗。使用辣根过氧化物酶(30-,30-二氨基联苯胺)试剂盒(BioGenex)检测免疫反应性,然后用苏木精复染,脱水和固定。每张切片拍摄5个视野。
1.4 Western blot检测将沉淀或细胞裂解物重悬于1×SDS上样缓冲液中,100 ℃金属浴煮沸8 min,并通过SDS-PAGE(10%)分离。将分离的蛋白质转移到PVDF膜上,用含有5%脱脂奶粉的封闭缓冲液封闭膜2 h,然后用单克隆抗体NCX1(1 :1 000)、Sp1(1 :1 000)、LC3(1 :1 000)、β-actin(1 :1 000)和GAPDH(1 :10 000)在4 ℃孵育过夜。用TBST洗涤后,室温孵育二抗1 h。使用增强的化学发光ECL显影。
1.5 实时荧光定量PCR检测细胞用1×PBS洗2次后,用TRIzol裂解,与三氯甲烷以5 :1比例提取总RNA,并将mRNA逆转录至cDNA。PCR反应体系含有以下物质:5 μL SYBR Premix Ex TaqTMⅡ,0.5 μL上游引物(10 μmol/L),0.5 μL下游引物(10 μmol/L),2.8 μL H2O,0.2 μL ROX ByeⅡ,1 μL DNA模板。扩增反应程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,扩增40个循环。选择GAPDH为内参,且每个样本设计3个复孔。最后运用ΔΔCt法进行定量分析,并将其标准化为每个样品中Sp1表达。
1.6 双荧光素酶实验构建NCX1启动子报告质粒,经http://genome.ucsc.edu/获得NCX1的启动子序列,亚克隆至pGL3-basic载体上,所获得产物命名为pGL3-basic-NCX1。利用空白对照及Sp1的抑制Mithramycin A预处理293T细胞后,将含有NCX1的启动子序列的双荧光素酶载体转染入293T细胞,48 h后分别测定Luc活性和海肾质粒活性,将相应的Luc进行标化。实验设3个复孔,取其平均值。
1.7 CCK-8实验将AR42J细胞按2000个/100 μL均匀铺至96孔板中,并分为阴性对照组和雨蛙素处理组(100 nmol/L),分别于0、24、48、72 h每孔加入10 μL CCK-8试剂,将培养板在培养箱内孵育1.5 h后,用酶标仪测定波长450 nm处的光密度值[D(450)]。每组、每个时间点3个复孔。
1.8 统计学分析采用GraphPad Prism 7.0软件进行统计学分析,数据以x±s表示,采用t检验比较两组间差异,多组比较采用单因素方差分析,检验水准:ɑ=0.05。
2 结果 2.1 雨蛙素处理可抑制大鼠胰腺外分泌细胞增殖采用大鼠胰腺外分泌细胞(AR42J细胞)作为细胞实验模型,首先利用雨蛙素处理AR42J细胞建立急性胰腺炎细胞模型。分别在雨蛙素处理0、24、48、72 h后通过CCK-8检测细胞增殖情况。与阴性对照组比较,雨蛙素处理24 h即可抑制AR42J细胞的增殖(P < 0.05),在雨蛙素处理72 h时可显著抑制AR42J细胞的增殖(P < 0.01), 且呈时间依赖性,结果见图 1。
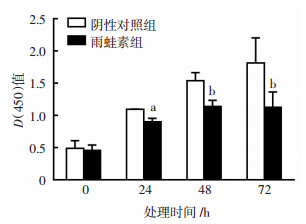
|
| a:P < 0.05,b:P < 0.01,与阴性对照组比较 图 1 CCK-8检测雨蛙素处理不同时间后AR42J细胞的增殖情况 (n=3) |
2.2 雨蛙素处理可诱导大鼠胰腺外分泌细胞发生自噬
利用雨蛙素处理AR42J细胞建立急性胰腺炎细胞模型。通过Western blot检测发现,雨蛙素分别处理3、6、12、24 h后,AR42J细胞中自噬标志分子LC3Ⅱ/LC3Ⅰ比值随着处理时间的延长逐步升高,呈时间依赖性,结果见图 2。
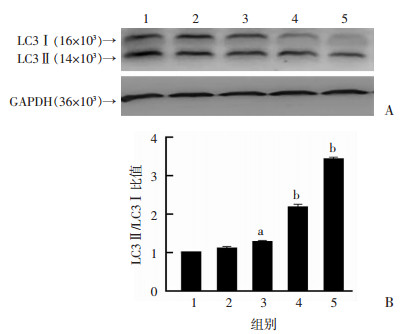
|
| 1:阴性对照组;2~5:雨蛙素刺激3、6、12、24 h组A:Western blot检测蛋白表达;B:半定量分析结果a:P < 0.05,b: P < 0.01,与阴性对照组比较 图 2 Western blot检测雨蛙素刺激AR42J细胞后不同时间的自噬水平 |
2.3 雨蛙素处理可促进大鼠胰腺外分泌细胞中Sp1蛋白表达
利用雨蛙素处理AR42J细胞后,通过qRT-PCR及Western blot检测转录因子Sp1的mRNA及蛋白表达情况。qRT-PCR结果显示,雨蛙素刺激AR42J细胞1 h后,Sp1的mRNA表达量为阴性对照组的(3.262±1.539)倍。当雨蛙素处理3 h后,Sp1的mRNA表达量上调达到峰值,为阴性对照组表达量的(7.056±1.711)倍(P < 0.05)。随后在6、12、24 h时,Sp1的mRNA表达量逐渐降低,结果见图 3A。Western blot结果显示,Sp1蛋白表达量在雨蛙素处理后明显增高,并在6 h时达到峰值,结果见图 3B、C。
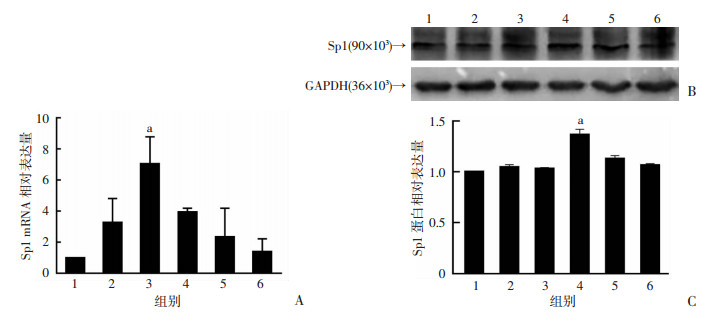
|
| 1:阴性对照组;2~6:雨蛙素处理1、3、6、12、24 h组;a:P < 0.05,与阴性对照组比较A:qRT-PCR检测Sp1 mRNA表达水平;B、C:Western blot检测及半定量分析 图 3 qRT-PCR和Western blot检测雨蛙素刺激AR42J细胞后不同时间Sp1 mRNA和蛋白的表达 |
2.4 雨蛙素处理可促进大鼠胰腺组织中Sp1蛋白表达
采用雨蛙素腹腔注射,建立急性胰腺炎SD大鼠模型。注射6 h后,麻醉处死大鼠,取胰腺组织石蜡包埋进行Sp1的免疫组化染色。结果显示在胰腺组织中,雨蛙素组Sp1的蛋白表达量明显高于阴性对照组,结果见图 4。
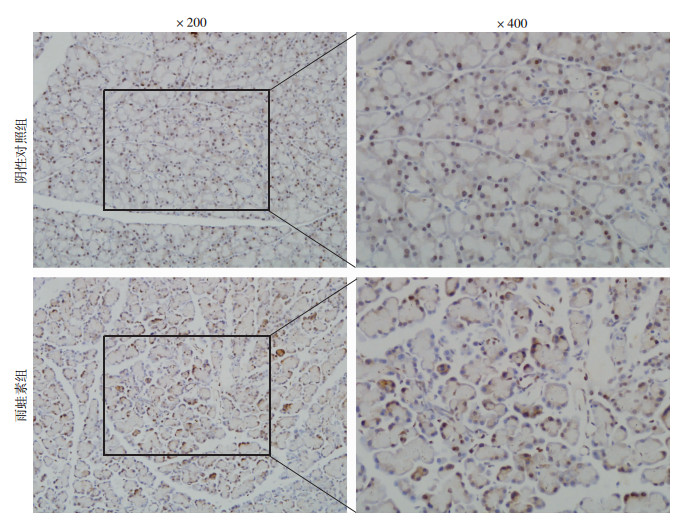
|
| 图 4 免疫组化染色检测两组大鼠胰腺组织中Sp1蛋白的表达 (SABC) |
2.5 抑制转录因子Sp1蛋白可下调NCX1蛋白表达
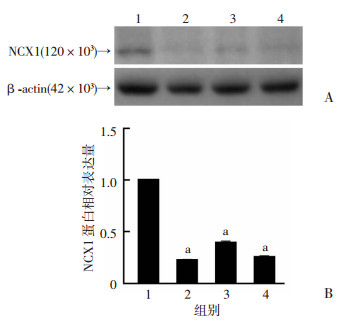
利用Sp1的抑制Mithramycin A(100 nmol/L)预处理293T细胞,并将含有NCX1的启动子序列的双荧光素酶载体转染入293T细胞48 h后,进行双荧光素酶活性检测。结果显示,Mithramycin A预处理后双荧光素酶活性为(0.920 3±0.076 8,n=3),而空白对照组酶活性为(1.444 0±0.170 3,n=3)。Mithramycin A处理后明显抑制了含有NCX1启动子序列的双荧光素酶载体的活性。利用Mithramycin A处理AR42J细胞后进行Westren blot检测也发现,Mithramycin A处理组在6、12、24 h的NCX1蛋白表达量较阴性对照组均明显下调(P < 0.01,图 5)。
|
| A:Western blot检测蛋白表达;B:半定量分析;1:阴性对照组;2~4:Mithramycin A(100 nmol/L)处理6、12、24 h组a:P < 0.01,与阴性对照组比较 图 5 Western blot检测Sp1抑制剂Mithramycin A对NCX1蛋白表达水平的影响 |
3 讨论
急性胰腺炎目前仍然是一种发病率和致死率极高的疾病,通常由酒精滥用或胆道疾病的并发症引起,其发病机制至今尚未完全阐明。近年来,胰蛋白酶原激活[10]、胰腺微循环障碍[11]、钙超载[12-14]、炎症途径[15-16]及自噬[3]等胰腺机制陆续被提出。1995年,KAISER等[17]首次提出胰腺炎症的严重程度与胰腺细胞的凋亡存在联系,并呈负相关性的假说。MARENI-NOVA等[18]证实自噬参与了大鼠急性胰腺炎中胰腺腺泡空泡形成及胰蛋白酶的激活,进而引起急性胰腺炎的发生。
本研究采用雨蛙素处理后发现胰腺腺泡细胞增殖能力受到抑制,且抑制作用随处理时间延长而增强。为进一步探索雨蛙素对腺泡细胞生命活动的影响,检测凋亡及自噬两种细胞表型,结果发现雨蛙素处理后对腺泡细胞凋亡过程几乎无影响,但自噬标志物LC3Ⅱ/LC3Ⅰ比值升高,表明其可促进胰腺腺泡细胞发生自噬。因此,我们推测雨蛙素抑制胰腺腺泡细胞增殖能力的原因可能是由于促进了其自噬过程。那么此过程可能的分子机制如何呢?据研究报道,炎症介导的PI3K/AKT/SP1激活途径可促进重症急性胰腺炎的炎症反应[8, 16],且在脑缺血预处理中,转录因子Sp1通过增加钠钙交换体NCX1启动子活性上调其mRNA和蛋白表达水平。而课题组前期结果已经证实,NCX1作为一种重要的具有双向转运钠钙离子功能的细胞膜蛋白,在大鼠急性胰腺炎模型中表达上调,并可促进炎症因子IL-6和TNF-α分泌及淀粉酶升高而促进胰腺炎发展[9],提示NCX1是一个可以促进胰腺炎发展的蛋白分子。我们应用UCSC数据库分析,发现NCX1启动子区域含有若干转录因子Sp1的结合位点,提示Sp1可能通过调控NCX1转录进而影响其表达。因此,本研究就Sp1及NCX1在急性胰腺炎中的作用进行探讨。在雨蛙素刺激诱导的急性胰腺炎细胞模型中,检测到雨蛙素体外刺激腺泡细胞中核转录因子Sp1 mRNA和蛋白水平表达变化,发现Sp1 mRNA表达在3 h内呈时间依赖性增加(P < 0.05),蛋白表达在6 h内呈梯度增加,而后均略有下调,提示Sp1在急性胰腺炎的发展中可能起重要作用。免疫组化染色也发现,在急性胰腺炎的整体动物模型中,与阴性对照组比较,雨蛙素处理组Sp1表达明显上调,进一步证实Sp1参与了急性胰腺炎的病理进程。结合UCSC数据库分析结果,构建NCX1的启动子载体转染293T细胞,通过双荧光素酶实验观察Sp1抑制剂Mithramycin A处理后NCX1启动子活性。与空白对照组比较,Mithramycin A能抑制含有NCX1启动子区域的荧光素酶载体的活性(P < 0.05)。接着用Mithramycin A处理腺泡细胞,发现NCX1的表达明显下调,提示在雨蛙素诱导的急性胰腺炎模型中,核转录因子Sp1通过调控NCX1转录过程介导其上调。但Sp1及NCX1对自噬的具体调控作用还需要深入研究。
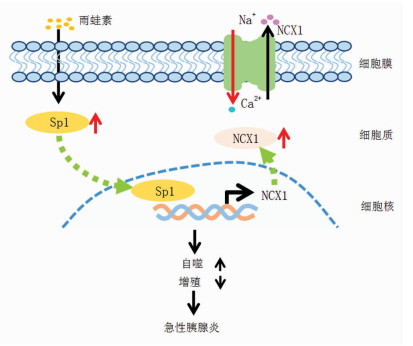
综上所述,本研究显示雨蛙素处理大鼠胰腺腺泡细胞后可通过促进自噬,进而抑制腺泡细胞的增殖能力,而其中的分子调控机制可能是由于转录因子Sp1上调并促进了NCX1蛋白表达,进一步促进下游其他炎症因子的表达及分泌,从而促进胰腺炎发展(图 6)。故Sp1及NCX1可能是防治急性胰腺炎新的潜在干预靶点。
|
| 图 6 雨蛙素通过上调Sp1和NCX1表达诱导急性胰腺炎 |
| [1] | VASQUES E R, CUNHA J E M, KUBRUSLY M S, et al. The M-RNA, expression of SERCA2 and NCX1 in the process of pharmacological cell protection in experimental acute pancreatitis induced by taurocholate[J]. Arq Bras Cir Dig, 2018, 31(1): e1352. DOI:10.1590/0102-672020180-001e1352 |
| [2] | XU P, LOU X L, CHEN C. Apoptotic mechanisms of peroxisome proliferator-activated receptor-γ activation in acinar cells during acute pancreatitis[J]. Pancreas, 2016, 45(2): 179–186. DOI:10.1097/MPA.0000000000000495 |
| [3] | LEVINE B, MIZUSHIMA N, VIRGIN H W. Autophagy in immunity and inflammation[J]. Nature, 2011, 469(7330): 323–335. DOI:10.1038/nature09782 |
| [4] |
杨淑丽, 刘洁, 陈卫昌. 自噬在急性胰腺炎发生发展中的作用[J].
临床肝胆病杂志, 2014, 30(8): 730–733.
YANG S L, LIU J, CHEN W C. Role of autophagy in development and progression of acute pancreatitis[J]. J Clin Hepatol, 2014, 30(8): 730–733. DOI:10.3969/j.issn.1001-5256 |
| [5] | SAFE S, ABBRUZZESE J, ABDELRAHIM M, et al. Specificity protein transcription factors and cancer: opportunities for drug development[J]. Cancer Prev Res (Phila), 2018, 11(7): 371–382. DOI:10.1158/1940-6207.CAPR-17-0407 |
| [6] | VIZCAÍNO C, MANSILLA S, PORTUGAL J. Sp1 transcription factor: A long-standing target in cancer chemotherapy[J]. Pharmacol Ther, 2015, 152: 111–124. DOI:10.1016/j.pharmthera.2015.05.008 |
| [7] | PHILIPSEN S, SUSKE G. A tale of three fingers: the family of mammalian Sp/XKLF transcription factors[J]. Nucleic Acids Res, 1999, 27(15): 2991–3000. DOI:10.1093/nar/27.15.2991 |
| [8] | FORMISANO L, GUIDA N, VALSECCHI V, et al. Sp3/REST/HDAC1/HDAC2 complex represses and Sp1/HIF-1/p300 complex activates ncx1 gene transcription, in brain ischemia and in ischemic brain preconditioning, by epigenetic mechanism[J]. J Neurosci, 2015, 35(19): 7332–7348. DOI:10.1523/JNEUROSCI.2174-14.2015 |
| [9] |
余森源, 谢睿, 陈昱杨, 等. 钠钙交换体NCX1在急性胰腺炎发生、发展中的作用[J].
第三军医大学学报, 2015, 37(13): 1325–1330.
YU S Y, XIE R, CHEN Y Y, et al. Role of sodium-calcium exchanger-1 in development of rat acute pancreatitis[J]. J Third Mil Med Univ, 2015, 37(13): 1325–1330. DOI:10.16016/j.1000-5404.201501236 |
| [10] | FENG J Y, LI Y Y. Alteration and role of heat shock proteins in acute pancreatitis[J]. J Dig Dis, 2010, 11(5): 277–283. DOI:10.1111/j.1751-2980.2010.00450.x |
| [11] | PETERSEN O H, SUTTON R. Ca2+signalling and pancreatitis: effects of alcohol, bile and coffee[J]. Trends Pharmacol Sci, 2006, 27(2): 113–120. DOI:10.1016/j.tips.2005.12.006 |
| [12] | FENG S, WEI Q, HU Q, et al. Research progress on the relationship between acute pancreatitis and calcium overload in acinar cells[J]. Dig Dis Sci, 2018, 64(1): 25–38. DOI:10.1007/s10620-018-5297-8 |
| [13] | ORABI A I, LUO Y, AHMAD M U, et al. IP3 receptor type 2 deficiency is associated with a secretory defect in the pancreatic acinar cell and an accumulation of zymogen granules[J]. PLoS ONE, 2012, 7(11): e48465. DOI:10.1371/journal.pone.0048465 |
| [14] | GU H, WERNER J, BERGMANN F, et al. Necro-inflammatory response of pancreatic acinar cells in the pathogenesis of acute alcoholic pancreatitis[J]. Cell Death Dis, 2013, 4(10): e816. DOI:10.1038/cddis.2013.354 |
| [15] | SAH R P, DAWRA R K, SALUJA A K. New insights into the pathogenesis of pancreatitis[J]. Curr Opin Gastroenterol, 2013, 29(5): 523–530. DOI:10.1097/MOG.0b013e328363e399 |
| [16] | LIU Y, LIAO R, QIANG Z, et al. Pro-inflammatory cytokine-driven PI3K/Akt/Sp1signalling and H(2)S production facilitates the pathogenesis of severe acute pancreatitis[J]. Biosci Rep, 2017, 37(2): BSR20160483. DOI:10.1042/BSR20160483 |
| [17] | KAISER A M, SALUJA A K, SENGUPTA A, et al. Relationship between severity, necrosis, and apoptosis in five models of experimental acute pancreatitis[J]. Am J Physiol, 1995, 269(5Pt1): C1295–C1304. DOI:10.1152/ajpcell.1995.269.5.C1295 |
| [18] | MARENINOVA O A, HERMANN K, FRENCH S W, et al. Impaired autophagic flux mediates acinar cell vacuole formation and trypsinogen activation in rodent models of acute pancreatitis[J]. J Clin Invest, 2009, 119(11): 3340–3355. DOI:10.1172/JCI38674 |



