流行病学研究显示:膀胱过度活动症(overactive bladder,OAB)在欧美等发达国家的中老年人群(40岁以上)中的发病率在8%~10%[1];而在中国汉族人群中,40岁以上的发病率为9.8%,50岁以上的男性和女性发病率分别为14.8%和16.1%,与欧美国家发病率相当,且有随年龄增长的趋势[2]。OAB严重影响着患者的生活质量,部分患者的临床治疗效果不满意; 如不及时终止病程,严重者还将引起肾、输尿管积水和肾功能损害[3]。膀胱兴奋性异常是此类疾病的共同发病机制和病程通路,研究和阐明OAB时膀胱兴奋性异常的调控机制具有重大的临床和社会意义。
超极化激活环核苷酸门控阳离子通道(hyperpolarization-activated cyclic nucleotide-gated channel,Hcn)属于电压门控离子通道超家族,含有Hcn1~4四个亚基。HCN通道在心脏和中枢神经系统中广泛表达,能产生HCN通道电流(Ih),控制心脏和神经元的节律性。HCN通道同样表达于胃肠道Cajal间质(interstitial cells of Cajal-like,ICCs)细胞,参与调控胃肠道ICCs细胞起搏活动,从而调节胃肠道的节律性收缩。该通道还具有稳定细胞膜电位、参与树突整合及调节神经递质释放等生理功能[4]。研究表明大鼠不稳定膀胱ICCs细胞中HCN蛋白表达明显改变,但具体涉及的亚型尚待研究证实[5]。本研究在成功构建大鼠膀胱过度活动症模型(DO)的基础上,运用二代测序RNA-seq技术分析DO模型大鼠膀胱组织蛋白以及涉及的通路改变情况,以期为研究膀胱过度活动的发生机制提供线索。
1 材料与方法 1.1 主要试剂、设备和动物来源乌拉坦购自美国Sigma公司,TRIzol、q-PCR反转录试剂盒购自日本TaKaRa公司,q-PCR荧光染料SYBR GREEN购自日本TOYOBO公司; RIPA裂解强缓冲液购自上海碧云天公司,GAPDH(60004)购自美国Proteintech公司,DC试剂盒购自美国Bio-Rad公司; Hcn1(ab84816)、Hcn2(ab65704)、Hcn3(ab84818)、Hcn4(ab69054)均购自美国Abcam公司; 二抗(ZB-2306)购自北京中杉金桥生物公司,显影液购自美国Millipore公司; RM-6240C型多通道生理信号采集处理单腔器官浴槽系统购自成都仪器厂。
雌性SD大鼠10只,体质量140~160 g,由本院实验动物中心提供。
1.2 DO大鼠模型构建将10只大鼠按随机数字法分为模型组(DO)和假手术组,每组5只。模型组:手术器械均高温、高压灭菌处理,20%乌拉坦(1 g/kg)腹腔注射麻醉大鼠,备皮,用碘伏消毒下腹部,取无菌PE50导管,涂抹适量甘油润滑导管,然后经大鼠尿道外口缓慢插入膀胱,轻压下腹部有尿液溢出说明插管成功; 再次用碘伏消毒大鼠腹部,在大鼠下腹部正中纵行切开长约2.5 cm切口,逐层分离,充分暴露膀胱颈部,用3-0丝线结扎膀胱颈部,结扎松紧度以牵拉导管时有一定阻力为宜,缓慢拔出导管,逐层缝合关闭腹部切口,再给予庆大霉素注射液(0.5 mg/kg)腹腔内注射预防感染。假手术组:除未行膀胱颈部结扎外,其余操作均与模型组处理相同。
1.3 尿动力学检测在建模4周后进行尿动力学相关检测。使用20%乌拉坦(1 g/kg)腹腔注射麻醉大鼠,大鼠取仰卧位固定四肢,适量碘伏消毒大鼠尿道外口及下腹部皮肤,取长约15 cm的PE50导管,少量甘油润滑导管后经尿道外口缓慢插入膀胱,轻压大鼠的下腹部排出膀胱内的残余尿液,导管经三通管与微量灌注泵压力传感器相连,调整微量灌注泵将37 ℃生理盐水以10 mL/h的速度泵入膀胱内,使用多通道生理信号采集处理系统(RM6240C型)记录膀胱的压力曲线,设置参数为:灵敏度12.5 cmH2O,扫描速度10 s/div,直流频率100 Hz,压力模式。尿动力学检测中若出现明显的非排空性收缩,则认为建模成功。
1.4 RNA提取及q-PCR、Western blot检测确定模型大鼠建模成功后,引颈处死10只大鼠,常规消毒腹部后,在大鼠下腹部正中纵行切开一长约2.5 cm的切口,逐层分离,充分暴露膀胱,取下膀胱,用4 ℃ PBS溶液快速清洗后,无菌眼科剪剪下膀胱部分组织,用液氮冷冻后充分研磨成粉末状,分装备用。取适量组织粉末置于TRIzol中,按TRIzol说明书提取膀胱组织总RNA,后用Thermo紫外分光光度计检测提取的总RNA浓度及纯度。
q-PCR检测:取适量RNA,按照TaKaRa试剂盒说明书方法将RNA反转录成cDNA,按照TOYOBO试剂盒SYBR GREEN荧光定量PCR方法配置20 μL反应体系,用Step One Plus q-PCR仪做定量PCR,检测模型大鼠膀胱中Hcn1~4各通道蛋白的mRNA表达,内参为GAPDH。
Western blot检测:提取总蛋白,将充分研磨好的膀胱组织粉末在RIPA裂解强缓冲液+PMSF中充分裂解后,在4 ℃下12 000×g离心5 min后小心吸取上清液。按照Bio-Rad DC试剂盒说明书测量蛋白浓度,在蛋白中加入适量SDS上样缓冲液并在100 ℃金属浴中煮5 min,加入50 μg蛋白样本于SDS-PAGE凝胶电泳分离蛋白,然后转移到PVDF膜上,5%脱脂牛奶摇床室温封闭2 h,按照Marker蛋白指示切取目的条带,TBST漂洗后,分别加入GAPDH、Hcn1~4 (1 :1 000)一抗4 ℃下孵育过夜,TBST漂洗3次后加入二抗,室温孵育2 h,TBST漂洗3次后加入化学发光液显影,凝胶成像系统曝光并保存图像。实验重复3次以上,Quantity One软件测量各条带灰度值,各蛋白用相对灰度值表示(目的条带灰度/内参条带灰度)。
1.5 RNA-seq测序和数据统计提取后的RNA经过质控后建库,进行RNA测序(RNA-seq)分析,该过程由上海天昊测序公司完成,各项结果指标均符合后续分析。基因表达富集分析(gene set enrichment analysis, GSEA)信号通路按照网站(http://software.broadinstitute.org/gsea/index.jsp)说明操作完成[6]。
统计学分析均在R平台完成(http://www.R-project.org/)。数值变量均采用x±s的方式呈现,采用Student’s t检验和秩和检验进行两组间差异比较。检验水准:α=0.05。运用GraphPad Prism 5软件进行直方图绘制。
2 结果 2.1 大鼠DO模型构建大鼠膀胱颈结扎4周后,尿流动力学检测结果显示:与假手术组比较,模型组膀胱质量[(368.13±20.09) vs (289.05±14.73) mg,P < 0.05]、膀胱壁厚度[(1.90±0.25) vs (0.98±0.05) mm,P < 0.05]和储尿期膀胱压力[(35.10±5.02) vs (28.40±6.10) cmH2O,P < 0.05]均显著增加; 模型组最大膀胱容量[(0.13±0.20) vs (2.05±3.10) mL,P < 0.05]和膀胱顺应性(0.70±0.22 vs 1.30±0.15,P < 0.05)显著降低。模型组膀胱逼尿肌不稳定收缩频率和幅度均增加(图 1)。提示DO大鼠模型构建成功。
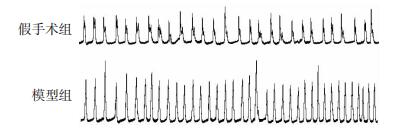
|
| 图 1 两组大鼠离体逼尿肌收缩实验结果 |
2.2 DO模型大鼠RNA-seq测序及相关基因表达
在成功构建的DO模型大鼠中,从3例DO模型大鼠和3例年龄、性别和体质量配对的假手术组大鼠的膀胱组织提取RNA,质控合格后进行整体RNA-seq测序分析。在DO组大鼠膀胱组织发现高表达的基因(表达增加2倍以上)有853个,低表达(表达降低2倍以上)的有304个。PCA主成分分析结果表明模型组和假手术组大鼠分别各自聚类在一起,提示测序结果可靠,可以进行后续的差异分析。显著升高表达的基因包括complement 3(c3)、chemokineligand 4(ccl4)、C-X-C motif chemokine receptor 2(cxcr2)、interleukin 1b(ll1b)等炎症相关基因,降低表达的基因包括vomeronasal 1 receptor 89(vom1r89)、Hcn1等离子通道相关基因(图 2)。提示DO模型大鼠膀胱组织有增加的炎症反应和降低的离子通道活性。
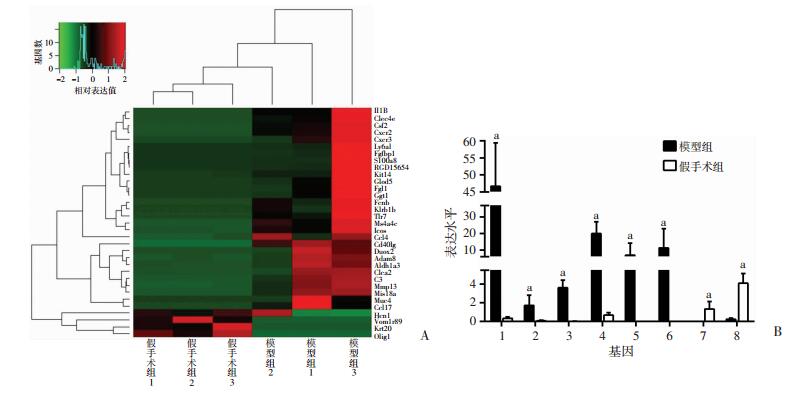
|
| A:Heatmap图显示两种不同组织状态基因表达差异聚类,6个样本中29个基因在DO模型高表达、4个基因在DO模型低表达,红色表示基因表达升高,绿色表示降低,蓝色表示不变; B:RT-PCR验证DO模型大鼠膀胱组织中显著高表达的6个基因和2个低表达的基因1:c3;2:ccl4;3:cxcr2;4:Il1b;5:cc17;6: cxcl3;7:vom1r89;8:Hcn1;a:P < 0.001, 与假手术组比较 图 2 DO模型大鼠膀胱组织RNA-seq测序分析及相关基因表达 |
2.3 DO模型大鼠信号通路分析
运用大鼠RNA-seq表达数据纳入6例样本和20 522个基因进行GSEA信号通路分析,结果提示:GO信号通路包括生物过程、细胞组分和分子功能3个部分在内的信号激活,其中包括细胞因子受体和白细胞趋化相关信号(图 3A)。与假手术组比较,Hcn通道活性在DO模型组抑制作用最明显[图 3B, 富集分数=-0.565, 错误发现率(FDR) q=0.044],图 3C表明该信号通路中显著抑制的基因情况。这些结果提示炎症反应可能抑制离子通道活性在OAB发生中发挥重要作用。
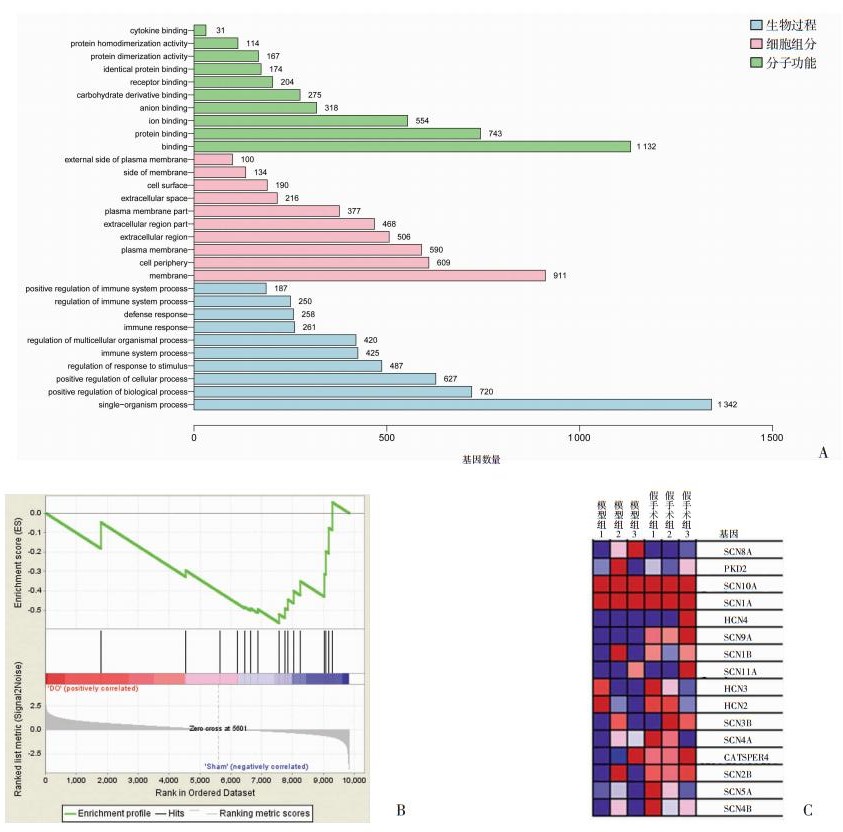
|
| A:GO信号通路富集显示涉及生物过程、细胞组分和分子功能在内的广泛信号通路激活,最显著的就是炎症相关信号; B:GSEA信号通路分析包含Hcn1通道在内的钠离子相关通路的激活被抑制; C:Heatmap图显示钠离子相关通路中基因表达差异聚类 图 3 DO模型大鼠膀胱组织中相关信号通路激活 |
2.4 Hcn1通道蛋白在DO模型大鼠中的表达
Western blot检测结果显示:DO模型组大鼠膀胱组织中Hcn通道各亚基的表达中,Hcn1通道蛋白表达较假手术组明显降低(图 4,P < 0.001)。上述结果提示DO模型大鼠中离子通道活性被抑制。
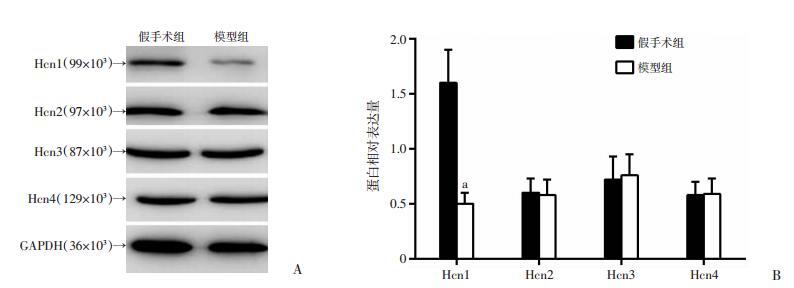
|
| A:Western blot检测; B:半定量分析a: P < 0.001, 与假手术组比较 图 4 Western blot检测DO模型大鼠膀胱组织中Hcn通道蛋白的表达 |
3 讨论
OAB发生机制复杂,很多病因都可能导致尿频、尿急的临床症状,比如下尿路梗阻、神经源性膀胱、间质性膀胱炎和细菌性膀胱炎等[7]。因此,针对不同OAB病因,研究者构建大鼠膀胱过度活动模型主要有膀胱出口梗阻、脊髓离断模型、间质性膀胱炎症模型和细菌性膀胱炎症模型[8]。由于膀胱颈结扎构建DO模型适用于大型动物,包括大鼠、猫、兔子等,结构解剖简单,价格低廉,加上实验周期较短,所以最为常用。本研究采用该方法成功建立DO大鼠模型,经尿动力学检测符合临床症状改变,膀胱测压、最大逼尿肌压以及肌条实验均显示其较假手术组有明显改变,为后续研究奠定了很好的基础。但是该模型构建过程中手术操作相对复杂,必须准确找到膀胱颈位置,对无菌要求比较严格,术后还需要导尿,因此大鼠能顺利手术且存活4周以上是关键[9]。
OAB可能与炎症有关很早就被研究证实,主要原因可能是由于体内刺激或压力导致的炎性细胞因子的释放[10]。这些前期的研究也在当前DO大鼠模型中得到证实,支持了炎症反应参与OAB发生的研究结果[11]。最近研究表明:白细胞和膀胱中的其他非炎性细胞释放表达的趋化因子,作用于尿路上皮和逼尿肌中的驻留细胞,可以进一步扩增、诱导浸润免疫细胞产生膀胱炎症[12]。根据相对位置和保守的N-末端半胱氨酸残基的数量,以及间隔氨基酸的有无,将趋化因子细分为4个家族(CXC、CC、C和CX3C)。研究提示第1个半胱氨酸之前具有谷氨酸-亮氨酸-精氨酸基序的CXC趋化因子(如GRO-a/CXCL1),有血管生成和促进中性粒细胞趋化特性[13]。值得注意的是,据报道细菌感染可诱导CXC家族产生更高水平的趋化因子[14]。本研究在DO模型大鼠体内发现相似水平的CXC趋化因子(ccl4、cxcr2和ccl17)以及补体c3水平的升高。表明OAB后不同的炎症通路被激活,可能跟患者疼痛有关,进一步证实炎症反应在OAB发生中的作用[13]。
本研究中值得关注的是Hcn通道各亚型中仅有Hcn1通道蛋白在DO模型中表达降低,其他亚基表达均没有显著改变,且还得到RT-PCR和Western blot结果的证实。而信号通路富集显示Hcn1所在的电压门控性钠离子通道活性被抑制,从侧面证实Hcn1离子通道的失活在OAB中的作用。Hcn1通道蛋白主要在人类新皮层、海马、小脑皮层的神经元表达,在大脑皮层第V层锥体神经元高表达,而在皮层的其他层没有表达。窦房结是心脏的起搏点,自律性高,受神经和体液调控,主要表达Hcn4和Hcn1。在膀胱兴奋异常性疾病既往研究中,Hcn通道蛋白的表达及功能均发生显著变化。课题组前期研究发现糖尿病膀胱及骶下脊髓横断诱导的神经源性膀胱时膀胱表现为低活动性[15],在这类疾病中Hcn通道4个亚型的表达及Ih密度均明显下降[16];在膀胱出口部分梗阻(partial bladder outlet obstruction, PBOO)引起的DO膀胱中,ICC-LCs上Hcn通道4个亚型的表达及Ih电流密度均明显增加[16];小鼠Hcn1通道基因敲除下调了其膀胱ICCs中BK通道的表达和功能,导致膀胱兴奋起搏的不足,进一步引起膀胱收缩性减弱[17]。同时还发现环磷酰胺诱导的OAB小鼠模型中Hcn通道4个亚型蛋白表达以及Ih密度均显著增加,进而导致膀胱高兴奋性。而Hcn1通道敲除可以显著缓解OAB时膀胱ICC-LCs高兴奋性以及膀胱逼尿肌肌条强收缩性,从而改善膀胱功能[18],提示Hcn通道表达及功能的增加是OAB时膀胱兴奋性调节异常的重要原因。本研究结果提示DO模型大鼠膀胱Hcn1离子通道的表达降低,但是仅是膀胱整体组织RNA-seq和蛋白表达情况,并不能反映间质ICC-LCs类细胞的表达,虽然我们前期的研究结果显示HCN通道在PBOO或者炎症小鼠膀胱的ICC-LCs表达和功能增强,并不能说明膀胱其他类细胞(包括逼尿肌细胞、神经细胞、上皮细胞等)中Hcn通道的表达和功能。并且,不同的模型处理可能对结果影响较大,更深入的研究需要将膀胱细胞进行分类和功能分析。不管未来的研究结果如何,这些研究均提示Hcn通道是膀胱自发兴奋性调控的核心环节,而其蛋白表达及功能异常与膀胱兴奋性调控异常密切相关。
| [1] | GRIEBLING T L. Overactive bladder in elderly men: epidemiology, evaluation, clinical effects, and management[J]. Curr Urol Rep, 2013, 14(5): 418–425. DOI:10.1007/s11934-013-0367-0 |
| [2] | WEN J G, LI J S, WANG Z M, et al. The prevalence and risk factors of OAB in middle-aged and old people in China[J]. Neurourol Urodynam, 2014, 33(4): 387–391. DOI:10.1002/nau.22429 |
| [3] | REYNOLDS W S, FOWKE J, DMOCHOWSKI R. The burden of overactive bladder on US public health[J]. Curr Bladder Dysfunct Rep, 2016, 11(1): 8–13. DOI:10.1007/s11884-016-0344-9 |
| [4] | HE C, CHEN F, LI B, et al. Neurophysiology of HCN channels: from cellular functions to multiple regulations[J]. Prog Neurobiol, 2014, 112: 1–23. DOI:10.1016/j.pneurobio.2013.10.001 |
| [5] |
丁砺蠡, 王永权, 方强, 等. 大鼠不稳定膀胱中ICCs细胞中HCN蛋白表达的变化[J].
第三军医大学学报, 2008, 30(7): 578–581.
DING L L, WANG Y Q, FANG Q, et al. Variation of HCN protein expression in interstitial cells of Cajal from rat with detrusor instability[J]. J Third Mil Med Univ, 2008, 30(7): 578–581. DOI:10.3321/j.issn:1000-5404.2008.07.008 |
| [6] | SUBRAMANIAN A, KUEHN H, GOULD J, et al. GSEA-P: a desktop application for gene set enrichment analysis[J]. Bioinformatics, 2007, 23(23): 3251–3253. DOI:10.1093/bioinformatics/btm369 |
| [7] | CRUZ F. Mechanisms involved in new therapies for overactive bladder[J]. Urology, 2004, 63(3 Suppl 1): 65–73. DOI:10.1016/j.urology.2003.11.001 |
| [8] | PARSONS B A, DRAKE M J. Animal models in overactive bladder research[J]. Handb Exp Pharmacol, 2011(202): 15–43. DOI:10.1007/978-3-642-16499-6_2 |
| [9] | SOLER R, CAMPEAU L, FÜLLHASE C, et al. Overactive bladder models[M]//SZALLASI A, BIRÓ T. TRP channels in drug discovery. Methods in pharmacology and toxicology. Totowa: Humana Press, 2012: 411-431. DOI: /10.1007/978-1-62703-077-9_21. |
| [10] | TYAGI P, BARCLAY D, ZAMORA R, et al. Urine cytokines suggest an inflammatory response in the overactive bladder: a pilot study[J]. Int Urol Nephrol, 2010, 42(3): 629–635. DOI:10.1007/s11255-009-9647-5 |
| [11] | PILLALAMARRI N, SHALOM D F, PILKINTON M L, et al. Inflammatory urinary cytokine expression and quality of life in patients with overactive bladder[J]. Female Pelvic Med Reconstr Surg, 2018, 24(6): 449–453. DOI:10.1097/SPV.0000000000000492 |
| [12] | BOUCHELOUCHE K, ALVAREZ S, HORN T, et al. Human detrusor smooth muscle cells release interleukin-6, interleukin-8, and RANTES in response to proinflammatory cytokines interleukin-1beta and tumor necrosis factor-alpha[J]. Urology, 2006, 67(1): 214–219. DOI:10.1016/j.urology.2005.07.049 |
| [13] | SAINI R, GONZALEZ R R, TE A E, et al. Chronic pelvic pain syndrome and the overactive bladder: the inflammatory link[J]. Curr Urol Rep, 2008, 9(4): 314–319. DOI:10.1007/s11934-008-0054-8 |
| [14] | ARMBRUSTERC E, SMITH S N, MODYL, et al. Urine cytokine and chemokine levels predict urinary tract infection severity independent of uropathogen, urine bacterial burden, host genetics, and host age[J]. Infect Immun, 2018, 86(9): IAI.00327–IAI.00318. DOI:10.1128/IAI.00327-18 |
| [15] | LIU Q, WU C, HUANG S Q, et al. Decreased hyperpolarization-activated cyclic nucleotide-gated channels are involved in bladder dysfunction associated with spinal cord injury[J]. Int J Mol Med, 2018, 41(5): 2609–2618. DOI:10.3892/ijmm.2018.3489 |
| [16] | DENG T X, ZHANG Q, WANG Q Q, et al. Changes in hyperpolarization-activated cyclic nucleotide-gated channel expression and activity in bladder interstitial cells of Cajal from rats with detrusor overactivity[J]. Int Urogynecol J, 2015, 26(8): 1139–1145. DOI:10.1007/s00192-015-2632-x |
| [17] |
孙碧韶, 刘骞, 朱景振, 等. HCN1通道基因敲除下调小鼠膀胱Cajal间质细胞中BK通道的表达及功能[J].
第三军医大学学报, 2015, 37(12): 1281–1287.
SUN B S, LIU Q, ZHU J Z, et al. Knock out of HCN1 channels down-regulates expression and function of BK channels in interstitial cells of Cajal in mouse urinary bladder[J]. J Third Mil Med Univ, 2015, 37(12): 1281–1287. DOI:10.16016/j.1000-5404.201501226 |
| [18] | LIU Q, LONG Z, DONG X Y, et al. Cyclophosphamide-induced HCN1 channel upregulation in interstitial Cajal-like cells leads to bladder hyperactivity in mice[J]. Exp Mol Med, 2017, 49(4): e319. DOI:10.1038/emm.2017.31 |



