非ST段抬高型急性冠脉综合征(non-ST-segment elevation acute coronary syndrome,NSTE-ACS)的发病率高,近年来在急性冠脉综合征(ACS)中的占比超过了70%;而NSTE-ACS的近期预后与ST段抬高型心肌梗死(ST-segment elevation myocardial infarction, STEMI)相当,远期预后甚至更差[1]。因此,寻找新的疾病标志物有助于NSTE-ACS的危险分层和优化管理,对于改善预后具有重要的临床意义。动脉粥样硬化被认为是慢性炎症参与的血管疾病[2],近期的CANTOS研究[3]显示抗炎治疗可以显著降低心梗患者的心血管事件风险。因此,利用炎症相关指标来评估NSTE-ACS的风险和预后具有一定的可行性。
循环单核细胞是动脉粥样斑块中巨噬/泡沫细胞的来源,是病变进程中的关键炎症细胞[4];而高密度脂蛋白胆固醇(HDL-C)可以对抗动脉粥样硬化的进展,是重要的心血管保护因素[5]。近期的研究[6]报道单核细胞与高密度脂蛋白胆固醇的比值(monocyte-to-high density lipoprotein cholesterol ratio,MHR)可以反映系统性炎症水平,且与动脉粥样硬化相关。然而,有关MHR和ACS的人群研究资料较少,MHR在NSTE-ACS预后中的作用目前尚不明确。因此,本研究拟探讨MHR对NSTE-ACS患者12个月内主要不良心脑血管事件(major adverse cardiovascular and cerebrovascular events,MACCE)的影响。
1 资料与方法 1.1 一般资料本研究为回顾性队列研究,选择2017年1月至2017年9月于陆军军医大学第二附属医院心血管内科住院的NSTE-ACS患者, NSTE-ACS的定义和诊断标准参照中国非ST段抬高型急性冠脉综合征诊断和治疗指南(2016)[7]。纳入标准为:①入院后均行冠脉造影检查;②具有完整的病历记录和临床资料。排除合并有如下疾病的患者:①非阻塞性冠脉疾病;②感染性疾病;③恶性肿瘤及接受化放疗;④造血系统功能异常、出凝血疾病及大量失血;⑤自身免疫性疾病及接受类固醇激素或其他免疫抑制剂治疗;⑥慢性肝病及肾功能不全;⑦原发性心肌病及心脏瓣膜病;⑧1月内有严重创伤或接受外科手术。最终共纳入435例患者,其中男性患者293例(67.4%),女性142例(32.6%),年龄53.0~68.0岁,平均62.0岁。单核细胞值以A×109/mL表示,HDL-C值以B×mmol/L表示,两个指标单位前数值的比值A/B即为MHR值。研究对象按MHR水平分为3组,以前三分位数组的145例为低水平组(0.152~0.433),以中三分位数组的145例为中水平组(0.435~0.633),以后三分位数组的145例为高水平组(0.636~2.904)。
1.2 收集录入收集患者的一般资料,包括人口学数据、疾病史、诊断及治疗情况等,并记录实验室检测指标。依据危险因素对每位患者进行GRACE评分,GRACE评分的8项指标分别为:年龄、Killip分级、收缩压、ST段变化、就诊时有无心脏骤停、初始心肌损伤标志物是否升高、血清肌酐以及心率。GRACE评分预测出院后6个月的死亡风险,依照积分高低,可分为低危(≤88)、中危(88~118)以及高危(>118)[8]。
1.3 随访与结局利用病历考察、电话访谈和门诊随访等方式对纳入患者进行随访。随访起始点为患者入院时间,限定随访期限为12个月,末次随访时间为2018年10月。主要观察结局为包括心源性死亡、心肌梗死、血运重建、心力衰竭以及卒中在内的主要不良心脑血管事件(MACCE)。
1.4 统计学分析使用SPSS 22.0软件进行统计学处理。分类变量以频数(百分数)表示。采用Kolmogorov-Smironov方法检验数据正态分布,符合正态分布的连续变量以x±s的方式表示,不符合正态分布的连续变量以M(P25~P75)表示。组间比较:分类变量采用χ2或Fisher确切概率法检验;正态分布且方差齐性的3组连续变量采用单因素方差分析,非正态分布的2组及3组连续变量分别采用Mann-Whitney U检验及Kruskal-Wallis H检验。相关分析采用Spearman秩相关;多因素分析采用COX比例风险回归模型;结局分析采用Kaplan-Meier法,并使用Log-rank法进行比较检验。
2 结果 2.1 MHR各组间的一般资料比较NSTE-ACS患者按照MHR水平均分为低、中、高3组。3组患者在性别、吸烟史、高血压史、卒中史、应用β受体阻滞剂、应用血管紧张素转化酶抑制剂/血管紧张素Ⅱ受体拮抗剂等方面,差异无统计学意义(P>0.05);而在年龄、糖尿病史、Killip分级、GRACE评分、经皮冠脉介入治疗率等方面,差异有统计学意义(P<0.05)。重要的是,3组间的MACCE有显著统计学差异(P<0.01),MACCE随MHR增高而增多,高水平组(25.5%)的MACCE明显多于中(17.2%)、低水平组(11.0%,表 1)。
| MHR分组 | n | 男性 /例(%) |
年龄 /岁,M(P25~P25) |
BMI≥24 kg/m2 /例(%) |
吸烟史 /例(%) |
高血压史 /例(%) |
收缩压 /mmHg,x±s |
舒张压 /mmHg,x±s |
糖尿病史 /例(%) |
卒中史 /例(%) |
Killip分级≥2 /例(%) |
GRACE评分 /M(P25~P25) |
ACEI/ARB /例(%) |
β-blocker /例(%) |
PCI/CABG /例(%) |
MACCE /例(%) |
心源性死亡 /例(%) |
心肌梗死 /例(%) |
血运重建 /例(%) |
心力衰竭 /例(%) |
卒中 /例(%) |
| 低水平组(0.152~0.433) | 145 | 98(67.6) | 58(49~65) | 74(51.0) | 64(44.1) | 45(31.0) | 130.9±21.0 | 76.6±14.6 | 31(21.4) | 16(11.0) | 15(10.3) | 84(73~103) | 119(82.1) | 106(73.1) | 94(64.8) | 16(11.0) | 3(2.1) | 4(2.8) | 6(4.1) | 2(1.4) | 1(0.7) |
| 中水平组(0.435~0.633) | 145 | 99(68.3) | 61(52~68) | 89(61.4) | 65(44.8) | 55(37.9) | 133.2±19.9 | 77.7±12.9 | 47(32.4) | 14(9.7) | 59(40.7) | 100(87~111) | 120(82.8) | 105(72.4) | 109(75.2) | 25(17.2) | 5(3.4) | 6(4.1) | 9(6.2) | 3(2.1) | 2(1.4) |
| 高水平组(0.636~2.904) | 145 | 96(66.2) | 68(62~72) | 66(45.5) | 64(44.1) | 38(26.2) | 124.0±19.8 | 74.3±11.8 | 48(33.1) | 17(11.7) | 95(65.5) | 119(95~135) | 121(83.4) | 107(73.8) | 113(77.9) | 37(25.5) | 7(4.8) | 9(6.2) | 12(8.3) | 5(3.4) | 4(2.8) |
| F/χ2 | - | 0.146 | 69.278 | 7.543 | 0.019 | 4.649 | 8.145 | 2.537 | 8.852 | 0.334 | 93.205 | 76.879 | 0.097 | 0.070 | 6.964 | 10.404 | 1.630 | 2.008 | 2.132 | 1.356 | 1.834 |
| P | 0.929 | <0.01 | 0.023 | 0.991 | 0.098 | <0.01 | 0.080 | 0.047 | 0.846 | <0.01 | <0.01 | 0.953 | 0.966 | 0.031 | 0.006 | 0.490 | 0.392 | 0.344 | 0.620 | 0.515 |
2.2 MHR各组间的实验室指标比较
MHR三组间,HbA1c、HDL-C、肌酐、BNP、CRP、白细胞及各成分计数等指标有显著的统计学差异(P<0.01),而TC、TG、LDL-C及尿酸等指标未见统计学差异(P>0.05,表 2)。
| MHR分组 | HbA1c /(%),M(P25~P25) |
TC /mmol·L-1, x±s |
LDL-C /mmol·L-1, x±s |
HDL-C mmol·L-1, M(P25~P25) |
TG /mmol·L-1, M(P25~P25) |
肌酐 μmol·L-1, x±s |
尿酸 /μmol·L-1, x±s |
BNP /pg·mL-1, M(P25~P25) |
CRP /μg·mL-1, M(P25~P25) |
白细胞计数 /×109·L-1, M(P25~P25) |
中性粒细胞计数 ×109·L-1, M(P25~P25) |
单核细胞计数 /×109·L-1, M(P25~P25) |
淋巴细胞计数 /×109·L-1, x±s |
MHR /M(P25~P25) |
| 低水平组(0.152~0.433) | 5.9(5.6~6.4) | 4.24±1.05 | 2.73±0.81 | 1.14(0.99~1.34) | 1.29(0.93~1.95) | 69.3±13.8 | 344.4±96.5 | 26.0(5.4~79.3) | 5.00(5.00~5.65) | 6.20(5.12~7.56) | 3.76(3.08~4.62) | 0.39(0.34~0.45) | 1.74±0.66 | 0.358(0.305~0.393) |
| 中水平组(0.435~0.633) | 6.2(5.8~6.7) | 4.12±1.10 | 2.71±0.82 | 0.98(0.88~1.08) | 1.52(1.10~2.21) | 72.3±13.5 | 360.0±91.9 | 68.3(27.6~172.0) | 5.50(5.00~7.85) | 6.84(5.96~8.47) | 4.34(3.44~5.87) | 0.52(0.46~0.57) | 1.66±0.58 | 0.530(0.479~0.581) |
| 高水平组(0.636~2.904) | 6.0(5.7~6.9) | 4.18±1.07 | 2.70±0.79 | 0.85(0.76~0.99) | 1.44(1.09~2.02) | 76.0±15.2 | 340.7±97.1 | 149.0(62.9~363.5) | 8.90(5.60~15.50) | 7.61(5.98~9.81) | 5.18(3.79~6.79) | 0.68(0.59~0.80) | 1.50±0.58 | 0.768(0.686~0.887) |
| F/χ2 | 11.943 | 0.480 | 0.047 | 120.106 | 5.555 | 8.183 | 1.678 | 88.370 | 101.139 | 26.213 | 31.362 | 236.085 | 5.850 | 385.782 |
| P | 0.003 | 0.619 | 0.954 | <0.01 | 0.062 | <0.01 | 0.188 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | 0.003 | <0.01 |
2.3 MHR水平与心血管危险因素的相关性分析
MHR与年龄(r=0.394)、GRACE评分(r=0.443)、CRP(r=0.534)、肌酐(r=0.204)、HbA1C(r=0.152)、BNP(r=0.484)、白细胞(r=0.295)及中性粒细胞计数(r=0.318)等指标显著正相关(P<0.01)。
2.4 MHR与GRACE评分及MACCE的关系 2.4.1 GRACE危险分层间的MHR比较GRACE评分低危组146例,MHR为0.409(0.349~0.549);中危组174例,MHR为0.540(0.441~0.645);高危组115例,MHR为0.697 (0.549~0.833),3组间MHR差异有统计学意义(P<0.01)。其中,中危组高于低危组,高危组高于中危组,差异均有统计学意义(P<0.01)。
2.4.2 有无MACCE组间的MHR比较随访12个月,共出现78例MACCE(17.9%);按是否发生MACCE分为两组,并比较两组间的MHR。MACCE组为0.622(0.471~0.809),无MACCE组为0.510(0.378~0.669),组间差异有统计学意义(P<0.01)。
2.5 MACCE的COX回归分析单因素COX回归分析显示年龄≥65岁、糖尿病、Killip分级≥2、BNP>100 pg/mL、CRP>5 μg/mL以及MHR与MACCE相关(P<0.05)。将以上危险因素(P<0.05)联合其他重要临床因素纳入多因素模型进行调整,以逐步向前回归法筛选自变量,结果显示年龄≥65岁、糖尿病、Killip≥2、应用β受体阻滞剂和MHR这五项与MACCE显著相关(P<0.05)。年龄≥65岁、糖尿病、Killip≥2和MHR是MACCE的独立预后危险因素,应用β受体阻滞剂是MACCE的独立预后保护因素。Cox回归分析显示MHR是NSTE-ACS患者发生MACCE的独立预测因子(HR=2.193,95%CI:1.075~4.472,P=0.031,表 3)。
| 变量 | 单因素分析 | 多因素分析 | |||||
| HR | 95%CI | P | HR | 95% CI | P | ||
| 年龄>60岁 | 2.476 | (1.489~4.116) | <0.001 | 2.230 | (1.329~3.741) | 0.002 | |
| 男性 | 1.007 | (0.626~1.621) | 0.976 | ||||
| BMI≥24 kg/m2 | 1.071 | (0.687~1.670) | 0.761 | ||||
| 吸烟史 | 1.066 | (0.681~1.668) | 0.779 | ||||
| 高血压 | 1.207 | (0.737~1.977) | 0.454 | ||||
| 糖尿病 | 1.875 | (1.196~2.938) | 0.006 | 1.675 | (1.065~2.634) | 0.026 | |
| 卒中史 | 1.088 | (0.500~2.365) | 0.831 | ||||
| Killip分级≥2 | 2.171 | (1.388~3.397) | 0.001 | 1.597 | (1.002~2.546) | 0.049 | |
| PCI/CABG | 0.732 | (0.428~1.254) | 0.256 | ||||
| ACEI/ARB | 0.889 | (0.481~1.645) | 0.708 | ||||
| β受体阻滞剂 | 0.648 | (0.406~1.033) | 0.068 | 0.601 | (0.375~0.964) | 0.035 | |
| 肌酐 | 1.394 | (0.891~2.180) | 0.146 | — | — | NS | |
| BNP>100 pg/mL | 1.909 | (1.222~2.982) | 0.005 | — | — | NS | |
| CRP>5 μg/mL | 1.757 | (1.092~2.826) | 0.020 | — | — | NS | |
| MHR | 2.528 | (1.500~4.261) | <0.001 | 2.193 | (1.075~4.472) | 0.031 | |
| LDL-C | 1.042 | (0.792~1.371) | 0.771 | ||||
| 白细胞计数 | 1.031 | (0.959~1.110) | 0.407 | ||||
| 中性粒细胞计数 | 1.066 | (0.994~1.143) | 0.072 | — | — | NS | |
2.6 MHR组间12个月的心血管结局分析
利用Kaplan-Meier法比较MHR低、中、高3组的12个月心血管结局有无差异。3组间的无MACCE生存率差异有统计学意义(log-rank=9.786,P=0.007);3组间的心源性死亡率差异无统计学意义(log-rank=1.888,P=0.169,图 1)。
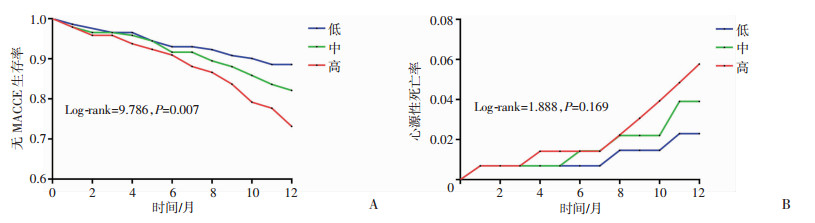
|
| A:NSTE-ACS患者12个月无MACCE生存曲线;B:NSTE-ACS患者12个月心源性死亡累积风险曲线 图 1 NSTE-ACS患者12个月心血管结局分析 |
3 讨论
本研究探讨了MHR水平对NSTE-ACS患者预后的影响。研究结果显示,MHR高水平组患者具有更多的心血管危险因素,MHR水平与炎症指标及GRACE评分成正相关;在12个月的随访区间内,MHR水平越高,MACCE发生率越高,MHR是NSTE-ACS患者发生MACCE的一个独立预测因子。
MHR是一个由循环单核细胞数和HDL-C组成的复合指标。循环单核细胞大致可分为经典亚群和非经典亚群两类。经典亚群约占单核细胞总数的90%,以CD14++CD16-为分子标记,在动脉粥样硬化中发挥重要作用;非经典亚群以CD14++CD16+及CD14+CD16++为分子标志,起免疫调节的作用[9]。HDL-C除了执行胆固醇逆转运,还参与抗炎和抗氧化等病理生理过程[10]。单核细胞与HDL-C之间也存在相互作用,HDL-C可抑制单核细胞迁移至血管壁,并抑制单核细胞的活化从而下调炎症[11];单核细胞亦可分泌蛋白酶影响HDL-C的成分[12];二者分别作为促炎和抗炎的因素参与粥样硬化进程,促炎因素的激活和抗炎因素的受抑引起粥样硬化炎症水平升高[13]。因此,MHR可能反映的不仅是静止的炎症状态,更是动态的炎症趋势,被视作一个新型的炎症标志物,并与心血管疾病密切相关。
有研究报道,稳定性冠心病患者的MHR与IL-6、CRP、amyloid A、MCP-1等炎症因子成正相关[14-15]。本研究发现MHR与CRP在NSTE-ACS人群中依然高度相关,且随着MHR的升高,心血管危险因素也相应增加。这再次肯定了MHR的炎症属性,并显示了MHR与NSTE-ACS的密切关系。有研究表明,高MHR可以预测高血压靶器官损害、冠脉斑块体积及病变严重程度[16-17]。由于高血压与冠脉病变严重程度均为NSTE-ACS的重要危险因素,故提示MHR可能有利于NSTE-ACS的风险评估。然而,临床常用的ACS评估模型并未纳入炎症相关指标,缺乏炎症因素对NSTE-ACS风险和预后的评价[18]。我们进一步比较了GRACE各分层间的MHR水平,发现MHR与GRACE之间也具有较好的关联性;MHR水平越高,GRACE评分越大,相应的心血管死亡风险也增大。因此,作为一个简易实用的指标,MHR可能有助于NSTE-ACS风险的初步评估,便于临床决策和疾病管理。
本研究重点探讨了MHR对NSTE-ACS患者12个月心血管结局的影响。我们发现,随着MHR水平的升高,总的MACCE发生率也相应地增加;限于样本量及随访时间,尽管MACCE的各成分事件未显示出显著的组间差异,但在数值上,高MHR的NSTE-ACS患者仍然具有更多的不良心血管事件;多因素回归分析进一步显示MHR是MACCE的独立预测因素。在近期研究中,Cicek等[19]也发现MHR与STEMI患者的全因死亡率显著相关;Cetin等[20]则发现MHR水平可以独立预测STEMI患者PCI术后的支架内血栓风险。MHR对心血管结局的影响取决于病变进程中的炎症水平,而慢性炎症与脂质积累是动脉粥样硬化的主要特征,MHR兼具炎症和脂质两方面的参数,相较其他的炎症指标,或许更能反映粥样硬化的炎症特点并预测疾病风险。因此,MHR对MACCE的独立预测作用可能归因于如下的炎症机制:①炎症促进斑块进展,加重心肌缺血,增加缺血驱动的血运重建和心功能不全[21];②炎症介导斑块不稳定,易损斑块破裂导致急性心血管事件[21];③炎症抑制内皮的抗栓功能,诱发血液高凝状态,促进血栓形成[22];④炎症诱导血管平滑肌细胞迁移至内膜,并刺激其异常增殖,引起支架术后再狭窄,增加PCI术后缺血事件[23];⑤炎症诱导冠脉钙化和瘤样扩张,加重冠脉病变复杂程度,增大了介入治疗的难度和风险,不利于完全血运重建[24]。
综上所述,MHR是NSTE-ACS的一个独立预后危险因素,检测MHR有助于NSTE-ACS的优化管理,从而减少心血管事件。本研究也存在包括回顾性研究方式,样本量较小,随访时间较短等诸多局限,希望今后通过设计前瞻性、大样本试验来进行更为充分的论证。
| [1] | ROFFI M, PATRONO C, COLLET J, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation[J]. Eur Heart J, 2016, 37(3): 267–315. DOI:10.1093/eurheartj/ehv320 |
| [2] | HANSSON G K. Inflammation and atherosclerosis: the end of a controversy[J]. Circulation, 2017, 136(20): 1875–1877. DOI:10.1161/CIRCULATIONAHA.117.030484 |
| [3] | RIDKER P M, EVERETT B M, THUREN T, et al. Anti inflammatory therapy with canakinumab for atherosclerotic disease[J]. New Engl J Med, 2017, 377(12): 1119–1131. DOI:10.1056/NEJMoa1707914 |
| [4] | PATEL V K, WILLIAMS H, LI S C H, et al. Monocyte inflammatory profile is specific for individuals and associated with altered blood lipid levels[J]. Atherosclerosis, 2017, 263: 15–23. DOI:10.1016/j.atherosclerosis.2017.05.026 |
| [5] | CHOI H Y, HAFIANE A, SCHWERTANI A, et al. High-density lipoproteins: biology, epidemiology, and clinical management[J]. Can J Cardiol, 2017, 33(3): 325–333. DOI:10.1016/j.cjca.2016.09.012 |
| [6] | SATOH K, SHIMOKAWA H. Recent advances in the development of cardiovascular biomarkers[J]. Arterioscler Thromb Vasc Biol, 2018, 38(5): e61–e70. DOI:10.1161/ATVBAHA.118.310226 |
| [7] |
中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 非ST段抬高型急性冠状动脉综合征诊断和治疗指南(2016)[J].
中华心血管病杂志, 2017, 45(5): 359–376.
Chinese Society of Cardiology of Chinese Medical Association, Editorial Board of Chinese Journal of Cardiology. Guideline and consensus for the management of patients with non-ST- elevation acute coronary syndrome (2016)[J]. Chin J Cardiol, 2017, 45(5): 359–376. DOI:10.3760/cma.j.issn.0253-3758.2017.05.003 |
| [8] | FOX K A, DABBOUS O H, GOLDBERG R J, et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE)[J]. BMJ-Brit Med J, 2006, 333(7578): 1091. DOI:10.1136/bmj.38985.646481.55 |
| [9] | GISTERA A, HANSSON G K. The immunology of atherosclerosis[J]. Nat Rev Nephrol, 2017, 13(6): 368–380. DOI:10.1038/nrneph.2017.51 |
| [10] | AWAN Z, GENEST J. Inflammation modulation and cardiovascular disease prevention[J]. Eur J Prev Cardiol, 2014, 22(6): 719–733. DOI:10.1177/2047487314529350 |
| [11] | MARSCHE G, SAEMANN M D, HEINEMANN A, et al. Inflammation alters HDL composition and function: Implications for HDL-raising therapies[J]. Pharmacol Ther, 2013, 137(3): 341–351. DOI:10.1016/j.pharmthera.2012.12.001 |
| [12] | GORDON S M, REMALEY A T. High density lipoproteins are modulators of protease activity: Implications in inflammation, complement activation, and atherothrombosis[J]. Atherosclerosis, 2017, 259: 104–113. DOI:10.1016/j.atherosclerosis.2016.11.015 |
| [13] |
LIBBY P, TABAS I, FREDMAN G, et al. Inflammation and its resolution as determinants of acute coronary syndrome[J].
Circ Res, 2014, 114(12): 1867–1879.
DOI:10.1161/ |
| [14] | GOMARASCHI M, BASILICO N, SISTO F, et al. High-density lipoproteins attenuate interleukin-6 production in endothelial cells exposed to pro-inflammatory stimuli[J]. Biochim Biophys Acta, 2005, 1736(2): 136–143. DOI:10.1016/j.bbalip.2005.08.003 |
| [15] | ACIKGOZ S K, ACIKGOZ E, SENSOY B, et al. Monocyte to high-density lipoprotein cholesterol ratio is predictive of in-hospital and five-year mortality in ST-segment elevation myocardial infarction[J]. Cardiol J, 2016, 23(5): 505–512. DOI:10.5603/CJ.a2016.0026 |
| [16] | AYDIN E, ATES I, FETTAH ARIKAN M, et al. The ratio of monocyte frequency to HDL cholesterol level as a predictor of asymptomatic organ damage in patients with primary hypertension[J]. Hypertens Res, 2017, 40(8): 758–764. DOI:10.1038/hr.2017.36 |
| [17] | AKBOGA M K, BALCI K G, MADEN O, et al. Usefulness of monocyte to HDL-cholesterol ratio to predict high SYNTAX score in patients with stable coronary artery disease[J]. Biomark Med, 2016, 10(4): 375–383. DOI:10.2217/bmm-2015-0050 |
| [18] | BETTINGER N, PALMERINI T, CAIXETA A, et al. Risk stratification of patients undergoing medical therapy after coronary angiography[J]. Eur Heart J, 2016, 37(40): 3103–3110. DOI:10.1093/eurheartj/ehv674 |
| [19] | CICEK G, KUNDI H, BOZBAY M, et al. The relationship between admission monocyte HDL-C ratio with short-term and long-term mortality among STEMI patients treated with successful primary PCI[J]. Coronary Artery Dis, 2016, 27(3): 176–184. DOI:10.1097/MCA.0000000000000343 |
| [20] | CETIN E H O, CETIN M S, CANPOLAT U, et al. Monocyte/HDL-cholesterol ratio predicts the definite stent thrombosis after primary percutaneous coronary intervention for ST-segment elevation myocardial infarction[J]. Biomark Med, 2015, 9(10): 967–977. DOI:10.2217/bmm.15.74 |
| [21] | KEDHI E, KENNEDY M W, MAEHARA A, et al. Impact of TCFA on unanticipated ischemic events in medically treated diabetes mellitus: insights from the PROSPECT Study[J]. JACC-Cardiovasc Imag, 2017, 10(4): 451. DOI:10.1016/j.jcmg.2015.12.023 |
| [22] | SAMAD F, RUF W. Inflammation, obesity, and thrombosis[J]. Blood, 2013, 122(20): 3415–3422. DOI:10.1182/blood-2013-05-427708 |
| [23] | MCDONALD R A, HALLIDAY C A, MILLER A M, et al. Reducing in-stent restenosis: therapeutic manipulation of miRNA in vascular remodeling and inflammation[J]. J Am Coll Cardiol, 2015, 65(21): 2314–2327. DOI:10.1016/j.jacc.2015.03.549 |
| [24] | YAHAGI K, KOLODGIE F D, LUTTER C, et al. Pathology of human coronary and carotid artery atherosclerosis and vascular calcification in diabetes mellitus highlights[J]. Arterioscler Thromb Vasc Biol, 2017, 37(2): 191–204. DOI:10.1161/ATVBAHA.116.306256 |



