2. 400016 重庆,重庆医科大学:基础医学院组织与胚胎教研室,干细胞与组织工程研究室;
3. 404120 重庆,三峡医药高等专科学校
2. Laboratory of Stem Cell and Tissue Engineering, Department of Histology and Embryology, College of Basic Medicine, Chongqing Medical University, Chongqing, 400016;
3. Chongqing Three Gorges Medical College, Chongqing, 404120, China
吴茱萸碱(evodiamine, EVO)提取自吴茱萸,具有多种生物活性,例如扩张血管、抗炎、抗肿瘤等[1-3]。作为世界上发病率第三高的恶性肿瘤,结肠癌(colorectal cancer, CRC)每年会导致超过600 000人死亡[4-5]。有研究显示EVO可以显著诱导结肠癌肿瘤细胞凋亡,抑制肿瘤细胞生长,然而其对于结肠癌肿瘤细胞的迁移以及侵袭的抑制机制仍不明确[6]。NF-κB家族包括:p65 (RelaA), RelB, c-Rel, p105/p50 (NF-κB1)以及p100/52 (NF-κB2)。作为一种核转录因子,调控着肿瘤的发生、增殖、分化、迁移、侵袭等[7-9]。NF-κB的转录活性受到细胞定位、磷酸化、乙酰化的调节[10-11]。因此本研究旨在对EVO抑制结肠癌SW480细胞迁移和侵袭的机制进行初步探讨。
1 材料与方法 1.1 材料、试剂与仪器细胞株:人结肠癌上皮细胞SW480由重庆医科大学附属第一医院馈赠。药品、试剂:EVO购自美国Selleck公司(货号:S2382);LPS和二甲基亚砜(DMSO)购自美国Sigma公司(货号:L2630, V90090);胎牛血清购自乌拉圭Lonsera公司(货号:S711-001S);高糖培养基DEME购自美国赛默飞世尔公司;蛋白浓度测定试剂盒、凝胶配制试剂盒、青链霉素购自中国碧云天公司;Cell Counting Kit-8 (CCK-8)购于日本DOJINDO公司;Matrigel胶和Transwell小室(直径6.5 mm,孔径8.0 μm)均购于Corning公司;一抗抗体IκBα、p-IκBα、NF-κB-p65、p-NF-κB-p65、β-actin购自美国Santa Cruz公司,MMP-9、MMP-13购自上海生工公司,MMP-2购自万类公司,二抗抗体购自Cell Signaling Technology公司,荧光二抗抗体购自Abbkine公司。主要仪器:低温高速离心机(平凡仪器,TGL-185);SDS-PAGE电泳仪:Bio-Rad(Power Pactm Basic);荧光显微镜:Leica(DMi8)。
1.2 方法 1.2.1 细胞培养与收集SW480细胞复苏后,用含10%胎牛血清、1%青链霉素的DEME培养基混匀细胞,在37 ℃、5%CO2条件下培养。EVO使用二甲基亚砜溶解为10 mmol/L的原液进行实验,二甲基亚砜的使用浓度小于0.1%。
1.2.2 CCK-8法检测细胞活性当细胞生长至对数期后,分别加入0、0.375、0.75、1.5、3、6、12 μmol/L的EVO培养24、48、72 h,在波长450 nm处测定光密度值[D(450)]。再根据公式计算细胞增殖率。
细胞增殖率=加药组D(450)值/对照组D(450)值×100%。
1.2.3 划痕实验将SW480细胞用胰蛋白酶消化重悬后,调整细胞数至5×106/L,接种于6孔细胞培养板,直至细胞长成单层后,用灭菌的10 μL枪头在细胞中划出笔直的划痕,用PBS冲去悬浮的细胞,用显微镜拍照。按实验设计分别加入含有不同浓度的EVO的培养基,培养24 h后,显微镜下拍照。
1.2.4 细胞侵袭实验预先将Matrigel用无血清的DEME培养基按1 :8的比例稀释,取80 μL稀释液铺于Transwell小室膜上,置于37 ℃,6 h凝固后,加入100 μL无血清的DEME培养基水化1 h。用胰蛋白酶消化无血清培养基重悬后,接种4×104/L的细胞于Transwell小室的上室。在小室下室分别加入500 μL不同浓度的EVO的培养基,置于37 ℃、5%CO2条件下培养。24 h后,用棉签擦去小室上室未侵袭的细胞和Matrigel,4%多聚甲醛室温固定30 min,PBS冲洗,结晶紫染色5 min,显微镜下拍照。
1.2.5 Western blot检测将SW480细胞分成4组,分别加入不同浓度(0、0.375、0.75、1.5 μmol/L)的EVO,作用24 h后收集细胞,抽提细胞全蛋白。蛋白进行SDS-PAGE电泳,电转至硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h,加入一抗(p-IκBα, p-NF-κB-p65和MMP-9,稀释比例均为1 :1 000)4 ℃孵育过夜。TBST液洗膜3次后,加入对应的二抗(稀释比例均为1 :10 000)室温孵育1 h,再用TBST洗膜,用ECL系统检测蛋白表达情况。用TBST再次洗膜,并用膜再生液于室温中摇床孵育30 min,重新进行封闭等步骤(一抗更换为IκBα、NF-κB-p65,稀释比例均为1 :2 000),并再次ECL系统检测蛋白表达情况。MMP-9、MMP-2、MMP-13以β-actin作为内参,p-IκBα、p-NF-κB-p65以IκBα、NF-κB-p65作为对照,独立实验重复3次。
1.2.6 免疫荧光实验取对数生长期的SW480细胞,2×105个细胞接种于铺有灭菌爬片的24孔板内培养24 h后,对照组加入完全培养基,加药组加入含1.5 μmol/L的EVO完全培养基。待药物作用24 h后,PBS(pH 8.0)洗3次,甲醛固定30 min后,PBS(pH 8.0)洗3次;0.1% Triton X-100作用30 min,PBS(pH 8.0)洗3次;山羊血清封闭60 min后,加入一抗抗体(p-NF-κB-p65和MMP-9,稀释比例均为1 :100),4 ℃孵育过夜;PBS(pH 8.0)洗3次,避光加入荧光二抗(稀释比例为1 :100)摇床上孵育2 h,避光加入DAPI(每孔10 μL)染核10 min,最后PBS(pH 8.0)洗3次,取出细胞爬片进行封片,荧光显微镜下拍照。
1.2.7 NF-κB-p65激活剂LPS预处理实验将SW480细胞分成3组,第1组不做药物处理;EVO组使用1.5 μmol/L的EVO处理24 h;激活剂组先用2.5 μmol/L的LPS预处理SW480细胞1 h后,再使用1.5 μmol/L的EVO处理24 h。实验结束后收集细胞,进行Western blot分析。
1.3 统计学处理采用SPSS 20.0统计软件进行分析。计量资料以x±s表示,两组之间的比较采用两两比较的独立样本t检验。检验水准α=0.05。
2 结果 2.1 EVO对SW480细胞增殖的影响使用CCK-8法检测不同浓度EVO作用于SW480细胞24、48、72 h后细胞的增殖率。如图 1所示,EVO能抑制SW480细胞的增殖,且呈时间和浓度依赖性。EVO作用SW480细胞48 h的IC50为12 μmol/L。
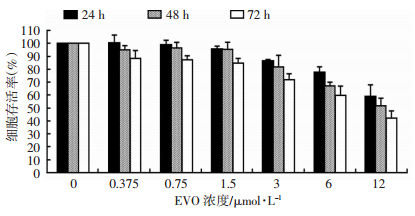
|
| 图 1 CCK-8法检测EVO对SW480细胞增殖的影响 |
2.2 EVO对SW480细胞迁移的影响
划痕实验检测SW480的迁移能力,如图 2所示:相较于对照组,加入0.375 μmol/L的EVO后,SW480迁移的距离减少,而随着EVO浓度的增加,SW480细胞的迁移距离愈加缩短(P < 0.01)。结果表明不同浓度的EVO对SW480的迁移具有抑制作用,并且呈现出浓度依赖性。

|
| A~E:划痕法检测不同浓度EVO(0 h 0 μmol/L,24 h 0, 0.375,0.75,1.5 μmol/L)对SW480细胞迁移的影响(×40);F:不同浓度EVO对SW480细胞迁移的影响;a: P < 0.01,与对照组(0 μmol/L)比较 图 2 EVO抑制SW480细胞的迁移 |
2.3 EVO对SW480细胞侵袭的影响
在Transwell小室上室铺上基质胶,以检测SW480的侵袭能力。如图 3所示:不同浓度的EVO对SW480的侵袭均有抑制作用,在1.5 μmol/L的EVO作用下,仅有约27个SW480细胞穿过了Transwell小室的上室。该结果表明随着浓度提高,EVO对SW480细胞侵袭的抑制作用也随之增强,呈现出浓度依赖性(P < 0.01)。
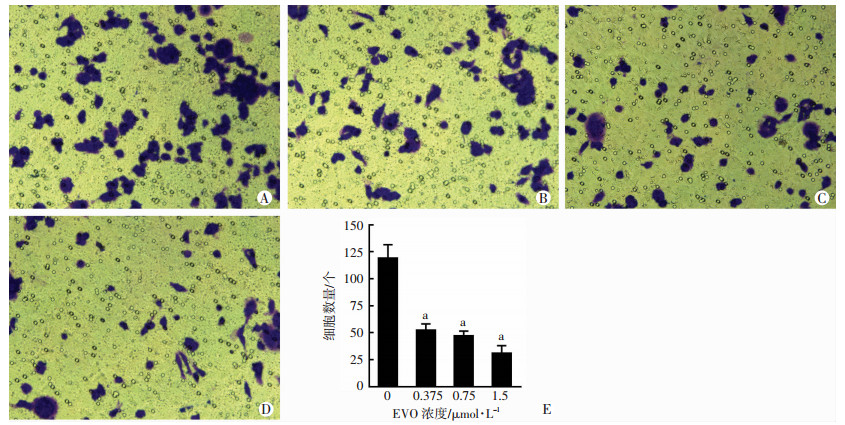
|
| A~D:Transwell法检测不同浓度EVO(0,0.375,0.75,1.5 μmol/L)对SW480细胞侵袭的影响(结晶紫×200);E:EVO对SW480细胞侵袭能力的影响a: P < 0.01,与对照组(0 μmol/L)比较 图 3 EVO对SW480细胞侵袭能力的影响 |
2.4 EVO对NF-κB-p65信号通路的影响
用不同浓度的EVO作用于SW480细胞后,抽提全蛋白,Western blot检测NF-κB-p65信号通路的相关蛋白。结果如图 4所示:EVO可显著抑制迁移与侵袭的相关蛋白MMP-9、MMP-2的表达(P < 0.05),但MMP-13的表达没有发生明显变化。尽管IκBα、NF-κB-p65的表达未受影响,但p-IκBα、p-NF-κB-p65的蛋白水平却明显下降(P < 0.01)。
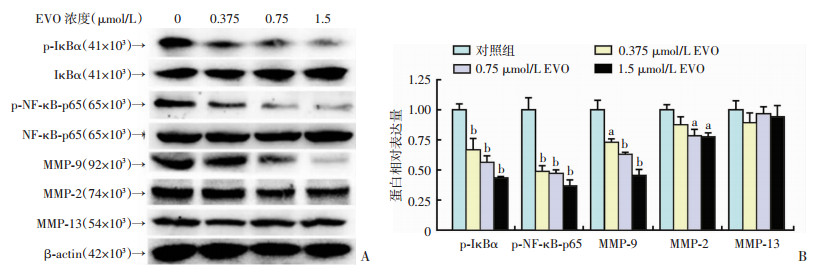
|
|
A: Western blot检测结果;B:半定量分析结果 a: P < 0.05, b: P < 0.01,与对照组(0 μmol/L)比较 图 4 EVO对SW480细胞NF-κB-p65信号通路的影响 |
2.5 EVO对p-NF-κB-p65和MMP-9表达的影响
免疫荧光结果显示:在无EVO诱导的情况下p-NF-κB-p65主要分布于SW480细胞的细胞核中,MMP-9主要分布于细胞胞质中;而用1.5 μmol/L的EVO作用于SW480细胞24 h后,p-NF-κB-p65和MMP-9的表达均显著减少(P < 0.01)。见图 5。
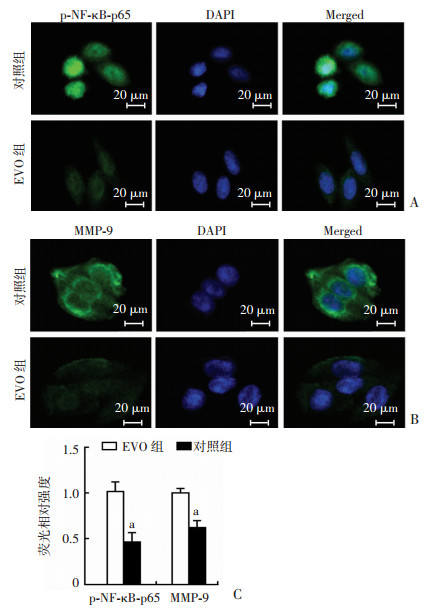
|
| A:免疫荧光检测NF-κB-p65的表达;B:免疫荧光检测MMP-9的表达;C:半定量分析结果 a: P < 0.01,与EVO组(1.5 μmol/L)比较 图 5 EVO对SW480细胞NF-κB-p65和MMP-9表达的影响 |
2.6 LPS削弱EVO对NF-κB-p65通路的抑制作用
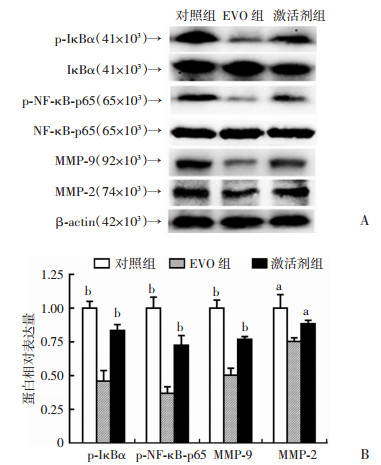
在使用NF-κB-p65的激活剂2.5 μmol/L LPS预处理SW480细胞1 h后,EVO对NF-κB-p65信号通路的抑制作用被显著削弱(P < 0.05,图 6)。
|
| A: Western blot检测结果;B:半定量分析结果 a: P < 0.05,b: P < 0.01,与EVO组(1.5 μmol/L)比较 图 6 LPS削弱EVO对NF-κB-p65通路的抑制作用 |
3 讨论
相关报道显示,EVO可以显著抑制多种肿瘤细胞的增殖,如肺癌、肝癌、胃癌、卵巢癌[12-15]。EVO也可以通过激活JNK信号通路来诱导结肠癌细胞的凋亡,阻滞其细胞周期于G2/M期,但其对于迁移和侵袭的影响却不明确[3]。因此,本研究着重探讨EVO对结肠癌细胞迁移和侵袭的影响,并初步探索其潜在的分子机制。
本研究首先使用CCK-8法检测EVO对SW480细胞的增殖抑制作用,结果显示,EVO能够显著抑制SW480细胞的增殖,且呈时间和浓度依赖性。在1.5 μmol/L的EVO作用24 h后,SW480细胞没有发生明显的增殖抑制。因此在后续的实验中选用0、0.375、0.75、1.5 μmol/L作为加药浓度,进一步研究EVO对SW480细胞迁移和侵袭的影响。
本研究划痕实验与Transwell实验结果显示EVO可以显著抑制结肠癌细胞SW480的迁移和侵袭,且呈浓度依赖性。结肠癌细胞的迁移和侵袭过程复杂,其中包括细胞的粘附、释放酶来降解细胞外基质(extracellular matrix,ECM)、细胞的增殖等[16]。在肿瘤的转移过程中,细胞与ECM之间的相互作用不可忽视[17]。基质金属蛋白酶家族(MMPs)已经被证明在各种ECM蛋白分解过程中扮演重要的角色。基质金属蛋白酶家族包括明胶酶、胶原酶、基质、弹性酶、膜型MMPs[18]。作为基质金属蛋白酶家族的重要成员,MMP-9能显著降解基底膜的主要成分——Ⅳ型胶原蛋白,调控肿瘤细胞的迁移和侵袭[19]。在结肠癌中,存在着MMPs的过表达现象,其中MMP-9的过表达尤其明显,MMPs的过度表达促进了结肠癌细胞的迁移与侵袭,因此抑制MMPs的表达可以作为一种潜在的治疗结肠癌的方式[20]。Western blot实验结果显示,MMP-9和MMP-2的蛋白表达被EVO明显的抑制, 并且随着EVO浓度的提高,抑制作用愈加明显,但MMP-13的表达没有明显变化。以上结果说明了EVO可以通过抑制MMPs的表达来抑制结肠癌的迁移与侵袭。
MMP-9和MMP-2的基因表达受到各种转录因子的调控,如AP-1、NF-κB、Sp-1等[21]。NF-κB-p65在细胞核内调节MMPs的表达,其转录活力受到其细胞定位、磷酸化的调节[22]。未激活状态下的NF-κB与IκBα结合形成复合体,存在于细胞质中。当IκBα被磷酸化后,其会发生泛素化并降解,释放出结合的NF-κB-p65[23]。而释放出的NF-κB-p65会被进一步磷酸化,随之增强其核定位信号,进入细胞核促进下游基因的表达[24]。通过Western blot和免疫荧光实验,发现1.5 μmol/L的EVO可以显著抑制IκBα、NF-κB-p65的磷酸化,从而抑制下游迁移与侵袭相关蛋白MMP-9和MMP-2的表达。在经过NF-κB-p65的激活剂LPS预处理后,发现EVO对NF-κB-p65的抑制作用被显著削弱,这说明EVO是通过抑制NF-κB-p65的活性来抑制MMP-9和MMP-2的基因表达,而不是通过抑制AP-1或者Sp-1来发挥抑制作用。在结肠癌细胞中,均存在着NF-κB-p65的持续性激活,NF-κB-p65的激活会促进下游目的基因如Bcl-2、c-Myc、MMP-9和MMP-2的高表达,促进了结肠癌细胞的增殖、迁移和侵袭[25]。因此,抑制NF-κB-p65的活性可以作为一种潜在的治疗结肠癌的方法,而EVO可以通过抑制NF-κB-p65的激活来抑制结肠癌迁移和侵袭。
本实验结果显示,EVO可以明显抑制结肠癌SW480细胞的迁移与侵袭,其机制是通过抑制IκBα/NF-κB-p65信号通路的激活来抑制迁移与侵袭相关蛋白的表达。该结果表明,EVO是一种潜在的治疗结肠癌的药物。
| [1] | KAN S F, YU C H, PU H F, et al. Anti-proliferative effects of evodiamine on human prostate cancer cell lines DU145 and PC3[J]. J Cell Biochem, 2007, 101(1): 44–56. DOI:10.1002/jcb.21036 |
| [2] | HEO S K, YUN H J, YI H S, et al. Evodiamine and rutaecarpine inhibit migration by LIGHT via suppression of NADPH oxidase activation[J]. J Cell Biochem, 2009, 107(1): 123–133. DOI:10.1002/jcb.22109 |
| [3] | CHIOU W F, KO H C, WEI B L. Evodia rutaecarpa and three major alkaloids abrogate influenza avirus (H1N1)-induced chemokines production and cell migration[J]. Evid Based Complement Alternat Med, 2011, 2011: 750513. DOI:10.1093/ecam/nep238 |
| [4] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7–30. DOI:10.3322/caac.21332 |
| [5] | SIEGEL R, DESANTIS C, JEMAL A. Colorectal cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(2): 104–117. DOI:10.3322/caac.21220 |
| [6] | HU X, JIAO R, LI H, et al. Antiproliferative hydrogen sulfide releasing evodiamine derivatives and their apoptosis inducing properties[J]. Eur J Med Chem, 2018, 151: 376–388. DOI:10.1016/j.ejmech.2018.04.009 |
| [7] | YAO X, WANG Y, DUAN Y, et al. IGFBP2 promotes salivary adenoid cystic carcinoma metastasis by activating the NF-κB/ZEB1 signaling pathway[J]. Cancer Lett, 2018, 432: 38–46. DOI:10.1016/j.canlet.2018.06.008 |
| [8] | LIU J Y, ZENG Q H, CAO P G, et al. RIPK4 promotes bladder urothelial carcinoma cell aggressiveness by upregulating VEGF-A through the NF-κB pathway[J]. Br J Cancer, 2018, 118(12): 1617–1627. DOI:10.1038/s41416-018-0116-8 |
| [9] | SHIH R H, WANG C Y, YANG C M. NF-kappaB signaling pathways in neurological inflammation: amini review[J]. Front Mol Neurosci, 2015, 8: 77. DOI:10.3389/fnmol.2015.00077 |
| [10] | ZHU C, JIANG W, CHENG Q, et al. Hemeoxygenase-1 suppresses IL-1β-induced apoptosis through the NF-κB pathway in human degenerative nucleus pulposus cells[J]. Cell Physiol Biochem, 2018, 46(2): 644–653. DOI:10.1159/000488632 |
| [11] | LIN Q, GENG Y, ZHAO M, et al. MiR-21 regulates TNF-α-induced CD40 expression via the SIRT1-NF-κB pathway in renal inner medullary collecting duct cells[J]. Cell Physiol Biochem, 2017, 41(1): 124–136. DOI:10.1159/000455981 |
| [12] | ZHAO N, TIAN K T, CHENG K G, et al. Antiproliferative activity and apoptosis inducing effects of nitric oxide donating derivatives of evodiamine[J]. Bioorg Med Chem, 2016, 24(13): 2971–2978. DOI:10.1016/j.bmc.2016.05.001 |
| [13] | LIN L, REN L, WEN L, et al. Effect of evodiamine on the proliferation and apoptosis of A549 human lung cancer cells[J]. Mol Med Rep, 2016, 14(3): 2832–2838. DOI:10.3892/mmr.2016.5575 |
| [14] | WEN Z, FENG S, WEI L, et al. Evodiamine, a novel inhibitor of the Wnt pathway, inhibits the self-renewal of gastric cancer stem cells[J]. Int J Mol Med, 2015, 36(6): 1657–1663. DOI:10.3892/ijmm.2015.2383 |
| [15] | CHEN T C, CHIEN C C, WU M S, et al. Evodiamine from Evodia rutaecarpa induces apoptosis via activation of JNK and PERK in human ovarian cancer cells[J]. Phytomedicine, 2016, 23(1): 68–78. DOI:10.1016/j.phymed.2015.12.003 |
| [16] | ZHU S, ZHANG X, WEICHERT-LEAHEY N, et al. LMO1 synergizes with MYCN to promote neuroblastoma initiation and metastasis[J]. Cancer Cell, 2017, 32(3): 310–323.e5. DOI:10.1016/j.ccell.2017.08.002 |
| [17] | BAEK S, LEE Y W, YOON S, et al. CDH3/P-Cadherin regulates migration of HuCCT1 cholangiocarcinoma cells[J]. Anat Cell Biol, 2010, 43(2): 110–117. DOI:10.5115/acb.2010.43.2.110 |
| [18] | ZENG Z S, COHEN A M, GUILLEM J G. Loss of basement membrane type Ⅳ collagen is associated with increased expression of metalloproteinases 2 and 9 (MMP-2 and MMP-9) during human colorectal tumorigenesis[J]. Carcinogenesis, 1999, 20(5): 749–755. DOI:10.1093/carcin/20.5.749 |
| [19] | MROCZKO B, GROBLEWSKA M, BARCIKOWSKA M. The role of matrix metalloproteinases and tissue inhibitors of metalloproteinases in the pathophysiology of neurodegeneration: a literature study[J]. J Alzheimers Dis, 2013, 37(2): 273–283. DOI:10.3233/JAD-130647 |
| [20] | HERSZÉNYI L, SIPOS F, GALAMB O, et al. Matrix metalloproteinase-9 expression in the normal mucosa-adenoma-dysplasia-adenocarcinoma sequence of the colon[J]. Pathol Oncol Res, 2008, 14(1): 31–37. DOI:10.1007/s12253-008-9004-5 |
| [21] | TAKAHRA T, SMART D E, OAKLEY F, et al. Induction of myofibroblast MMP-9 transcription in three-dimensional collagen I gel cultures: regulation by NF-kappaB, AP-1 and Sp1[J]. Int J Biochem Cell Biol, 2004, 36(2): 353–363. DOI:10.1016/s1357-2725(03)00260-7 |
| [22] | CHOI B H, LEE D H, KIM J, et al. Controls of nuclear factor-Kappa B signaling activity by 5'-AMP-activated protein kinase activation with examples in human bladder cancer cells[J]. Int Neurourol J, 2016, 20(3): 182–187. DOI:10.5213/inj.1632718.359 |
| [23] | XU Y H, LI Z L, QIU S F. IFN-γ induces gastric cancer cell proliferation and metastasis through upregulation of integrin β3-mediated NF-κB signaling[J]. Transl Oncol, 2018, 11(1): 182–192. DOI:10.1016/j.tranon.2017.11.008 |
| [24] | FANG R, WANG C, JIANG Q, et al. NEMO-IKKβ are essential for IRF3 and NF-κB activation in the cGAS-STING pathway[J]. J Immunol, 2017, 199(9): 3222–3233. DOI:10.4049/jimmunol.1700699 |
| [25] | LU Y X, JU H Q, WANG F, et al. Inhibition of the NF-κB pathway by nafamostat mesilate suppresses colorectal cancer growth and metastasis[J]. Cancer Lett, 2016, 380(1): 87–97. DOI:10.1016/j.canlet.2016.06.014 |



